szereg elektrochemiczny
szereg elektrochemiczny
szereg elektrochemiczny
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
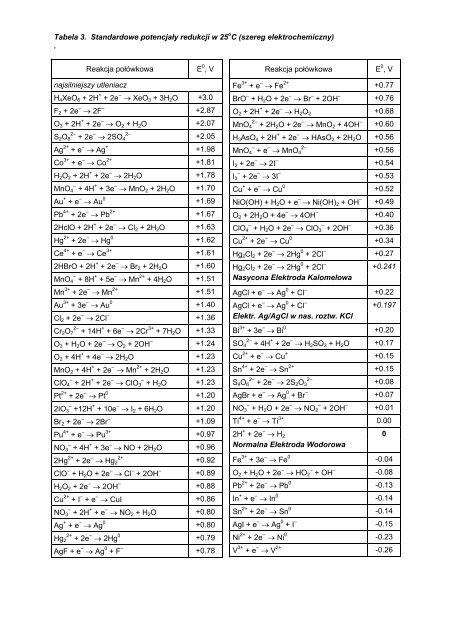
Tabela 3. Standardowe potencjały redukcji w 25 o C (<strong>szereg</strong> <strong>elektrochemiczny</strong>).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , Vnajsilniejszy utleniaczH 4 XeO 6 + 2H + + 2e – → XeO 3 + 3H 2 O +3.0F 2 + 2e – → 2F – +2.87O 3 + 2H + + 2e – → O 2 + H 2 O +2.07S 2 O 2– 8 + 2e – 2–→ 2SO 4 +2.05Ag 2+ + e – → Ag + +1.98Co 3+ + e – → Co 2+ +1.81H 2 O 2 + 2H + + 2e – → 2H 2 O +1.78MnO – 4 + 4H + + 3e – → MnO 2 + 2H 2 O +1.70Au + + e – → Au 0 +1.69Pb 4+ + 2e – → Pb 2+ +1.672HclO + 2H + + 2e – → Cl 2 + 2H 2 O +1.63Hg 2+ + 2e – → Hg 0 +1.62Ce 4+ + e – → Ce 3+ +1.612HBrO + 2H + + 2e – → Br 2 + 2H 2 O +1.60MnO – 4 + 8H + + 5e – → Mn 2+ + 4H 2 O +1.51Mn 3+ + 2e – → Mn 2+ +1.51Au 3+ + 3e – → Au 0 +1.40Cl 2 + 2e – → 2Cl – +1.36Cr 2 O 2– 7 + 14H + + 6e – → 2Cr 3+ + 7H 2 O +1.33O 3 + H 2 O + 2e – → O 2 + 2OH – +1.24O 2 + 4H + + 4e – → 2H 2 O +1.23MnO 2 + 4H + + 2e – → Mn 2+ + 2H 2 O +1.23ClO – 4 + 2H + + 2e – → ClO – 3 + H 2 O +1.23Pt 2+ + 2e – → Pt 0 +1.202IO – 3 +12H + + 10e – → I 2 + 6H 2 O +1.20Br 2 + 2e – → 2Br – +1.09Pu 4+ + e – → Pu 3+ +0.97NO – 3 + 4H + + 3e – → NO + 2H 2 O +0.962Hg 2+ + 2e – 2+→ Hg 2 +0.92ClO – + H 2 O + 2e – → Cl – + 2OH – +0.89H 2 O 2 + 2e – → 2OH – +0.88Cu 2+ + I – + e – → CuI +0.86NO – 3 + 2H + + e – → NO 2 + H 2 O +0.80Ag + + e – → Ag 0 +0.80Hg 2+ 2 + 2e – → 2Hg 0 +0.79AgF + e – → Ag 0 + F – +0.78Fe 3+ + e – → Fe 2+ +0.77BrO – + H 2 O + 2e – → Br – + 2OH – +0.76O 2 + 2H + + 2e – → H 2 O 2 +0.68MnO 4 2– + 2H 2 O + 2e – → MnO 2 + 4OH – +0.60H 3 AsO 4 + 2H + + 2e – → HAsO 2 + 2H 2 O +0.56MnO 4 – + e – → MnO 42–+0.56I 2 + 2e – → 2I – +0.54I 3 – + 2e – → 3I – +0.53Cu + + e – → Cu 0 +0.52NiO(OH) + H 2 O + e – → Ni(OH) 2 + OH – +0.49O 2 + 2H 2 O + 4e – → 4OH – +0.40ClO 4 – + H 2 O + 2e – → ClO 3 – + 2OH – +0.36Cu 2+ + 2e – → Cu 0 +0.34Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.27Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.241Nasycona Elektroda KalomelowaAgCl + e – → Ag 0 + Cl – +0.22AgCl + e – → Ag 0 + Cl – +0.197Elektr. Ag/AgCl w nas. roztw. KClBi 3+ + 3e – → Bi 0 +0.20SO 4 2– + 4H + + 2e – → H 2 SO 3 + H 2 O +0.17Cu 2+ + e – → Cu + +0.15Sn 4+ + 2e – → Sn 2+ +0.15S 4 O 6 2– + 2e – → 2S 2 O 32–+0.08AgBr + e – → Ag 0 + Br – +0.07NO 3 – + H 2 O + 2e – → NO 2 – + 2OH – +0.01Ti 4+ + e – → Ti 3+ 0.002H + + 2e – → H 2 0Normalna Elektroda WodorowaFe 3+ + 3e – → Fe 0 -0.04O 2 + H 2 O + 2e – → HO 2 – + OH – -0.08Pb 2+ + 2e – → Pb 0 -0.13In + + e – → In 0 -0.14Sn 2+ + 2e – → Sn 0 -0.14AgI + e – → Ag 0 + I – -0.15Ni 2+ + 2e – → Ni 0 -0.23V 3+ + e – → V 2+ -0.26
Tabela 3. Standardowe potencjały redukcji w 25 o C (<strong>szereg</strong> <strong>elektrochemiczny</strong>; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VCo 2+ + 2e – → Co 0 -0.28In 3+ + 3e – → In 0 -0.34Tl + + e – → Tl 0 -0.34PbSO 4 + 2e – → Pb 0 2–+ SO 4 -0.36Ti 3+ + e – → Ti 2+ -0.37In 2+ + e – → In + -0.40Cd 2+ + 2e – → Cd 0 -0.40Cr 3+ + e – → Cr 2+ -0.41Fe 2+ + 2e – → Fe 0 -0.44In 3+ + 2e – → In + -0.44S + 2e – → S 2– -0.48In 3+ + e – → In 2+ -0.49Ga + + e – → Ga 0 -0.53O 2 + e – –→ O 2 -0.56U 4+ + e – → U 3+ -0.61Se + 2e – → Se 2– -0.67Cr 3+ + 3e – → Cr 0 -0.74Zn 2+ + 2e – → Zn 0 -0.76Cd(OH) 2 + 2e – → Cd 0 + 2OH – -0.812H 2 O + 2e – → H 2 + 2OH – -0.83Te + 2e – → Te 2– -0.84Cr 2+ + 2e – → Cr 0 -0.91Mn 2+ + 2e – → Mn 0 -1.18V 2+ + 2e – → V 0 -1.19Ti 2+ + 2e – → Ti 0 -1.63Al 3+ + 3e – → Al 0 -1.66U 3+ + 3e – → U 0 -1.79Be 2+ + 2e – → Be 0 -1.85Mg 2+ + 2e – → Mg 0 -2.36Ce 3+ + 3e – → Ce 0 -2.48La 3+ + 3e – → La 0 -2.52Na + + e – → Na 0 -2.71Ca 2+ + 2e – → Ca 0 -2.87Sr 2+ + 2e – → Sr 0 -2.89Ba 2+ + 2e – → Ba 0 -2.91Ra 2+ + 2e – → Ra 0 -2.92Cs + + e – → Cs 0 -2.92Rb + + e – → Rb 0 -2.93K + + e – → K 0 -2.93Li + + e – → Li 0 -3.05najsilniejszy reduktorTabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VAg 2+ + e – → Ag + +1.98Ag + + e – → Ag 0 +0.80AgBr + e – → Ag 0 + Br – +0.07AgCl + e – → Ag 0 + Cl – +0.22AgCl + e – → Ag 0 + Cl – +0.197Elektroda Ag/AgCl w nas. roztw. KClAgF + e – → Ag 0 + F – +0.78AgI + e – → Ag 0 + I – -0.15Al 3+ + 3e – → Al 0 -1.66H 3 AsO 4 + 2H + + 2e – → HAsO 2 + 2H 2 O +0.56Au 3+ + 3e – → Au 0 +1.40Au + + e – → Au 0 +1.69Ba 2+ + 2e – → Ba 0 -2.91Be 2+ + 2e – → Be 0 -1.85Bi 3+ + 3e – → Bi 0 +0.202HBrO + 2H + + 2e – → Br 2 + 2H 2 O +1.60BrO – + H 2 O + 2e – → Br – + 2OH – +0.76Br 2 + 2e – → 2Br – +1.09Ca 2+ + 2e – → Ca 0 -2.87Cd 2+ + 2e – → Cd 0 -0.40Cd(OH) 2 + 2e – → Cd 0 + 2OH – -0.81Ce 4+ + e – → Ce 3+ +1.61Ce 3+ + 3e – → Ce 0 -2.48ClO – 4 + 2H + + 2e – → ClO – 3 + H 2 O +1.23ClO – 4 + H 2 O + 2e – → ClO – 3 + 2OH – +0.362HClO + 2H + + 2e – → Cl 2 + 2H 2 O +1.63
Tabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VClO – + H 2 O + 2e – → Cl – + 2OH – +0.89Cl 2 + 2e – → 2Cl – +1.36Co 3+ + e – → Co 2+ +1.81Co 2+ + 2e – → Co 0 -0.28Cr 2 O 7 2– + 14H + + 6e – → 2Cr 3+ + 7H 2 O +1.33Cr 3+ + e – → Cr 2+ -0.41Cr 3+ + 3e – → Cr 0 -0.74Cr 2+ + 2e – → Cr 0 -0.91Cs + + e – → Cs 0 -2.92Cu 2+ + e – → Cu + +0.15Cu 2+ + I – + e – → CuI +0.86Cu 2+ + 2e – → Cu 0 +0.34Cu + + e – → Cu 0 +0.52F 2 + 2e – → 2F – +2.87Fe 3+ + e – → Fe 2+ +0.77Fe 3+ + 3e – → Fe 0 -0.04Fe 2+ + 2e – → Fe 0 -0.44Ga + + e – → Ga 0 -0.532H + + 2e – → H 2 0Normalna Elektroda Wodorowa2H 2 O + 2e – → H 2 + 2OH – -0.832Hg 2+ + 2e – → Hg 22++0.92Hg 2+ + 2e – → Hg 0 +1.62Hg 2 2+ + 2e – → 2Hg 0 +0.79Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.27Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.241Nasycona Elektroda Kalomelowa2IO 3 – +12H + + 10e – → I 2 + 6H 2 O +1.20I 2 + 2e – → 2I – +0.54I 3 – + 2e – → 3I – +0.53In 3+ + e – → In 2+ -0.49In 3+ + 2e – → In + -0.44In 3+ + 3e – → In 0 -0.34In 2+ + e – → In + -0.40In + + e – → In 0 -0.14K + + e – → K 0 -2.93La 3+ + 3e – → La 0 -2.52Li + + e – → Li 0 -3.05Mg 2+ + 2e – → Mg 0 -2.36MnO – 4 + e – 2–→ MnO 4 +0.56MnO – 4 + 4H + + 3e – → MnO 2 + 2H 2 O +1.70MnO – 4 + 8H + + 5e – → Mn 2+ + 4H 2 O +1.51MnO 2– 4 + 2H 2 O + 2e – → MnO 2 + 4OH – +0.60MnO 2 + 4H + + 2e – → Mn 2+ + 2H 2 O +1.23Mn 3+ + e – → Mn 2+ +1.51Mn 2+ + 2e – → Mn 0 -1.18NO – 3 + 2H + + e – → NO 2 + H 2 O +0.80NO – 3 + H 2 O + 2e – → NO – 2 + 2OH – +0.01NO – 3 + 4H + + 3e – → NO + 2H 2 O +0.96Na + + e – → Na 0 -2.71NiO(OH) + H 2 O + e – → Ni(OH) 2 + OH – +0.49Ni 2+ + 2e – → Ni 0 -0.23O 2 + e – –→ O 2 -0.56O 2 + H 2 O + 2e – → HO – 2 + OH – -0.08O 2 + 2H + + 2e – → H 2 O 2 +0.68O 2 + 4H + + 4e – → 2H 2 O +1.23O 2 + 2H 2 O + 4e – → 4OH – +0.40O 3 + 2H + + 2e – → O 2 + H 2 O +2.07O 3 + H 2 O + 2e – → O 2 + 2OH – +1.24H 2 O 2 + 2H + + 2e – → 2H 2 O +1.78H 2 O 2 + 2e – → 2OH – +0.88Pb 4+ + 2e – → Pb 2+ +1.67Pb 2+ + 2e – → Pb 0 -0.13PbSO 4 + 2e – → Pb 0 2–+ SO 4 -0.36Pt 2+ + 2e – → Pt 0 +1.20Pu 4+ + e – → Pu 3+ +0.97Ra 2+ + 2e – → Ra 0 -2.92Rb + + e – → Rb 0 -2.93S 2 O 2– 8 + 2e – 2–→ 2SO 4 +2.05SO 2– 4 + 4H + + 2e – → H 2 SO 3 + H 2 O +0.17S 4 O 2– 6 + 2e – 2–→ 2S 2 O 3 +0.08S + 2e – → S 2– -0.48Se + 2e – → Se 2– -0.67Sn 4+ + 2e – → Sn 2+ +0.15
Tabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VSn 2+ + 2e – → Sn 0 -0.14Sr 2+ + 2e – → Sr 0 -2.89Te + 2e – → Te 2– -0.84Ti 4+ + e – → Ti 3+ 0.00Ti 3+ + e – → Ti 2+ -0.37Ti 2+ + 2e – → Ti 0 -1.63Tl + + e – → Tl 0 -0.34U 4+ + e – → U 3+ -0.61U 3+ + 3e – → U 0 -1.79V 3+ + e – → V 2+ -0.26V 2+ + 2e – → V 0 -1.19H 4 XeO 6 + 2H + + 2e – → XeO 3 + 3H 2 O +3.0Zn 2+ + 2e – → Zn 0 -0.76