Manual de Procedimientos de Laboratorio para el
Manual de Procedimientos de Laboratorio para el
Manual de Procedimientos de Laboratorio para el
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 1 07/12/2003
Elaborado por::<br />
Dr. Sergio MOLLINEDO PEREZ<br />
Jefe <strong>de</strong> la Unidad <strong>de</strong> Parasitología y Entomología <strong>de</strong>l INLASA<br />
Patólogo Clínico, Medico Tropicalista, Master en Parasitología<br />
COLABORADORES: <strong>Laboratorio</strong> <strong>de</strong> Parasitología y Entomología INLASA<br />
Dr. Edwing HOLGUIN<br />
Lic. Lour<strong>de</strong>s ZEGARRA<br />
Lic. Wilson GIRONDA<br />
Lic. Boris BARROSO<br />
Tec. Walter DELGADO<br />
Tec. Victor DIAZ<br />
Tec. Roberto ARANDA<br />
Tec. Victor BALBOA<br />
Tec. Hugo SELAEZ<br />
Tec. Enzo GAMARRA<br />
IRD<br />
Dr. Laurent BRUTUS<br />
Ing. Dominique SHCNEIDER<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 2 07/12/2003
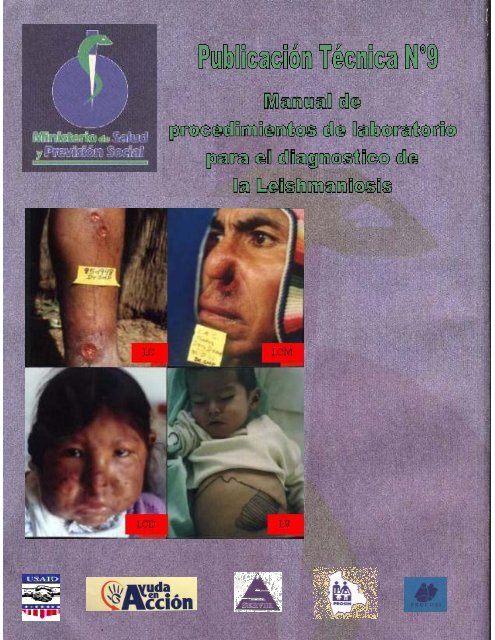
PUBLICACION TECNICA N- 9<br />
MANUAL DE PROCEDIMIENTOS<br />
DE LABORATORIO PARA EL<br />
DIAGNOSTICO DE<br />
LAS LEISHMANIOSIS<br />
UNIDAD DE PARASITOLOGIA Y ENTOMOLOGIA<br />
INLASA<br />
Primera Edición / La Paz 2.002<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 3 07/12/2003
A) Introducción<br />
B) Métodos <strong>de</strong> Diagnóstico:<br />
CONTENIDO<br />
Leéis manía y Leishmaniosis<br />
B.1. Introducción al diagnóstico <strong>de</strong> las Leishmaniosis<br />
B.2. Frotis <strong>de</strong> la lesión<br />
B.3. Cultivo <strong>de</strong> Leishmania<br />
B.4. Inoculación a hámster<br />
B.5. Diagnóstico histopatológico<br />
B.6. Intra<strong>de</strong>rmoreacción <strong>de</strong> Montenegro (IDR)<br />
B.7. Prueba Inmunoenzimática (ELISA)<br />
B.8. Inmunofluorescencia indirecta (IF)<br />
B.8. Envió <strong>de</strong> muestras y resultados<br />
Merito fotográfico<br />
Bibliografía<br />
Anexos<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 4 07/12/2003
A) INTRODUCCIÓN:<br />
Las Leishmaniosis son un complejo <strong>de</strong> Enfermeda<strong>de</strong>s que pue<strong>de</strong>n infectar al humano que<br />
vive o tiene activida<strong>de</strong>s laborales en las áreas tropicales y sub tropicales <strong>de</strong>l planeta; las<br />
transformaciones ecológicas principalmente en los países en vías <strong>de</strong> <strong>de</strong>sarrollo, su<strong>el</strong>en<br />
condicionar la aparición <strong>de</strong> nuevos focos <strong>de</strong> la enfermedad, situación que hoy en día permite<br />
a que estas enfermeda<strong>de</strong>s se presenten cada vez más expandidas y cobren mayor importancia<br />
en la Salud Pública <strong>de</strong> los pueblos.<br />
Se han <strong>de</strong>scrito alre<strong>de</strong>dor <strong>de</strong> 29 diferentes especias <strong>de</strong> Leishmanias, <strong>de</strong> las que 21 se han<br />
aislado <strong>de</strong> humanos y son responsables <strong>de</strong> producirles diferentes formas clínicas <strong>de</strong> la<br />
enfermedad con manifestaciones muy variadas: las formas viscerales pue<strong>de</strong>n tener un<br />
comportamiento epidémico, endémico u holoendémico, con formas inaparentes o sub clínicas<br />
a casos graves mortales; las formas tegumentarias (que afectan a tegumentos: pi<strong>el</strong> y mucosas)<br />
presentan un largo espectro clínico que van <strong>de</strong>s<strong>de</strong> la forma cutánea que curan<br />
espontáneamente, hasta las formas incurables cutáneo difusas o formas cutáneo mucosas que<br />
producen graves <strong>de</strong>strucciones faciales.<br />
Para fines <strong>de</strong>l siglo XX, según la Organización Mundial <strong>de</strong> la Salud (Desjeux, 1993), las<br />
Leishmaniosis tiene una distribución mundial, están presentes en 4 <strong>de</strong> los 5 continentes <strong>de</strong>l<br />
planeta (África, Asia, América y Europa); extendiéndose por 88 países, (21 <strong>de</strong> América); la<br />
población en riesgo es <strong>de</strong> aproximadamente 350 millones <strong>de</strong> habitantes y anualmente un<br />
millón y medio <strong>de</strong> personas (adultos y niños) enferman <strong>de</strong> Leishmaniosis en todas sus<br />
formas; estas cifras son <strong>de</strong> difícil evaluación <strong>de</strong>bido a que su distribución es focal en zonas<br />
alejadas y dispersas, existiendo casos no diagnosticados, casos asintomáticos, y por que los<br />
Sistemas <strong>de</strong> Salud generalmente no consi<strong>de</strong>ran la <strong>de</strong>claración obligatoria <strong>de</strong> la enfermedad.<br />
Bolivia, con una población <strong>de</strong> casi 8.350.000 (INE: censo 2001) <strong>de</strong> habitantes repartidos en<br />
forma irregular en un territorio muy gran<strong>de</strong> y geográficamente diverso (1.098.581 Km2); <strong>el</strong><br />
área endémica <strong>de</strong> la Leishmaniosis se extien<strong>de</strong> por más <strong>de</strong>l 70 % <strong>de</strong>l territorio, solamente<br />
en 3 <strong>de</strong>partamentos <strong>de</strong> los 9 (Oruro, Potosí y Chuquisaca) no se han reportado casos<br />
autóctonos (17, 28, 30); <strong>el</strong> número <strong>de</strong> casos oficialmente reportados por año han aumentado<br />
<strong>de</strong> 120 (1982) a 2310 (1996); por lo tanto po<strong>de</strong>mos inferir, que las Leishmaniosis al igual<br />
que otras enfermeda<strong>de</strong>s transmitidas por vectores (Malaria, Enfermedad <strong>de</strong> Chagas), tien<strong>de</strong> a<br />
aumentar por influencias diversas, algunas <strong>de</strong> las cuales son las siguientes:<br />
• Lucha química anti vectorial no integrada y <strong>de</strong>pendiente <strong>de</strong> financiamiento<br />
externo.<br />
• Múltiples asentamientos (colonizadores) en zonas endémicas <strong>de</strong> los Valles<br />
(Yugas), Amazonía y Chaco, antiguamente no poblada.<br />
• Desarrollo <strong>de</strong> importantes Proyectos Agrícolas, Gana<strong>de</strong>ros, Industriales,<br />
Auríferos, Petrolíferos, Gasíferos, <strong>de</strong> vinculación caminera, etc., en zonas<br />
endémicas.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 5 07/12/2003
• Migraciones temporarias a gran escala <strong>de</strong> la población Andina (Altiplánica)<br />
<strong>de</strong>bida a sequías, cierre <strong>de</strong> las Minas y búsqueda <strong>de</strong> mejores condiciones socio<br />
económicas.<br />
• Calentamiento global y fenómenos climáticos El Niño oscilación sur (ENOS).<br />
• Urbanización rápida y no planificada <strong>de</strong> estos nuevos pueblos.<br />
• Modificaciones ecológicas producidas por la población.<br />
En Bolivia a pesar <strong>de</strong>l conocimiento ancestral <strong>de</strong> estas enfermeda<strong>de</strong>s, las medidas <strong>para</strong><br />
enfrentar los requerimientos <strong>de</strong> investigación, diagnóstico oportuno, tratamiento precoz y<br />
completo y educación <strong>para</strong> la Salud; las Leishmaniosis se están extendiendo, (Cochabamba,<br />
Santa Cruz, Beni, Pando, La Paz) re-emergiendo (Tarija) y adaptándose al medio urbano<br />
antropización <strong>de</strong>l ciclo.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 6 07/12/2003
B) MÉTODOS DIAGNÓSTICOS:<br />
Los procedimientos <strong>de</strong> laboratorio utilizados <strong>para</strong> <strong>el</strong> diagnóstico <strong>de</strong> las Leishmaniosis han<br />
sido y siguen siendo exhaustivamente revisados por diferentes autores (1, 12, 25, 26, 55,<br />
62, 63), en <strong>el</strong> presente resumen preten<strong>de</strong>mos citar las partes más importantes <strong>de</strong> estas<br />
técnicas y la r<strong>el</strong>ación con nuestra propia experiencia en la utilización <strong>de</strong> las mismas.<br />
El diagnóstico acertado <strong>de</strong> un proceso infeccioso como son las Leishmaniosis, es la<br />
<strong>de</strong>mostración <strong>de</strong>l agente patógeno (parásito) o <strong>de</strong> sus productos en los tejidos o fluidos <strong>de</strong>l<br />
huésped (anticuerpos), esta <strong>de</strong>tección no siempre es posible. La <strong>de</strong>tección <strong>de</strong> los parásitos<br />
(amastigotos) agentes <strong>de</strong> la Leishmaniosis es frecuentemente complicado, en particular<br />
cuando se trata <strong>de</strong> parásitos <strong>de</strong>l complejo Leishmania (V.) braziliensis, (importante en<br />
nuestro país), don<strong>de</strong> <strong>el</strong> número <strong>de</strong> amastigotes presentes en las lesiones es escaso; en<br />
nuestra experiencia sobre terreno y tomando en cuenta las características e idiosincrasia <strong>de</strong><br />
nuestra población que recurre al centro médico rural solo <strong>de</strong>spués <strong>de</strong> haber fracasado en sus<br />
métodos <strong>de</strong> curación empíricos, solamente en <strong>el</strong> 40% o menos <strong>de</strong> los casos con lesiones <strong>de</strong><br />
diferentes estadios se pue<strong>de</strong> <strong>de</strong>mostrar <strong>el</strong> parásito (Mollinedo S., datos no publicados),<br />
similares observaciones fueron señaladas por Furuya et al. (20) y Mardsen, (34); sin<br />
embargo se <strong>de</strong>be hacer notar que cuando se realizan exámenes en pacientes con lesiones <strong>de</strong><br />
corta evolución, sin infección agregada, sin tratamiento, la sensibilidad sube hasta <strong>el</strong> 90%;<br />
<strong>de</strong>bido a que las Leishmaniosis son enfermeda<strong>de</strong>s rurales los investigadores están<br />
proponiendo alternativas <strong>de</strong> métodos <strong>de</strong> diagnóstico con mayor sensibilidad y<br />
especificidad, recomendándose que sean simples, <strong>de</strong> corta ejecución y bajo costo<br />
operacional.<br />
El conocimiento <strong>de</strong> las técnicas <strong>de</strong> diagnóstico y su correcta interpretación, son<br />
fundamentales <strong>para</strong> orientar las acciones <strong>de</strong> los médicos generales, tropicalistas,<br />
<strong>de</strong>rmatólogos, epi<strong>de</strong>miólogos, que asocian estos resultados a la signo sintomatología clínica<br />
que presenta <strong>el</strong> paciente. La mayor parte <strong>de</strong>l territorio <strong>de</strong> Bolivia es endémica a estas<br />
enfermeda<strong>de</strong>s, en la actualidad <strong>el</strong> diagnóstico <strong>de</strong> las Leishmaniosis es realizado en base a<br />
las manifestaciones clínicas; <strong>el</strong> frotis es <strong>de</strong>ficientemente realizado y no se realizan<br />
exámenes serológicos, que a su vez no son capaces <strong>de</strong> discriminar las infecciones recientes<br />
<strong>de</strong> las antiguas y pue<strong>de</strong>n ser falsos positivos, al presentar reactividad cruzada con la<br />
enfermedad <strong>de</strong> Chagas, malaria, tuberculosis, lepra y bruc<strong>el</strong>osis; por lo anotado es<br />
imperioso mejorar estos con <strong>el</strong> estudio y la precisa realización <strong>de</strong> las técnicas <strong>de</strong>scritas en <strong>el</strong><br />
presente manual.<br />
En <strong>el</strong> diagnóstico <strong>de</strong> las Leishmaniosis se pue<strong>de</strong>n presentar las siguientes situaciones<br />
clínico epi<strong>de</strong>miológicas, <strong>para</strong> las cuales se <strong>de</strong>ben tener en cuenta diferentes estrategias <strong>de</strong><br />
diagnóstico:<br />
• Confirmación <strong>de</strong> un caso clínico sospechoso<br />
• Descarte <strong>de</strong> un caso atípico<br />
• Seguimiento <strong>de</strong> tratamiento<br />
• Encuesta sero epi<strong>de</strong>miológica<br />
• Investigación<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 7 07/12/2003
B.1. Introducción al Diagnóstico <strong>de</strong> las Leishmaniosis:<br />
METODOS PARASITOLOGICOS:<br />
• Métodos Parasitológicos Directos: Con estos exámenes se observa <strong>el</strong> agente<br />
etiológico directamente, por lo que constituyen la base fundamental <strong>de</strong>l diagnóstico<br />
biológico <strong>de</strong> confirmación <strong>de</strong> la enfermedad, los principales son:<br />
- Frotis: El parásito se lo <strong>de</strong>tecta en forma amastigote en la muestra obtenida <strong>de</strong> la<br />
lesión (úlcera) <strong>de</strong>l paciente.<br />
- Biopsia: El parásito también esta en forma amastigote en los tejidos y requiere<br />
un proceso clásico histopatológíco.<br />
• Métodos Parasitológicos especiales: La ejecución <strong>de</strong> estos exámenes en <strong>el</strong> caso <strong>de</strong>l<br />
cultivo y Xenodiagnóstico es limitada a laboratorios especializados (II y III Niv<strong>el</strong>),<br />
<strong>de</strong>bido a que no son métodos <strong>para</strong>sitológicos especiales y se los utiliza generalmente<br />
<strong>para</strong> investigación.<br />
- Cultivo: Generalmente se realiza <strong>de</strong> tejido cutáneo o mucoso (biopsia), aspirado<br />
<strong>de</strong> lesión, material obtenido por punción <strong>de</strong> médula ósea o bazo.<br />
- Xenodiagnóstico: Laboriosa técnica que requiere la crianza en laboratorio <strong>de</strong><br />
especies <strong>de</strong> Lutzomyias, con las que se hace picar al paciente sospechoso <strong>de</strong> la<br />
enfermedad, presenta múltiples inconvenientes.<br />
- Intra<strong>de</strong>rmoreacción <strong>de</strong> Montenegro (IDRM) o Leishmanina. Rev<strong>el</strong>a la respuesta<br />
a mediación c<strong>el</strong>ular y se la emplea principalmente en I niv<strong>el</strong>.<br />
METODOS SEROLOGICOS:<br />
• Métodos Serológicos: Constituyen una herramienta valiosa <strong>para</strong> <strong>el</strong> diagnóstico <strong>de</strong> la<br />
infección, se basan en la respuesta <strong>de</strong>l organismo frente al parásito (antígeno<br />
generalmente en forma promastigote); lo i<strong>de</strong>al <strong>de</strong> estos métodos es que sean fáciles <strong>de</strong><br />
realizar, que se obtengan resultados rápidos y confiables y que su lectura sea objetiva:<br />
- Las pruebas Inmunoenzimáticas (ELISA), Inmunofluorescencia Indirecta (IFI);<br />
Aglutinación Directa (AD); rev<strong>el</strong>an la respuesta a mediación humoral<br />
• Métodos serológicos especiales: Son aqu<strong>el</strong>las pruebas que no han tenido una<br />
validación suficientemente amplia, utilizan diferentes reactivos y mezclas <strong>de</strong> antígenos<br />
que preten<strong>de</strong>n aumentar la especificidad <strong>de</strong>l diagnóstico; se han propuesto diferentes<br />
matrices <strong>para</strong> la inmovilización <strong>de</strong>l antígenos como tiras reactivas (Dipstick); Westwern<br />
blot, etc.<br />
Algunas <strong>de</strong> estas pruebas han mostrado alta sensibilidad y especificidad, <strong>de</strong>biéndose<br />
estandarizarlas como pruebas <strong>de</strong> rutina en los laboratorios regionales; la especificidad su<strong>el</strong>e<br />
variar consi<strong>de</strong>rablemente por lo que se recomienda que los límites <strong>de</strong> positividad <strong>de</strong>ben<br />
<strong>de</strong>finirse localmente; sin embargo es necesario indicar que en la actualidad la prueba<br />
serológica i<strong>de</strong>al no existe; las curvas <strong>de</strong> distribución <strong>de</strong> frecuencias <strong>de</strong> títulos en una<br />
población dada se superponen, vale <strong>de</strong>cir que vamos a encontrar un porcentaje <strong>de</strong> falsos<br />
positivos y otro <strong>de</strong> falsos negativos, que no nos permiten diferenciar claramente entre los<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 8 07/12/2003
individuos infectados <strong>de</strong> los no infectados y discriminar las personas enfermas (que pue<strong>de</strong>n<br />
<strong>de</strong>sarrollar la enfermedad) <strong>de</strong> las no enfermas (que no <strong>de</strong>sarrollaran la enfermedad). Para<br />
que haya confiabilidad, estas técnicas <strong>de</strong>ben estandarizarse y tener un estricto control <strong>de</strong><br />
calidad en base a una “Red <strong>de</strong> <strong>Laboratorio</strong>s”, que permita constantes intercambios <strong>de</strong><br />
experiencias y muestras <strong>de</strong> referencia y muestras problema.<br />
El cuadro anterior resume las principales situaciones <strong>para</strong> utilizar estas técnicas y también<br />
observamos en <strong>el</strong> Flujograma N- 1 y 2 las responsabilida<strong>de</strong>s <strong>de</strong> realización <strong>de</strong> estas<br />
técnicas por niv<strong>el</strong>es :<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 9 07/12/2003<br />
CASO PROBABLE
TEJIDO EXUDADO<br />
SUERO<br />
RASPADO BIOPSIA<br />
FROTIS PCR<br />
FROTIS<br />
HISTOPATOLOGIA<br />
INMUNOPATOLOGIA<br />
PACIENTE CON SOSPECHA<br />
CLÍNICO EPIDEMIOLOGICA<br />
TOMA DE MUESTRA<br />
- ASPIRADO<br />
- MICROPIPETA<br />
- CULTIVO<br />
- INOCULACIÓN EN<br />
HAMSTERS<br />
AISLAMIENTO<br />
DEL GERMEN<br />
CARACTERIZACIÓN<br />
- ELECTROFORESIS DE ISOENZIMAS<br />
- ANTICUERPOS MONOCLONALES<br />
- REACCIÓN EN CADENA DE LA<br />
POLIMERASA (PCR)<br />
- IFI<br />
- ELISA<br />
- DOT-ELISA<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 10 07/12/2003<br />
IDRM<br />
LESHMANINA<br />
CASO CONFIRMADO<br />
INVESTIGACION
E<br />
N<br />
V<br />
I<br />
O<br />
D<br />
E<br />
I<br />
N<br />
F<br />
O<br />
R<br />
M<br />
A<br />
C<br />
I<br />
Ó<br />
N<br />
LABORATORIO NACIONAL DE REFERENCIA<br />
LABORATORIO DE ENDEMIAS PARASITARIAS<br />
TRANSMITIDAS POR VECTORES<br />
- INMUNOFLUORESCENCIA INDIRECTA (IFI)<br />
- DIAGNOSTICO HISTOPATOLÓGICO<br />
- INOCULACIONES EN HAMSTERS O RATONES<br />
- CARASCTERIZACIÓN DE CEPAS (ISOENZIMAS)<br />
- SUSCEPTIBILIDAD DEL PARASITO A LAS DROGAS<br />
ANTILEISMANIASICAS<br />
- ANTICUERPOS MONOCLONALES<br />
- REACCIÓN EN CADENA DE LA POLIMERASA (PCR)<br />
ENVIO MUESTRAS PARA<br />
- CONFIRMACIÓN<br />
- DIAGNOSTICO<br />
- CONTROL DE CALIDAD<br />
LABORATORIO REGIONAL<br />
- ELISA Y/O DOT ELISA<br />
- PCR<br />
- MANTENIMIENTO DE CULTIVOS DE LEISHMANIA<br />
- IDENTIFICACIÓN TAXONOMICA DE Lutzomyia<br />
- MANTENIMIENTO DE COLONIAS DE Lutzomyia<br />
ENVIO DE MUESTRAS PARA<br />
- ENTIFICACION<br />
- DIAGNOSTICO<br />
- CONTROL DE CALIDAD<br />
LABORATORIO INTERMEDIO<br />
- AISLAMIENTO PARASITO MEDIANTE CULTIVO<br />
- ASPIRADO<br />
- BIOPSIA<br />
- RECONOCIMIENTO DEL VECTOR<br />
ENVIO DE MUESTRAS PARA<br />
- VERIFICACIÓN<br />
- CONTROL DE CALIDAD<br />
LABORATORIO LOCAL<br />
- FROTIS<br />
- INTRADERMORREACCIÓN (LEISHMANINA)<br />
- CAPTURA DE Lutzomyia<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 11 07/12/2003<br />
E<br />
N<br />
V<br />
I<br />
O<br />
D<br />
E<br />
R<br />
E<br />
S<br />
U<br />
L<br />
T<br />
A<br />
D<br />
O<br />
S
B.2. Frotis <strong>de</strong> la Lesión:<br />
Fundamento:<br />
Es <strong>el</strong> examen rápido, fácil, económico y <strong>de</strong> certeza, todos los <strong>de</strong>más exámenes son<br />
complementarios; pue<strong>de</strong> ser implementado inclusive a niv<strong>el</strong> <strong>de</strong> los recolectores <strong>de</strong><br />
muestras (Niv<strong>el</strong> I) <strong>para</strong> ser enviado a lectura don<strong>de</strong> exista un microscopio; consiste en<br />
reconocer por examen microscópico las formas amastigotes teñidas <strong>de</strong>ntro <strong>de</strong> los<br />
macrófagos o fuera <strong>de</strong> estos, obtenidas <strong>de</strong> una muestra <strong>de</strong> sustancia interc<strong>el</strong>ular <strong>de</strong> las<br />
lesiones extendida en un portaobjeto (ver fotografías), la sensibilidad es variable <strong>de</strong>l 30 al<br />
90% y <strong>de</strong>pen<strong>de</strong> <strong>de</strong> la forma clínica; técnica empleada <strong>para</strong> la toma, procesamiento y lectura<br />
<strong>de</strong> la muestra; tiempo <strong>de</strong> evolución <strong>de</strong> la lesión, tratamientos previos, existencia <strong>de</strong><br />
infección sobre añadida y experiencia <strong>de</strong>l examinador.<br />
Muestra requerida:<br />
El frotis pue<strong>de</strong> ser tomado <strong>de</strong> diferentes tejidos, <strong>de</strong>pendiendo <strong>el</strong> tipo <strong>de</strong> leishmaniosis:<br />
• Frotis directo <strong>de</strong>l bor<strong>de</strong> <strong>de</strong> la ulcera (punción extendida con palito)<br />
• Frotis halo inflamatorio o ro<strong>de</strong>te <strong>de</strong> la lesión cutánea (con bisturí)<br />
• Frotis <strong>de</strong> la lesión secundaria activa<br />
• Frotis <strong>de</strong> medula ósea<br />
Equipo, materiales y reactivos:<br />
• Laminas porta objetos<br />
• Hoja <strong>de</strong> Bisturi 20 o 21 o palillos <strong>de</strong> ma<strong>de</strong>ras<br />
• Gasa estéril<br />
• Alcohol al 70 %<br />
• Lápiz marcador<br />
• Jeringa estéril <strong>de</strong> 1cc<br />
• Anestésicos<br />
• Giemsa<br />
• Buffer pH 7.2<br />
• Microscopio<br />
• Aceite <strong>de</strong> inmersión<br />
E.2.A. Procedimiento:<br />
Frotis directo <strong>de</strong>l bor<strong>de</strong> <strong>de</strong> la lesión (úlcera):<br />
• S<strong>el</strong>ección <strong>de</strong>l área <strong>de</strong> muestra. Si hay varias lesiones, <strong>de</strong>be escogerse la que tenga<br />
menor tiempo <strong>de</strong> evolución y los bor<strong>de</strong>s más indurados.<br />
• Con una mano enguantada, lavar la zona <strong>de</strong> la lesión con abundante agua corriente. De<br />
existir una costra <strong>de</strong>berá ser retirada; si existe pus se <strong>de</strong>be limpiar minuciosamente; si<br />
existe sangrado se <strong>de</strong>be realizar una buena hemostasia.<br />
• La muestra <strong>de</strong>be ser tomada <strong>de</strong> tres lugares diferentes, <strong>de</strong> la misma úlcera y escogiendo<br />
áreas activas representativas o más sospechosas.<br />
• Producir isquemia, presionando sostenidamente con <strong>el</strong> <strong>de</strong>do un área adyacente al bor<strong>de</strong><br />
<strong>de</strong> la lesión.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 12 07/12/2003
• Con un palillo <strong>de</strong> ma<strong>de</strong>ra (escarba dientes) previamente esterilizado se proce<strong>de</strong> a<br />
pinchar en <strong>el</strong> bor<strong>de</strong> <strong>de</strong> la lesión y se hace girar (rotar) <strong>el</strong> mismo, evitando <strong>el</strong> excesivo<br />
sangrado (1).<br />
La muestra obtenida se extien<strong>de</strong> en tres lugares diferentes, en un porta objetos, rotando <strong>el</strong><br />
palillo, evitando pasar dos veces por <strong>el</strong> mismo sitio (2).<br />
•<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 13 07/12/2003<br />
2<br />
1
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 14 07/12/2003<br />
3<br />
4
Se repite <strong>el</strong> proceso en dos o tres lugares <strong>de</strong> la misma lesión<br />
• I<strong>de</strong>ntificar la lamina con <strong>el</strong> código e iniciales <strong>de</strong>l paciente y <strong>de</strong>jar secar a medio<br />
ambiente.<br />
• Fijar la muestra con alcohol corriente <strong>de</strong> 70 % y secar al medio ambiente<br />
• Anotar los datos <strong>de</strong>l paciente en <strong>el</strong> cua<strong>de</strong>rno <strong>de</strong> registro <strong>de</strong> muestras (Anexo No. ) y<br />
en <strong>el</strong> formulario <strong>de</strong> remisión <strong>de</strong> láminas.<br />
Isquemia:<br />
Producir isquemia presionando sostenidamente en <strong>el</strong> bor<strong>de</strong> <strong>de</strong> la lesión y lugar exacto<br />
escogido.<br />
Dadas las características <strong>de</strong> nuestros servicios <strong>de</strong> Niv<strong>el</strong> I, recomendamos esta técnica por su<br />
sencillez, escasos requerimientos <strong>de</strong> material y buenos resultados, cuando se respetan<br />
minuciosamente todos los pasos <strong>de</strong>scritos.<br />
E.2.B. Halo inflamatorio <strong>de</strong> la lesión:<br />
• Se siguen las dos primeras citas <strong>de</strong>scritos en F.2.A.<br />
• Escoger un área representativa <strong>de</strong>l bor<strong>de</strong> <strong>de</strong> la ulcera (halo inflamatorio o ro<strong>de</strong>te)<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 15 07/12/2003
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 16 07/12/2003<br />
5<br />
6
• Presionar con firmeza <strong>el</strong> bor<strong>de</strong> escogido <strong>de</strong> la lesión, hasta que se vu<strong>el</strong>va pálida<br />
(isquemia)<br />
• En la parte central <strong>de</strong>l bor<strong>de</strong> activo (<strong>para</strong>l<strong>el</strong>o a la úlcera) con la hoja <strong>de</strong> bisturí realizar<br />
una pequeña incisión <strong>de</strong> 3 mm <strong>de</strong> longitud con 3 mm <strong>de</strong> profundidad.<br />
• Secar la sangre con gasa seca y estéril<br />
• Con la punta <strong>de</strong>l bisturí raspar los bor<strong>de</strong>s <strong>de</strong> la incisión tratando <strong>de</strong> obtener tejido<br />
• Con <strong>el</strong> pequeño material sero hemático obtenido en la hoja <strong>de</strong> bisturí, hacer un frotis<br />
<strong>de</strong>lgado en una lámina porta objetos, evitando pasar dos veces por <strong>el</strong> mismo sitio.<br />
• I<strong>de</strong>ntificar la lamina con <strong>el</strong> código e iniciales <strong>de</strong>l paciente y <strong>de</strong>jar secar a medio<br />
ambiente.<br />
• Fijar la muestra con alcohol corriente <strong>de</strong> 70 % y secar al medio ambiente<br />
• Anotar los datos <strong>de</strong>l paciente en <strong>el</strong> cua<strong>de</strong>rno <strong>de</strong> registro <strong>de</strong> muestras (Anexo No. ) y en<br />
<strong>el</strong> formulario <strong>de</strong> remisión <strong>de</strong> láminas.<br />
Esta técnica es <strong>de</strong>sconocida en nuestro medio pero con <strong>el</strong>la se su<strong>el</strong>en obtener mayor<br />
número <strong>de</strong> parásitos.<br />
E.2.C. Frotis <strong>de</strong> la lesión secundaria activa:<br />
• Si las lesiones están en las fosas nasales, se invita al paciente a limpiarse la nariz <strong>para</strong><br />
retirar <strong>el</strong> mucus<br />
• Con la mano enguantada se lava cuidadosamente la lesión secundaria con agua<br />
corriente, retirando costras, evitar <strong>el</strong> sangrado, y si <strong>el</strong> mismo se produce, hacer una<br />
buena hemostasia.<br />
• Escoger un área activa (área ulcerada) <strong>de</strong> la lesión.<br />
• Con un escarba dientes (palillo <strong>de</strong> ma<strong>de</strong>ra) realizar un raspado fino y cuidadoso<br />
• Con <strong>el</strong> escaso material obtenido, hacer un frotis <strong>de</strong>lgado en una lámina porta objetos,<br />
evitando pasar dos veces por <strong>el</strong> mismo sitio.<br />
• I<strong>de</strong>ntificar la lamina con <strong>el</strong> código e iniciales <strong>de</strong>l paciente y <strong>de</strong>jar secar a medio<br />
ambiente.<br />
• Fijar la muestra con alcohol corriente <strong>de</strong> 70 % y secar al medio ambiente<br />
Anotar los datos <strong>de</strong>l paciente en <strong>el</strong> cua<strong>de</strong>rno <strong>de</strong> registro <strong>de</strong> muestras (Anexo No. ) y en <strong>el</strong><br />
formulario <strong>de</strong> remisión <strong>de</strong> láminas.<br />
E.2.D. Frotis <strong>de</strong> Médula ósea (sospecha <strong>de</strong> Leishmaniosis visceral):<br />
• La toma <strong>de</strong> muestra <strong>de</strong>be realizarse <strong>de</strong> preferencia por personal capacitado en ambiente<br />
hospitalario, con previo recuento <strong>de</strong> plaquetas (no inferior a 40.000 x mm3)<br />
• Para garantizar la seguridad <strong>de</strong>l examen y rapi<strong>de</strong>z, <strong>de</strong>be pre<strong>para</strong>rse al personal (1<br />
operador y 2 asistentes que sujeten al paciente) y añadir al material mencionado líneas<br />
arriba, lo siguiente:<br />
- Aguja (tricar) 0,8 mm con jeringa <strong>de</strong> 5 mL (estéril)<br />
- Medios <strong>de</strong> cultivo<br />
- Una caja <strong>de</strong> curaciones<br />
- Alcohol yodado<br />
- Xilocaina al 2% con jeringa <strong>de</strong> 5 mL.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 17 07/12/2003
• Al paciente en <strong>de</strong>cúbito lateral, inmovilizado, tras <strong>el</strong> reconocimiento y palpación <strong>de</strong>l<br />
operador, se le realiza asepsia a niv<strong>el</strong> <strong>de</strong> la cresta iliaca antero superior.<br />
• Se inyecta anestesia intradérmica en forma <strong>de</strong> abanico en <strong>el</strong> lugar escogido.<br />
• Después <strong>de</strong> esperar entre 3 a 5 minutos, se hace un pequeño corte (1 cm), que facilite <strong>el</strong><br />
acceso a la cresta iliaca, realizando la hemostasia correspondiente.<br />
• Con la herida abierta, se introduce <strong>el</strong> trocar al hueso y se aspira.<br />
• El escaso material aspirado (<strong>de</strong> media a dos gotas) <strong>de</strong>be ser sembrado en medios <strong>de</strong><br />
cultivo inmediatamente, con <strong>el</strong> restante se realizan frotis (mínimo 3 láminas por<br />
paciente).<br />
• Obtenida la muestra, se proce<strong>de</strong> a suturar la herida (1 o 2 puntos <strong>de</strong> sutura)<br />
Procesamiento <strong>de</strong> la Muestra: La muestra obtenida por cualquiera <strong>de</strong> los métodos se la<br />
procesa <strong>de</strong> la siguiente manera:<br />
• Se proce<strong>de</strong> a fijar la muestra con alcohol metílico (en nuestro país por costos se utiliza<br />
alcohol etílico 96º) durante por lo menos 3 minutos; <strong>de</strong>scartar <strong>el</strong> alcohol y secar a<br />
temperatura ambiente.<br />
• Cubrir la lámina con solución <strong>de</strong> trabajo Giemsa (una gota <strong>de</strong> solución Giemsa madre<br />
por cada ml <strong>de</strong> solución buffer pH 7,2 a 7,4 por 30 minutos. Se pue<strong>de</strong>n utilizar otros<br />
colorantes: May Grundwald Giemsa, Wright.<br />
• Descartar <strong>el</strong> colorante y lavar suavemente con agua corriente<br />
• Secar al medio ambiente<br />
• Observar a inmersión con microscopio<br />
Envío <strong>de</strong> la muestra:<br />
• En <strong>el</strong> puesto <strong>de</strong> salud, <strong>el</strong> RPS, o <strong>el</strong> sanitario en su recorrido <strong>de</strong>ben realizar este examen<br />
y <strong>de</strong>bido a que NO cuenta con microscopio, <strong>de</strong>berá remitir la muestra (frotis) al<br />
laboratorio más cercano <strong>de</strong> la red, teniendo <strong>el</strong> siguiente cuidado:<br />
- Envolver la lámina (fijada y secada) en un pap<strong>el</strong> en forma individual,<br />
<strong>de</strong>bidamente rotulada y envu<strong>el</strong>ta en paquetes <strong>de</strong> no más <strong>de</strong> 10 láminas.<br />
- El paquete <strong>de</strong>be ser colocado en una caja <strong>de</strong> cartón y adicionar las ficha<br />
epi<strong>de</strong>miológicas respectivas.<br />
- Cubrir la caja con un pap<strong>el</strong>, rotular este y enviarlo al laboratorio <strong>de</strong> referencia<br />
más cercano.<br />
- Los laboratorios <strong>de</strong> mayor complejidad <strong>de</strong>berán enviar sus muestras en cajas<br />
porta placas, <strong>de</strong>bidamente i<strong>de</strong>ntificadas y numeradas<br />
Lectura e interpretación <strong>de</strong> resultados:<br />
• Por medio <strong>de</strong>l microscopio con objetivo 100 X y aceite <strong>de</strong> inmersión se <strong>de</strong>be observar<br />
la lámina por no menos <strong>de</strong> 30 minutos.<br />
• De encontrar <strong>el</strong>ementos sospechosos <strong>de</strong> ser parásitos, lo primero que tenemos que hacer<br />
es verificar su forma y tamaño.<br />
• Los amastigotes generalmente están <strong>de</strong>ntro <strong>de</strong> los macrófagos, también se los pue<strong>de</strong><br />
encontrar fuera <strong>de</strong> estos (fotografías); se los reconoce por que tienen forma redon<strong>de</strong>ada<br />
u ovalada, mi<strong>de</strong>n <strong>de</strong> 2 a 6 micras <strong>de</strong> diámetro y <strong>de</strong>ntro <strong>de</strong>l citoplasma se observa 2<br />
estructuras bien coloreadas al contener ADN:<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 18 07/12/2003
- El Núcleo, <strong>de</strong> forma redon<strong>de</strong>ada, que ocupa 1/4 a 1/5 <strong>de</strong> la célula, esta pegada a<br />
la membrana citoplasmática.<br />
- El Kinetoplasto o Kinetonucleo, formación pequeña <strong>de</strong> forma <strong>de</strong> bastón,<br />
ubicada a un costado <strong>de</strong>l núcleo, se tiñe más intensamente que <strong>el</strong> núcleo<br />
• En caso <strong>de</strong> que <strong>el</strong> resultado sea negativo y exista una fuerte sospecha <strong>de</strong> la enfermedad,<br />
se recomienda repetir <strong>el</strong> examen <strong>de</strong> un sitio diferente <strong>de</strong> la misma lesión o <strong>de</strong> otras<br />
lesiones.<br />
Los resultados <strong>de</strong> laboratorio <strong>de</strong>ben consignar obligatoriamente la <strong>de</strong>nsidad <strong>para</strong>sitaria que<br />
observa según la siguiente escala propuesta por la OMS (45):<br />
• Resultado Negativo: (-) No se observan formas <strong>para</strong>sitarias en 1.000 campos<br />
observados, o en un mínimo <strong>de</strong> 30 minutos <strong>de</strong> observación.<br />
• Resultado Positivo: (+) observación <strong>de</strong> ocasionales o escasos amastigotes solos o en<br />
pequeños grupos en forma intrac<strong>el</strong>ular (Macrófagos) o extrac<strong>el</strong>ular,<br />
• Negativo escaso múltiple: (-) 1 a 10 parásitos en 1.000 campos observados.<br />
Fuentes <strong>de</strong> error limitación <strong>de</strong> procedimientos, interferencias y precauciones:<br />
• Nuestros pacientes primero utilizan farmacopea empírica en sus enfermeda<strong>de</strong>s, por lo<br />
que las lesiones frecuentemente están contaminadas con bacterias y/u hongos, <strong>de</strong>spués<br />
que fracasan en su curación empírica, recién recurren al sistema <strong>de</strong> salud por lo que<br />
recomendamos un buen lavado con agua corriente o agua y jabón, <strong>de</strong> acuerdo a criterio<br />
médico se pue<strong>de</strong> realizar tratamiento previo antimicrobiano.<br />
• las úlceras que evolucionan mucho tiempo (crónicas), presentan un menor número <strong>de</strong><br />
parásitos.<br />
• El frotis <strong>de</strong>l lecho ulceroso sin limpieza previa, frecuentemente permite solo observar<br />
<strong>de</strong>tritus c<strong>el</strong>ular y no parásitos<br />
• El uso <strong>de</strong> agua oxigenada, alcohol Iodado en la limpieza previa <strong>de</strong> las ulceras, también<br />
<strong>el</strong>imina los parásitos por lo que no se recomienda su utilización<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 19 07/12/2003
E.3. Cultivo <strong>de</strong> Leishmania:<br />
El material obtenido a partir <strong>de</strong> la Biopsia o aspirado <strong>de</strong> la lesión primaria o secundaria, se<br />
incorpora al medio <strong>de</strong> cultivo in vitro, tradicionalmente se usa <strong>el</strong> medio bifásico con base<br />
<strong>de</strong> agar sangre Medio Novy-Mac Neal-Nicolle (NNN); en la actualidad existen otros<br />
medios, agar sangre, Drosophila <strong>de</strong> Schnei<strong>de</strong>r, RPMI, LIT, Seneckjie); <strong>el</strong> cultivo se utiliza<br />
<strong>para</strong> i<strong>de</strong>ntificar la especie <strong>de</strong>l parásito, también pue<strong>de</strong> emplearse <strong>para</strong> investigación <strong>de</strong><br />
mamíferos reservorios (roedores, perros), <strong>para</strong> potenciales vectores y como fuente <strong>de</strong><br />
antígeno <strong>para</strong> pruebas inmunológicas (Ver anexos).<br />
El medio <strong>de</strong> Cultivo con r<strong>el</strong>ación al frotis, tiene la facilidad <strong>de</strong> que se observan<br />
generalmente un número mayor <strong>de</strong> promastigotes móviles, mientras que en <strong>el</strong> frotis existen<br />
generalmente escasas formas amastigotes; <strong>el</strong> inconveniente es que se requiere la instalación<br />
<strong>de</strong> estufas <strong>de</strong> cultivo y un procedimiento con técnicas <strong>de</strong> asepsia rigurosas <strong>de</strong>bido a la fácil<br />
contaminación bacteriana <strong>de</strong> los medios.<br />
CULTIVO DE ASPIRADO<br />
• Muestra: biopsia, aspirado <strong>de</strong> médula ósea<br />
• Material y Equipos requeridos:<br />
- Jeringa <strong>de</strong> tuberculina (1 mL) con aguja 25 o 26<br />
- Alcohol al 70%<br />
- Suero fisiológico estéril<br />
- Antimicrobianos en viales (Sulfato <strong>de</strong> Estreptomicina 1g y Penicilina Sódica<br />
1’000.000 <strong>de</strong> Unida<strong>de</strong>s).<br />
- Tubos <strong>de</strong> medio <strong>de</strong> Cultivo NNN (2 a 4 por paciente)<br />
- Gasa estéril<br />
- Mechero <strong>de</strong> alcohol<br />
- Microscopio <strong>de</strong> Luz<br />
- Estufa <strong>de</strong> cultivo<br />
• Procedimiento:<br />
El material es obtenido <strong>de</strong> acuerdo al método <strong>de</strong>scrito en 1.979 por Hendricks y Wright,<br />
sigue los siguientes pasos:<br />
- Lavar la lesión con abundante agua<br />
- Elegir una zona representativa y <strong>de</strong>sinfectar esta con <strong>el</strong> alcohol al 70%<br />
- Se carga la jeringa <strong>de</strong> tuberculina con 0,2 ml <strong>de</strong> solución salina estéril más los<br />
antimicrobianos; estando lista la jeringa, se escoge un área <strong>de</strong>colorada <strong>de</strong> la<br />
pápula o <strong>de</strong>l bor<strong>de</strong> no necrotizado <strong>de</strong> la úlcera, procediéndose a punzar e<br />
inyectar suavemente <strong>el</strong> contenido <strong>de</strong> la jeringa<br />
- Inmediatamente se aspira, haciendo girar suavemente la aguja en abanico, la<br />
obtención <strong>de</strong> escasas gotas <strong>de</strong>be manejarse cuidadosamente tratando <strong>de</strong> no<br />
contaminarlas<br />
- Se proce<strong>de</strong> al sembrado en los tubos <strong>de</strong> cultivo, con la protección <strong>de</strong>l mechero,<br />
una gota por tubo con tapa rosca, a la cual se le aña<strong>de</strong> 0,1 ml <strong>de</strong> solución salina<br />
con antimicrobianos<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 20 07/12/2003
- Los tubos se cultivan a 24 ºC, revisándolos cada día, en caso <strong>de</strong> no contar con<br />
una estufa <strong>de</strong> cultivo, se pue<strong>de</strong> mantener los tubos a temperatura ambiente,<br />
remitiéndolos a la brevedad posible al laboratorio más cercano <strong>de</strong> la red.<br />
CULTIVO DE BIOPSIA:<br />
• Muestra: Tejido<br />
• Material y Equipo requerido: Todo <strong>el</strong> material requerido <strong>para</strong> <strong>el</strong> aspirado y a<strong>de</strong>más:<br />
- “Punch sacabocados” estériles <strong>de</strong> 2 y 4 mm, (<strong>de</strong> preferencia <strong>de</strong>sechables, se<br />
utilizara <strong>el</strong> más pequeño en lesiones <strong>de</strong> cara o partes nobles).<br />
- Bisturí con hoja 20 o 21<br />
- Dos Pinzas estériles<br />
- Una tijera <strong>de</strong> punta estéril<br />
- Xilocaina al 2%<br />
- Pap<strong>el</strong> filtro<br />
- Mortero o caja Petri<br />
- Viales<br />
• Procedimiento <strong>de</strong> la realización <strong>de</strong> la Biopsia:<br />
- Lavar generosamente la lesión con agua<br />
- Escoger un bor<strong>de</strong> representativo y “activo” <strong>de</strong> la úlcera.<br />
- Desinfectar con alcohol al 70%<br />
- Inyectar 1 mL. <strong>de</strong> anestésico (Xilocaina al 2%), en la zona escogida en forma <strong>de</strong><br />
abanico.<br />
- Introducir <strong>el</strong> punch, en <strong>el</strong> bor<strong>de</strong> <strong>de</strong> la lesión (tomando tejido sano y necrótico)<br />
haciendo rotar suavemente.<br />
- Retirar <strong>el</strong> punch y pinzar en fragmento, <strong>para</strong> que con <strong>el</strong> bisturí o tijera se corte la<br />
base <strong>de</strong>l fragmento y se <strong>de</strong>sprenda la muestra.<br />
- La herida sangrante <strong>de</strong>be ser presionada con gasa por un mínimo <strong>de</strong> 5 minutos,<br />
<strong>el</strong> operador evaluará si existe la necesidad <strong>de</strong> realizar un o dos puntos <strong>de</strong> sutura<br />
y cubrir la herida con apositos.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 21 07/12/2003<br />
7
- El fragmento <strong>de</strong> tejido se lo <strong>de</strong>posita en pap<strong>el</strong> filtro <strong>para</strong> absorber la sangre,<br />
evitar cualquier contaminación.<br />
- Se <strong>de</strong>posita <strong>el</strong> fragmento en una caja Petri o un vial que contenga solución salina<br />
más antimicrobianos, se espera 2 horas <strong>para</strong> continuar <strong>el</strong> proceso.<br />
- Se tritura la muestra en un mortero estéril (mortero <strong>de</strong> tubo) añadiendo 0,5 mL<br />
<strong>de</strong> solución salina con antimicrobianos. De no contar con mortero, se pue<strong>de</strong><br />
utilizar una caja Petri en la que ayudado por <strong>el</strong> bisturí se tritura la muestra en 0,5<br />
mL <strong>de</strong> solución salina y antimicrobianos.<br />
- El resultado <strong>de</strong>l triturado es un homogeneizado rosado que se lo recoge con una<br />
jeringa estéril o pipeta <strong>de</strong> Pasteur, <strong>para</strong> luego inocular 2 a 3 gotas por tubo <strong>de</strong><br />
medio <strong>de</strong> cultivo<br />
- El procedimiento <strong>de</strong>be estar ro<strong>de</strong>ado <strong>de</strong> medidas <strong>para</strong> evitar la contaminación<br />
bacteriana y micótica, utilizando campana <strong>de</strong> flujo laminar o mechero, <strong>de</strong><br />
acuerdo a las características <strong>de</strong>l centro don<strong>de</strong> se procese la muestra.<br />
• Lectura e Interpretación <strong>de</strong> Resultados:<br />
Si se cuenta con microscopio invertido se pue<strong>de</strong> leer los tubos <strong>de</strong> cultivo diariamente sin<br />
temor a contaminarlos en <strong>el</strong> proceso; si se cuenta con microscopios normales se utiliza la<br />
protección <strong>de</strong>l flujo laminar o mechero y con una asa <strong>de</strong> platino se revisan los tubos cada<br />
48 horas a partir <strong>de</strong>l tercer día (un tubo a la vez por días); se toma una gota <strong>de</strong>l<br />
sobrenadante <strong>para</strong> su observación al microscopio en búsqueda <strong>de</strong> promastigotes, la<br />
presencia <strong>de</strong> formas móviles indica positividad, <strong>de</strong>biéndose informar <strong>de</strong>talladamente en la<br />
hoja <strong>de</strong> resultados (Ver fotografías).<br />
- (+) Presencia <strong>de</strong> promastigotes.<br />
Los cultivos que permanecen negativos, se los <strong>de</strong>scarta a los 30 días.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 22 07/12/2003<br />
8
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 23 07/12/2003<br />
10<br />
9
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 24 07/12/2003<br />
11<br />
12
E.4. Inoculación a hámsters (Mesocricetus aureatus):<br />
Este procedimiento se pue<strong>de</strong> realizar <strong>de</strong> preferencia en trabajo sobre terreno, o búsqueda<br />
activa (en la zona rural) con la finalidad <strong>de</strong> aislar la cepa; al no existir medidas que<br />
garanticen un aislamiento en tubos <strong>de</strong> cultivo se utiliza este procedimiento que es más<br />
sencillo si se toman todas las medidas recomendadas.<br />
El material homogeneizado obtenido <strong>de</strong> la úlcera por medio <strong>de</strong> la aspiración o biopsia, se lo<br />
inocula al animal <strong>de</strong> laboratorio por medio <strong>de</strong> una jeringa <strong>de</strong> insulina (<strong>de</strong> 1 mL), inoculando<br />
intra<strong>de</strong>rmicamente en <strong>el</strong> área <strong>de</strong> la nariz o dorso <strong>de</strong> las patas traseras.<br />
• Se utiliza Hámster dorados (<strong>de</strong> preferencia machos) <strong>de</strong> 150-200 g <strong>de</strong> peso y mayores a<br />
11 semanas <strong>de</strong> edad.<br />
• Los animales inoculados <strong>de</strong>ben ser enviados a un bioterio, <strong>de</strong>bidamente i<strong>de</strong>ntificados,<br />
con atención especial, se los revisa cada semana tratando <strong>de</strong> <strong>de</strong>tectar en las zonas don<strong>de</strong><br />
se ha inoculado, generalmente la presencia <strong>de</strong> inflamación (enrojecimiento) o la<br />
aparición <strong>de</strong> una pápula, constituyen evi<strong>de</strong>ncia <strong>de</strong> infección por Leishmania (Ver<br />
fotografías).<br />
• En <strong>el</strong> Hámster positivo, <strong>para</strong> excluir una inflamación con la contaminación <strong>de</strong>l proceso<br />
se proce<strong>de</strong> a la confirmación <strong>de</strong>l caso y recuperación <strong>de</strong> la cepa por medio <strong>de</strong>:<br />
- frotis <strong>de</strong> la lesión<br />
- aislamiento por aspiración y resembrado en medios <strong>de</strong> cultivo<br />
- sacrificio <strong>de</strong>l animal y procesamiento <strong>de</strong> sus patas<br />
• Al animal negativo, sé lo sacrifica a los 3 meses <strong>para</strong> proce<strong>de</strong>r a la necropsía <strong>para</strong><br />
realizar cultivos <strong>de</strong> bazo e hígado.<br />
13<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 25 07/12/2003<br />
14
E.5.Diagnóstico Histopatológico:<br />
El estudio histopatológico <strong>de</strong> una muestra (biopsia <strong>de</strong> lesión), solo confirma <strong>el</strong> diagnóstico<br />
cuando <strong>el</strong> patólogo reporta la existencia <strong>de</strong> amastigotes, su sensibilidad es menor al examen<br />
directo y frecuentemente solo se informa como “reacción inflamatoria <strong>de</strong> tipo<br />
granulomatosa compatible con Leishmaniosis”.<br />
• Material:<br />
- bisturí<br />
- viales (frascos) conteniendo formol al 10%<br />
- etiquetas y ficha <strong>de</strong> envío <strong>de</strong> muestras<br />
• Procedimiento:<br />
- Se toma la muestra <strong>de</strong> una región representativa previamente i<strong>de</strong>ntificada (bor<strong>de</strong><br />
<strong>de</strong> una úlcera en pi<strong>el</strong> o lesión secundaria activa <strong>de</strong> mucosas).<br />
- Con <strong>el</strong> bisturí se proce<strong>de</strong> a realizar un corte mínimo que nos permita obtener<br />
parte <strong>de</strong> tejido sano y bor<strong>de</strong> <strong>de</strong> la úlcera o lesión activa.<br />
- La fracción <strong>de</strong> tejido es introducido inmediatamente al frasco que contiene<br />
formol al 20%<br />
- Se rotula la muestra con <strong>el</strong> nombre <strong>de</strong>l paciente y datos importantes <strong>de</strong> su<br />
enfermedad y se envía la muestra al laboratorio Regional más cercano<br />
- En <strong>el</strong> laboratorio <strong>de</strong> referencia, se proce<strong>de</strong> a la inclusión <strong>de</strong>l pedazo <strong>de</strong> tejido en<br />
<strong>para</strong>fina, <strong>para</strong> su posterior corte con micrótomo, los cortes montados en un porta<br />
objetos, se tiñen con Tinción Universal (hematoxilina –Eosina) y se observan al<br />
microscopio.<br />
• Lectura e Interpretación <strong>de</strong> Resultados: La histopatología es muy variable en función<br />
a la especie <strong>para</strong>sitaria, evolución clínica <strong>de</strong> la enfermedad, etc., por lo que es difícil<br />
señalar parámetros estándar.<br />
• Los procesos <strong>de</strong> Inmunohistopatologia, con la utilización <strong>de</strong> anticuerpos policlonales<br />
(53) o monoclonales, permiten un diagnóstico específico y sensible aunque más<br />
costoso.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 26 07/12/2003<br />
15
E.6.Intra<strong>de</strong>rmoreacción <strong>de</strong> Montenegro (IDR), Leishmanina:<br />
Fundamento :<br />
Es una prueba <strong>de</strong> hipersensibilidad retardada(inmunidad c<strong>el</strong>ular) que pone en evi<strong>de</strong>ncia la<br />
presencia o contacto con <strong>el</strong> parásito, Al introducir antígeno en la cara anterior, tercio<br />
medio <strong>de</strong>l antebrazo, se produce una reacción tisular a las 48 a 72 hs. Que se manifiesta por<br />
induración en <strong>el</strong> sitio <strong>de</strong> la inoculación.<br />
Es una herramienta complementaria <strong>para</strong> <strong>el</strong> diagnostico<br />
Fundamento principio <strong>de</strong>l procedimiento:<br />
Se recomienda utilizarla en centros <strong>de</strong> I niv<strong>el</strong> periféricos o sobre terreno en los siguientes<br />
casos:<br />
- En pacientes con sospecha <strong>de</strong> la enfermedad<br />
- En pacientes con duda diagnóstica, con lesión activa <strong>de</strong> más <strong>de</strong> 4 semanas <strong>de</strong><br />
evolución.<br />
- Pacientes con lesiones tórpidas o atípicas.<br />
- Pacientes en estadio latente con enfermedad antigua o cicatrizada, que presenten<br />
signo sintomatología cutánea mucosa.<br />
• Material y reactivos:<br />
- Leishmanina <strong>de</strong> 30 ug?ml (Ag obtenidos a partir <strong>de</strong> promastigotes)<br />
- Jeringa estéril <strong>de</strong> 1 ml (insulina o tuberculina)<br />
- Alcohol al 70%<br />
- +Algodón<br />
- Regla graduada en mm<br />
- Bolígrafo<br />
• Procedimiento:<br />
- Desinfectar con alcohol al 70% la región <strong>de</strong> la cara anterior, tercio medio <strong>de</strong>l<br />
antebrazo.<br />
- Inyectar vía intradérmica 0.1 ml <strong>de</strong> la leishmanina en la superficie escogida.<br />
- Llenar la ficha epi<strong>de</strong>miológica y <strong>el</strong> cua<strong>de</strong>rno <strong>de</strong> registro con los datos <strong>de</strong>l<br />
paciente y marcar <strong>el</strong> perímetro <strong>de</strong> la zona <strong>de</strong> inoculación con <strong>el</strong> bolígrafo<br />
poniendo la fecha.<br />
- Recomendar al paciente las siguientes observaciones: No tocar ni rascarse la<br />
zona, no emplear cremas, alcohol u otras sustancias en la zona, no frotarse en <strong>el</strong><br />
área <strong>de</strong> la punción, no beber bebidas alcohólicas<br />
El paciente que esta infectado, presenta una reacción <strong>de</strong> hipersensibilidad al antígeno <strong>de</strong> la<br />
leishmanina, que se manifiesta con induración, e<strong>de</strong>ma y enrojecimiento.<br />
• Lectura e interpretación <strong>de</strong>l resultado:<br />
Se <strong>de</strong>be leer entre las 48 a 72 horas <strong>de</strong> inyectado <strong>el</strong> antígeno<br />
El paciente que esta infectado, presenta una reacción <strong>de</strong> hipersensibilidad al antígeno <strong>de</strong> la<br />
Leishmanina, que se manifiesta con induración, e<strong>de</strong>ma y enrojecimiento.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 27 07/12/2003
Lectura:<br />
- Se <strong>de</strong>limita <strong>el</strong> área <strong>de</strong> induración utilizando un bolígrafo, marcando la periferia o<br />
bor<strong>de</strong> <strong>de</strong> la induración <strong>de</strong>terminado con la yema <strong>de</strong> los <strong>de</strong>dos en los cuatro<br />
cuadrantes; también se pue<strong>de</strong> buscar con <strong>el</strong> bolígrafo un área <strong>de</strong> resistencia en<br />
un trazado <strong>de</strong> la periferia hacia <strong>el</strong> punto <strong>de</strong> inoculación.<br />
- Se proce<strong>de</strong> a medir <strong>el</strong> diámetro solamente <strong>de</strong>l área indurada (pápula) por medio<br />
<strong>de</strong> una regla graduada en mm; <strong>de</strong>be evitarse confusión con <strong>el</strong> área eritematosa<br />
que generalmente es más amplia.<br />
Si <strong>el</strong> diámetro <strong>de</strong> la induración es <strong>de</strong> 5 mm o mayor se consi<strong>de</strong>ra la IDRM positiva.<br />
Algunas veces la reacción es tan fuerte que pue<strong>de</strong> haber necrosis en <strong>el</strong> punto <strong>de</strong> inoculación<br />
(9-33-35-36).<br />
16<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 28 07/12/2003<br />
17
E.7.Prueba Inmunoenzimática (ELISA):<br />
La prueba <strong>de</strong> ELISA (Enzyme Linked Immuno Sorbent Assay) es una prueba sensible que<br />
nos permite <strong>de</strong>tectar y cuantificar anticuerpos en fluidos biológicos, principalmente suero<br />
sanguíneo (20, 26, 46, 63).<br />
El antígeno (Ag) se lo fija (adsorbe) a una superficie sólida (placa <strong>de</strong> poliestireno); es<br />
reconocido por <strong>el</strong> anticuerpo específico (Ac) existente en <strong>el</strong> suero <strong>de</strong>l paciente, esta<br />
reacción antígeno-anticuerpo <strong>de</strong> rev<strong>el</strong>ado por un conjugado que esta constituido por una<br />
anti-inmunoglobulina humana marcada por una enzima (ej: peroxidasa); posteriormente se<br />
adiciona <strong>el</strong> sustrato no cromático (ej:peróxido <strong>de</strong> hidrogeno), <strong>el</strong> cual, por acción <strong>de</strong> la<br />
enzima es transformado en un producto coloreado y soluble que se pue<strong>de</strong> leer en forma<br />
visual o con un fotocolorimetro <strong>para</strong> <strong>de</strong>terminar la <strong>de</strong>nsidad óptica.<br />
Las principales características <strong>de</strong> la enzima a usarse son:<br />
- <strong>de</strong>be ser estable<br />
- <strong>de</strong>be presentar alta actividad específica<br />
- <strong>de</strong>be ser <strong>de</strong> fácil unión covalente al antígeno o al anticuerpo.<br />
• MUESTRA: Suero<br />
• MATERIAL Y EQUIPO REQUERIDO:<br />
- Antígeno: proteínas solubles <strong>de</strong> promastigotes <strong>de</strong> Leishmania sp.<br />
- Sueros:<br />
*Sueros control positivo, con título <strong>de</strong> anticuerpos conocido.<br />
*Sueros control negativo.<br />
*Sueros <strong>de</strong> muestras problema <strong>de</strong> los pacientes<br />
- Conjugado: inmunoglobulinas <strong>de</strong> carnero o cabra anti inmunoglobulinas<br />
humanas marcadas con exima-IgG y anti-IgM humanas, marcadas con la enzima<br />
peroxidasa.<br />
- Tampón fosfato salino (PBS) 0.01 M, pH 7.2<br />
- Tween 20 al 0.05%<br />
- Tampón carbonato-bicarbonato 0.06 m, pH 9.6<br />
- HCL 2 N o H2SO4 2 N<br />
- KOH 0.1 N<br />
- Sustrato soluble: peróxido <strong>de</strong> hidrógeno y ortophenilendiamina OPD) como<br />
cromógeno<br />
- Albúmina bovina sérica (BSA) al 1% o leche en polvo <strong>de</strong>scremada al 5% <strong>para</strong><br />
bloqueo <strong>de</strong> sitios activos libres <strong>de</strong> la placa<br />
- Micropipeta multicanal (200 uL)<br />
- Micropipetas (20 a 200 uL)<br />
- Placas <strong>de</strong> microtitulación <strong>de</strong> poliestireno.<br />
- Cámara húmeda (pap<strong>el</strong> absorbente hume<strong>de</strong>cido con agua <strong>de</strong>ntro <strong>de</strong> un envase<br />
plástico cerrado)<br />
- Puntillas <strong>de</strong> pipetas <strong>para</strong> 20, 100 y 200 uL, puntas <strong>de</strong>scartables.<br />
- Refrigerador<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 29 07/12/2003
- Estufa a 37grados centígrados<br />
- Lector ELISA <strong>para</strong> microplacas<br />
- Impresora <strong>para</strong> lector ELISA<br />
• PROCEDIMIENTO:<br />
- Diluir <strong>el</strong> antígeno en tampón carbonato-bicarbonato 0.06 M, pH 9.6<br />
- Sensibilizar las placas colocando 100 ul <strong>de</strong>l antígeno diluido en cada pocillo <strong>de</strong><br />
la placa.<br />
- Colocar las placas en cámara húmeda e incubar a 37ºC por 2 horas o en<br />
refrigeración (4C) por 18 horas.<br />
- Lavar 3 veces con PBS -Tween 20 al 0.05% por 10 minutos cada vez.<br />
- Adicionar 200 ul <strong>de</strong> solución BSA al 1% o leche en polvo <strong>de</strong>scremada al 5%<br />
(diluido en tampón carbonato-bicarbonato 0.06 M. pH 9.6) en cada pocillo e<br />
incubar en cámara húmeda a 37ºC por una hora. Esto evitará reacciones<br />
inespecíficas.<br />
- Lavar 3 veces con PBS-Tween 20 al 0.05% por diez minutos cada vez.<br />
- Diluir los sueros problema al doble a partir <strong>de</strong> 1/10 en PBS-Tween 20 al 0.05%<br />
(1/10, 1/20, 1/40,1/80, ...); colocar 100 uL en cada pocillo e incubar en cámara<br />
húmeda a 37ºC por dos horas.<br />
- Lavar 3 veces con PBS -Tween 20 al 0.05% por 10 minutos cada vez con una<br />
leve agitación.<br />
- Adicionar 100 uL <strong>de</strong> conjugado e incubar en cámara húmeda a 37ºC por una<br />
hora. Previamente, diluir <strong>el</strong> conjugado según su título en PBS-Tween 20 al<br />
0.05% .<br />
- Lavar 3 veces con PBS - Tween 20 al 0.05% por 10 minutos cada vez.<br />
- Colocar rápidamente 100 uL <strong>de</strong>l sustrato recién pre<strong>para</strong>do e incubar en<br />
oscuridad (lejos <strong>de</strong> la luz), por 30 minutos a temperatura ambiente.<br />
- Detener la reacción adicionando 100 uL <strong>de</strong> HCL 2N o H2SO4 2N en cada<br />
pocillo.<br />
- Realizar la lectura utilizando un lector <strong>de</strong> ELISA con filtro <strong>de</strong> 492 nm.<br />
• LECTURA E INTERPRETACION DE RESULTADOS:<br />
En caso que la muestra sea positiva, se forma <strong>el</strong> complejo antígeno-anticuerpo específico,<br />
manifestado por un producto coloreado y soluble.<br />
- Resultado Cuantitativo: Se obtiene midiendo las <strong>de</strong>nsida<strong>de</strong>s ópticas (grados <strong>de</strong><br />
absorbancia) <strong>de</strong> los productos solubles, mediante <strong>el</strong> lector <strong>de</strong> ELISA<br />
(espectrofotómetro).<br />
=<strong>el</strong> blanco <strong>de</strong>be dar una lectura inferior a 0.100<br />
=los sueros negativos dan lecturas menores a 0.200.<br />
=los sueros positivos son mayores a 0.200<br />
• FACTORES DE ERROR:<br />
Los resultados falsos positivos y falsos negativos su<strong>el</strong>en <strong>de</strong>berse a reacciones inespecíficas:<br />
- Reacciones cruzadas con otros tripanosomi<strong>de</strong>os, principalmente Trypanosoma.<br />
- Bloqueo ina<strong>de</strong>cuado <strong>de</strong> las placas.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 30 07/12/2003
- Antígenos y/o conjugados mal titulados.<br />
- Solución cromógena pre<strong>para</strong>da con <strong>de</strong>masiada anterioridad (más <strong>de</strong> 15 min).<br />
- Paciente con factor reumatoi<strong>de</strong> (FR) positivo ó anticuerpos antinucleares<br />
(ANAS).<br />
- Placas <strong>de</strong> microtitulación ina<strong>de</strong>cuadas.<br />
• OBSERVACIONES: Esta técnica <strong>de</strong>be ser estandarizada por cada laboratorio<br />
- Las concentraciones óptimas <strong>de</strong> los antígenos y los conjugados <strong>de</strong>berán ser<br />
<strong>de</strong>terminadas por titulación en bloque.<br />
- Las muestras <strong>de</strong> sueros <strong>de</strong>berán ser trabajadas por duplicado y diluidas en serie a<br />
partir <strong>de</strong> 1/10.<br />
- En la realización <strong>de</strong> cada prueba se utilizarán tanto los sueros controles positivos<br />
<strong>de</strong> título conocido como los sueros negativos diluidos en serie. Esto permitirá<br />
<strong>de</strong>terminar los títulos <strong>de</strong> las muestras en estudio.<br />
- El volumen <strong>de</strong> los componentes, así como los tiempos <strong>de</strong> incubación <strong>de</strong> las<br />
distintas etapas <strong>de</strong> la técnica <strong>de</strong> ELISA, pue<strong>de</strong>n variar <strong>de</strong> acuerdo a la<br />
estandarización que realice cada laboratorio.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 31 07/12/2003
E.8.Inmunofluorescencia indirecta (IFI):<br />
Esta prueba permite <strong>de</strong>tectar la presencia <strong>de</strong> anticuerpos específicos anti Leishmania (IgG e<br />
IgM) en suero <strong>de</strong> pacientes, don<strong>de</strong> los promastigotes <strong>de</strong> Leishmania (antígenos) son<br />
adheridos a un portaobjetos. El complejo Ag Ac rev<strong>el</strong>ado con isotiocianato <strong>de</strong> fluoresceína<br />
es visualizado al microscopio <strong>de</strong> inmunofluorescencia.<br />
Con promastigotes <strong>de</strong> Leishmania (antígenos), adheridos en un. En caso <strong>de</strong> ser positiva la<br />
reacción antígeno-anticuerpo es rev<strong>el</strong>ado con isotiocianato <strong>de</strong> fluoresceína es visualizada<br />
con <strong>el</strong> microscopio <strong>de</strong> inmunfluorescencia por medio <strong>de</strong> la adición <strong>de</strong> una antiinmunoglobulina<br />
humana marcada con isotiocianato <strong>de</strong> fluoresceína, la reacción<br />
fluorescente da un color ver<strong>de</strong> manzana brillante a los promastigotes (ver fotografía).<br />
• Muestra suero sanguíneo <strong>de</strong> un minimo <strong>de</strong> 2ml <strong>de</strong> sangre.<br />
• MATERIAL Y EQUIPO REQUERIDO:<br />
- Antígeno: promastigotes <strong>de</strong> Leishmania sp. Fijado en placa<br />
- Sueros:<br />
*Sueros control positivo con título conocido <strong>de</strong> anticuerpo.<br />
*Sueros control negativo<br />
*Sueros problema <strong>de</strong> pacientes con sospecha <strong>de</strong> Leishmaniosis<br />
- Conjugado: anti-Inmunoglobulinas humanas marcada con isotiocianato <strong>de</strong><br />
fluorescencia.<br />
- Tampón fosfato salino (PBS) pH 7.2<br />
- Tampón fosfato salino (PBS) pH 7.2 – Tween 80 a 1%<br />
- Azul <strong>de</strong> Evans.<br />
- Glicerina tamponada, pH 8.5<br />
- Placas <strong>de</strong> microtitulación <strong>de</strong> poliestireno.<br />
- Tubos <strong>de</strong> hemolisis <strong>para</strong> dilución <strong>de</strong> suero.<br />
- Pap<strong>el</strong> filtro.<br />
- Cámara húmeda (placa petri conteniendo pap<strong>el</strong> absorbente húmedo).<br />
- Microscopio <strong>de</strong> fluorescencia<br />
• PROCEDIMIENTO PREPARACION DE ANTIGENO:<br />
- Se requiere una línea constante <strong>de</strong> cultivo <strong>de</strong> promastigotes <strong>de</strong> Leishmania.<br />
- Micropipetas / tips <strong>de</strong>scartables<br />
- Jarros couplin<br />
- El momento <strong>de</strong> máximo crecimiento (7 a 8 días), se toma la parte liquida <strong>de</strong>l<br />
medio y se la centrifuga a 2500 rpm/10 minutos.<br />
- Se <strong>de</strong>scarta <strong>el</strong> sobrenadante y se lava <strong>el</strong> sedimento con PBS, dos veces, por<br />
medio <strong>de</strong> la centrifugación a 2500 r.p.m. por 10 minutos.<br />
- Descartar <strong>el</strong> sobrenadante y resuspen<strong>de</strong>r <strong>el</strong> sedimento con PBS-formalina al 2%<br />
y se <strong>de</strong>ja reposar durante 24 horas.<br />
- Descartar <strong>el</strong> sobrenadante y lavar <strong>el</strong> sedimento con PBS, dos veces, por medio<br />
<strong>de</strong> la centrifugación a 2500 r.p.m. por 10 minutos.<br />
- Descartar <strong>el</strong> sobrenadante y diluir <strong>el</strong> sedimento <strong>de</strong> la centrifugación final en PBS<br />
hasta obtener <strong>de</strong> 25 a 30 parásitos por campo microscópico (objetivo <strong>de</strong> 40 X).<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 32 07/12/2003
- Se <strong>de</strong>positan 10 uL <strong>de</strong> la solución obtenida en cada campo en que están<br />
divididas las láminas <strong>de</strong> microscopía; <strong>de</strong>jar secar a temperatura ambiente.<br />
- Se guardan los porta objetos (láminas con Ag) en cajas porta-láminas y se<br />
almacenan a – 70ºC ó a –20ªC, hasta su uso.<br />
• PROCEDIMIENTO<br />
- Descong<strong>el</strong>ar las placas necesarias, <strong>de</strong>jándolas a temperatura ambiente por una<br />
hora.<br />
- Se retiran un número <strong>de</strong> láminas con antígeno <strong>de</strong>l cong<strong>el</strong>ador <strong>de</strong> acuerdo a los<br />
requerimientos y se las <strong>de</strong>ja a temperatura ambiente por una hora.<br />
- Hacer las diluciones correspondientes con PBS en tubos <strong>de</strong> hemólisis (1/20,<br />
1?40, 1/80, 1/160)<br />
- Se colocan 20 uL <strong>de</strong> cada dilución <strong>de</strong>l suero sobre las áreas <strong>de</strong> la lámina que<br />
contiene <strong>el</strong> antígeno fijado; es necesario llevar un protocolo (anotación) <strong>de</strong> la<br />
localización <strong>de</strong> los sueros problema y controles en los pocillos.<br />
- Se incuban las láminas en cámara húmeda y estufa a 37ºC, por 30 minutos.<br />
- Se retiran las láminas <strong>de</strong> la estufa y se lavan 3 veces con PBS:<br />
Primer Lavado: con una pizeta que contiene PBS se lavan las láminas evitando<br />
que <strong>el</strong> chorro caiga directamente sobre las muestras.<br />
Segundo Lavado: colocar las láminas en recipientes (Koplin o caja Petri)<br />
cubriéndolas con PBS por 10 minutos, luego <strong>de</strong>scartar <strong>el</strong> PBS.<br />
Tercer Lavado: se proce<strong>de</strong> como en <strong>el</strong> segundo lavado.<br />
- Utilizando pap<strong>el</strong> filtro retirar cuidadosamente <strong>el</strong> exceso <strong>de</strong> PBS <strong>de</strong>l contorno <strong>de</strong><br />
las pre<strong>para</strong>ciones.<br />
- Colocar sobre cada área que contiene <strong>el</strong> antígeno, 20 uL <strong>de</strong>l conjugado e incubar<br />
en cámara húmeda a 37ºC por 30 minutos. Previamente se diluye <strong>el</strong> conjugado<br />
según su título en tampón PBS-Tween 80 al 1% o azul <strong>de</strong> Evans al 0.2%<br />
- Lavar como se indica en párrafos anteriores.<br />
- Se seca la lámina cuidadosamente con pap<strong>el</strong> filtro (como se indica<br />
anteriormente), luego se coloca glicerina tamponada e inmediatamente se cubre<br />
con laminilla cubre objetos.<br />
- La lectura en microscopio <strong>de</strong> inmunofluorescencia se realiza inmediatamente<br />
con objetivo <strong>de</strong> 40 X.<br />
• LECTURA E INTERPRETACION DE RESULTADOS:<br />
REACCION POSITIVA:<br />
- La presencia <strong>de</strong> anticuerpos contra las leishmanias en <strong>el</strong> suero dan lugar a la<br />
formación <strong>de</strong>l complejo antígeno-anticuerpo específico rev<strong>el</strong>ado por la<br />
coloración fluorescente color ver<strong>de</strong> manzana.<br />
- El suero es titulado consi<strong>de</strong>rando <strong>el</strong> valor mayor <strong>de</strong> dilución que presente<br />
fluorescencia nítida en toda la superficie <strong>de</strong>l parásito.<br />
Se reporta <strong>el</strong> titulo <strong>de</strong> anticuerpos consi<strong>de</strong>rando la mayor dilución que presente dilución<br />
nítida en la superficie <strong>de</strong>l parásito.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 33 07/12/2003
REACCION NEGATIVA:<br />
- En las reacciones negativas no hay fluorescencia, <strong>el</strong> parásito presenta una<br />
coloración café rojiza.<br />
- El umbral <strong>de</strong> reactividad <strong>para</strong> anticuerpos totales generalmente es una dilución<br />
<strong>de</strong> 1/40.<br />
FACTORES DE ERROR:<br />
Las reacciones falsas positivas y falsas negativas pue<strong>de</strong>n ser causadas por:<br />
- Reacciones cruzadas con Tripanosoma cruzi.<br />
- Conjugados <strong>de</strong> título ina<strong>de</strong>cuado.<br />
- Mezcla <strong>de</strong> distintos sueros.<br />
- Conjugados y sueros control mal conservados.<br />
- Iluminación <strong>de</strong>ficiente <strong>de</strong>l microscopio (lám<strong>para</strong> <strong>de</strong> iluminación gastada).<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 34 07/12/2003<br />
18
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 35 07/12/2003
E.9. ENVIO DE MUESTRAS Y RESULTADO:<br />
• ENVIO DE LAMINAS:<br />
En <strong>el</strong> caso <strong>de</strong> tener un paciente con sospecha <strong>de</strong> Leishmaniosis (lesión primaria) en Niv<strong>el</strong> I,<br />
<strong>de</strong>berá hacerse un mínimo <strong>de</strong> 2 láminas por lesión:<br />
- Una se procesará en <strong>el</strong> Niv<strong>el</strong> I<br />
- La segunda se remitirá con <strong>el</strong> diagnóstico presuntivo y la ficha clínica -<br />
epi<strong>de</strong>miológica respectiva al laboratorio <strong>de</strong> referencia regional <strong>para</strong> su control<br />
<strong>de</strong> calidad.<br />
• ENVIO DE MATERIAL CULTIVADO Y SUEROS:<br />
La muestra, tomada siguiendo las recomendaciones <strong>de</strong> la presente guía <strong>de</strong>be enviárs<strong>el</strong>a<br />
tomando todas las medidas <strong>de</strong> bioseguridad <strong>de</strong>bido a que <strong>el</strong> material es altamente riesgoso,<br />
solo se recomienda <strong>el</strong> manejo en investigación o en laboratorios <strong>de</strong> Niv<strong>el</strong> III y IV.<br />
El tubo conteniendo la muestra <strong>de</strong>be ser colocado en forma vertical, envu<strong>el</strong>to al algodón<br />
<strong>de</strong>ntro <strong>de</strong> una cajita <strong>de</strong> cartón, en cuyo exterior se colocará una flechita indicando la<br />
posición en que se <strong>de</strong>be mantener la caja. Incluir ficha con datos clínicos y epi<strong>de</strong>miológicos<br />
<strong>de</strong>l paciente, la efecha y asegurarse que llegara a su <strong>de</strong>stino en <strong>el</strong> menor tiempo posible; no<br />
refrigerar.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 36 07/12/2003<br />
20<br />
19
• INFORME DE RESULTADOS:<br />
El resultado <strong>de</strong>l diagnóstico será remitido en dos copias:<br />
- al Programa <strong>de</strong> Control <strong>de</strong> las Leishmaniosis <strong>de</strong> la Dirección <strong>de</strong> Vigilancia<br />
Epi<strong>de</strong>miológica o Dirección <strong>de</strong> Control <strong>de</strong> enfermeda<strong>de</strong>s.<br />
- A los remitentes <strong>de</strong>l Niv<strong>el</strong> I, <strong>para</strong> <strong>el</strong> tratamiento <strong>de</strong>l paciente y la<br />
correspondiente inclusión en la Historia Clínica <strong>para</strong> fines estadísticos y<br />
epi<strong>de</strong>miológicos.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 37 07/12/2003
MINISTERIO DE SALUD Y PREVISIÓN SOCIAL<br />
Red Nacional <strong>de</strong> <strong>Laboratorio</strong>s <strong>de</strong> Salud (Leishmaniosis)<br />
Nombre y ap<strong>el</strong>lidos: ...............................................................................................<br />
Edad: ...................................... Municipio: ...................................<br />
Distrito: ......................... Área: ................ Sector: ........................................<br />
Servicio <strong>de</strong> Salud: .................................................................................................<br />
Responsable <strong>de</strong>l Programa: .................................................................................<br />
Examen solicitado.................................................................................................<br />
Fecha: ..................................................................................................................<br />
RESULTADOS<br />
• Descripción <strong>de</strong> a muestra:<br />
______________________________________________________________<br />
• Frotis:<br />
( ) Negativo ( ) Positivo, ................cruces<br />
Interpretación <strong>de</strong>l frotis:<br />
-Resultado Negativo: (-) No se observan formas <strong>para</strong>sitarias en 1.000 campos observados, o en un mínimo <strong>de</strong><br />
30 minutos <strong>de</strong> observación.<br />
-Resultado: (+) observación <strong>de</strong> ocasionales o escasos amastigotes solos o en pequeños grupos en forma<br />
intrac<strong>el</strong>ular (Macrófagos) o extrac<strong>el</strong>ular, 1 a 10 parásitos en 1.000 campos observados.<br />
-Resultado (++) observación entre 1 a 10 amastigotes en 100 campos observados en forma intra o<br />
extrac<strong>el</strong>ular.<br />
-Resultado: (+++) se observan abundantes amastigotes en nidos intra y extra c<strong>el</strong>ulares, 1 a 10 amastigotes en<br />
10 campos observados.<br />
-Resultado: (++++) se observan <strong>de</strong> 1 a 10 parásitos por campo<br />
-Resultado (+++++) se observan <strong>de</strong> 10 a 100 parásitos por campo<br />
-Resultado (++++++) se observan más <strong>de</strong> 100 parásitos por campo<br />
________________________________________________________________<br />
• Intra<strong>de</strong>rmo reacción <strong>de</strong> Montenegro (Leishmanina)<br />
( ) Negativo ( ) Positivo, ........ milímetros<br />
La lectura se realiza a las 48 o 72 horas y se consi<strong>de</strong>ra positivo si la induración es mayor a 5<br />
milímetros.<br />
_______________________________________________________________<br />
• Biopsia (Histopatologia)<br />
______________________________________________________________<br />
• Inmunofluorescencia indirecta: (IFI)<br />
• Enzimo inmuno ensayo (ELISA):<br />
_______________________________________________________________<br />
CONCLUSIONES:<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 38 07/12/2003
G. MERITO FOTOGRAFICO:<br />
Diseño <strong>de</strong> la carátula Mollinedo S. y Aranda R.; Formas clínicas <strong>de</strong> Leishmaniosis<br />
presentes en Bolivia<br />
Fotografía 20.- Dr. Bermú<strong>de</strong>z; Tubos Vacutainer con medio NNN, <strong>para</strong> realización <strong>de</strong><br />
cultivo en casos especiales en <strong>el</strong> I Niv<strong>el</strong> <strong>de</strong> atención.<br />
Todas las restantes fotografías fueron realizadas por <strong>el</strong> Dr. Sergio Mollinedo.<br />
Fotografía 1.- Toma <strong>de</strong> muestra por “punción rotación” por medio <strong>de</strong> palo (escarba<br />
dientes), <strong>para</strong> realizar frotis en búsqueda <strong>de</strong> amastigotes, tobillo izquierdo, Hospital Virgen<br />
<strong>de</strong> Chaguaya, Bermejo, Tarija.<br />
Fotografía 2.- Toma <strong>de</strong> muestra por “punción rotación” por medio <strong>de</strong> palo (escarba<br />
dientes), <strong>para</strong> realizar frotis en búsqueda <strong>de</strong> amastigotes, pierna izquierda, Palos Blancos,<br />
La Paz.<br />
Fotografía 3.- Toma <strong>de</strong> muestra por “raspado” con bor<strong>de</strong> posterior <strong>de</strong> lanceta, en bor<strong>de</strong> <strong>de</strong><br />
la úlcera en codo izquierdo, <strong>para</strong> realización <strong>de</strong> frotis y búsqueda <strong>de</strong> amastigotes, Hospital<br />
Virgen <strong>de</strong> Chaguaya, Bermejo, Tarija.<br />
Fotografía 4.- Toma <strong>de</strong> muestra por “raspado” con bor<strong>de</strong> posterior <strong>de</strong> lanceta, en bor<strong>de</strong> <strong>de</strong><br />
la úlcera en pierna, <strong>para</strong> realización <strong>de</strong> frotis y búsqueda <strong>de</strong> amastigotes, Hospital Virgen <strong>de</strong><br />
Chaguaya, Bermejo, Tarija.<br />
Fotografía 5.- Presión entre dos <strong>de</strong>dos <strong>de</strong>l bor<strong>de</strong> <strong>de</strong> la úlcera (halo inflamatorio o ro<strong>de</strong>te),<br />
hasta que se vu<strong>el</strong>va pálida (isquemia), teniendo listo <strong>el</strong> bisturi<br />
Fotografía 6.- Corte con bisturí y raspado en <strong>el</strong> bor<strong>de</strong> <strong>de</strong> la úlcera en halo inflamatorio o<br />
ro<strong>de</strong>te.<br />
Fotografía 7.- Toma <strong>de</strong> muestra <strong>para</strong> frotis por medio <strong>de</strong> “Punción Aspiración” en bor<strong>de</strong> <strong>de</strong><br />
la úlcera<br />
Fotografía 8.- Materiales <strong>para</strong> realización <strong>de</strong> biopsia (punch biopsy <strong>de</strong>scartable y mortero)<br />
Fotografía 9.- Biopsia <strong>de</strong>l bor<strong>de</strong> activo <strong>de</strong> la úlcera<br />
Fotografía 10.- Tubos con medio <strong>de</strong> cultivo NNN<br />
Fotografía 11.- Técnico realizando lectura al microscopio <strong>de</strong> frotis teñidos con Giemsa, en<br />
búsqueda <strong>de</strong> amastigotes, <strong>de</strong>lante <strong>de</strong> <strong>el</strong> tiene láminas <strong>de</strong> referencia.<br />
Fotografía 12.- Rosaceas (grupos <strong>de</strong> promastigotes unidos por sus flag<strong>el</strong>os) en medio <strong>de</strong><br />
cultivo.<br />
Fotografía 13.- Animal <strong>de</strong> laboratorio (Hamster) con lesiones en pata <strong>de</strong>lantera y hocico<br />
Fotografía 14.- Patas <strong>de</strong> animal <strong>de</strong> laboratorio (Hamster) tras haber sido inoculado con<br />
Leishmania amazonensis con importantes lesiones “en guante <strong>de</strong> boxeador”<br />
Fotografía 15.- Nidos <strong>de</strong> amastigotes en corte <strong>de</strong> tejido observados al microscopio<br />
Fotografía 16.- Inoculación <strong>de</strong> la IDR <strong>de</strong> Montenegro en tercio medio, cara anterior <strong>de</strong><br />
antebrazo, formación <strong>de</strong>l habon<br />
Fotografía 17.- Medición <strong>de</strong> la reacción cutánea (induración) <strong>de</strong> la IDR <strong>de</strong> Montenegro a<br />
las 72 horas.<br />
Fotografía 18.- Promastigotes observado en microscopio <strong>de</strong> Inmunofluorescencia, <strong>de</strong>spués<br />
<strong>de</strong> realización <strong>de</strong> la técnica <strong>de</strong> (IFI).<br />
Fotografía 19.- Envío <strong>de</strong> placas (láminas <strong>de</strong> frotis), <strong>para</strong> su lectura o control <strong>de</strong> calidad<br />
Fotografía 21.- Tinción Giemsa, Técnicos diluyendo la solución madre; Riberalta, Beni<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 39 07/12/2003
H.BIBLIOGRAFIA:<br />
1. Alvar Ezquerra Jorge; (1997); Las Leishmaniosis <strong>de</strong> la Biología al control; Junta <strong>de</strong><br />
Castilla y León; Zamora, España.<br />
2. Angles R.; Le Pont F.; Desjeux P.; (1.982); Visceral canine Leishmaniosis in<br />
Bolivia. Transactions of the Royal Society of Tropical Medicine and Hygiene, 76,<br />
704.<br />
3. Argemiro D.O.; Costa S.; Barbosa A.; Orge M.; Carvalho J.; (1.997) Asymptomatic<br />
Leishmania chagasi Infection in r<strong>el</strong>atives and neighbors of patients with Visceral<br />
Leishmaniosis; Memorias do Instituto Oswaldo Cruz; Vol. 92(1), Jan/Feb.<br />
4. Arias J., Monteiro, P.S., Zicker, F., (1.996), The Reemergence of Visceral<br />
Leishmaniosis in Brazil, Emerging Infectious <strong>de</strong>sease, Vol 2 Nº 2.<br />
5. Balcazar Juan Manu<strong>el</strong>, (1.956); Historia <strong>de</strong> la Medicina en Bolivia, Ediciones<br />
Juventud, La Paz Bolivia.<br />
6. Balcazar Juan Manu<strong>el</strong>, (1.955); Epi<strong>de</strong>miología en Bolivia, Ediciones Juventud, La<br />
Paz Bolivia.<br />
7. Barroso Boris; (2001); Biología y Ecología <strong>de</strong> Leishmania sp. en canes infestados<br />
en <strong>el</strong> distrito <strong>de</strong> salud V, Bermejo Tarija; Tesis <strong>de</strong> Licenciatura, Facultad <strong>de</strong> ciencias<br />
agrícolas y pecuarias, Universidad Tomas Frias.<br />
8. Bryceson A.D.M., (1.969), Diffuse cutaneous Leishmaniosis in Ethiopia I. The<br />
Clinical and Histological features of the disease. Trans. Roy. Soc. Trop. Med. Hyg.,<br />
63, 708-737.<br />
9. Convit J., Pinardi, M.E., and Randon, A.J., (1.972), Diffuse cutaneous<br />
Leishmaniosis: a disease due to an immunological <strong>de</strong>fect of the host. Trans. Roy.<br />
Soc. Trop. Med. Hyg., 66, 603-610.<br />
10. Dario V<strong>el</strong>ez Ivan & Agu<strong>de</strong>lo Sonia; (1996); Leishmaniosis: <strong>Manual</strong> <strong>de</strong><br />
procedimientos <strong>para</strong> <strong>el</strong> diagnóstico <strong>de</strong> la Leishmaniosis cutánea americana; editorial<br />
Universidad <strong>de</strong> Antioquia; Me<strong>de</strong>llín, Colombia.<br />
11. De Arruda W.; Da Costa F.; Nahas S.; Rosenf<strong>el</strong>d G.; (1.949); Leishmaniose<br />
Visceral Americana: constatacao <strong>de</strong> dois casos; Brasil Med. 63, 8-9<br />
12. De<strong>de</strong>t J.P.; (1.999); Les Leishmanioses; Universites Francophones; Ellipses Aup<strong>el</strong>f<br />
/ Uref<br />
13. D<strong>el</strong>gado, O., F<strong>el</strong>iciang<strong>el</strong>i M.M., Gomez, B., Alvarado, J., Garcia, L., B<strong>el</strong>lo, C.,<br />
(1.998); The re-emergence of American Visceral Leishmaniosis in an old focus in<br />
Venezu<strong>el</strong>a: present situation of human and canine infections, Parasite, Dec, 5(4):<br />
317-323.<br />
14. Desjeux P.; Le Pont F.; Mollinedo S.; (1.986) Visceral Leishmaniosis in the La Paz<br />
Departement of Bolivia; Mem Inst. Oswaldo Cruz; Rio <strong>de</strong> janeiro; Vol 81: 96.<br />
15. Desjeux P.; Le Pont F.; Mollinedo S. (1.989); Etu<strong>de</strong> epi<strong>de</strong>miologique <strong>de</strong>s<br />
Leishmanioses du Departement <strong>de</strong> La Paz Bolivie; Raports Commisions <strong>de</strong>s<br />
Communautes Europeennes; 248 – 252.<br />
16. Desjeux P., S. Mollinedo, F. Le Pont, A. Pare<strong>de</strong>s and G. Ugarte, (1.987); cutaneous<br />
Leishmaniosis in Bolivia. A study of 185 human cases from Alto Beni (La Paz<br />
Department) Isolation and isoenzyme characterization of 26 strains of Leishmania<br />
brasiliensis brasiliensis. Transactions of the Royal Society of Tropical Medicine<br />
and Hygene. 81, 742-746.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 40 07/12/2003
17. Desjeux P.; Le Pont F.; Mollinedo S.; Tibayrenc M. (1.986); Les leishmania <strong>de</strong><br />
Bolivie. I. Leishmania braziliensis Vianna, 1.911 dans les <strong>de</strong>partements <strong>de</strong> La Paz<br />
et du Beni. Premiers isolements <strong>de</strong> souches d’origen humaine. Caracterisation<br />
enzymatique. Coll. Int. CNRS/INSER; IMEEE, Montp<strong>el</strong>lier , pp401-410.<br />
18. Desjeux, P.; Aranda, E.; Aliaga, O.; Mollinedo, S.; (1.983); "Human visceral<br />
Leishmaniosis in Bolivia; First proven autochthonous case from los Yungas"; Trans.<br />
R. Soc. Med. Trop.Hyg.; 77 (6) p: 851-852.<br />
19. Dostrovsky A. & Sagher F.; (1.964); “The intracutaneous test in cutaneous<br />
Leishmaniosis”; Amm. Trop. Med. Parasit. 40, 265-269.<br />
20. Furuya, M., Mimori T., Gomez E.A.L., De Coron<strong>el</strong> V.V., Kawabata, M, and<br />
Hashiguchi Y., (1989), Epi<strong>de</strong>miological survey of Leishmaniosis using skin test and<br />
ELISA in Ecuador. Jpn. J. Trop. Med. Hyg, 17, 331-338.<br />
21. Garret Aillon Jorge (1.983), La espundia en Bolivia, observaciones <strong>de</strong>l Dr. Manu<strong>el</strong><br />
Antonio Vaca Diez. Comentario Histórico. Boletin Informativo <strong>de</strong> CENETROP. IX,<br />
1-5.<br />
22. Gatti G.; Boggino J. & Prieto C.; (1.939); Un nouveau foyer <strong>de</strong> leishmaniose<br />
viscerale en Amerique du Sud, Bulletin <strong>de</strong> la Societe <strong>de</strong> Pathologie Exotique, 67,<br />
387-395.<br />
23. Grimaldi G.; Leishmanioses tegumentareas. Aspectos Clínicos e Inmunopatológicos;<br />
Mem. Inst. Oswaldo cruz, Rio <strong>de</strong> janeiro, Vol 77 (2): 195-215, Abr/Jun.<br />
24. Grimaldi, G.Jr. and McMahon-Pratt, D., (1991); Leishmaniosis and its etiologigic<br />
agents in the new worl: and overview. In. T. sun (ed.), Progress in Clinical<br />
<strong>para</strong>sitology, vol 2. Fi<strong>el</strong>d and Wood medical Publishers, Inc., New York, 73-118.<br />
25. Golvan Y.J. & Ambroise-Thomas P.; (1.984); Les Nouv<strong>el</strong>les techniques en<br />
Parasitologie; Flammarion Me<strong>de</strong>cine Sciences, France.<br />
26. Guimaraes M.C.S.; C<strong>el</strong>este B.J.; Franco E.L.; (1.992); “Rendimiento diagnóstico <strong>de</strong><br />
la Inmunofluorescencia y <strong>el</strong> ensayo inmunoenzimático en sueros <strong>de</strong> pacientes con<br />
Leishmaniosis <strong>de</strong>l Noreste <strong>de</strong> Brasil”; Bol. Of. Sanit. Panam. 113(4).<br />
27. Hashigushi Y., De Coron<strong>el</strong>, V.V., and Gomez, E.A.L., (1.987), An<strong>de</strong>an<br />
Leishmaniosis in Ecuador, Hashiguchi Y. Ed. Studies on New World Leishmaniosis<br />
and its transmission with particular reference to Ecuador. Kochi Japan, Kyowa<br />
printing, Res. Rep. Ser. N° 1, 116-131.<br />
28. La Fuente, C., Recacochea, M., Tybayrenc, M., Urj<strong>el</strong>, R., Darras, C., Cardozo, L.,<br />
(1.986); Leishmaniosis en Bolivia: presencia <strong>de</strong> dos complejos en los llanos<br />
orientales <strong>de</strong>l <strong>de</strong>partamento <strong>de</strong> Santa Cruz-Bolivia. Boletin científico <strong>de</strong>l<br />
CENETROP, Vol. XII, 1-15.<br />
29. Le Pont F.; Mollinedo S.; Mouchet J.; Desjeux P.; (1.989); Leishmaniose en Bolivie.<br />
IV. Le chien dans les cycles <strong>de</strong>s Leishmanioses en Bolivie; Mem. Inst. Oswaldo<br />
cruz, Rio <strong>de</strong> Janeiro, Vol 84 (3): 417-421, Jul/Sept.<br />
30. Le Pont F.; (1.990) Les Phlébotomes et les leishmanioses en Bolivie; These <strong>de</strong><br />
Doctorat <strong>de</strong> l’Université <strong>de</strong> Paris Sud.<br />
31. Le Pont F. & Desjeux P.; (1.885); Leishmaniosis in Bolivia I: Lutzomyia longipalpis<br />
(Lutz & Neiva, 1.912) as the vector of visceral Leishmaniosis in los Yungas;<br />
Transactions of the Society of Tropical me<strong>de</strong>cine and Hygiene 79, 227-231.<br />
32. Le Ray, D., Bermu<strong>de</strong>z H., (1.986); Leishmanioses en Bolivie. Summaries of the final<br />
reports, Commision of the European Communites, EUR 12 143 EN,: 241- 247 .<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 41 07/12/2003
33. Manson-Bahr, P.E.C., (1987); Diagnosis, In: W. Peters and R. Killick-Kendric (ed),<br />
The Leishmaniosis in biology and me<strong>de</strong>cine, vol 2. Clinical aspects and control.<br />
Aca<strong>de</strong>mic Press, Inc., New York, 709-729.<br />
34. Mars<strong>de</strong>n, P.D., (1995); Clinical presentations of Leishmania braziliensis<br />
braziliensis, Parasitol. Today, 1, 129-133.<br />
35. Martinez E.; Le Pont F.; Torrez M.; T<strong>el</strong>leria J.; Vargas F.; Muñoz M.; De Doncker<br />
S.; Dujardin J.C.; Dujardin J.P.; (1.998); “A new focus of cutaneous Leishmaniosis<br />
due to Leishmania amazonensis in a Sub An<strong>de</strong>an region of Bolivia”; Acta Trópica<br />
71 97-106.<br />
36. Martinez E.; Le Pont, F.; Mollinedo S. and Cupolillo E.; (2001); A first case of<br />
cutaneous Leishmaniosis due to leishmania (Viannia) lainsoni in Bolivia;<br />
Transactions of the Royal society of Tropical Me<strong>de</strong>cina and Hygiene 95, 375-377.<br />
37. Minaya Gloria; (1997); <strong>Manual</strong> <strong>de</strong> <strong>Procedimientos</strong> <strong>de</strong> <strong>Laboratorio</strong> <strong>para</strong> <strong>el</strong><br />
Diagnóstico <strong>de</strong> la Leishmaniosis; Serie <strong>de</strong> Normas Técnicas N° 13; Instituto<br />
Nacional <strong>de</strong> Salud; Ministerio <strong>de</strong> Salud; Lima Perú.<br />
38. Mita Neida; (2001); Infecciones mixtas: I<strong>de</strong>ntificación <strong>de</strong> complejos <strong>de</strong> Leishmania<br />
sp. y clones <strong>de</strong> Trypanosoma cruzi por PCR – hibridación en pacientes y mamíferos<br />
peridomiciliares <strong>de</strong> los Yungas <strong>de</strong> La Paz; Tesis <strong>de</strong> Licenciatura; Facultad <strong>de</strong><br />
ciencias farmaceuticas y bioquímicas, Universidad Mayor <strong>de</strong> San Andres.<br />
39. Molineux D.H. & Killic-Kendrick R. (1987); En: The Leishmaniases in Biology<br />
and Medicine. Vol I. Peters W y Killic-Kendrick R (ed). Aca<strong>de</strong>mic Press: London<br />
Págs 121-176.<br />
40. Monteiro <strong>de</strong> Barroso; (1.942); Leishmaniose visceral americana: Um caso <strong>de</strong> Bolivia;<br />
Revista Clínica <strong>de</strong> Sao Paulo ; Volumen XI, Abril, Nº 4; 91-99.<br />
41. Mollinedo S.; Muñoz M.; Hervas D.; Yaksic N.; Torrez M.; (1.992) “Leishmaniosis<br />
visceral y tegumentaria en niños en dos zonas endémicas <strong>de</strong> Bolivia; Parasitología<br />
al Día; 16: 117 – 120.<br />
42. Mollinedo S; Desjeux P.; Le Pont F.; (1.985) American Leishmaniosis Sh<strong>el</strong>l<br />
international petroleum Maatschappij B.V. Ocupational Health and Hygiene Digest.<br />
23: 14-16.<br />
43. OMS; (1.984) “Les Leishmanioses”; Rapport technique N° 701; Geneve Suisse.<br />
44. OMS; (1.990) “Lutte contre les Leishmanioses”; Rapport d’un Comité OMS<br />
d’experts; rapport technique N° 793; Geneve Suisse.<br />
45. OMS; (1992); Métodos Básicos <strong>de</strong> laboratorio en Parasitología Médica; Ginebra.<br />
46. Palma, G. and Gutierrez, Y., (1991); Laboratory disgnosis of Leishmania.Clin. Lab.<br />
Med., 11, 902-922.<br />
47. Prado Barrientos L.; (1.948a); Um caso atipico <strong>de</strong> Leishmaniose cutaneo-mucosa<br />
(Espundia). Memorias do Instituto Oswaldo Cruz; 46, 415-418 82).<br />
48. Prado Barrientos L.; (1.948b); Un caso <strong>de</strong> leishmaniosis cutaneo-mucosa con<br />
predominio <strong>de</strong> leishmani<strong>de</strong>s cutáneas. Boletin <strong>de</strong> la Agrupación Médica <strong>de</strong> estudios,<br />
249-257.<br />
49. Pessoa B. Samu<strong>el</strong>; Viana Martins Amilcar (1.982); Parasitología Médica; 11-<br />
Edicao; Edit. Guanabara Kogan; Rio <strong>de</strong> Janeiro.<br />
50. Quilici M.; Dunan S.; Ranque J.; (1.968); “L’Immunofluorescence dans les<br />
Leishmanioses. Com<strong>para</strong>ison avec la Reaction <strong>de</strong> Fixation du Complement”;<br />
Me<strong>de</strong>cine Tropicale Vol 28; Nº 1.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 42 07/12/2003
51. Revollo, S., Dimier-David, L., David, P., Lyevre, P., Camacho, C., De<strong>de</strong>t, J.P.,<br />
(1.992), Isoenzyme characterization of Leishmania braziliensis braziliensis isoletes<br />
abtained from Bolivian and Peruvian patients, Transactions of the Royal Society of<br />
Tropical Me<strong>de</strong>cine and Hygiene 86, 388-391<br />
52. Rioux Jean-Antoine; (1.986); Leishmania taxonomie – Phylogenése; Institut<br />
mediterranéen d’Etu<strong>de</strong>s Epi<strong>de</strong>miologiques et ecologiques; Montp<strong>el</strong>lier.<br />
53. Salinas G.; Val<strong>de</strong>rrama L.; Palma G.; Montes G.; Saravia N.; (1.989); Detección <strong>de</strong><br />
amastigotas en Leishmaniosis cutánea y mucocutánea por <strong>el</strong> método <strong>de</strong> la<br />
inmunoperoxidasa, usando anticuerpo policlonal: sensibilidad y especificidad<br />
com<strong>para</strong>das con métodos convencionales <strong>de</strong> diagnóstico; Mem. Inst. Oswaldo Cruz,<br />
Rio <strong>de</strong> Janeiro, Vol. 84(1) 53-60.<br />
54. Servicio Nacional <strong>de</strong> Antioquia; (1987); Leishmaniosis, Normas Técnicas y<br />
Administrativas; Antioquia, Colombia.<br />
55. Shaw J.J. & Lainson R.; (1.975); “Leishmaniosis in Brazil: X. Some observations<br />
on intra<strong>de</strong>rmal reactions to different Trypanosomatid antigens of patients suffering<br />
from cutaneous and mucocutaneous Leishmaniosis”; Trans. R. Soc. Med. Hyg.; Vol<br />
69; Nº 3; 323-335.<br />
56. Simpson, M.H., Mullins, J.F., and Stone, O.J., (1.968), Disseminated anergic<br />
cutaneous Leishmaniosis and autochtonous case in Texas and the Mexican states of<br />
Tumaulipas and Nueva Leon, Arch. Derm. 97, 301-303.<br />
57. Thomaz Soccol Vanete; (1993); Les Leishmania du Nouveau Mon<strong>de</strong>. Analyse<br />
enzymatique. Démarche progresive phénetique-cladistique. T<strong>el</strong>ation phylogénetique<br />
avec les Leishmania <strong>de</strong> l’Ancien Mon<strong>de</strong>; These Universite Montp<strong>el</strong>lier I, Faculté <strong>de</strong><br />
Mé<strong>de</strong>cine.<br />
58. Torrez, M., Lopez, M., Le Pont, F., Martinez, E., Muñoz, M., Hervas, D., Yaksic,<br />
N., Arevalo, J., Sossa, D., De<strong>de</strong>t, J.P., Dujardin, J.P.(1.998), Lutzomyia nunestovari<br />
anglesi (Diptera Psychodidae) as a probable vector of Leishmania braziliensis in the<br />
Yungas, Bolivia. Acta Trópica 71, 311-316.<br />
59. Valda L.; (1.980); Leishmaniosis Cutáneo Difusa: Informe <strong>de</strong>l segundo caso<br />
Boliviano; Cua<strong>de</strong>rnos <strong>de</strong>l Hospital Vol 31, Nº 1.<br />
60. V<strong>el</strong>asco J.E. (1.973); The phlebotomine sandflies of the los Yungas region of<br />
Bolivia M.S. Thesis, Louisiana State University, Departament of Tropical Me<strong>de</strong>cine<br />
and Parasitology, 204 p.<br />
61. Vieira, J.B., Lacerda, M.M., Mardsen, P.D., National Reporting of Leishmaniosis:<br />
The Brazilian Experience.<br />
62. Weigle K. A.; Val<strong>de</strong>rrama L.; Arias A.L.; Santrich C.; Saravia N.; (1.991);<br />
“Leishmanine skin test standarization and evaluation of safety, dose, storage,<br />
longevity of reaction and sensitization”; Am. J. Trop. Med. Hyg. 44(3).<br />
63. Weigle, K.a., Davalos, M., Heredia, P., Molineros, R., Saravia, N.G. and<br />
D’Alessandro, A. (1987); Diagnosis of cutaneous and mucocutaneous<br />
Leishmaniosis in Colombia: a comparison of seven methods. Am. J. Trop. Med.<br />
Hyg., 36, 489-496.<br />
64. Wirth, D. Rogers, W.O., Barker, R., Dourado, H., Suebseang, L. and Albuquerque,<br />
B., (1986); Leishmaniosis and malaria: new tools for epi<strong>de</strong>miological analysis.<br />
Science, 234, 974-979.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 43 07/12/2003
ANEXO 1: REACTIVOS DE COLORACION:<br />
Tinción Giemsa:<br />
• Solución GIEMSA <strong>de</strong> stock o solución madre:<br />
- Giemsa, colorante en polvo ............. 0,75 g<br />
- Alcohol metílico puro ...................... 65 mL<br />
- Glicerina pura .................................. 35 mL<br />
Se disu<strong>el</strong>ve <strong>el</strong> polvo <strong>de</strong> giemsa en <strong>el</strong> alcohol y la glicerina y la solución se la guarda<br />
en un frasco oscuro (color ámbar) con perlas <strong>de</strong> vidrio <strong>de</strong>ntro, bien tapado y <strong>de</strong>berá<br />
agitarse <strong>de</strong> 6 a 10 veces al día <strong>para</strong> que se mezcle completamente hasta obtener una<br />
mezcla homogenea; al tercer día podrá usarse previa filtración <strong>de</strong>l pre<strong>para</strong>do.<br />
• Solución <strong>de</strong> Trabajo o Giemsa diluido :<br />
- Solución Giemsa <strong>de</strong> stock .................................. 1 mL<br />
- Agua <strong>de</strong>stilada o Buffer fosfato pH 7,2 a 7,4 ..... 9mL<br />
De acuerdo a la cantidad <strong>de</strong> placas a procesar se sugiere pre<strong>para</strong>r una cantidad <strong>de</strong> reactivo<br />
a<strong>de</strong>cuada a cada necesidad, mezclar antes <strong>de</strong> usar.<br />
• Solución Buffer Fosfato PBS pH 7.2-7.4 ( Agua Mineral):<br />
- Na HPO4 ..................................................... 6.0 g<br />
- Kh2po4 ......................................................... 5.0 g<br />
Mezclar las sales, pesar 1 g <strong>de</strong> la mezcla y distribuir en pequeños tubos o viales.<br />
Disolver <strong>el</strong> contenido <strong>de</strong> cada uno <strong>de</strong> estos tubos en un litro <strong>de</strong> agua <strong>de</strong>stilada. Este buffer<br />
tendrá un pH <strong>de</strong> 7.2 a 7.4. Debido al problema que implica la obtención <strong>de</strong> solución Buffer<br />
hemos hecho experiencias con diferentes aguas minerales comerciales , teniendo buenos<br />
resultados cuando esta tiene un pH próximo a 7,2 y 7,4, por lo que recomendamos su<br />
utilización.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 44 07/12/2003<br />
21
ANEXO 2. MEDIOS DE CULTIVO<br />
En nuestro recorrido a niv<strong>el</strong> nacional, hemos podido apreciar que nuestro personal <strong>de</strong>l<br />
Sistema nacional <strong>de</strong> Salud tiene notable capacidad <strong>para</strong> realizar estas pruebas, solamente le<br />
faltaba la guía técnica, por lo anotado <strong>de</strong>scribiremos en <strong>de</strong>talle las técnicas <strong>de</strong> aislamiento<br />
<strong>de</strong> las Leishmanias.<br />
Para <strong>el</strong> aislamiento por cultivo <strong>de</strong> las leishmanias requerimos <strong>de</strong> 3 componentes:<br />
• SOLUCION FISIOLOGICA 0.85%: Si no tiene solución fisiológica, pre<strong>para</strong> tu propia<br />
solución<br />
- ClNa .................................................. 0.85 g<br />
- Agua <strong>de</strong>stilada ................................... 100 g<br />
Diluir y autoclavar.<br />
• SOLUCION STOCK DE ANTIBIOTICOS :<br />
- Sulfato <strong>de</strong> Estreptomicina ....................... 0.5 g<br />
- Penicilina Sódica ..................................... 0.5 g<br />
- Agua <strong>de</strong>stilada estéril ............................... 10 mL<br />
Usar 1 ml <strong>de</strong> la solución <strong>para</strong> 100 ml <strong>de</strong> solución salina.<br />
• MEDIO NNN:<br />
- Bacto agar ............................................. 1.4 g<br />
- Cloruro <strong>de</strong> sodio .................................... 0.6 g<br />
- Agua <strong>de</strong>stilada ....................................... 90 mL<br />
- Sangre <strong>de</strong>fibrinada <strong>de</strong> conejo ................. 13.5 mL<br />
- Solución stock <strong>de</strong> antibióticos ............... 1 mL<br />
La sangre <strong>de</strong> conejo se obtiene por punción cardiaca, esta se vierte en un matraz o<br />
balón estéril, <strong>el</strong> cual, contiene perlas <strong>de</strong> vidrio. Para <strong>de</strong>sfibrinar la sangre se agita<br />
suavemente con movimientos rotatorios, durante 10 minutos. Se<strong>para</strong>r 15 mL en una<br />
probeta estéril.<br />
PREPARACION :<br />
- Diluir <strong>el</strong> agar y autoclavar a 121ºC por 20 minutos.<br />
- Dejar enfriar a temperatura ambiente; cuando alcance los 56ºC<br />
aproximadamente, agregar los 15 mL <strong>de</strong> sangre <strong>de</strong>sfibrada y 1 mL <strong>de</strong> la<br />
solución stock <strong>de</strong> antibióticos.<br />
- Homogenizar y repartir aproximadamente 1 mL <strong>de</strong>l medio en tubos <strong>de</strong> cultivo<br />
<strong>de</strong> 13 x 100 con tapa rosca.<br />
- Colocar los tubos en plano inclinado y <strong>de</strong>jar al medio ambiente por 2 horas.<br />
- Controlar si hay contaminación bacteriana en estufa a 37ºC por 24 horas<br />
- Conservar los tubos en refrigeración (4ºC) hasta <strong>el</strong> momento <strong>de</strong> uso.<br />
<strong>Laboratorio</strong> Nacional <strong>de</strong> Parasitología y Entomología<br />
(LANPE) Página 45 07/12/2003