54023 Lemon Clock Manual(v5) - Imaginarium
54023 Lemon Clock Manual(v5) - Imaginarium
54023 Lemon Clock Manual(v5) - Imaginarium
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
4<br />
3<br />
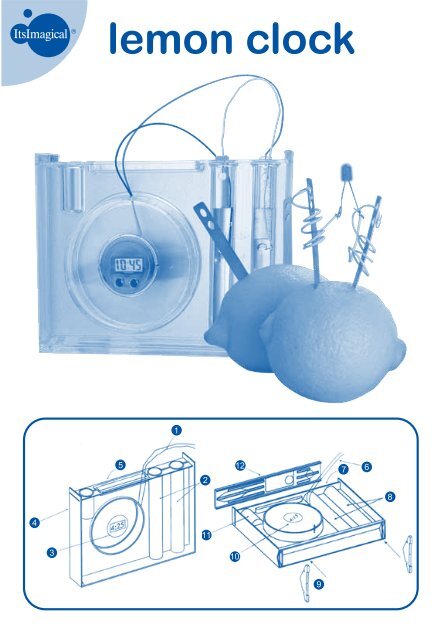
lemon clock<br />
5<br />
1<br />
2<br />
11<br />
10<br />
12 6<br />
7<br />
9<br />
8
(ES)¡Produce electricidad limpia tú mismo! Solo con la energía<br />
de un limón y este kit puedes hacer funcionar un reloj. ¡Vive la<br />
ciencia!<br />
ADVERTENCIA:<br />
Ciertos experimentos requieren la supervisión de un adulto.<br />
Tenga cuidado al usar las piezas con bordes afilados.La tira de<br />
magnesio incluida es altamente inflamable. Mantenerla lejos del<br />
calor. No usarla de manera distinta a la indicada. Si arde, NO<br />
INHALAR EL HUMO.<br />
COMPONENTES<br />
Consola de experimento ● Electrodos- Tira de magnesio ●<br />
Electrodos- Aluminio ● Electrodos- Latón ● Electrodos- Cobre ●<br />
Electrodos- Zinc ● Electrodos- Carbono ● Módulo de reloj digital<br />
● LED ● CablesTubo de goma (látex) ● Tubo de plástico ● Lana<br />
de acero ● Papel pH (papel indicador) ● Embudo ● <strong>Manual</strong> de<br />
instrucciones ● Cuchara de medir ● Clip Cuadrado de<br />
poliestireno ● Requiere pilas de 1,5 AA V (no incluidas) ● Se<br />
necesitan ciertos productos del hogar<br />
INTRODUCCIÓN<br />
Este kit muestra cómo producir electricidad con materiales<br />
naturales mediante simples reacciones químicas con algunos<br />
metales. Como una pila de zinc y una varilla de carbono que se<br />
colocan entre una pasta química.<br />
Fabricando tu propia pila, sigues el mismo proceso que con las<br />
pilas normales. La corriente eléctrica fluye porque tiene lugar una<br />
reacción química entre los metales y los ácidos de las verduras,<br />
frutas, etc.<br />
En algunos experimentos una pieza de fruta, como un limón,<br />
puede producir mucha electricidad, suficiente para encender un<br />
LED o el reloj. En otros casos, necesitas usar 3, 4 o más piezas<br />
de fruta.<br />
LA CONSOLA DE EXPERIMENTO<br />
1. Cables del reloj<br />
2. Probetas<br />
3. Tapa de la placa de Petri con módulo de reloj LCD ya en su<br />
sitio<br />
4. Probeta pequeña<br />
5. Recipiente rectangular<br />
6. Cables del reloj<br />
7. Recipiente rectangular<br />
8. Probetas<br />
9. Patas para poner la consola de pie<br />
10. Tapa de la placa de Petri con módulo de reloj LCD ya en su<br />
sitio<br />
11. Probeta pequeña<br />
12. Tapa superior de la consola<br />
Cuidado al manipular el reloj, evita que la placa se moje.<br />
Preparación de los electrodos.<br />
Utilizas diferentes electrodos:<br />
Aluminio: Al Magnesio: Mg<br />
Hierro: Fe Zinc: Zn<br />
Carbono: C Cobre: Cu<br />
Probeta: P.<br />
NOTA: el electrodo de carbono es negro, el de aluminio es de<br />
color plata brillante y el de cinc, plata-grisáceo mate. La tira de<br />
magnesio tiene un color parecido al del electrodo de zinc, pero es<br />
más fina y no tiene agujeros.<br />
Advertencia: Esta actividad requiere la supervisión de un adulto.<br />
Cuidado al cortar los tubos de goma y de plástico.<br />
Cortar en piezas de unos 6-7mm con unas buenas tijeras. Estas<br />
piezas son necesarias para unir los cables a los electrodos.<br />
Ejemplo:<br />
Preparación de los electrodos de carbono<br />
Paso 1: Coloca un trozo del tubo de goma en el electrodo de<br />
carbono.<br />
Paso 1. Electrodo de carbono con trozo de goma.<br />
Paso 2: Introduce el extremo expuesto del cableen el trozo de<br />
goma para que toque el carbono.<br />
1<br />
Paso 3. Extremo del cable expuesto doblado<br />
en el trozo de goma.<br />
Paso 3: Dobla el extremo del cablehacia arriba para evitar que<br />
se salga.<br />
Paso 2 . Introduzca el extremo expuesto del cable<br />
en el trozo de goma.<br />
Preparación de los electrodos de magnesio<br />
ADVERTENCIA: La tira de magnesio incluida es<br />
altamente inflamable. Mantenerla lejos del calor. No<br />
usarla de manera distinta a la indicada. Si arde, NO<br />
INHALAR EL HUMO.<br />
Paso 1: Divide la tira de<br />
Chincheta<br />
magnesio en tres partes y<br />
córtala cuidadosamente<br />
con unas tijeras haciendo<br />
trozos de 33mm.<br />
Paso 2: Con una<br />
chincheta, haz dos<br />
agujeros en un extremo de<br />
cada electrodo de<br />
magnesio como estos.<br />
Extremo expuesto de cable<br />
pasado por la pieza de<br />
Paso 3: Pasa el extremo<br />
magnesio.<br />
de un cable por ambos<br />
agujeros, tápalo junto con<br />
las tiras de magnesio con<br />
el tubo de goma. El<br />
electrodo de magnesio ya Cable y magnesio tapados<br />
está listo.<br />
con el tubo de goma.<br />
Preparación de los demás electrodos<br />
Para los electrodos de zinc y los demás electrodos, usa el tubo<br />
de plástico como se ilustra arriba.<br />
NOTA: los dos tipos de tubos tienen tres importantes funciones:<br />
a) Sujeta el cable al electrodo garantizando un buen contacto<br />
eléctrico.<br />
b) Protege este contacto de contaminación innecesaria.<br />
c) Previene que un electrodo toque al otro al introducirlos los<br />
dos juntos, uno encima del otro, en la misma probeta.<br />
El dibujo muestra cómo usar<br />
el LED que va unido<br />
a los electrodos.<br />
Tira de Mg<br />
Experimento 1. Solución de indicador coloreado<br />
LED<br />
FLAMMABLE<br />
Electrodo de carbono<br />
Equipo: Vaso. Sal. Electrodo de Zinc. Electrodo de<br />
carbono. Tira de magnesio. Papel pH. Cuchara<br />
medidora. Consola de experimentos.<br />
Llena una de las<br />
probetas largas de la<br />
consola de<br />
experimento con agua<br />
salada e introduce 3<br />
tiras de papel pH. Es el<br />
papel naranja:<br />
Papel pH<br />
Cuando el agua salada se coloree con las tres tiras, retíralas y<br />
repite el experimento Nº 1 en este líquido coloreado.<br />
Introduce los electrodos de magnesio y carbono en la probeta<br />
larga con el líquido amarillo y conecta los dos cables de los<br />
electrodos.<br />
FLAMMABLE
Mg<br />
C<br />
Probeta larga<br />
rellena de agua<br />
salada<br />
Papel Ph<br />
Transcurridos unos minutos, la solución se vuelve violeta<br />
alrededor del electrodo de magnesio.<br />
La solución de debajo del carbono también cambia de color, pero<br />
de forma mucho más lenta.<br />
¿Qué ocurre? ¿Por qué? ¿Qué<br />
ocurriría si no conectaras los<br />
cables a los electrodos? ¿Y si en<br />
lugar de magnesio usaras zinc o<br />
electrodos? ¿Qué tiene que ver<br />
esto con la electricidad?<br />
El color del papel pH indica la<br />
presencia de un ácido o base al<br />
cambiar de color. Un ácido es<br />
una sustancia amarga. Muchas<br />
frutas contienen ácidos, como el<br />
limón o la naranja. Un ácido<br />
fuerte normalmente corroe los<br />
metales. Una base es lo opuesto<br />
a un ácido. Las sustancias que<br />
son bases también se llaman<br />
álcalis. Una base neutraliza un<br />
ácido y forma una sal. El color<br />
violeta alrededor del electrodo de<br />
magnesio indica que has<br />
producido una base cerca de un<br />
2 tiras de papel pH<br />
(mojados) sobre la pila<br />
La solución<br />
amarilla se<br />
vuelve violeta<br />
Trozo de poliestireno para<br />
mantener la pila y el papel<br />
pH en su sitio<br />
¿Se ha<br />
producido algún<br />
cambio?<br />
electrodo. Al final se logra un color rojizo cerca del electrodo de<br />
carbono. El líquido ahí se vuelve ácido.<br />
Si no se conectan los cables del electrodo, parece que no ocurre<br />
nada. Provocarás reacciones similares con otros electrodos pero<br />
probablemente conseguirás una solución menos básica y el color<br />
alrededor del zinc o el electrodo de aluminio se volverá azul antes<br />
que violeta.<br />
Experimento 2. El papel indicador<br />
Equipo: 2 trozos de papel pH. Pila 1,5 AA V. Trozo pequeño de<br />
poliestireno. Consola de experimento<br />
Mete las tiras de papel pH en la solución de agua salada, sólo<br />
para que se mojen.<br />
Fíjate en el color del papel pH mojado.<br />
Une las dos tiras de papel pH por un extremo. Pon las tiras en el<br />
lateral de la pila AA y dobla los dos extremos tapando la parte<br />
superior e inferior de la pila.<br />
Coloca la pila con los papeles pH en el compartimento<br />
rectangular (CR), el hueco poco profundo de la parte superior de<br />
la consola de experimento. Mantén este "sistema" en su sitio<br />
mediante el pequeño trozo de poliestireno, como se muestra.<br />
LA CONSOLA DESDE ARRIBA<br />
Pila AA Papeles pH uno encima del otro<br />
Espera dos o tres horas manteniendo el papel húmedo (echa<br />
unas gotas de agua salada en el papel si es necesario).<br />
Al final del experimento verás que el papel de la parte inferior de<br />
la pila se vuelve violeta (rodeado de azul) y la parte superior, roja<br />
(rodeado de amarillo). ¿Por qué?<br />
Es el mismo cambio químico que en el Experimento 1.<br />
La corriente eléctrica que pasa a través del agua de sal ha<br />
supuesto un cambio químico en la sal y esto ha cambiado el color<br />
2<br />
del papel. El color violeta es básico e indica negativo; el rojo es<br />
ácido e indica positivo. La corriente negativa que fluye desde el<br />
lado negativo de la pila y el color rojo indican el lado positivo de la<br />
batería. La dirección en la que fluye la corriente se llama<br />
polaridad.<br />
Experimento 3. Transferencia eléctrica<br />
Equipo: Equipo del experimento 1. Clavo o tornillo de hierro o<br />
acero. Solución de cobre.<br />
Cómo preparar una solución de cobre. Necesitas:<br />
- Consola de experimentos<br />
- Vinagre<br />
- Electrodos de cobre<br />
La consola tiene varios compartimentos: 2 probetas largas, 1<br />
probeta corta y 1 compartimento rectangular. Ya hemos utilizado<br />
las probetas largas y el compartimento rectangular. Ahora<br />
usaremos la corta.<br />
Llenar con vinagre la probeta corta y el contenedor rectangular<br />
casi hasta el borde. Colocar en posición vertical uno de los<br />
electrodos de cobre dentro de la probeta corta y apoyar el<br />
segundo electrodo de cobre dentro del compartimento<br />
rectangular como se indica en el dibujo.<br />
Electrodo de cobre<br />
Nota: No es absolutamente necesario utilizar electrodos para este<br />
experimento. Una moneda de cobre, cables de cobre o cualquier<br />
otro pequeño objeto de cobre funcionará, siempre que esté hecho<br />
de cobre y no de hierro teñido de cobre. Deja a esta mezcla<br />
reposar durante una noche o más, sin moverlo. Pasadas 24<br />
horas, verás que la mezcla toma un color entre azulado y<br />
verdoso.<br />
Atención: este líquido es VENENOSO, no utilizar nada que<br />
pudiera entrar en contacto con comida.<br />
Para este experimento necesitas un clavo de hierro o, mejor aún,<br />
un tornillo de hierro o acero. Tanto el clavo como el tornillo deben<br />
estar completamente limpios. Introduce el electrodo de cobre y el<br />
tornillo de hierro en el CR con líquido azulado como se indica en<br />
el dibujo. Espera media hora, un día, una semana, cien años...<br />
¿Qué crees que ocurrirá? ¿Qué ocurre en realidad?<br />
Líquido<br />
azulado<br />
Electrodo<br />
de cobre<br />
Vinagre<br />
Clavo o tornillo<br />
de hierro<br />
El tornillo de hierro y el electrodo de cobre forman un conjunto<br />
eléctrico. Se produce electricidad. En la cabeza del tornillo de<br />
hierro se forma una "barba" marrón de polvo de cobre (lo que<br />
esperábamos). Cada vez se forma más polvo.<br />
(¿De dónde viene?)<br />
El líquido azul permanece azul. (¿Por qué?) Ahí va una<br />
explicación sencilla:<br />
El cobre sale de la solución de cobre y se fija en la cabeza del<br />
tornillo. Debido a la electricidad producida por el conjunto del<br />
Cu/Fe. Esto sucede hasta que se acaba el cobre, se seca el agua<br />
o la "barba" de cobre toca el electrodo de cobre.<br />
Experimento 4. El reloj digital eléctrico<br />
Equipo: Consola de experimento. Módulo de reloj LC. Solución<br />
(agua salada, zumo de frutas o verduras).<br />
Si sacas los cables accidentalmente, el reloj se desconectará.
Coloca los cables a través de la ranura y cierra cuidadosamente<br />
la placa de Petri. Es importante que permanezca cerrada para<br />
que el reloj no se moje.<br />
Ranura para los cables<br />
Prepara la "fuente de alimentación" con cualquier fuente de<br />
energía natural que desees. ¿Qué combinaciones hacen que el<br />
reloj funcione durante más tiempo? Anota tus conclusiones en la<br />
siguiente tabla (como en el ejemplo):<br />
e.g.:<br />
ELECTRODOS MATERIAL SOLUCIÓN HORA DE INICIO FECHA<br />
HORA DE<br />
FINALIZACIÓN<br />
FECHA<br />
Cobre y zinc limón detergente 08:00 h jueves 12/1 11:46 h<br />
domingo<br />
15/1<br />
Comprueba si tienes suficiente electricidad observando si se<br />
enciende el LED. Recuerda que el LED sólo funciona cuando<br />
esta conectado en la dirección correcta. La misma regla sirve<br />
para el módulo de reloj.<br />
Cuando consigas encender el reloj, abre la placa de Petri y verás<br />
dos pequeñas placas de metal en el dorso del módulo de reloj<br />
LCD. Son para ajustar la hora como en los relojes LCD o de<br />
pulsera.<br />
Mira el módulo LCD desde la parte de atrás. El contacto del lado<br />
derecho es el contacto de modo. Púlsalo y el modo aparecerá.<br />
Púlsalo dos veces y aparecerá el número 12: A. El contacto del<br />
lado izquierdo es para ajustar la hora, pulsa el contacto de modo<br />
y después el contacto ajustado para fijar los minutos.<br />
Al terminar, cierra cuidadosamente la tapa de la placa de Petri.<br />
Usa un clip o un<br />
bolígrafo para<br />
ajustar la hora<br />
VISTA POSTERIOR DEL MODO DIGITAL<br />
Usa un clip o un<br />
bolígrafo para<br />
cambiar el modo<br />
Recuerda: si el reloj se para, tendrás ajustarlo de nuevo.<br />
3<br />
Experimento 5. La lámpara o reloj de limón<br />
Equipo: Electrodo de aluminio. Electrodo de latón. Electrodos de<br />
cobre. Electrodos de zinc. 3 – 4 limones.<br />
Sigue experimentando con varios tipos de "lámparas" y relojes.<br />
Podrías fabricar una lámpara de limón, como en este ejemplo.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
EL RELOJ DE LIMÓN<br />
Zn<br />
Brass<br />
Cu<br />
Brass<br />
Este experimento como casi todos, sólo funciona si los cables<br />
hacen contacto PERFECTAMENTE con todos los electrodos. Si<br />
uno no hace contacto, el LED no se enciende. Asegúrate de que<br />
los cables y los electrodos están perfectamente limpios. Si hace<br />
falta, inténtalo añadiendo otro limón y otro par de cables.<br />
Asegúrate de que los limones son jugosos. Si es necesario,<br />
añade agua.<br />
Al<br />
Al
(EN) Produce your own clean electricity! Using just the energy of<br />
a lemon and this kit you can make a clock work. Enjoy science!<br />
WARNING: Certain experiments require adult supervision. Be<br />
careful when using parts with sharp points or edges. The<br />
Magnesium ribbin included in your kit is highly flammable. Do not<br />
use this material in any way other than described in the<br />
experiments! Keep it away from any source of heat. If for any<br />
reason this material burns, DO NOT INHALE THE FUMES!<br />
PARTS LIST<br />
Experiment console ● Electrodes- Magnesium strip ● Electrodes-<br />
Aluminum ● Electrodes- Brass ● Electrodes- Copper ●<br />
Electrodes- Zinc ● Electrodes- Carbon ● <strong>Clock</strong> module ● Led ●<br />
Wires ● Rubber (latex) tube ● Plastic tube ● Steel wool ● pH<br />
paper (indicator paper) ● Funnel ● Instruction manual ●<br />
Measuring spoon ● Paper clip ● Polystyrene square ● One and a<br />
half volt (1½ V) AA batteries required (not included) ● Certain<br />
household substances required<br />
INTRODUCTION<br />
This kit is called “Nature´s Electricity” because it shows how<br />
electricity can be produced from several materials containing<br />
chemicals that react when they come in contact with various<br />
metals, just like a battery.<br />
A battery is made of Zinc and a Carbon rod, which are placed<br />
between a chemical paste. When you make your own natural<br />
battery, the same process occurs as in the ordinary batteries you<br />
are familiar with. The electric current flows because a chemical<br />
reaction takes place between the metals and the acids in the<br />
vegetables, fruits, soaps, etc.<br />
In some experiments, you may find that one piece of fruit, such as<br />
a lemon, can produce lots of electricity, enough to light up a LED<br />
or the clock module. In other cases, you may have to use 3 or 4<br />
or even more pieces of fruit to get good results. This is very much<br />
the same as with batteries. In certain cases, 1 battery will be<br />
enough, and in others, you may need 2 or 3 or even 4 batteries.<br />
THE EXPERIMENT CONSOLE<br />
1 Wires from clock<br />
2 Test tubes<br />
3 Petri dish lid with LCD clock module already in place<br />
4 Small test tube<br />
5 Rectangular container<br />
6 Wires from clock<br />
7 Rectangular container<br />
8 Test tubes<br />
9 Legs to stand console upright (Snap in place)<br />
10 Petri dish lid with LCD clock module already in place<br />
11 Small test tube<br />
12 Top console cover<br />
Preparing the electrodes<br />
Become familiar with the parts of the experiment console. Be very<br />
careful when handling the clock module. Keep the petri dish<br />
covered so that the clock will not get wet.<br />
Abbreviations<br />
You will use electrodes made from various materials. Chemists<br />
use recognised abbreviations for most of these.<br />
Aluminium al magnesium mg<br />
Iron fe zinc zn<br />
Carbon c copper cu<br />
Test tube t.T.<br />
Note: the carbon electrode is black, the aluminum one is shiny<br />
silver, and the zinc electrode is a dull greyish silver. The<br />
magnesium ribbon is similar in color to the zinc electrode, but is<br />
thinner and has no holes.<br />
Caution: this activity must be performed with adult supervision.<br />
Be very careful when slicing the rubber and plastic tubing!<br />
Your kit includes rubber and plastic tubing. These need to be cut<br />
into pieces about 1/4 of a inch (6-7 mm) lengths. Each cut piece<br />
should look like this:<br />
Cut the tubing very carefully with a good pair of scissors. These<br />
pieces of rubber and plastic are necessary to attach wires to the<br />
electrodes.<br />
Preparing carbon electrodes<br />
Step 1 : take a slice of the rubber tubing and slip it over the<br />
carbon electrode.<br />
4<br />
Step 1: Carbon electrode with rubber slice<br />
Step 2 : take a wire and push its exposed end into the rubber<br />
tubing so that touches the carbon.<br />
Step 2: Insert exposed end of wire into rubber slice<br />
Step 3 : bend the end of the exposed wire upwards to prevent the<br />
wire from pulling out.<br />
Step 3: Bend exposed end of wire over rubber slice<br />
PREPARING MAGNESIUM ELECTRODES<br />
WARNING: The Magnesium ribbon included in your<br />
kit is highly flammable. Do not use this material in any<br />
way other than described in the experiments! Keep it<br />
away from any source of heat. If for any reason this<br />
material burns.<br />
FLAMMABLE<br />
DO NOT INHALE THE FUMES!<br />
Divide the Magnesium strip into<br />
Thumbtack<br />
three parts, and cut careflly<br />
with a pair of scissors. Each<br />
piece should be about one inch<br />
(33 mm) long.<br />
On one end of each of the<br />
Piece of magnesium<br />
Magnesium electrodes, pierce<br />
two holes as shown in the<br />
illustration. Use a thumbtack<br />
very carfully to do this.<br />
Exposed end of wire<br />
Thread the exposed end of one threaded through piece of<br />
of your wires through both magnesium<br />
holes as illustrated.<br />
Cover the wire and Magnesium<br />
strips with the rubber tubing.<br />
Now your Magnesium<br />
Wire and magnesium covered<br />
electrode is also ready for use. by rubber tubing<br />
Preparing All Other Electrodes<br />
For the Zinc and all other electrodes, use the plastic tubing. Use<br />
it in the same way as explained and illustrated above.<br />
NOTE: The two kinds of tubing serve three important functions:<br />
a) Like an elastic band, the tubing holds the wire to the<br />
electrode, ensuring good electrical contact.<br />
b) It shields this contact from unnecessary contamination.<br />
c) It helps to prevent one electrode from touching the other,<br />
when both are immersed, one above the other, in the same<br />
test tube.<br />
The drawing here<br />
shows you how to<br />
use the LED attached<br />
to electrodes.<br />
Mg ribbon<br />
Experiment 1 Coloring Indicator Solution<br />
Led<br />
Equipment: Empty, clean glass, Table salt, Zinc<br />
electrode, Carbon electrode, Magnesium ribbon, pH<br />
paper, Measuring spoon<br />
Carbon electrode<br />
FLAMMABLE
Fill one of the long test tubes<br />
from the experiment console<br />
with salt water and insert 3<br />
strips of pH paper. The pH<br />
paper is the orange paper<br />
which looks like this:<br />
Ph paper<br />
When the salt water becomes<br />
colored by these three strips, remove them and repeat exp. No. 1<br />
in this colored liquid.<br />
Insert the Magnesium and Carbon electrodes into the long T.T.<br />
with the yellow liquid and connect the two electrode wires.<br />
Mg<br />
C<br />
Long test tube<br />
filled with salt<br />
water<br />
pH paper<br />
After a few minutes, the yellow of the colored salt water solution<br />
becomes violet around<br />
the Magnesium<br />
electrode.<br />
The solution at the<br />
bottom of the Carbon<br />
also changes color, but<br />
much more slowly.<br />
What hppens and why?<br />
What would happen if<br />
you did not connect the<br />
wires of the electrodes?<br />
What would happen if<br />
instead of Magnesium,<br />
you used Zinc or do<br />
with electrodes? What<br />
has all this to do with<br />
electricity?<br />
The answers are at the<br />
back of the book.<br />
Yellow solution<br />
becomes violet<br />
Any change<br />
here?<br />
Experiment 2 The Indicator Paper<br />
Equipment: 2 pieces of pH paper, AA size 1½ V battery, small<br />
piece of polystyrene, experiment console<br />
Dip two strips of pH paper into salt water solution, just enough to<br />
make them wet. Note the color of the wet pH paper.<br />
Overlap the two strips of the pH paper so that they stick together<br />
at one end. Lay the strips along the side of an AA battery, and<br />
bend the two ends fo that they cover the top and the bottom of the<br />
battery.<br />
The top of your experiment console has a shallow, rectangular<br />
depression, which we call the rectangular compartment (R.C.).<br />
Place the battery with the pH papers into this depression and<br />
keep this “set-up” in place by meas of the small piece of<br />
polystyrene, as shown in the drawing.<br />
CONSOLE FROM ABOVE<br />
AA battery pH papers overlapping<br />
2 strips of pH paper (wet)<br />
on battery<br />
Piece of polystyrene to hold<br />
battery and pH paper in place<br />
5<br />
Wait two to three hours, keeping the paper wet by dripping a drop<br />
of salt water onto the paper, as necessary.<br />
At the end of the experiment, you will see that the paper at the<br />
bottom of the battery is now violet (surrounded by blue) and the<br />
top, red (surrouded by yellow). Why?<br />
See explanation at the back of the book.<br />
THE SAME CHEMICAL CHANGE TOOK PLACE IN<br />
EXPERIMENT 1.<br />
Experiment 3 Electric transfer<br />
Equipment: experiment console, iron or steel nail or screw,<br />
copper electrodes.<br />
Your console has several compartments: two long test tubes<br />
(T.T.), 1 short test tube, 1 rectangular compartment (R.C.), and<br />
one short test tube. We have already used the two long test<br />
tubes and the rectangular compartment. Now we will use the<br />
short one.<br />
Fill both the short test tube and the rectangular container almost<br />
to the top with vinegar. Stand one of the copper electrodes into<br />
the short T.T. and lean the second copper electrode into the R.C.<br />
as shown in the drawing.<br />
Note: It is not absolutely necessary to use electrodes for this<br />
experiment. A copper coin, copper wires or any other small<br />
copper article would do nicely, just as long as you are certain it is<br />
made of copper and not, say, copper-plated iron. Permit this “<br />
set-up” to stand undisturbed overnight or even longer. This will<br />
be the RAW MATERIAL for several experiments.<br />
You already know what will happen if you dip an iron screw into<br />
the bluish liquid which now fills the R.C. For this experiment you<br />
need an iron nail, or better still, an iron or steel screw. Either nail<br />
or screw must be shiny clean. Stand the Copper electrode and Fe<br />
(Iron) screw into the bluish liquid-filled R.C. as shown in the<br />
drawing. Wait ½ an hour, a day, a week, 100 years … What do<br />
you think will happen?<br />
What in fact does happen?<br />
Coppeer electrode<br />
Bluish liquid<br />
Copper electrode<br />
Vinegar<br />
Iron nail or screw<br />
The Iron (Fe) screw and the Copper electrode together make up<br />
an electric couple. Electricity is produced. A brown “beard” of<br />
Copper powder forms at the head of the Iron (Fe) screw. (That<br />
was to be expected). More and more of this powder is formed.<br />
(Where does it come from?)<br />
The blue liquid remains blue (Why?) Here is a very simplified<br />
explanation:<br />
Copper leaves the Copper solution and settles around the head of<br />
the screw. Because of the electricity produced by the Cu/Fe<br />
couple, more Copper from the Copper electrode goes into<br />
solution and is deposited near the screw. This goes on until either<br />
all the copper is gone, or the liquid dries up or the copper “beard”<br />
touches the Copper electrode.
Experiment 4 The Digital Electric <strong>Clock</strong><br />
Equipment: Experiment console, LCD <strong>Clock</strong> module, Solution<br />
(salt water, or fruit juice, or vegetable juice)<br />
Begin working with the digital clock mode that has been already<br />
inserted to fit securely into the cover of the petri dish. Be very<br />
careful when handling the module. If you accidentally pull on the<br />
wires, the clock will be disconnected.<br />
Place the wires through the slot and carefully close the petri dish<br />
with this cover. After you have done this, you are ready to begin<br />
your experiments. It is important that the petri dish remains<br />
closed so that the clock will not get wet.<br />
Slot for wires<br />
Prepare your “power source” from whichever natural source you<br />
choose. You can choose a salt water solution, vegetable or fruit<br />
juices, etc, as listed in the following chart, based on the results of<br />
your experiments.<br />
e.g.:<br />
ELECTRODES MATERIAL SOLUTION TIME STARTED DATE TIME STOPPED DATE<br />
Copper and Zinc lemon detergent 8:00 a.m thurs.12/1 11:46 a.m. Sun.15/1<br />
The best way to test if you have enough electricity is to check if<br />
the LED lights up. If it does light up, then the clock will work.<br />
Remember, the LED only works when it is connected in the<br />
correct direction. This same rule also applies to the clock<br />
module.<br />
Be very careful once you have the clock working. If you<br />
accidentally move the clock, this may disconnect the flow of<br />
electricity into the clock.<br />
As soon as you have succeeded in lighting up the clock, open the<br />
petri dish. You will see 2 small metal plates on the back of the<br />
LCD clock module. These plates are used for adjusting the time<br />
on the clock. This is similar to all LCD clocks and watches.<br />
Look at the LCD module from the back. The contact on the right<br />
hand side is the mode contact. Press this and the mode will<br />
appear. Press twice and you will get a number 12:A. Now press<br />
the left contact to adjust the hour, press the mode contact and<br />
then the adjusted contact to set the minutes. The clock also<br />
includes a date module, but we suggest that you do not use it.<br />
6<br />
Use paper clip<br />
or pen press to<br />
adjust<br />
REAR VIEW OF DIGITAL MODE<br />
Use paper clip or<br />
pen press for<br />
mode change<br />
Remember: If there is a break in the flow of electricity to the clock,<br />
the clock will stop working and will have to be reset when the<br />
electricity flow continues again.<br />
Experiment 5 The <strong>Lemon</strong> Lamp Or <strong>Clock</strong><br />
Equipment: Aluminum electrode, Brass electrode, Copper<br />
electrodes, Zinc electrodes,<br />
3 – 4 lemons<br />
Continue to experiment with various kinds of<br />
“lamps” and clocks. You could make yourself a lemon lamp as<br />
illustrated here.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
This experiment as well as most of the other ones, will work only if<br />
all wires make P-E-R-F-E-C-T contact with all electrodes.<br />
If there is just one contact which is not good, the LED will not light<br />
up. Make certain that the wires and the electrodes are perfectly<br />
clean.<br />
If necessary, try adding another lemon and another electrode<br />
couple. Make sure that the lemons are juicy. If necessary, add<br />
water.<br />
Cu<br />
THE LEMON CLOCK<br />
Zn<br />
Brass<br />
Cu<br />
Brass<br />
Al<br />
Al
(FR) Produisez vous-même de l'électricité ! Vous pouvez faire<br />
marcher une horloge uniquement grâce à ce kit et à l'énergie d'un<br />
citron. Vive la science !<br />
AVERTISSEMENT :<br />
Certaines expériences doivent se dérouler sous la surveillance<br />
d'un adulte.<br />
Les pièces aux bords tranchants doivent être manipulées avec<br />
précaution.<br />
La bande de magnésium, qui est fournie, est hautement<br />
inflammable. Conserver à l'abri de la chaleur. Ne pas utiliser<br />
d'une façon autre que celle indiquée dans ce manuel. En cas<br />
d'embrasement, NE PAS INHALER LA FUMÉE.<br />
COMPOSANTS<br />
Console d'expérimentation ● Électrodes - Bande de magnésium<br />
● Électrodes - Aluminium ● Électrodes - Laiton ● Électrodes -<br />
Cuivre ● Électrodes - Zinc ● Électrodes - Carbone ● Module<br />
d'horloge numérique ● LED ● Câbles ● Tube en caoutchouc<br />
(latex) ● Tube en plastique ● Laine d'acier ● Papier pH (papier<br />
indicateur) ● Entonnoir ● Mode d'emploi ● Cuillère de mesure ●<br />
Trombone ● Carré en polystyrène ● Utiliser des piles de 1,5 AA V<br />
(non comprises) ● Certains produits ménagers doivent être<br />
employés<br />
INTRODUCTION<br />
Ce kit explique la façon dont il est possible de produire de<br />
l'électricité grâce à de simples réactions chimiques dues au<br />
contact entre des matériaux naturels et certains métaux. Comme<br />
une pile en zinc et une baguette en carbone placées entre une<br />
pâte chimique.<br />
La fabrication de votre propre pile suit le même procédé que pour<br />
celui des piles normales. Le courant électrique est produit suite à<br />
une réaction chimique entre les métaux et l'acidité des légumes,<br />
des fruits, etc.<br />
Dans certains cas, un fruit tel que le citron peut produire un<br />
courant électrique capable d'allumer un voyant LED ou de faire<br />
fonctionner une horloge. Dans d'autres cas, vous aurez besoin de<br />
3, 4 ou davantage de fruits.<br />
LA CONSOLE D'EXPÉRIMENTATION<br />
1. Câbles de l'horloge<br />
2. Éprouvettes<br />
3. Couvercle de la boîte de Petri avec le module de l'horloge<br />
déjà en place<br />
4. Petite éprouvette<br />
5. Récipient rectangulaire<br />
6. Câbles de l'horloge<br />
7. Récipient rectangulaire<br />
8. Éprouvettes<br />
9. Supports pour redresser la console (enclencher aux endroits<br />
indiqués)<br />
10. Couvercle de la boîte de Petri avec le module de l'horloge<br />
déjà en place<br />
11. Petite éprouvette<br />
12. Couvercle supérieur de la console<br />
Manipuler l'horloge avec soin et éviter que la boîte ne se mouille.<br />
Préparation des électrodes. Utilisation des différentes électrodes :<br />
Aluminium : Al Magnésium : Mg<br />
Fer : Fe Zinc : Zn<br />
Carbone : C Cuivre : Cu<br />
Éprouvette : P.<br />
REMARQUE : l'électrode de carbone est noire, l'électrode<br />
d'aluminium est de couleur argentée brillante et l'électrode de<br />
zinc est de couleur argentée grisâtre mate. La bande de<br />
magnésium a une couleur qui se rapproche de celle du zinc, mais<br />
elle est plus fine et n'a pas de trous.<br />
Avertissement : Cette expérience doit se dérouler sous la<br />
surveillance d'un adulte. Faites attention au moment de couper<br />
les tubes en caoutchouc et en plastique.<br />
Coupez des bandes de 6 à 7 mm avec de bons ciseaux. Ces<br />
bandes sont nécessaires pour relier les câbles aux électrodes.<br />
Exemple :<br />
Préparation des électrodes de carbone<br />
Étape 1 : Placez un morceau du tube en caoutchouc<br />
sur l'électrode de carbone.<br />
Étape 1. Électrode de carbone avec une<br />
pièce en caoutchouc.<br />
7<br />
Étape 2 : Insérez l'extrémité du câble à découvert<br />
dans la pièce en caoutchouc, de façon à<br />
toucher le carbone.<br />
Étape 2. Insérez l'extrémité du câble à découvert<br />
dans la pièce en caoutchouc<br />
Étape 3 : Pliez l'extrémité du câblevers le haut afin<br />
d'éviter qu'il ne ressorte.<br />
Étape 3. Extrémité du câble à découvert,<br />
pliée dans la pièce en caoutchouc.<br />
Préparation des électrodes de magnésium<br />
AVERTISSEMENT : La bande de magnésium, qui est<br />
fournie, est hautement inflammable. Conserver à l'abri<br />
de la chaleur. Ne pas utiliser d'une façon autre que<br />
celle indiquée dans ce manuel. En cas<br />
d'embrasement, NE PAS INHALER LA FUMÉE.<br />
Étape 1 : À l'aide de<br />
ciseaux, découpez<br />
Punaise<br />
soigneusement la bande de<br />
magnésium en trois<br />
morceaux de 33 mm.<br />
Thread the exposed end of<br />
one of your wires through<br />
both holes as illustrated.<br />
Étape 2 : Percez deux trous<br />
à une extrémité de chaque<br />
électrode de magnésium à<br />
l'aide d'une punaise,<br />
comme indiqué sur le<br />
dessin.<br />
Étape 3 : Enfilez l'extrémité<br />
d'un câble dans les deux<br />
trous et couvrir ce dernier et<br />
les bandes de magnésium à<br />
l'aide du tube en<br />
caoutchouc. L'électrode de<br />
magnésium est prête.<br />
Préparation des autres électrodes<br />
Pour les électrodes de zinc et les autres, utilisez le tube en<br />
plastique comme illustré ci-dessus.<br />
REMARQUE :les deux types de tube remplissent trois fonctions<br />
importantes :<br />
a) Reliez le câble à l'électrode, ce qui assure un contact<br />
électrique efficace.<br />
b) Protégez ce contact contre toute nuisance.<br />
c) Empêchez tout contact entre deux électrodes lorsque<br />
celles-ci sont introduites ensemble, l'une au-dessus de l'autre,<br />
dans une même éprouvette.<br />
Le dessin explique comment utiliser le voyant<br />
LED relié aux électrodes.<br />
LED<br />
Mg Bande de Mg<br />
Expérience 1. Solution d'indicateur coloré<br />
Extrémité du câble à<br />
découvert insérée dans la<br />
bande de magnésium.<br />
Câble et magnésium couverts<br />
par le tube en caoutchouc.<br />
Équipement : Verre. Sel. Électrode de zinc. Électrode<br />
de carbone. Bande de magnésium. Papier pH.<br />
Cuillère de mesure. Console d'expérimentation.<br />
FLAMMABLE<br />
Électrode de carbone<br />
FLAMMABLE
Remplissez d'eau salée l'une<br />
des éprouvettes longues de la<br />
console d'expérimentation et<br />
insérez-y trois bandes de papier<br />
pH. Il s'agit du papier orange :<br />
Papier pH<br />
Lorsque l'eau salée devient<br />
colorée sous l'effet de ces trois bandes, enlevez-les et répétez<br />
l'expérience 1 dans ce liquide coloré.<br />
Insérez les électrodes de magnésium et de carbone dans<br />
l'éprouvette longue avec le liquide jaune et reliez les deux câbles<br />
des électrodes.<br />
Mg<br />
C<br />
Éprouvette<br />
longue remplie<br />
d'eau salée<br />
Papier pH<br />
Au bout de quelques minutes, la solution devient violette autour de<br />
l'électrode de magnésium.<br />
La solution au-dessous<br />
du carbone change<br />
également de couleur,<br />
mais beaucoup plus<br />
lentement.<br />
Que se passe-t-il ?<br />
Pourquoi ? Que se<br />
passerait-il si les câbles<br />
n'étaient pas reliés aux<br />
électrodes ? Et que se<br />
passerait-il si vous<br />
utilisiez du zinc ou des<br />
électrodes au lieu de<br />
magnésium ? Qu'est-ce<br />
que cela a à voir avec<br />
l'électricité ?<br />
La couleur du papier pH<br />
indique la présence d'un<br />
acide ou d'une solution<br />
basique lors d'un<br />
changement de couleur.<br />
Un acide est une<br />
La solution<br />
jaune devient<br />
violette<br />
Y a-t-il eu un<br />
changement ?<br />
substance amère. De nombreux fruits contiennent des acides,<br />
comme le citron ou l'orange. Un taux d'acidité élevé entraîne une<br />
corrosion des métaux. La base est le contraire de l'acide. Les<br />
bases sont également appelées « alcalis ». Une base neutralise<br />
un acide et forme du sel. La couleur violette autour de l'électrode<br />
de magnésium indique que vous avez produit une base autour<br />
d'une électrode. Finalement, une couleur rougeâtre apparaît à<br />
proximité de l'électrode de carbone. Là, le liquide devient acide.<br />
Si les câbles de l'électrode ne sont pas reliés, on dirait qu'il ne se<br />
passe rien. Vous provoquerez des réactions similaires avec<br />
d'autres électrodes, mais vous obtiendrez probablement une<br />
solution moins basique et la couleur autour du zinc ou l'électrode<br />
d'aluminium deviendra bleue plutôt que violette.<br />
Expérience 2. Le papier indicateur<br />
Équipement : Deux bandes de papier pH. Pile 1,5 AA V. Un petit<br />
morceau de polystyrène. Console d'expérimentation<br />
Mouillez les bandes de papier pH en les plongeant dans la<br />
solution d'eau salée.<br />
Observez la couleur du papier pH mouillé.<br />
Reliez les deux bandes de papier pH par une des extrémités.<br />
Placez les bandes sur le côté de la pile AA et pliez les deux<br />
extrémités en couvrant la partie supérieure et inférieure de la pile.<br />
Placez la pile avec les papiers pH dans le compartiment<br />
rectangulaire (C.R.), un espace creux situé dans la partie<br />
supérieure de la console d'expérimentation. Maintenez cette «<br />
construction » en place à l'aide du petit morceau de polystyrène,<br />
comme illustré sur le dessin.<br />
Attendez deux ou trois heures en veillant à ce que le papier reste<br />
humide (projetez quelques gouttes d'eau salée sur le papier si<br />
nécessaire).<br />
8<br />
LA CONSOLE VUE DU HAUT<br />
Pile AA Papiers pH placés l'un sur l'autre<br />
À la fin de l'expérience, vous observerez que le papier de la partie<br />
inférieure de la pile devient violet (avec du bleu autour), tandis<br />
que la partie supérieure devient rouge (avec du jaune autour).<br />
Pourquoi ?<br />
Il s'agit de la même transformation chimique que pour<br />
l'expérience 1.<br />
Le courant électrique qui traverse l'eau salée a entraîné une<br />
transformation chimique du sel, ce qui s'est traduit par une<br />
modification de la couleur du papier. La couleur violette est<br />
basique et négative, tandis que la couleur rouge est acide et<br />
positive. Le courant négatif qui circule depuis le côté négatif de la<br />
pile et la couleur rouge indiquent le côté positif de la pile. Le sens<br />
dans lequel circule le courant est appelé « polarité ».<br />
Expérience 3. Transfert électrique<br />
Équipement : Équipement de l'expérience 1. Clou ou vis en fer ou<br />
en acier. Solution de cuivre.<br />
Comment préparer une solution de cuivre. Ce dont vous avez<br />
besoin :<br />
- Console d'expérimentation<br />
- Vinaigre<br />
- Électrodes de cuivre<br />
La console se divise en plusieurs compartiments : deux<br />
éprouvettes longues, une petite éprouvette et un compartiment<br />
rectangulaire. Nous avons déjà utilisé les éprouvettes longues et<br />
le compartiment rectangulaire. Nous allons maintenant utiliser la<br />
petite éprouvette.<br />
Remplissez de vinaigre la petite éprouvette et le compartiment<br />
rectangulaire. Remplissez-les presque jusqu'au bord. Placez en<br />
position verticale l'une des électrodes de cuivre dans la petite<br />
éprouvette et placez l'autre électrode dans le compartiment<br />
rectangulaire, comme indiqué sur le dessin.<br />
Électrode de cuivre<br />
Vinaigre<br />
Deux bandes de papier<br />
pH (mouillés) sur la pile<br />
Morceau de polystyrène servant à<br />
maintenir en place la pile et le papier pH<br />
Remarque : Les électrodes ne sont pas indispensables à cette<br />
expérience. Une pièce de monnaie en cuivre, des câbles en<br />
cuivre ou tout autre petit objet en cuivre peuvent aussi faire<br />
l'affaire, à condition que le support utilisé soit en cuivre et non pas<br />
en fer plaqué cuivre. Laissez ce mélange reposer pendant une<br />
nuit ou plus, sans le remuer. Au bout de 24 heures, vous<br />
observerez que le mélange a acquis une couleur bleutée tirant au<br />
vert.<br />
Attention : ce liquide est TOXIQUE. Veillez à ce qu'il n'entre pas<br />
en contact avec de la nourriture.<br />
Pour cette expérience, vous avez besoin d'un clou en fer ou,<br />
mieux encore, d'une vis en fer ou en acier. Aussi bien le clou que<br />
la vis doit être parfaitement propre. Insérez l'électrode de cuivre<br />
et la vis en fer dans le compartiment rectangulaire avec le liquide<br />
bleuté, comme indiqué sur le dessin. Attendez une demi-heure,<br />
un jour, une semaine, cent ans... Que va-t-il se passer, d'après<br />
vous ? Que se passe-t-il, en réalité ?
Électrode de cuivre<br />
Liquide bleuté<br />
Clou ou vis en fer<br />
La vis en fer et l'électrode de cuivre forment un ensemble<br />
électrique. De l'électricité est produite. Une « barbe » marron de<br />
poudre de cuivre se forme sur la tête de la vis en fer (résultat<br />
attendu). On observe une concentration de plus en plus<br />
importante de poussière.<br />
(À quoi cela est-il dû ?)<br />
Le liquide bleu reste bleu. (Pourquoi ?) Voici une explication<br />
simple :<br />
Le cuivre sort de la solution de cuivre et se fixe sur la tête de la<br />
vis. À cause de l'électricité produite par l'ensemble Cu/Fe. Ce<br />
processus ne s'arrête que lorsqu'il n'y a plus de cuivre, que l'eau<br />
s'assèche ou que la « barbe » de cuivre touche l'électrode de<br />
cuivre.<br />
Expérience 4. L'horloge électrique numérique<br />
Équipement : Console d'expérimentation.Module d'horloge<br />
LCSolution (eau salée, jus de fruits ou de légumes).<br />
Si vous retirez les câbles accidentellement, l'horloge cessera de<br />
fonctionner. Placez les câbles dans la rainure et fermez<br />
soigneusement la boîte de Petri. Il est important que cette<br />
dernière reste bien fermée, afin d'éviter que l'horloge ne se<br />
mouille.<br />
Rainure pour les câbles<br />
Préparez la « source d'alimentation » avec la source d'énergie<br />
naturelle de votre choix. Quelles combinaisons permettent à<br />
l'horloge de fonctionner plus longtemps ? Indiquez vos<br />
conclusions dans le tableau suivant (en suivant l'exemple) :<br />
e.g.:<br />
ÉLECTRODES MATÉRIEL SOLUTION HEURE DE DÉBUT DATE HEURE DE FIN DATE<br />
Cuivre et zinc Citron Détergent 8 h Jeudi 12/1 11 h 46<br />
Dimanche<br />
15/1<br />
Pour savoir si cous avez suffisamment d'électricité, regardez si le<br />
voyant LED s'allume. N'oubliez pas que le voyant LED ne<br />
s'allume que lorsqu'il est connecté dans le bon sens. La même<br />
règle s'applique pour le module d'horloge.<br />
9<br />
Dès que vous parvenez à allumer l'horloge, ouvrez la boîte de<br />
Petri et vous verrez deux petites plaques en métal à l'arrière du<br />
module d'horloge LCD. Elles servent à régler l'heure, comme pour<br />
les montres ou les horloges LCD.<br />
Observez le module LCD depuis l'arrière. Le bouton droit indique<br />
le mode. Appuyez dessus pour que s'affiche le mode. Appuyez<br />
deux fois et vous verrez s'afficher le chiffre 12 :A. Appuyez sur le<br />
bouton gauche pour régler l'heure. Pour les minutes, appuyez sur<br />
le bouton affichant le mode, puis sur le bouton de réglage.<br />
Quand vous avez terminé, refermes soigneusement le couvercle<br />
de la boîte de Petri.<br />
VUE ARRIÈRE DU MODE NUMÉRIQUE<br />
Utilisez un<br />
trombone ou un<br />
stylo pour régler<br />
l'heure<br />
Utilisez un<br />
trombone ou un<br />
stylo pour changer<br />
de mode<br />
Rappel : si l'horloge s'arrête, vous devrez procéder à un nouveau<br />
réglage.<br />
Expérience 5. La lampe ou l'horloge au citron<br />
Équipement : Électrode d'aluminium. Électrode de laiton.<br />
Électrodes de cuivre. Électrodes de zinc. 3 – 4 citrons.<br />
Poursuivez vos expériences avec plusieurs sortes de « lampes »<br />
et d'horloges. Vous pourriez fabriquer une lampe au citron,<br />
comme dans cet exemple.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
HORLOGE AU CITRON<br />
Zn<br />
Cu<br />
Brass<br />
Cette expérience, comme pour les autres, ne fonctionne que si<br />
les câbles sont PARFAITEMENT en contact avec toutes les<br />
électrodes. Si un contact est défectueux, le voyant LED ne<br />
s'allumera pas. Veillez à ce que les câbles et les électrodes soient<br />
parfaitement propres. Si nécessaire, essayez à nouveau en<br />
ajoutant un autre citron et une autre paire de câbles. Choisissez<br />
des citrons bien juteux. Ajoutez de l'eau si nécessaire.<br />
Al<br />
Al
(DE) Erzeuge deinen eigenen umweltfreundlichen Strom! Nur mit<br />
der Energie einer Zitrone und diesem Kit kannst du deine Uhr<br />
zum Laufen bringen. Hoch lebe die Wissenschaft!<br />
N ELECTRICITY<br />
WARNUNG:<br />
Bestimmte Experimente sollten von Erwachsenen beaufsichtigt<br />
werden.<br />
Seien Sie vorsichtig bei der Verwendung von Teilen mit spitzen<br />
Kanten.<br />
Der beigefügte Magnesiumstreifen ist leicht entzündbar. Von<br />
Wärmequellen entfernt halten. Nicht auf andere als die<br />
angegebene Art verwenden. Falls er brennt, DEN RAUCH NICHT<br />
EINATMEN.<br />
TEILE<br />
Konsole für Experimente ● Elektroden - Magnesiumstreifen ●<br />
Elektroden - Aluminium ● Elektroden - Messing ● Elektroden -<br />
Kupfer ● Elektroden - Zink ● Elektroden - Kohlenstoff ● Modul mit<br />
digitaler Uhr ● Leuchtdiode ● Kabel ● Gummirohr (Latex) ●<br />
Kunststoffrohr ● Stahlwolle ● PH-Indikatorpapier ● Trichter ●<br />
BEDIENUNGSANLEITUNG ● Messlöffel ● Büroklammer ●<br />
Quadratischer Polystyrolbehälter ● 1,5 V AA Batterien<br />
erforderlich (nicht inklusive) ● Bestimmte Haushaltsprodukte sind<br />
erforderlich<br />
EINLEITUNG<br />
Dieses Kit zeigt, wie Strom mit natürlichen Materialien infolge<br />
einfacher chemischer Reaktionen mit einigen Metallen erzeugt<br />
werden kann. Beispielsweise eine Zinkbatterie und ein<br />
Kohlenstoffstab, die in eine chemische Masse gelegt werden.<br />
Beim Herstellen deiner eigenen Batterie machst du dasselbe wie<br />
bei der Herstellung normaler Batterien. Der elektrische Strom<br />
fließt, weil eine chemische Reaktion zwischen den Metallen, den<br />
Gemüse- und Fruchtsäuren usw. aufgebaut wird.<br />
Bei einigen Experimenten mit einer Frucht, beispielsweise einer<br />
Zitrone, kannst du genug Elektrizität erzeugen, um eine<br />
Leuchtdiode oder eine Uhr zu betreiben. In anderen Fällen<br />
benötigst du drei, vier oder mehr Früchte.<br />
DIE KONSOLE FÜR EXPERIMENTE<br />
1. Kabel für die Uhr<br />
2. Reagenzgläser<br />
3. Deckel der Petrischale mit bereits eingebautem<br />
LCD-Uhr-Modul<br />
4. Kleines Reagenzglas<br />
5. Rechteckiger Behälter<br />
6. Kabel für die Uhr<br />
7. Rechteckiger Behälter<br />
8. Reagenzgläser<br />
9. Füße zum Aufstellen der Konsole (schnappen in die richtige<br />
Stellung)<br />
10. Deckel der Petrischale mit bereits eingebautem<br />
LCD-Uhr-Modul<br />
11. Kleines Reagenzglas<br />
12. Oberer Deckel der Konsole<br />
Vorsicht bei der Handhabung der Uhr. Vermeide, dass sie feucht<br />
wird.<br />
Vorbereitung der Elektroden. Du verwendest unterschiedliche<br />
Elektroden:<br />
Aluminium: Al Magnesium: Mg<br />
Eisen: Fe Zink: Zn<br />
Kohlenstoff: C Kupfer: Cu<br />
Reagenzglas: P.<br />
HINWEIS: Die Elektroden sehen folgendermaßen aus: Die<br />
Kohlenstoffelektrode ist schwarz, die aus Aluminium hat eine<br />
glänzende Silberfarbe und die Zinkelektrode ist matt silbergrau.<br />
Der Magnesiumstreifen hat eine ähnliche Farbe wie die<br />
Zinkelektrode, ist aber dünner und hat Löcher.<br />
Warnung:Bei diesen Experimenten ist die Beaufsichtigung eines<br />
Erwachsenen erforderlich. Vorsicht beim Schneiden der Gummiund<br />
Kunststoffrohre.<br />
Mit einer scharfen Schere in 6-7 mm lange Stücke schneiden.<br />
Diese Teile werden für die Verbindung der Kabel mit den<br />
Elektroden benötigt. Beispiel:<br />
Vorbereitung der Kohlenstoffelektroden<br />
Schritt 1: Stecke ein Stück Gummirohr in die<br />
Kohlenstoffelektrode.<br />
Schritt 1:Kohlenstoffelektrode mit Gummistück.<br />
10<br />
Schritt 2: Führe ein frei liegendes Kabelende in das<br />
Gummistück, damit es mit dem Kohlenstoff in<br />
Berührung kommt.<br />
Schritt 2. Führe das frei liegende<br />
Kabelende in das Gummistück.<br />
Schritt 3: Knicke das Gummi-Endstück um. nach oben, damit<br />
es nicht herausrutscht.<br />
Schritt 3.Umgeknicktes frei liegendes<br />
Kabelende im Gummistück.<br />
Vorbereitung der Magnesiumelektroden<br />
WARNUNG: Der beigefügte Magnesiumstreifen ist<br />
leicht entzündbar. Von Wärmequellen entfernt halten.<br />
Nicht auf andere als die angegebene Art verwenden.<br />
Falls es brennt, DEN RAUCH NICHT EINATMEN.<br />
FLAMMABLE<br />
Schritt 1: Teile den<br />
Magnesiumstreifen in drei<br />
Stücke und schneide ihn<br />
Reißzwecke<br />
mit einer Schere<br />
vorsichtig in 33 mm lange<br />
Streifen.<br />
Thread the exposed end<br />
Piece of magnesium<br />
of one of your wires<br />
through both holes as<br />
illustrated.<br />
Schritt 2: Bohre mit einer<br />
Reißzwecke zwei Löcher<br />
in die Enden eines jeden<br />
Magnesiumstreifens, wie<br />
in der Abb. gezeigt.<br />
Schritt 3: Zieh ein<br />
Kabelende durch beide<br />
Löcher und bedecke es<br />
zusammen mit den<br />
Magnesiumstreifen mit<br />
dem Gummirohr. Die<br />
Magnesiumelektrode ist<br />
jetzt fertig.<br />
Vorbereitung der restlichen Elektroden<br />
Für die Zink- und anderen Elektroden verwende das<br />
Kunststoffrohr so wie auf der obigen Abbildung zu sehen ist.<br />
HINWEIS: Die beiden Rohrarten erfüllen drei wichtige Aufgaben:<br />
a) Sie halten den Kontakt des Kabels mit der Elektrode aufrecht.<br />
b) Sie schützen diesen Kontakt vor unnötiger Verschmutzung.<br />
c) Sie vermeiden, dass sich die beiden Elektroden Einführen in<br />
dasselbe Reagenzglas berühren, denn sie liegen aufeinander.<br />
Die Abbildung zeigt,<br />
wie die mit den<br />
Leuchtdiode<br />
Elektronen<br />
verbundene<br />
Leuchtdiode<br />
zu verwenden ist.<br />
Mg-Streifen<br />
Experiment 1. Indikatorlösung färben<br />
Durch das Magnesiumstück<br />
gezogene frei liegendes<br />
Kabelende.<br />
Im Gummirohr<br />
eingeschlossenes Kabel und<br />
Magnesium.<br />
Material: Glas. Salz. Zinkelektrode.<br />
Kohlenstoffelektrode. Magnesiumstreifen. PH-Papier.<br />
MeßlöffelKonsole für Experimente<br />
Kohlenstoffelektrode<br />
FLAMMABLE
Fülle eines der langen<br />
Reagenzgläser der<br />
Experimentenkonsole mit<br />
Salzwasser und lege drei<br />
Streifen PH-Papier hinein.<br />
Nimm das orangefarbene<br />
PH-Papier<br />
Papier:<br />
Wenn das Salzwasser von den drei Streifen gefärbt ist, nimm die<br />
Streifen heraus und wiederhole das Experiment 1 mit dieser<br />
farbigen Flüssigkeit.<br />
Führe die Magnesium- und Kohlenstoffelektroden in das lange<br />
Reagenzglas mit der gelben Flüssigkeit und schließe die beiden<br />
Elektrodenkabel an.<br />
Nach einigen Minuten wird die Lösung rund um die<br />
Magnesiumelektrode violett.<br />
Die Lösung unter der<br />
Kohlenstoffelektrode wechselt<br />
auch die Farbe, aber viel<br />
langsamer.<br />
Was geschieht? Warum? Was<br />
würde passieren, wenn du die<br />
Kabel nicht an die Elektroden<br />
anschließen würdest? Und was,<br />
wenn du Zink oder Elektroden<br />
benutzen würdest? Was hat das<br />
mit Elektrizität zu tun?<br />
Die Farbe des PH-Papiers zeigt<br />
mit dem Farbwechsel das<br />
Vorhandensein einer Säure<br />
oder Base an. Eine Säure ist ein<br />
bitterer Stoff. Viele Früchte<br />
enthalten Säuren,<br />
beispielsweise Zitronen und<br />
Apfelsinen. Eine starke Säure<br />
Mg<br />
C<br />
Mit Salzwasser<br />
gefülltes langes<br />
Reagenzglas<br />
PH-Papier<br />
Die gelbe<br />
Lösung wird<br />
violett<br />
Verändert sich<br />
etwas?<br />
zerfrisst normalerweise die Metalle. Eine Base ist das Gegenteil<br />
einer Säure. Basische Stoffe werden auch Alkali genannt. Eine<br />
Base neutralisiert eine Säure und bildet ein Salz. Die violette<br />
Farbe rund um die Magnesiumelektrode zeigt, dass du eine Base<br />
in der Nähe der Elektrode erzeugt hast. Zum Schluss entsteht<br />
eine rötliche Farbe nahe bei der Kohlenstoffelektrode. Dort wird<br />
die Flüssigkeit sauer.<br />
Wenn die Elektrodenkabel nicht angeschlossen werden, sieht es<br />
so aus, als würde gar nichts geschehen. Mit anderen Elektroden<br />
kannst du ähnliche Reaktionen hervorbringen. Aber es ist<br />
möglich, dass eine Lösung weniger basisch wird und die Farbe<br />
um die Zink- oder Aluminiumelektrode sich erst blau färbt, bevor<br />
sie violett wird.<br />
Experiment 2. Das Indikatorpapier<br />
Material: 2 Stück PH-Papier. 1,5 AA V Batterie. Ein kleines Stück<br />
Polystyrol.Konsole für Experimente<br />
Steck die PH-Papierstreifen nur zum Anfeuchten in die<br />
Salzwasserlösung.<br />
Sieh dir die Farbe des feuchten PH-Papiers genau an.<br />
Lege die beiden PH-Papierstreifen an einer Seite übereinander.<br />
Leg die Streifen um die Seite der AA Batterie und falte die beiden<br />
Enden so, dass sie die Ober- und Unterseite der Batterie<br />
bedecken.<br />
Leg die Batterie mit den PH-Papierstücken in das rechteckige<br />
Fach (CR), die flache Öffnung des Oberteils der<br />
Experimentenkonsole. Befestige diesen Aufbau mit dem kleinen<br />
Stück Polystyrol, wie es auf der Abbildung gezeigt wird.<br />
Warte zwei bis drei Stunden und halte das Papier feucht<br />
(eventuell musst du das Papier mit ein paar Tropfen Salzwasser<br />
besprenkeln).<br />
Zum Ende des Experiments siehst du, dass das Papier an der<br />
Unterseite der Batterie violett wird (von Blau umgeben) und die<br />
11<br />
DIE KONSOLE VON OBEN<br />
AA Batterie Übereinander liegende PH-Papierstücke<br />
Ein Stück Polystyrol,<br />
damit die Batterie und das<br />
PH-Papier nicht verrutschen<br />
2 feuchte Streifen<br />
PH-Papier auf der Batterie<br />
Oberseite rot (von Gelb umgeben). Warum?<br />
Es handelt sich um dieselbe chemische Änderung wie im<br />
Experiment 1.<br />
Der elektrische Strom, der durch das Salzwasser fließt, hat eine<br />
chemische Veränderung hervorgerufen und diese hat die Farbe<br />
des Papiers verändert. Die violette Farbe ist basisch und zeigt<br />
eine negative Ladung an; das Rot ist sauer und zeigt eine positive<br />
Ladung. Die negative Spannung, die von der negativen Seite der<br />
Batterie ausgeht, und die rote Farbe zeigen die positive Ladung<br />
der Batterie an.Die Richtung, in die der Strom fließt, nennt sich<br />
Polarität.<br />
Experiment 3. Elektrische Übertragung<br />
Material: Wie für das Experiment 1. Nagel oder Schraube aus<br />
Eisen oder Stahl.Kupferlösung<br />
Zubereitung der Kupferlösung. Du brauchst:<br />
- Konsole für Experimente<br />
- Essig<br />
- Kupferelektroden<br />
Die Konsole hat mehrere Fächer: 2 lange Reagenzgläser, 1<br />
kurzes Reagenzglas und 1 rechteckiges Fach. Die langen<br />
Reagenzgläser und das rechteckige Fach haben wir bereits<br />
benutzt. Jetzt verwenden wir das kurze Reagenzglas.<br />
Füll das kurze Reagenzglas und das rechteckige Fach fast<br />
randvoll mit Essig. Leg eine der Kupferelektroden längs in das<br />
kurze Reagenzglas und die zweite Kupferelektrode in das<br />
rechteckige Fach, so wie du es auf der Abbildung siehst.<br />
Hinweis: Du brauchst für dieses Experiment eigentlich gar keine<br />
Elektroden. Ein Geldstück aus Kupfer, Kupferkabel oder ein<br />
anderer Kupfergegenstand funktionieren auch, vorausgesetzt, sie<br />
bestehen aus Kupfer und nicht aus verkupfertem Eisen. Lass<br />
diese Mischung eine Nacht oder länger stehen, ohne sie zu<br />
bewegen. Nach 24 Stunden siehst du, wie die Mischung<br />
blau-grün wird.<br />
Achtung: Diese Flüssigkeit ist GIFTIG. Nichts verwenden, was in<br />
Kontakt mit Nahrungsmitteln kommen könnte.<br />
Kupferelektrode<br />
Bläuliche<br />
Flüssigkeit<br />
Kupferelektrode<br />
Essig<br />
Eisennagel oder<br />
-schraube
Für dieses Experiment brauchst du einen Eisennagel oder besser<br />
eine Eisen- oder Stahlschraube. Sowohl der Nagel als auch die<br />
Schraube müssen absolut sauber sein. Tauche die<br />
Kupferelektrode und die Eisenschraube in den CR mit der<br />
bläulichen Flüssigkeit, wie auf der Abbildung gezeigt. Warte eine<br />
halbe Stunde, einen Tag, eine Woche, hundert Jahre... Was<br />
glaubst du, was geschehen wird?Was passiert wirklich?<br />
Der Eisennagel und die Kupferelektrode bilden eine elektrische<br />
Einheit. Es entsteht Elektrizität. Am Kopf der Eisenschraube<br />
bildet sich eine brauner "Bart" aus Kupferstaub (was wir erwartet<br />
hatten). Es bildet sich immer mehr Staub. (Woher kommt er?)<br />
Die blaue Flüssigkeit bleibt blau. (Warum?) Hier eine einfache<br />
Erklärung:<br />
Das Kupfer löst sich aus der Kupferflüssigkeit und setzt sich am<br />
Schraubenkopf fest. Das geschieht infolge der von der<br />
Cu/Fe-Einheit erzeugte Elektrizität. Das dauert so lange, bis das<br />
Kupfer aufgebraucht ist. Das Wasser trocknet und der<br />
"Kupferbart" berührt die Kupferelektrode.<br />
Experiment 4. Elektrische digitale Uhr<br />
Material: Konsole für Experimente. LC Uhrenmodul.<br />
Salzwasserlösung, Frucht- oder Gemüsesaft.<br />
Wenn du die Kabel ungewollt herausnimmst, bleibt die Uhr<br />
stehen. Ziehe die Kabel durch den Schlitz und schließe vorsichtig<br />
die Petrischale. Es ist wichtig, dass die Schale geschlossen<br />
bleibt, damit die Uhr nicht feucht wird.<br />
e.g.:<br />
Schlitz für die Kabel<br />
ELEKTRODEN MATERIAL Behebung BEGINN DES DATUM ENDE DES DATUM<br />
EXPERIMENTS<br />
EXPERIMENTS<br />
Kupfer und Zink Zitrone Reinigungsmittel 08.00 Uhr Donnerstag, 11.46 Uhr<br />
der 12.1<br />
Sonntag, der<br />
15.1.<br />
Bereite die "Stromquelle" mit der von dir gewünschten natürlichen<br />
Energiequelle vor. Mit welchen Kombinationen läuft die Uhr am<br />
längsten? Notiere deine Schlussfolgerungen in der<br />
nachstehenden Tabelle (wie in dem Beispiel):<br />
Prüfe, ob du genügend Strom hast, indem du die Leuchtdiode<br />
beobachtest. Denke daran, dass die Leuchtdiode nur funktioniert,<br />
wenn sie in der korrekten Richtung angeschlossen ist. Diese<br />
Regel gilt auch für das Uhrenmodul.<br />
Wenn du es schaffst, die Leuchtdiode zum Leuchten zu bringen,<br />
öffne die Petrischale. Du siehst zwei kleine Metallplatten auf der<br />
Rückseite des LCD Uhrenmoduls. Damit stellst du die Uhrzeit ein,<br />
wie bei anderen LCD- und Armbanduhren auch.<br />
Betrachte das LCD-Modul von hinten. Der Kontakt an der rechten<br />
12<br />
Seite ist der Kontakt zur Modusauswahl. Wenn du darauf drückst,<br />
erscheint der Modus. Wenn du zweimal darauf drückst, erscheint<br />
die Zahl 12: A. Der Kontakt auf der linken Seite dient der<br />
Stundeneinstellung. Drück auf den Modus-Kontakt und danach<br />
den eingestellten Kontakt zur Minuteneinstellung.<br />
Wenn du fertig bist, schließ vorsichtig den Deckel der Petrischale.<br />
Hintenansicht des digitalen ModusBereite die "Stromquelle" mit<br />
der von dir gewünschten natürlichen Energiequelle vor. Mit<br />
welchen Kombinationen läuft die Uhr am längsten? Notiere deine<br />
Schlussfolgerungen in der nachstehenden Tabelle (wie in dem<br />
Beispiel):<br />
REAR VIEW OF DIGITAL MODE<br />
Die Stunde kannst<br />
du mit einer<br />
Büroklammer oder<br />
einem<br />
Kugelschreiber<br />
einstellen<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
DIE ZITRONENUHR<br />
Zn<br />
Brass<br />
Cu<br />
Brass<br />
Den Modus kannst<br />
du mit einer<br />
Büroklammer oder<br />
einem<br />
Kugelschreiber<br />
ändern<br />
Denk daran: Falls die Uhr stehen bleibt, musst du sie erneut<br />
einstellen.<br />
Experiment 5. Die Lampe oder Zitronenuhr<br />
Material: Aluminiumelektrode. Messingelektrode.<br />
Kupferelektroden. Zinkelektroden. 3–4 Zitronen.<br />
Mach weitere Experimente mit unterschiedlichen Arten von<br />
"Lampen" und Uhren. Du könntest eine Zitronenlampe herstellen,<br />
wie in diesem Beispiel.<br />
Wie fast alle Experimente funktioniert dieses nur, wenn die Kabel<br />
einen PERFEKTEN Kontakt zu den Elektroden haben. Wenn eins<br />
keinen Kontakt hat, geht die Leuchtdiode nicht an. Prüfe, ob die<br />
Kabel und Elektroden sauber sind. Falls nötig, versuche es mit<br />
einer weiteren Zitrone und einem anderen Kabelpaar. Versichere<br />
dich, dass die Zitronen viel Saft haben. Falls nötig, füge Wasser<br />
hinzu.<br />
Al<br />
Al
(IT) Produci energia elettrica pulita da solo! Solo con l'energia di<br />
un limone e questo kit sarai in grado di far funzionare un orologio.<br />
Vivi la scienza!<br />
N ELECTRICITY<br />
AVVERTENZA:<br />
Alcuni esperimenti richiedono da sorveglianza da parte di un<br />
adulto.<br />
Fare attenzione nell'utilizzare le parti con i bordi più affilati.<br />
La striscia di magnesio in dotazione è estremamente<br />
infiammabile. Mantenerla lontana da fonti di calore. Non usarla in<br />
modo diverso da quello indicato. Se si infiamma, NON<br />
RESPIRARNE IL FUMO.<br />
COMPONENTI<br />
Console per l'esperimento ● Elettrodi- Striscia di magnesio ●<br />
Elettrodi- Alluminio ● Elettrodi- Ottone ● Elettrodi- Rame ●<br />
Elettrodi- Zinco ● Elettrodi- Carbonio ● Modulo dell'orologio<br />
digitale ● LED ● Cavi ● Tubo di gomma (lattice) ● Tubo di plastica<br />
● Lana di acciaio ● Cartina pH (cartine al tornasole)<br />
Imbuto ● <strong>Manual</strong>e di istruzioni ● Cucchiaio per misurare ● Clip ●<br />
Quadrato di polistirene ● Richiede pile da 1,5 AA V (non<br />
comprese) ● Sono necessari alcuni prodotti domestici<br />
INTRODUZIONE<br />
Questo kit insegna come produrre elettricità con materiali naturali<br />
mediante semplici reazioni chimiche con alcuni metalli. Come una<br />
pila di zinco e una barretta di carbonio messi tra una pasta<br />
chimica.<br />
Fabbricando da solo la tua pila potrai seguire la stessa procedura<br />
che con le pile normali. La corrente elettrica fluisce poiché si<br />
verifica una reazione chimica tra i metalli e gli acidi della verdura,<br />
della frutta, ecc.<br />
In alcuni esperimenti un frutto, come ad esempio un limone, può<br />
produrre una gran quantità di elettricità, sufficiente ad accendere<br />
un LED o l'orologio. In altri casi, avrai bisogno di usare 2, 4 o più<br />
frutti.<br />
LA CONSOLE PER L'ESPERIMENTO<br />
1. Cavi dell'orologio<br />
2. Provette<br />
3. Coperchio della piastra di Petri con modulo dell'orologio LCD<br />
già applicato<br />
4. Provetta piccola<br />
5. Recipiente rettangolare<br />
6. Cavi dell'orologio<br />
7. Recipiente rettangolare<br />
8. Provette<br />
9. Supporti per mantenere in piedi la console (si rimettono a<br />
posto)<br />
10. Coperchio della piastra di Petri con modulo dell'orologio LCD<br />
già applicato<br />
11. Provetta piccola<br />
12. Coperchio superiore della console<br />
Fare attenzione al momento di usare l'orologio, bisogna evitare<br />
che la piastra si bagni.<br />
Preparazione degli elettrodi.<br />
Usa diversi elettrodi:<br />
Alluminio: Al Magnesio: Mg<br />
Ferro: Fe Zinco: Zn<br />
Carbonio: C Rame: Cu<br />
Provetta: P.<br />
NOTA: l'elettrodo di carbonio è nero, quello di alluminio è di color<br />
argento lucido, mentre quello di zinco, è di color argento-grigiastro<br />
opaco.La striscia di magnesio ha un colore simile all'elettrodo di<br />
zinco, ma è più sottile e non presenta fori.<br />
Avvertenza:Questa attività richiede la sorveglianza di un adulto.<br />
Fare attenzione nel tagliare i tubi di gomma e di plastica.<br />
Tagliare in pezzi di circa 6-7mm con delle buone forbici. Questi<br />
pezzi sono necessari ad unire i cavi agli elettrodi. Esempio:<br />
Preparazione degli elettrodi di carbonio<br />
Passo 1: Disporre un pezzo del tubo di gomma all'interno<br />
dell'elettrodo di carbonio.<br />
Fase 1. Elettrodo di carbonio con pezzo di gomma.<br />
13<br />
Passo 2: Inserire l'estremità a vista del cavo all'interno de<br />
lpezzo di gomma affinché entri in contatto con il<br />
carbonio.<br />
Passo 2. Inserire l'estremo a vista del cavo<br />
nel pezzo di gomma.<br />
Passo 3: Piegare l'estremità del cavo verso l'alto per evitare<br />
che fuoriesca.<br />
Preparazione degli elettrodi di magnesio<br />
Passo 3. Estremo a vista del cavo piegato<br />
nel pezzo di gomma.<br />
AVVERTENZA: La striscia di magnesio in dotazione è<br />
estremamente infiammabile. Tenerla lontana da fonti di<br />
calore. Non usarla in modo diverso da quello indicato.<br />
Se si infiamma, NON RESPIRARNE IL FUMO.<br />
FLAMMABLE<br />
Passo 1: Dividere la striscia di<br />
magnesio in tre parti e tagliarla<br />
Thumbtack<br />
con molta attenzione con delle<br />
forbici, ottenendo pezzi da<br />
33mm.<br />
Thread the exposed end of one<br />
of your wires through both<br />
Piece of magnesium<br />
holes as illustrated.<br />
Passo 2: Con una puntina,<br />
creare buchi su un'estremità di<br />
ogni elettrodo di magnesio,<br />
come mostrato.<br />
Passo 3: Far attraversare<br />
entrambi i fori con l'estremo di<br />
un cavo, ricoprire insieme alle<br />
strisce di magnesio con il tubo<br />
di gomma. Ed ecco che<br />
l'elettrodo di magnesio è già<br />
pronto.<br />
Preparazione del resto degli elettrodi<br />
Per gli elettrodi di zinco ed il resto degli elettrodi, usare il tubo di<br />
plastica come mostrato in alto.<br />
NOTA: i due tipi di tubo hanno tre funzioni importanti:<br />
a) Tenere il cavo fisso all'elettrodo garantendo un buon contatto<br />
elettrico.<br />
b) Proteggere tale contatto da contaminazioni non necessarie.<br />
c) Prevenire il contatto tra un elettrodo e l'altro una volta inseriti<br />
insieme, uno sopra all'altro all'interno di una stessa provetta.<br />
Il disegno mostra<br />
come usare<br />
LED<br />
il LED che si unisce<br />
agli elettrodi.<br />
Striscia di Mg<br />
Esperimento 1. Soluzione al tornasole<br />
Estremo a vista del cavo che<br />
attraversa il pezzo di<br />
magnesio.<br />
Cavo e magnesio coperti dal<br />
tubo di gomma.<br />
Elettrodo di carbonio<br />
Attrezzatura: Bicchiere. Sale. Elettrodo di Zinco.<br />
Elettrodo di carbonioStriscia di magnesio. Cartina al<br />
tornasole per il pH. Cucchiaio misurino. Console di<br />
esperimenti.<br />
Riempi una delle provette lunghe della console di esperimento<br />
con acqua salata e insieriscici 3 strisce di carta al tornasole per<br />
pH. È la cartina arancione:<br />
long T.T. with the yellow liquid and connect the two electrode<br />
wires.<br />
FLAMMABLE
Quando l'acqua salata<br />
cambia colore con le tre<br />
strisce, rimuovile e ripeti<br />
l'esperimento Nº 1 in<br />
questo liquido colorato.<br />
Inserisci gli elettrodi di<br />
magnesio e di carbonio<br />
all'interno della provetta<br />
Mg<br />
C<br />
Cartina al<br />
tornasole per il pH<br />
lunga con il liquido giallo e collega i due cavi degli elettrodi.<br />
Provetta lunga<br />
riempita con<br />
acqua salata<br />
Cartina al<br />
tornasole<br />
per il pH<br />
Dopo qualche minuto, la soluzione diventa viola attorno<br />
all'elettrodo di magnesio.<br />
Anche la soluzione al di<br />
sotto del carbonio<br />
cambia colore, ma in<br />
modo molto più lento.<br />
Cosa succede?<br />
Perché? Che<br />
succederebbe se non si<br />
collegassero i cavi agli<br />
elettrodi? E se invece di<br />
usare il magnesio<br />
usassi lo zinco o gli<br />
elettrodi? Che cosa ha<br />
a che fare tutto questo<br />
con l'elettricità?<br />
Il colore della cartina<br />
tornasole per il pH<br />
indica la presenza di un<br />
acido o di un<br />
componente basico<br />
quando cambia colore.<br />
Un acido è una<br />
La soluzione<br />
gialla diventa<br />
viola<br />
Ci sono stati dei<br />
cambiamenti?<br />
sostanza amara. Molti frutti contengono acidi, come ad esempio<br />
il limone o l'arancia.Un acido forte normalmente corrode i metalli.<br />
Un componente basico è esattamente il contrario di un acido. Le<br />
sostanze basiche sono anche denominate alcali. Una base<br />
neutralizza un acido e forma un sale. Il colore viola che appare<br />
intorno all'elettrodo di magnesio dimostra che hai creato un<br />
elemento basico intorno ad un elettrodo. Alla fine si ottiene un<br />
colore rossiccio intorno all'elettrodo di carbonio. Il liquido in quella<br />
zona diventa acido.<br />
Se non si collegano i cavi dell'elettrodo, sembra che non succeda<br />
nulla. Provocherai reazioni simili con altri elettrodi, ma<br />
probabilmente otterrai una soluzione meno basica ed il colore<br />
intorno allo zinco o all'elettrodo di alluminio diventerà blu piuttosto<br />
che viola.<br />
Esperimento 2. La cartina al tornasole<br />
Attrezzatura: 2 pezzi di cartina al tornasole per il pH. Pila 1,5 AA<br />
V. Pezzo piccolo di polistirene. Console per l'esperimento<br />
Inserire le strisce di cartina al tornasole per il pH nella soluzione di<br />
acqua salata, solo per bagnarle un po'.<br />
Osserva bene il colore della cartina al tornasole per il pH bagnata.<br />
Unire le due strisce di cartina al tornasole per il pH da una parte.<br />
Mettere le strisce su un lato della pila AA e piegare i due estremi<br />
coprendo la parte superiore ed inferiore della pila.<br />
Disporre la pila con le cartine al tornasole per il pH nello<br />
scompartimento rettangolare (CR), il vano poco profondo della<br />
parte superiore della console dell'esperimento. Mantenere questo<br />
"sistema" fermo in questa posizione con il pezzettino di<br />
polistirene, come mostrato.<br />
14<br />
LA CONSOLE DALLA PARTE SUPERIORE<br />
Pila AA Cartine al tornasole per il pH, una sull'altra<br />
Pezzo di polistirene per<br />
mantenere la pila e la cartina<br />
al tornasole per il pH fermi<br />
2 strisce di cartine al tornasole<br />
per il pH (bagnate) sulla pila<br />
Attendere due o tre ore mantenendo la cartina bagnata (versare<br />
delle gocce di acqua salata sulla cartina, se è necessario).<br />
Alla fine dell'esperimento vedrai che la cartina che si trova sulla<br />
parte inferiore della pila diventa viola (con un alone blu) e la parte<br />
superiore, rossa (con un alone giallo). Perché?<br />
Si tratta dello stesso cambiamento chimico dell'Esperimento 1.<br />
La corrente elettrica che attraversa l'acqua salata ha causato un<br />
cambiamento chimico nel sale, comportando il cambiamento del<br />
colore della cartina. Il colore viola è basico ed indica la negatività;<br />
il rosso è acido ed indica la positività. La corrente negativa che si<br />
muove dal lato negativo della pila ed il colore rosso indicano il lato<br />
positivo della batteria. La direzione in cui si muove la corrente si<br />
chiama polarità.<br />
Esperimento 3. Passaggio elettrico<br />
Attrezzatura: Attrezzatura dell'esperimento 1. Chiodo o vite di<br />
ferro o acciaio. Soluzione di rame.<br />
Come preparare una soluzione di rame. Hai bisogno di:<br />
- Console di esperimenti<br />
- Aceto<br />
- Elettrodi di rame<br />
La console presenta vari scompartimenti: 2 provette lunghe, 1<br />
provetta corta e 1 scompartimento rettangolare. Abbiamo già<br />
utilizzato le provette lunghe e il vano rettangolare.Ora adoperiamo<br />
quella corta.<br />
Riempire con aceto la provetta corta ed il contenitore rettangolare<br />
fino quasi al bordo. Disporre in posizione verticale uno degli<br />
elettrodi di rame all'interno della provetta corta ed appoggiare il<br />
secondo elettrodo di rame all'interno dello scompartimento<br />
rettangolare come mostrato nel disegno.<br />
Elettrodo di rame<br />
Aceto<br />
Nota: Non è assolutamente necessario usare elettrodi per questo<br />
esperimento. Una moneta di rame, cavi di rami o qualsiasi altro<br />
oggetto piccolo di rame potranno servire allo scopo, l'importante e<br />
che siano di rame e non di ferro dipinto di rame. Lasciare riposare<br />
il miscuglio una notte intera o più, senza muoverlo.Dopo 24 ore,<br />
noterete che il miscuglio diventa di colore verde-azzurro.<br />
Attenzione: questo liquido è VELENOSO, non usare nulla che<br />
possa poi essere messo a contatto con il cibo.<br />
Per questo esperimento hai bisogno di un chiodo di ferro o,<br />
ancora meglio, di una vite di ferro o di acciaio. Sia il chiodo sia la<br />
vite devono essere completamente puliti. Inserisci l'elettrodo di<br />
rame e la vite di ferro nel CR con un liquido blu come mostrato<br />
nel disegno. Attendi mezz'ora, un giorno, una settimana,<br />
cent'anni... cosa pensi che succeda? Cosa succede realmente?
e.g.:<br />
Elettrodo di rame<br />
Liquido blu<br />
Chiodo o vite di ferro<br />
La vite di ferro e l'elettrodo di rame formano un insieme elettrico.<br />
Si produce elettricità. Sulla testa della vite di ferro si forma una<br />
"barbetta" marrone di polvere di rame (come ci si aspettava). E si<br />
crea sempre più polvere.<br />
(Da dove viene?)<br />
Il liquido blu, rimane blu. Perché? Vi è una spiegazione semplice:<br />
Il rame proviene dalla soluzione di rame e si fissa sulla testa della<br />
vite. A causa dell'elettricità prodotta dall'insieme di Cu/Fe. Ciò<br />
avviene fino a che non si esaurisce il rame, si asciuga l'acqua o la<br />
"barbetta" di rame tocca l'elettrodo di rame.<br />
Esperimento 4. L'orologio digitale elettrico<br />
Attrezzatura: Console per l'esperimentoModulo dell'orologio<br />
LCSoluzione (acqua salata, succo di frutta o di verdure).<br />
Se tiri fuori i cavi per sbaglio, l'orologio si scollega. Fai passare i<br />
cavi nelle fessure e chiudi per bene la piastra di Petri. È<br />
importante mantenerla ben chiusa affinché l'orologio non si bagni.<br />
Fessura per i cavi<br />
Prepara la "fonte di alimentazione" con qualsiasi fonte di energia<br />
naturale che vuoi. Quali sono le combinazioni che fanno sì che<br />
l'orologio funziona più a lungo? Appunta le tue conclusioni sulla<br />
seguente tabella (come mostrato nell'esempio):<br />
ELETTRODI MATERIALE SOLUZIONE ORARIO DI INIZIO DATA ORARIO DI DATA<br />
CONCLUSIONE<br />
Rame e zinco limone detergente Ore 08:00 giovedì 12/1 Ore 11:46 domenica<br />
15/1<br />
Verifica se hai abbastanza elettricità, vedendo se si accende il<br />
LED. Ricorda che il LED funziona solo quando è collegato nella<br />
direzione corretta.La stessa regola vale anche per il modulo<br />
dell'orologio.<br />
Una volta che sei riuscito ad accendere l'orologio, apri la piastra<br />
15<br />
di Petri e vedrai due piccole piastre di metallo sul dorso del<br />
modulo dell'orologio LCD. Servono per regolare l'ora come per gli<br />
orologi LCD o da polso.<br />
Osserva il modulo LCD da dietro. Il contatto del lato destro è il<br />
contatto per la modalità. Premilo e apparirà la modalità.Premilo<br />
due volte ed apparirà il numero 12: A. Il contatto del lato sinistro<br />
serve per regolare l'ora, premi il contatto della modalità e poi il<br />
contatto regolato per fissare i minuti.<br />
Una volta concluso il processo chiudi con attenzione il coperchio<br />
della piastra di Petri.<br />
VISTA POSTERIORE DELLA MODALITÀ DIGITALE<br />
Usa un clip o<br />
una penna per<br />
regolare l'ora<br />
Usa un clip o una<br />
penna per<br />
cambiare la<br />
modalità<br />
Ricorda: se l'orologio si ferma dovrai impostarlo nuovamente.<br />
Esperimento 5. La lampada o l'orologio di limone<br />
Attrezzatura: Elettrodo di alluminio. Elettrodo di ottone. Elettrodi di<br />
rameElettrodi di zinco. 3 – 4 limoni.<br />
Continua a sperimentare con vari tipi di "lampade" e orologi.<br />
Potrai costruire una lampada di limone, come in questo esempio.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
L'OROLOGIO DI LIMONE<br />
Zn<br />
Cu<br />
Brass<br />
Questo esperimento, come quasi tutti, funziona solo se i cavi<br />
sono PERFETTAMENTE in contatto con tutti gli elettrodi. Se uno<br />
non fa contatto, il LED non si accende. Assicurati che i cavi e gli<br />
elettrodi sono perfettamente puliti. Se è necessario, prova ad<br />
aggiungere un altro limone ed un altro paio di cavi. Assicurati di<br />
usare limoni molto succosi. Se necessario, aggiungi un po'<br />
d'acqua.<br />
Al<br />
Al
(PT) Produz electricidade limpa tu mesmo! Só com a energia de<br />
um limão e este kit podes fazer funcionar um relógio. Vive a<br />
ciência!<br />
N ELECTRICITY<br />
ADVERTÊNCIA:<br />
Certos experimentos requerem a supervisão de um adulto.<br />
Tenha cuidado ao usar as peças com bordas afiadas.<br />
A tira de magnésio incluída é altamente inflamável. Mantê-la<br />
longe do calor. Não a usar de maneira diferente à indicada. Se<br />
arder, NÃO INALAR O FUMO.<br />
COMPONENTES<br />
Consola de experimento ● Eléctrodos Tira de magnésio ●<br />
Eléctrodos Alumínio ● Eléctrodos Latão ● Eléctrodos Cobre ●<br />
Eléctrodos Zinco ● Eléctrodos Carbono ● Módulo de relógio<br />
digital ● LED ● Cabos ● Tubo de borracha (látex) ● Tubo de<br />
plástico ● Lã de aço ● Papel pH (papel indicador) ● Funil ●<br />
<strong>Manual</strong> de instruções ● Colher de medir ● Clipe ● Quadrado de<br />
poliestireno ● Requer pilhas de 1,5 AA V (não incluídas) ● São<br />
necessários certos produtos do lar<br />
INTRODUÇÃO<br />
Este kit mostra como produzir electricidade com materiais<br />
naturais mediante simples reacções químicas com alguns metais.<br />
Como uma pilha de zinco e uma vareta de carbono que se<br />
colocam entre uma pasta química.<br />
Fabricando a tua própria pilha, segues o mesmo processo que<br />
com as pilhas normais. A corrente eléctrica flui porque tem lugar<br />
uma reacção química entre os metais e os ácidos das verduras,<br />
frutas, etc.<br />
Nalguns experimentos, uma peça de fruta, como um limão, pode<br />
produzir muita electricidade, suficiente para acender um LED ou<br />
o relógio. Noutros casos, precisas usar 3, 4 ou mais peças de<br />
fruta.<br />
A CONSOLA DE EXPERIMENTO<br />
1. Cabos do relógio<br />
2. Provetas<br />
3. Tampa da placa de Petri com módulo de relógio LCD já no<br />
seu sítio<br />
4. Proveta pequena<br />
5. Recipiente rectangular<br />
6. Cabos do relógio<br />
7. Recipiente rectangular<br />
8. Provetas<br />
9. Pés para pôr a consola de pé (voltam ao seu sítio)<br />
10. Tampa da placa de Petri com módulo de relógio LCD já no<br />
seu sítio<br />
11. Proveta pequena<br />
12. Tampa superior da consola<br />
Cuidado ao manipular o relógio, evita que a placa se molhe.<br />
Preparação dos eléctrodos. Utilizas diferentes eléctrodos:<br />
Alumínio: Al Magnésio: Mg<br />
Ferro: Fe Zinco: Zn<br />
Carbono: C Cobre: Cu<br />
Proveta: P.<br />
NOTA: o eléctrodo de carbono é preto, o de alumínio é de cor<br />
prata brilhante, e o de zinco, prata-cinzento fosco. A tira de<br />
magnésio tem uma cor parecida à do eléctrodo de zinco, mas é<br />
mais fina e não tem buracos.<br />
Advertência: Esta actividade requer a supervisão de um adulto.<br />
Cuidado ao cortar os tubos de borracha e de plástico.<br />
Cortar em peças de uns 6-7mm usando uma boa tesoura. Estas<br />
peças são necessárias para unir os cabos aos eléctrodos.<br />
Exemplo:<br />
Preparação dos eléctrodos de carbono<br />
Passo 1: Coloca um pedaço do tubo de borracha no eléctrodo<br />
de carbono.<br />
Passo 1. Eléctrodo de carbono com<br />
pedaço de borracha.<br />
Passo 2: Introduz a extremidade exposta do cabo no pedaço<br />
de borracha, para que toque o carbono.<br />
Passo 2 . Introduz a extremidade exposta do<br />
cabo no pedaço de borracha.<br />
16<br />
Passo 3: Dobra a extremidade do cabo para cima para evitar<br />
que saia.<br />
Preparação dos eléctrodos de magnésio<br />
ADVERTÊNCIA: A tira de magnésio incluída é<br />
altamente inflamável. Mantê-la longe do calor. Não a<br />
usar de maneira diferente à indicada. Se arder, NÃO<br />
INALAR O FUMO.<br />
Passo 1: Divide a tira de<br />
magnésio em três partes<br />
Percevejo<br />
e corta-a<br />
cuidadosamente com<br />
uma tesoura, fazendo<br />
pedaços de 33mm.<br />
Passo 2: Com um<br />
percevejo, faz dois<br />
buracos num extremo de<br />
cada eléctrodo de<br />
magnésio, como estes.<br />
Passo 3: Passa a<br />
extremidade de um cabo<br />
por ambos os buracos,<br />
tapa-o junto com as tiras<br />
de magnésio com o tubo<br />
de borracha. O eléctrodo<br />
de magnésio já está<br />
pronto.<br />
Passo 3. Extremidade do cabo exposta dobrada<br />
no pedaço de borracha.<br />
Preparação dos outros<br />
Para os eléctrodos de zinco e os outros eléctrodos, usa o tubo de<br />
plástico como se ilustra acima.<br />
NOTA: os dois tipos de tubos têm três importantes funções:<br />
a) Sujeita o cabo ao eléctrodo, garantindo um bom contacto<br />
eléctrico.<br />
b) Protege este contacto de contaminação desnecessária.<br />
c) Previne que um eléctrodo toque no outro ao introduzi-los os<br />
dois juntos, um em cima do outro, na mesma proveta.<br />
O desenho mostra<br />
como usar<br />
LED<br />
o LED que vai unido<br />
aos eléctrodos.<br />
Tira de Mg<br />
Experimento 1. Solução de indicador colorido<br />
Equipamento: Copo. Sal. Eléctrodo de Zinco.<br />
Eléctrodo de carbono. Tira de magnésio. Papel pH.<br />
Colher medidora. Consola de experimentos<br />
Enche uma das provetas<br />
longas da consola de<br />
experimento com água<br />
salgada e introduz 3 tiras de<br />
papel pH. É o papel laranja:<br />
FLAMMABLE<br />
Extremidade exposta de<br />
cabo passada pela peça de<br />
magnésio.<br />
Cabo e magnésio tapados<br />
com o tubo de borracha.<br />
Eléctrodo de carbono<br />
FLAMMABLE<br />
Papel pH
Quando a água salgada se colorir com as três tiras, retira-as e<br />
repete o experimento Nº 1 neste líquido colorido.<br />
Introduz os eléctrodos de magnésio e carbono na proveta longa<br />
com o líquido amarelo e conecta os dois cabos dos eléctrodos.<br />
Mg<br />
C<br />
Proveta longa<br />
cheia de água<br />
salgada<br />
Papel Ph<br />
Decorridos alguns minutos, a solução torna-se violeta ao redor do<br />
eléctrodo de magnésio.<br />
A solução de debaixo do<br />
carbono também muda de<br />
cor, mas de forma muito<br />
mais lenta.<br />
O que é que se passa? Por<br />
quê? O que aconteceria se<br />
não conectasses os cabos<br />
aos eléctrodos? E se, em<br />
vez de magnésio, usasses<br />
zinco ou outros eléctrodos?<br />
O que é que isto tem a ver<br />
com a electricidade?<br />
A cor do papel pH indica a<br />
presença de um ácido ou<br />
base ao mudar de cor. Um<br />
ácido é uma substância<br />
amarga. Muitas frutas<br />
contêm ácidos, como o<br />
limão ou a laranja. Um<br />
ácido forte normalmente<br />
corrói os metais. Uma base<br />
A solução<br />
amarela<br />
torna-se<br />
violeta<br />
Produziu-se<br />
alguma<br />
mudança?<br />
é o oposto a um ácido. As substâncias que são bases também<br />
chamam-se álcalis. Uma base neutraliza um ácido e forma um<br />
sal. A cor violeta ao redor do eléctrodo de magnésio indica que<br />
produziste uma base perto de um eléctrodo. Ao final consegue-se<br />
uma cor avermelhada perto do eléctrodo de carbono. O líquido ali<br />
torna-se ácido.<br />
Se não se conectam os cabos do eléctrodo, parece que não<br />
acontece nada. Provocarás reacções similares com outros<br />
eléctrodos, mas provavelmente conseguirás uma solução menos<br />
básica, e a cor ao redor do zinco ou do eléctrodo de alumínio<br />
tornar-se-á azul antes que violeta.<br />
Experimento 2. O papel indicador<br />
Equipamento: 2 pedaços de papel pH. Pilha 1,5 AA V. Pedaço<br />
pequeno de poliestireno. Consola de experimento<br />
Mergulha as tiras de papel pH na solução de água salgada, só<br />
para que se molhem.<br />
Repara na cor do papel pH molhado.<br />
Une as duas tiras de papel pH por uma extremidade. Põe as tiras<br />
na lateral da pilha AA e dobra as duas extremidades tapando a<br />
parte superior e inferior da pilha.<br />
Coloca a pilha com os papéis pH no compartimento rectangular<br />
(CR), o buraco pouco profundo da parte superior da consola de<br />
experimento. Mantém este "sistema" no seu sítio mediante o<br />
pequeno pedaço de poliestireno, como se mostra.<br />
A CONSOLA VISTA DE CIMA<br />
Pilha AA Papéis pH um em cima do outro<br />
Pedaço de poliestireno para manter<br />
a pilha e o papel pH no seu sítio<br />
2 tiras de papel pH (molhados) sobre a pilha<br />
17<br />
Espera duas ou três horas mantendo o papel húmido (deita umas<br />
gotas de água salgada no papel, se necessário).<br />
Ao final do experimento, verás que o papel da parte inferior da<br />
pilha torna-se violeta (rodeado de azul), e na parte superior,<br />
vermelho (rodeado de amarelo). Por quê?<br />
É a mesma mudança química que no Experimento 1.<br />
A corrente eléctrica que passa através da água de sal supôs uma<br />
mudança química no sal, e isto mudou a cor do papel. A cor<br />
violeta é básica, e indica negativo; o vermelho é ácido, e indica<br />
positivo. A corrente negativa que flui desde o lado negativo da<br />
pilha e a cor vermelha indicam o lado positivo da bateria. A<br />
direcção em que flui a corrente chama-se polaridade.<br />
Experimento 3. Transferência eléctrica<br />
Equipamento: Equipamento do experimento 1. Prego ou parafuso<br />
de ferro ou aço. Solução de cobre.<br />
Como preparar uma solução de cobre. Necessitas:<br />
- Consola de experimentos<br />
- Vinagre<br />
- Eléctrodos de cobre<br />
A consola tem vários compartimentos: 2 provetas longas, 1<br />
proveta curta e 1 compartimento rectangular. Já utilizámos as<br />
provetas longas e o compartimento rectangular. Agora usaremos<br />
a curta.<br />
Encher com vinagre a proveta curta e o contentor rectangular<br />
quase até à borda. Colocar na posição vertical um dos eléctrodos<br />
de cobre dentro da proveta curta, e apoiar o segundo eléctrodo<br />
de cobre dentro do compartimento rectangular como se indica no<br />
desenho.<br />
Eléctrodo de cobre<br />
Nota: Não é absolutamente necessário utilizar eléctrodos para<br />
este experimento. Uma moeda de cobre, cabos de cobre ou<br />
qualquer outro pequeno objecto de cobre funcionará, sempre que<br />
esteja feito de cobre e não de ferro tingido de cobre. Deixa esta<br />
mistura repousar durante uma noite ou mais, sem a mexer.<br />
Passadas 24 horas, verás que a mistura toma uma cor entre<br />
azulada e esverdeada.<br />
Atenção: este líquido é VENENOSO, não utilizar nada que possa<br />
entrar em contacto com comida.<br />
Para este experimento precisas de um prego de ferro ou, melhor<br />
ainda, um parafuso de ferro ou aço. Tanto o prego como o<br />
parafuso devem estar completamente limpos. Introduz o<br />
eléctrodo de cobre e o parafuso de ferro no CR com líquido<br />
azulado, como se indica no desenho. Espera meia hora, um dia,<br />
uma semana, cem anos ... O que acreditas que acontecerá? O<br />
que acontece na realidade?<br />
Eléctrodo de cobre<br />
Líquido azulado<br />
Vinagre<br />
Prego ou<br />
parafuso de ferro<br />
O parafuso de ferro e o eléctrodo de cobre formam um conjunto<br />
eléctrico. Produz-se electricidade. Na cabeça do parafuso de<br />
ferro forma-se uma "barba" castanha de pó de cobre (o que<br />
esperávamos). Cada vez forma-se mais pó.<br />
(De onde vem?)<br />
O líquido azul permanece azul. (Porquê?) Aí vai uma explicação<br />
simples:
O cobre sai da solução de cobre e fixa-se na cabeça do<br />
parafuso. Devido à electricidade produzida pelo conjunto do<br />
Cu/Fe. Isto acontece até que acabe o cobre, se seque a água ou<br />
a "barba" de cobre toque o eléctrodo de cobre.<br />
Experimento 4. O relógio digital eléctrico<br />
Equipamento: Consola de experimento. Módulo de relógio LC.<br />
Solução (água salgada, sumo de frutas ou verduras).<br />
Se retirares os cabos acidentalmente, o relógio<br />
desconectar-se-á. Coloca os cabos através da ranhura e fecha<br />
cuidadosamente a placa de Petri. É importante que permaneça<br />
fechada para que o relógio não se molhe.<br />
e.g.:<br />
Ranhura para os cabos<br />
ELECTRODOS MATERIAL SOLUCIÓN HORA DE INICIO FECHA<br />
HORA DE<br />
FINALIZACIÓN<br />
FECHA<br />
Cobre y zinc limón detergente 08:00 h jueves 12/1 11:46 h domingo<br />
15/1<br />
Prepara a "fonte de alimentação" com qualquer fonte de energia<br />
natural que desejes. Que combinações fazem com que o relógio<br />
funcione durante mais tempo? Anota as tuas conclusões na<br />
seguinte tabela (como no exemplo):<br />
Comprova se tens suficiente electricidade observando se o LED<br />
se acende. Recorda que o LED só funciona quando está<br />
conectado na direcção correcta. A mesma regra serve para o<br />
módulo de relógio.<br />
Quando consigas acender o relógio, abre a placa de Petri e verás<br />
duas pequenas placas de metal no dorso do módulo de relógio<br />
LCD. São para ajustar a hora como nos relógios LCD ou de<br />
pulseira.<br />
Olha o módulo LCD desde a parte de atrás. O contacto do lado<br />
direito é o contacto de modo. Prime-o e o modo aparecerá.<br />
Prime-o duas vezes e aparecerá o número 12: A. O contacto do<br />
lado esquerdo é para ajustar a hora, prime o contacto de modo e<br />
depois o contacto ajustado para fixar os minutos.<br />
Ao terminar, fecha cuidadosamente a tampa da placa de Petri.<br />
Vista posterior do modo digital<br />
18<br />
Usa um clipe ou<br />
uma caneta para<br />
ajustar a hora<br />
VISTA POSTERIOR DO MODO DIGITAL<br />
Usa um clipe ou<br />
uma caneta para<br />
mudar o modo<br />
Recorda: se o relógio parar, terás de ajustá-lo de novo.<br />
Experimento 5. A lâmpada ou o relógio de limão<br />
Equipamento: Eléctrodo de alumínio. Eléctrodo de latão.<br />
Eléctrodos de cobre. Eléctrodos de zinco. 3 - 4 limões.<br />
Continua a experimentar com vários tipos de "lâmpadas" e<br />
relógios. Poderias fabricar uma lâmpada de limão, como neste<br />
exemplo.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
O RELÓGIO DE LIMÃO<br />
Zn<br />
Cu<br />
Brass<br />
Este experimento, como quase todos, só funciona se os cabos<br />
fazem contacto PERFEITAMENTE com todos os eléctrodos. Se<br />
um deles não fizer contacto, o LED não se acenderá. Assegura-te<br />
de que os cabos e os eléctrodos estão perfeitamente limpos. Se<br />
for preciso, tenta-o acrescentando outro limão e outro par de<br />
cabos. Certifica-te de que os limões são suculentos. Se for<br />
necessário, acrescenta água.<br />
Al<br />
Al
(RO) Produ electricitate curată singur! Doar cu energia unei lămâi<br />
şi acest kit poţi face să funcţioneze un ceas. Trăieşte ştiinţa!<br />
N ELECTRICITY<br />
AVERTIZARE<br />
Anumite experimente necesită supravegherea unui adult.<br />
Fiţi atenţi când utilizaţi piese cu margini ascuţite.<br />
Banda de magneziu inclusă este extrem de inflamabilă. A se<br />
păstra departe de orice sursă de căldură. A nu se utiliza într-un<br />
mod diferit de cel indicat. În cazul în care arde, NU INHALAŢI<br />
FUMUL.<br />
COMPONENTE<br />
Consolă de experimente ● Electrozi- Bandă de magneziu ●<br />
Electrozi- Aluminiu ● Electrozi- Bronz ● Electrozi- Cupru ●<br />
Electrozi- Zinc ● Electrozi- Carbon ● Modul de ceas digital ● LED<br />
● Cabluri ● Tub din cauciuc (latex) ● Tub din plastic ● Fibră de<br />
oţel ● Hârtie pH (hârtie indicatoare) ● Pâlnie ● <strong>Manual</strong> cu<br />
instrucţiuni ● Lingură de măsurat ● Agrafă ● Pătrat din polistiren<br />
● Necesită baterii de 1,5 AA V (nu sunt incluse) ● Sunt necesare<br />
anumite produse casnice<br />
INTRODUCERE<br />
Această trusă arată cum se poate produce electricitate cu<br />
materiale naturale prin reacţii chimice simple cu anumite metale.<br />
Cum sunt o baterie de zinc şi o tijă de carbon care se vor aşeza<br />
între o pastă chimică.<br />
Fabricându-ţi propria baterie, urmezi acelaşi proces ca în cazul<br />
bateriilor normale. Curentul electric se produce deoarece are loc<br />
o reacţie chimică între metalele şi acizii verdeţurilor, fructelor, etc.<br />
La anumite experimente o bucată de fruct, cum este lămâia,<br />
poate produce multă electricitate, suficientă pentru a aprinde un<br />
LED sau pentru a pune în funcţiune ceasul. În alte cazuri, trebuie<br />
să utilizeze 3, 4 sau mai multe bucăţi de fructe.<br />
CONSOLĂ DE EXPERIMENTE<br />
1. Cabluri de ceas<br />
2. Eprubete<br />
3. Capacul plăcii Petri cu modul de ceas LCD deja montat<br />
4. Eprubetă mică<br />
5. Recipient dreptunghiular<br />
6. Cabluri de ceas<br />
7. Recipient dreptunghiular<br />
8. Eprubete<br />
9. Picioare pentru ridicarea consolei (revin la locul lor)<br />
10. Capacul plăcii Petri cu modul de ceas LCD deja montat<br />
11. Eprubetă mică<br />
12. Capacul superior al consolei<br />
Atenţie la manevrarea ceasului, evitaţi umezirea plăcii.<br />
Pregătirea electrozilor.<br />
Utilizezi diferiţi electrozi:<br />
Aluminiu: Al Magneziu: Mg<br />
Fier: Fe Zinc: Zn<br />
Carbon: C Cupru: Cu<br />
Eprubetă: P.<br />
OBSERVAŢIE:electrodul de carbon este negru, cel de aluminiu<br />
este argintiu strălucitor şi cel de zinc, gri argintiu mat. Banda de<br />
magneziu are o culoare asemănătoare celei a electrodului de<br />
zinc, dar este mai fină şi nu are orificii.<br />
Avertizare: Această activitate necesită supravegherea unui adult.<br />
Atenţie la tăierea tuburilor de cauciuc şi plastic.<br />
Tăiaţi piesele în bucăţi de 6-7mm cu o foarfecă bună. Aceste<br />
bucăţi sunt necesare pentru a uni cablurile de electrozi. Exemplu<br />
Pregătirea electrozilor de carbon<br />
Pasul 1: Aşază o bucată de tub de cauciuc în electrodul de<br />
carbon.<br />
Pasul 1. Electrod de carbon cu bucată de cauciuc.<br />
Pasul 2: Introdu extremitatea expusă a cablului în inserţia de<br />
cauciuc pentru a atinge carbonul.<br />
Pasul 2 . Introdu extremitatea expusă a<br />
cablului în bucata de cauciuc.<br />
19<br />
Pasul 3: Îndoaie extremitatea cablului în sus pentru a evita<br />
ieşirea acestuia.<br />
Pasul 3 . Extremitatea cablului expus<br />
îndoit în bucata de cauciuc.<br />
Pregătirea electrozilor de magneziu<br />
AVERTIZARE: Banda de magneziu inclusă este<br />
extrem de inflamabilă. A se păstra departe de orice<br />
sursă de căldură. A nu se utiliza într-un mod diferit de<br />
cel indicat. În cazul în care arde, NU INHALAŢI<br />
FUMUL.<br />
Pasul 1: Împarte<br />
banda de magneziu în<br />
Piuneză<br />
trei părţi şi taie-o cu<br />
atenţie cu o foarfecă în<br />
bucăţi de 33 mm.<br />
Pasul 2: Cu o piuneză<br />
fă două orificii într-o<br />
extremitate a fiecărui<br />
electrod de magneziu<br />
ca acestea.<br />
Pasul 3: Trece<br />
extremitatea unui<br />
cablu prin ambele<br />
orificii, acoperă-l<br />
împreună cu benzile<br />
de magneziu cu tubul<br />
de cauciuc. Electrodul<br />
de magneziu este<br />
acum gata.<br />
Bandă de Mg<br />
FLAMMABLE<br />
Extremitatea expusă a<br />
cablului trecut prin bucata de<br />
magneziu.<br />
Cablu şi magneziu acoperite<br />
cu tubul de cauciuc.<br />
Pregătirea celorlalţi electrozi<br />
Pentru electrozii de zinc şi ceilalţi electrozi utilizează tubul de<br />
plastic conform ilustraţiilor de mai sus.<br />
OBSERVAŢIE: cele două tipuri de tub au trei funcţii importante:<br />
a) Susţin cablul de electrod garantând un contact electric bun.<br />
b) Protejează acest contact de poluări inutile.<br />
c) Previn atingerea celor doi electrozi atunci când sunt introduşi<br />
unul deasupra celuilalt în aceeaşi eprubetă.<br />
Desenul arată modul<br />
LED<br />
de utilizare<br />
a LED-ului unit de<br />
electrozi.<br />
Experimentul 1. Soluţia cu indicatorul colorat<br />
Echipament:Pahar.Sare. Electrod de Zinc. Electrod de<br />
carbon. Bandă de magneziu. Hârtie pH. Lingură de<br />
măsură. Consolă de experimente.<br />
Umple una dintre eprubetele<br />
lungi ale consolei de<br />
experimente cu apă sărată şi<br />
introdu 3 benzi de hârtie pH.<br />
Este hârtia portocalie:<br />
Atunci când apa sărată se<br />
colorează cu cele trei benzi,<br />
Electrodul de carbon<br />
FLAMMABLE<br />
Hârtie pH
scoate-le şi repetă experimentul nr. 1 în acest lichid colorat.<br />
Introdu electrozii de magneziu şi carbon în eprubeta lungă cu<br />
lichidul galben şi conectează cablurile la electrozi.<br />
Mg<br />
CONSOLA VĂZUTĂ DE SUS<br />
Baterie AA Hârtii pH una deasupra celeilalte<br />
2 benzi de hârtie pH (umezite) peste baterie<br />
C<br />
Eprubetă lungă<br />
plină de apă<br />
sărată<br />
Hârtie pH<br />
După câteva minute, soluţia devine violet în jurul electrodului de<br />
magneziu.<br />
Soluţia de sub carbon îşi schimbă culoarea de asemenea, dar<br />
mult mai lent.<br />
Ce se întâmplă?De ce? Ce s-ar întâmpla dacă nu conectezi<br />
cablurile la electrozi? Şi<br />
dacă în loc de magneziu<br />
ai utiliza zinc sau<br />
electrozi? Ce legătură<br />
are acest lucru cu<br />
electricitatea?<br />
Culoarea hârtiei pH<br />
indică prezenţa unui<br />
acid sau a unei baze<br />
atunci când îşi schimbă<br />
culoarea. Acidul este o<br />
substanţă amară. Multe<br />
fructe conţin acizi, cum<br />
sunt lămâia sau<br />
portocala. Un acid<br />
puternic corodează în<br />
mod normal metalele.<br />
Baza se opune acidului.<br />
Substanţele care sunt<br />
baze se mai numesc şi<br />
alcaline. Baza<br />
neutralizează acidul şi<br />
formează o sare.<br />
Soluţia<br />
galbenă<br />
devine violet<br />
S-a produs vreo<br />
schimbare?<br />
Culoarea violet din jurul electrodului de magneziu indică faptul că<br />
s-a produs o bază lângă un electrod. În final se obţine o culoare<br />
roşiatică în jurul electrodului de carbon. Lichidul de acolo devine<br />
acid.<br />
Dacă nu se conectează cablurile electrodului pare că nu se<br />
întâmplă nimic. Vei provoca reacţii similare cu alţi electrozi, dar<br />
vei obţine probabil o soluţie mai puţin bazică şi culoarea din jurul<br />
zincului sau a electrodului de aluminiu va deveni albastră mai<br />
degrabă decât violet.<br />
Experimentul 2. Hârtia indicatoare<br />
Echipament:2 bucăţi de hârtie pH. Baterie de 1,5 AA V. Bucată<br />
mică de poliester. Consolă de experiment<br />
Pune benzile de hârtie pH în soluţia de apă sărată doar cât să se<br />
umezească.<br />
Observă culoarea hârtiei pH umezite.<br />
Uneşte cele două benzi de hârtie pH la un capăt. Pune benzile pe<br />
partea laterală a bateriei AA şi îndoaie cele două extremităţi<br />
acoperind partea superioară şi inferioară a bateriei.<br />
Aşază bateria cu hârtiile pH în compartimentul dreptunghiular<br />
(CR), orificiul cel mai puţin adânc din partea superioară a consolei<br />
de experiment. Menţine acest "sistem" pe poziţie prin bucata mică<br />
de poliester, conform imaginilor.<br />
Bucată de poliester pentru<br />
a menţine bateria şi hârtia pH pe poziţie<br />
20<br />
Aşteaptă două sau trei ore menţinând hârtia umedă (mai pune<br />
nişte picături de apă sărată pe hârtie dacă este necesar).<br />
La sfârşitul experimentului vei vedea că hârtia din partea<br />
inferioară a bateriei devine violet (înconjurată de albastru) şi<br />
partea superioară, roşie (înconjurată de galben). De ce?<br />
Este aceeaşi transformare chimică de la Experimentul 1.<br />
Curentul electric ce trece prin apa cu sare a presupus o<br />
modificare chimică a sării şi acest lucru a modificat culoarea<br />
hârtiei. Culoarea violet este bazică şi indică negativ; roşul este<br />
acid şi indică pozitiv. Curentul negativ care curge dinspre partea<br />
negativă a bateriei şi culoarea roşie indică partea pozitivă a<br />
bateriei. Direcţia în care curge curentul se numeşte polaritate.<br />
Experimentul 3. Transfer electric<br />
Echipament:Echipamentul pentru experimentul 1. Cui sau şurub<br />
de fier sau oţel. Soluţie de cupru.<br />
Cum se prepară o soluţie de cupru. Sunt necesare:<br />
- Consolă de experimente<br />
- Oţet<br />
- Electrozi de cupru<br />
Consola are mai multe compartimente: 2 eprubete lungi, 1<br />
eprubetă scurtă şi 1 compartiment dreptunghiular. Am utilizat deja<br />
eprubetele lungi şi compartimentul dreptunghiular. Acum o vom<br />
utiliza pe cea scurtă.<br />
Umpleţi cu oţet eprubeta scurtă şi recipientul dreptunghiular până<br />
la margine. Aşezaţi în poziţie verticală unul dintre electrozii de<br />
cupru în eprubeta scurtă şi sprijiniţi al doilea electrod de cupru în<br />
interiorul compartimentului dreptunghiular după cum indică<br />
desenul.<br />
Electrod de cupru<br />
Lichid albăstrui<br />
Electrod de cupru<br />
Oţet<br />
Observaţie: Nu este neapărat necesar să utilizaţi electrozi pentru<br />
acest experiment. O monedă de cupru, cabluri de cupru sau orice<br />
alt obiect mic de cupru va funcţiona, cu condiţia să fie realizat din<br />
cupru, nu din fier vopsit cu cupru. Lasă acest amestec timp de o<br />
noapte sau mai multe, fără a-l mişca. După 24 ore, vei observa că<br />
amestecul capătă o culoare verde-albăstruie.<br />
Atenţie: acest lichid este OTRĂVITOR, nu utilizaţi nimic ce ar<br />
putea intra în contact cu mâncarea.<br />
Pentru acest experiment ai nevoie de un cui de fier sau, şi mai<br />
bine, de un şurub de fier sau oţel. Atât cuiul, cât şi şurubul trebuie<br />
să fie perfect curate. Introdu electrodul de cupru şi şurubul de fier<br />
în CR cu lichid albăstrui după cum indică desenul. Aşteaptă o<br />
jumătate de oră, o zi, o săptămână, o sută de ani...Ce crezi că se<br />
va întâmpla? Ce se întâmplă în realitate?<br />
Cui sau şurub de fier<br />
Şurubul de fier sau electrodul de cupru formează un ansamblu<br />
electric. Se produce electricitate. Pe capul şurubului de fier se<br />
formează o "barbă" maro de praf de cupru (ceea ce era de<br />
aşteptat). Pe măsură ce trece timpul, se formează tot mai mult<br />
praf.<br />
(De unde vine?)<br />
Lichidul albastru rămâne albastru. (De ce?) Iată o explicaţie<br />
simplă:<br />
Cuprul iese din soluţia de cupru şi se fixează pe capul şurubului.
Din cauza electricităţii produse de ansamblul Cu/Fe. Acest lucru<br />
se întâmplă până când se termină cuprul, se usucă apa sau<br />
"barba" de cupru atinge electrodul de cupru.<br />
Experimentul 4. Ceasul digital electric<br />
Echipament:Consolă de experiment. Modul de ceas LC. Soluţie<br />
(apă sărată, suc de fructe sau verdeţuri).<br />
Dacă scoţi din greşeală cablurile, ceasul se va deconecta. Aşază<br />
cablurile prin fantă şi închide cu grijă placa Petri. Este important<br />
să rămână închisă pentru ca ceasul să nu se ude.<br />
e.g.:<br />
Fantă pentru cabluri<br />
ELECTROZI MATERIALE SOLUŢIE ORA ÎNCEPERII DATA ORA FINALIZĂRII DATA<br />
Cupru şi zinc lămâie detergent ora 08:00 joi 12/1 ora 11:46 duminică<br />
15/1<br />
Pregăteşte "sursa de alimentare" cu orice sursă de energie<br />
naturală dorită. Ce combinaţii fac ca ceasul să funcţioneze cât<br />
mai mult timp? Notează-ţi concluziile în următorul tabel (ca în<br />
exemplu):<br />
Verifică dacă ai suficientă electricitate observând dacă se aprinde<br />
LED-ul. Nu uita că LED-ul funcţionează doar atunci când este<br />
conectat în direcţia corectă. Aceeaşi regulă se aplică pentru<br />
modulul de ceas.<br />
Atunci când reuşeşti să porneşti ceasul, deschide placa Petri şi<br />
vei observa două mici plăci de metal pe partea din spate a<br />
modulului ceasului LCD. Sunt pentru ajustarea orei ca la<br />
ceasurile LCD sau de mână.<br />
Observă modulul LCD din partea din spate. Contactul din partea<br />
dreaptă este contactul de mod. Apasă-l şi va apărea modul.<br />
Apasă-l de două ori şi va apărea numărul 12: A. Contactul din<br />
partea stângă este pentru ajustarea orei, apasă contactul de mod<br />
şi apoi contactul reglaj pentru a fixa minutele.<br />
La sfârşit, închideţi cu grijă capacul plăcii Petri.<br />
Vedere din spate a modului digital<br />
21<br />
Zn<br />
Zn<br />
VISTA POSTERIORE DELLA MODALITÀ DIGITALE<br />
Utilizează o<br />
agrafă sau un<br />
pix pentru a<br />
regla ora<br />
Cu<br />
Zn<br />
CEASUL DIN LĂMÂIE<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
Cu<br />
Brass<br />
Utilizează o<br />
agrafă sau un pix<br />
pentru a schimba<br />
modul<br />
Nu uita: dacă ceasul se opreşte, va trebui să-l reglezi din nou.<br />
Experimentul 5. Lampa sau ceasul din lămâie<br />
Echipament:Electrod de aluminiu Electrod de bronz. Electrozi de<br />
cupru. Electrozi de zinc. 3 – 4 lămâi.<br />
Continuă să experimentezi cu diferite tipuri de "lămpi " şi ceasuri.<br />
Ai putea fabrica o lampă din lămâie, ca în acest exemplu.<br />
Acest experiment, ca aproape toate, funcţionează doar dacă<br />
există contact PERFECT între cabluri şi toţi electrozii. Dacă unul<br />
nu face contact, LED-ul nu se aprinde. Asigură-te că electrozii şi<br />
cablurile sunt perfect curate. Dacă este nevoie, încearcă<br />
adăugând o altă lămâie şi o altă pereche de cabluri. Asigură-te că<br />
lămâile sunt zemoase. Dacă este necesar, adaugă apă.<br />
Al<br />
Al
(TR) Temiz enerjinizi kendiniz üretin! Sadece bu set ve bir<br />
limonun enerjisiyle saatinizi çalıştırabilirsiniz. Yaşasın bilim!<br />
N ELECTRICITY<br />
UYARI:<br />
Bazı deneyler bir yetişkinin gözetimini gerektirmektedir.<br />
Keskin kenarlı parçaları kullanırken dikkatli olun.<br />
Ürün dahilindeki magnezyum şeridi son derece yanıcıdır. Onu<br />
sıcaktan uzak tutun. Onu belirtilenden daha farklı bir şekilde<br />
kullanmayın. Tutuşması durumunda, DUMANINI SOLUMAYIN.<br />
PARÇALAR<br />
Deney masası ● Elektrotlar- Magnezyum şeridi ● Elektrotlar-<br />
Alüminyum ● Elektrotlar- Pirinç ● Elektrotlar- Bakır ● Elektrotlar-<br />
Çinko ● Elektrotlar - Karbon ● Dijital saat modülü ● LED ●<br />
Kablolar ● Lastik (lateks) boru ● Plastik boru ● Çelik yünü ● pH<br />
kâğıdı (gösterge kâğıt) ● Huni ● Kullanım kılavuzu ● Ölçek ● Ataş<br />
● Polistiren levha ● 1,5 V AA pille çalışır (dahil değildir) ● Bazı ev<br />
gereçlerine ihtiyaç vardır<br />
GİRİŞ<br />
Bu kit bazı metallerle basit kimyasal reaksiyonlar yaratarak doğal<br />
malzemelerle nasıl elektrik üretileceğini gösteriyor. Kimyasal bir<br />
hamurun arasına yerleştirilen bir çinko ve bir karbon çubuktan<br />
meydana gelen bir pil gibi.<br />
Kendi ürettiğiniz piller de, normal pillerdekine benzer bir işlemden<br />
geçecektir. Metaller ile sebze, meyve vs. asitleri arasında<br />
kimyasal bir reaksiyon gerçekleştiğinden elektrik akımı<br />
sağlanmaktadır.<br />
Bazı deneylerde limon gibi bir meyve parçası, bir LED ışığını<br />
yakacak ya da bir saati çalıştırmaya yetecek kadar elektrik<br />
üretebilmektedir. Diğer durumlarda ise, 3, 4 ya da daha fazla<br />
meyve parçası kullanmanız gerekecektir.<br />
DENEY MASASI<br />
1. Saat kabloları<br />
2. Test tüpleri<br />
3. Yerleşik LCD saat modüllü Petri levhasının kapağı<br />
4. Küçük test tüpü<br />
5. Dikdörtgen kap<br />
6. Saat kabloları<br />
7. Dikdörtgen kap<br />
8. Test tüpleri<br />
9. Deney masasını kaldırmak için ayaklar (yerlerine geri<br />
dönüyorlar)<br />
10. Yerleşik LCD saat modüllü Petri levhasının kapağı<br />
11. Küçük test tüpü<br />
12. Üst konsol kapağı<br />
Saati ellerken dikkatli olun, levhanın ıslanmamasına özen<br />
gösterin.<br />
Elektrotların hazırlanması. Çeşitli malzemelerden üretilmiş farklı<br />
elektrotlar kullanacaksınız:<br />
Alüminyum: Al Magnezyum: Mg<br />
Demir: Fe Çinko: Zn<br />
Karbon: C Bakır: Cu<br />
Test tüpü: T.T..<br />
NOT: Karbon elektrodu siyah, alüminyum elektrodu parlak gümüş,<br />
çinko elektrodu ise grimsi mat gümüş rengidir.Magnezyum<br />
şeridinin rengi çinko elektrodununkine benzese de, magnezyum<br />
şeridi daha ince ve deliksizdir.<br />
Uyarı:Bu aktivite bir yetişkinin gözetimi altında<br />
gerçekleştirilmelidir. Lastik ve plastik boruları keserken çok<br />
dikkatli olun.<br />
İyi bir makasla yaklaşık 6-7 mm'lik parçalar halinde kesin. Bu<br />
parçalar, kabloların elektrotlarla birleştirilmesi için<br />
gereklidir.Örnek:<br />
Karbon elektrotlarının hazırlanması<br />
1. Adım: Lastik borunun bir parçasını karbon elektroduna<br />
yerleştirin.<br />
1. Adım. Lastik parçalı karbon elektrodu.<br />
2. Adım: Kablonun açık ucunu karbona değecek şekilde lastik<br />
parçanın içine sokun.<br />
2. Adım: Kablonun açık ucunu lastik parçanın<br />
içine sokun.<br />
22<br />
3. Adım: Kablonun ucunu, çıkmaması için yukarıya doğru<br />
katlayın.<br />
3. Adım. Kablonun açık ucu katlanmış<br />
vaziyette lastik parçanın içinde.<br />
Magnezyum elektrotlarının hazırlanması<br />
UYARI: Ürün dahilindeki magnezyum şeridi son<br />
derece yanıcıdır. Onu sıcaktan uzak tutun. Onu<br />
belirtilenden daha farklı bir şekilde kullanmayın.<br />
Tutuşması durumunda, DUMANINI SOLUMAYIN.<br />
1. Adım: Magnezyum<br />
şeridini üç parçaya<br />
Raptiye<br />
ayırın ve bir makas<br />
yardımıyla 33 mm'lik<br />
parçalar halinde<br />
dikkatlice kesin.<br />
2. Adım: Bir raptiye<br />
yardımıyla, her<br />
magnezyum<br />
elektrodunun bir ucuna<br />
şunlara benzeyen iki<br />
delik açın.<br />
3. Adım: Bir kablonun<br />
ucunu her iki delikten<br />
de geçirin. Lastik<br />
boruyu kullanarak<br />
kabloyu magnezyum<br />
şeritleriyle birlikte<br />
örtün.Magnezyum<br />
elektrodu artık hazır.<br />
Diğer elektrotların hazırlanması<br />
Çinko elektrotları ve diğer elektrotlar için, yukarıdaki resimde<br />
gösterildiği gibi plastik boru kullanın.<br />
NOT:İki boru tipinin de üç önemli işlevi bulunmaktadır:<br />
a) Kabloyu elektroda bağlayarak iyi bir elektrik kontağını garanti<br />
eder.<br />
b) Bu kontağı gereksiz kirlenmeden korur.<br />
c) Elektrotları biri diğerinin üzerinde olacak şekilde aynı test<br />
tüpünün içine sokarken, bunların birbirlerine değmesine engel<br />
olur.<br />
Resimde, elektrotlara<br />
bitişik olan LED'in<br />
nasıl kullanılması<br />
gerektiği<br />
gösterilmektedir.<br />
Mg şeridi<br />
Deney 1. Boyalı gösterge solüsyonu<br />
Kablonun açık ucu<br />
magnezyum parçasının<br />
içinden geçirilmiş.<br />
Kablo ve magnezyum lastik<br />
boru ile örtülmüş.<br />
LED<br />
FLAMMABLE<br />
Karbon elektrodu<br />
Malzemeler: Bardak. Tuz. Çinko elektrodu. Karbon<br />
elektroduMagnezyum şeridi. pH kâğıdı. Ölçek. Deney<br />
masası.<br />
FLAMMABLE<br />
Deney masasının uzun<br />
test tüplerinden bir<br />
tanesini tuzlu su ile<br />
doldurun ve içine 3 şerit<br />
pH kâğıdı koyun.<br />
Turuncu kâğıt:<br />
pH kâğıdı.<br />
Üç şerit, tuzlu suya renk verdiğinde bunları suyun içinden çıkarın<br />
ve deney 1'i bu renkli sıvının içinde tekrarlayın.<br />
Magnezyum ve karbon elektrotlarını sarı sıvıyla beraber uzun test<br />
tüpünün içine koyun ve elektrotların her iki kablosunu birbirine<br />
değdirin.
DENEY MASASININ YUKARIDAN GÖRÜNÜŞÜ<br />
AA pil Üst üste koyulmuş pH kâğıtlar<br />
Pili ve pH kâğıdını yerinde<br />
tutmak için polistiren parçası<br />
Mg<br />
C<br />
Tuzlu suyla<br />
doldurulmuş<br />
uzun test tüpü<br />
pH kâğıdı<br />
Birkaç dakikanın sonunda, solüsyon magnezyum elektrodunun<br />
çevresinde mora dönüşecektir.<br />
Aşağıdaki karbon solüsyonu da renk değiştirir, ancak bu çok daha<br />
yavaş gerçekleşir.<br />
Ne oldu? Neden?<br />
Kabloları elektrotlara<br />
bağlamasaydınız ne<br />
olacaktı? Peki ya<br />
magnezyum yerine<br />
çinkoyu ya da diğer<br />
elektrotları<br />
kullansaydınız? Bunun<br />
elektrikle nasıl bir ilgisi<br />
var?<br />
pH kâğıdının renk<br />
değiştirmesi, bir asidin<br />
ya da bazın varlığına<br />
işaret eder. Asit acı bir<br />
maddedir. Limon ya da<br />
portakal gibi çoğu<br />
meyve asit içerir. Güçlü<br />
bir asit normalde<br />
metalleri aşındırır. Baz<br />
ise asidin tersidir. Baz<br />
olan maddelere alkali<br />
Pilin üzerindeki 2 şerit<br />
pH kâğıdı (ıslatılmış)<br />
Sarı solüsyon<br />
mora dönüşür<br />
Herhangi bir<br />
değişiklik oldu<br />
mu?<br />
de denir. Baz, asidi etkisiz kılar ve tuz oluşturur. Magnezyum<br />
elektrodunun etrafındaki mor renk, bir elektrodun yakınında baz<br />
ürettiğinize işaret eder. Sonuçta karbon elektrodunun yakınında<br />
kırmızımsı bir renk elde edilir. Sıvı burada aside dönüşür.<br />
Elektrot kabloları birbirine bağlanmazsa, hiçbir etkileşim olmaz.<br />
Diğer elektrotlarla da benzer tepkimelere yol açacaksınız. Ancak<br />
baz oranı olasılıkla daha düşük bir solüsyon elde edebilirsiniz ve<br />
çinko ya da alüminyum elektrodunun etrafındaki renk, mordan<br />
önce maviye dönüşebilir.<br />
Deney 2. Gösterge kâğıt<br />
Malzemeler: 2 parça pH kâğıdı. 1,5 V AA pil. Küçük bir parça<br />
polistiren. Deney masası<br />
pH kâğıdı şeritlerini, sadece ıslanmaları için tuzlu su<br />
solüsyonunun içine koyun.<br />
Islanmış pH kâğıdının rengine dikkat edin.<br />
İki pH kâğıdı şeridini tek uçtan birleştirin. Şeritleri AA pilin yan<br />
kısmına koyun ve uçlarını pilin alt ve üst kısmını kapatacak<br />
şekilde katlayın.<br />
Pili pH kâğıtlarıyla birlikte deney masasının üst kısmında bulunan<br />
ve çok derin olmayan bir oyuntudan ibaret dikdörtgen bölmeye<br />
(DDB) yerleştirin. Bu "sistemi" küçük polistiren parça aracılığıyla,<br />
gösterilen şekilde yerinde tutun.<br />
Kâğıdı nemli tutarak iki ya da üç saat bekleyin (gerektiğinde<br />
kâğıdın üzerine birkaç damla tuzlu su serpin).<br />
Deneyin sonunda pilin alt kısmındaki kâğıdın mora (çevresi<br />
mavi), üsttekinin ise kırmızıya (çevresi sarı) dönüştüğünü<br />
23<br />
göreceksiniz. Neden?<br />
Bu, Deney 1'deki kimyasal değişimin aynısıdır.<br />
Tuzlu su aracılığıyla geçen elektrik akımı tuzda kimyasal bir<br />
değişime yol açtı ve bu da kâğıdın renginin değişmesine neden<br />
oldu. Mor renk baziktir ve negatif değeri gösterir; kırmızı asidiktir<br />
ve pozitif değeri gösterir. Pilin negatif ucundan akan negatif akım<br />
ve kırmızı renk, bataryanın pozitif ucunu gösterir. Akımın aktığı<br />
yöne kutup denir.<br />
Deney 3. Elektrik aktarımı<br />
Malzemeler: Deney 1'de kullanılan malzemeler. Demir ya da çelik<br />
vida veya çivi. Bakır solüsyonu.<br />
Bakır solüsyonu nasıl hazırlanır. Gerekli malzemeler:<br />
- Deney masası.<br />
- Sirke<br />
- Bakır elektrotları<br />
Deney masasının çeşitli bölmeleri bulunmaktadır: 2 uzun test<br />
tüpü, 1 kısa test tüpü ve 1 dikdörtgen bölme. Uzun test tüplerini<br />
ve dikdörtgen bölmeyi daha önce kullanmıştık. Şimdi diğerini<br />
kullanacağız.<br />
Kısa test tüpünü ve dikdörtgen kabı hemen hemen ağzına kadar<br />
sirke ile doldurun. Bakır elektrotlarından birini kısa test tüpünün<br />
içine dikey şekilde yerleştirin, diğer bakır elektrodunu ise resimde<br />
gösterildiği şekilde dikdörtgen bölmenin içine dayayın.<br />
Bakır elektrodu<br />
Sirke<br />
Not: Bu deney için elektrotların kullanılması şart değildir. Bakır<br />
para, bakır kablolar ya da bakırdan yapılmış herhangi küçük bir<br />
obje işinizi görecektir. Önemli olan, bakırla kaplanmış demirden<br />
değil, saf bakırdan yapılmış olmasıdır. Bu karışımı hareket<br />
ettirmeksizin bir gece ya da daha uzun süre dinlenmeye bırakın.<br />
24 saatin sonunda karışımın mavi ile yeşil arası bir renk aldığını<br />
göreceksiniz.<br />
Dikkat: Bu sıvı ZEHİRLİDİR. Gıda maddeleriyle temas edebilecek<br />
hiçbir şey kullanmayın.<br />
Bu deney için demirden bir çiviye ya da daha da iyisi demirden ya<br />
da çelikten bir vidaya ihtiyacınız olacak. Çivi de vida da tertemiz<br />
olmalıdır. Bakır elektrodunu ve demir vidayı, resimde gösterildiği<br />
şekilde, içinde mavi sıvı olan dikdörtgen bölmeye koyun. Yarım<br />
saat, bir gün, bir hafta, yüz yıl bekleyin... Ne olacağını<br />
düşünüyorsunuz? Gerçekte ne olur?<br />
Mavileşmiş sıvı<br />
Bakır elektrodu<br />
Demir çivi ya da vida<br />
Demir vida ve bakır elektrodu bir elektrik bileşimi oluşturur.<br />
Elektrik üretilir. Demir vidanın başında bakır tozundan kahverengi<br />
bir "sakal" oluşur (beklediğimiz sonuç). Her seferinde daha fazla<br />
toz oluşur.<br />
(Bu toz nereden geliyor?)<br />
Mavi sıvı rengini korur. (Neden?) İşte size basit bir açıklama:<br />
Bakır, bakır solüsyonundan ayrılır ve vidanın başına toplanır.<br />
Cu/Fe bileşiminin ürettiği elektrikten dolayı. Bu, bakır bitene, su<br />
kuruyana ya da bakır "sakal" bakır elektroduna değene kadar<br />
devam eder.<br />
Deney 4. Elektrikli dijital saat<br />
Malzemeler: Deney masası. LC saat modülü. Solüsyon (tuzlu su,<br />
meyve ya da sebze suyu).
Kabloları kazayla çıkaracak olursanız, saat devre dışı kalacaktır.<br />
Kabloları yuvaya yerleşin ve Petri levhasını dikkatlice kapatın.<br />
Saatin ıslanmaması için kapalı kalması son derece önemlidir.<br />
e.g.:<br />
Kablo yuvası<br />
ELEKTROTLAR MATERYAL SOLÜSYON BAŞLANGIÇ SAATİ TARİH BİTİŞ SAATİ TARİH<br />
Bakır ve çinko limon deterjan 08:00 12/01<br />
11:46<br />
Perşembe<br />
Saati ayarlamak<br />
için ataş ya da<br />
tükenmez kalem<br />
kullanın.<br />
15/01 Pazar<br />
Dilediğiniz herhangi bir doğal enerji kaynağından "güç kaynağını"<br />
hazırlayabilirsiniz. Hangi kombinasyonlar saatin daha uzun süre<br />
çalışmasını sağlıyor? Aşağıdaki tabloya kendi çıkarımlarınızı not<br />
edin (örnekte olduğu gibi):<br />
LED ışığının yanışını gözlemleyerek, yeterli elektriğinizin olup<br />
olmadığını kontrol edin. LED ışığının sadece doğru yöne<br />
bağlıyken çalıştığını hatırlayın. Saat modülü için de aynı kural<br />
geçerlidir.<br />
Saati çalıştırmayı başardığınızda Petri levhasını açın; LCD saat<br />
modülünün arka yüzünde iki küçük metal levha göreceksiniz.<br />
Bunlar LCD saatlerde ya da bilekliklerde olduğu gibi, saati<br />
ayarlamak içindir.<br />
LCD modülünün arka kısmına bakın. Sağ taraftaki bağlantı, mod<br />
bağlantısıdır. Buna bastığınızda mod belirecektir. Buna iki kere<br />
bastığınızda 12 sayısı belirecektir: A. Sol taraftaki bağlantı, saati<br />
ayarlamak içindir. Saat ayarı için mod bağlantısına ve ardından<br />
dakikayı belirlemek için ayarlanmış bağlantıya basın.<br />
İşlem bittiğinde Petri levhasının kapağını dikkatlice kapatın.<br />
Dijital modun arkadan görünüşü<br />
Modu değiştirmek<br />
için ataş ya da bir<br />
tükenmez kalem<br />
kullanın.<br />
Hatırlatma: Saat durursa onu yeniden ayarlamanız gerekecektir.<br />
24<br />
Deney 5. Limon saati ya da lambası<br />
Malzemeler: Alüminyum elektrodu. Pirinç elektrodu. Bakır<br />
elektrotlarıÇinko elektrotları. 3 – 4 limon.<br />
Çeşitli tipte "lambalar" ve saatlerle deney yapmaya devam edin.<br />
Bu örnektekine benzer şekilde bir limon lambası da üretebilirsiniz.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Zn<br />
LİMON SAATİ<br />
Cu<br />
Brass<br />
Cu<br />
Brass<br />
Bu deney, diğer deneylerin hemen hepsinde olduğu gibi, sadece<br />
kablolar tüm elektrotlarla KUSURSUZ bir şekilde temas ediyorsa<br />
çalışır. Bir tanesi temas etmediğinde LED yanmaz. Kabloların ve<br />
elektrotların tertemiz olduğundan emin olun. Gerekirse bir limon<br />
ve bir çift kablo daha ekleyerek tekrar deneyin. Limonların sulu<br />
olduğundan emin olun. Gerekirse su ekleyin.<br />
Al<br />
Al
(EL) Μπορείτε να παράγετε από μόνοι σας καθαρό ηλεκτρισμό! Μ<br />
όνο με την ενέργεια ενός λεμονιού κι αυτό το κιτ μπορεί να κάνει ν<br />
α λειτουργήσει ένα ρολόι. Ζήτω η επιστήμη!<br />
N ELECTRICITY<br />
ΠΡΟΕΙΔΟΠΟΙΗΣΗ:<br />
Κάποια πειράματα πρέπει να πραγματοποιούνται υπό την επίβλε<br />
ψη ενός ενήλικα.<br />
Προσέχετε όταν χρησιμοποιείτε τα εξαρτήματα συναρμολόγησης μ<br />
ε κοφτερές άκρες.<br />
Η ταινία μαγνησίου που συμπεριλαμβάνεται είναι λίαν εύφλεκτη. Κ<br />
ρατήστε την μακριά από πηγές θερμότητας, Χρησιμοποιείτε μόνο<br />
για το σκοπό που προορίζεται. Αν πάρει φωτιά, ΜΗΝ ΕΙΣΠΝΕΕΤ<br />
Ε ΤΟΝ ΚΑΠΝΟ.<br />
ΕΞΑΡΤΗΜΑΤΑ<br />
Κονσόλα για πείραμα ● Ηλεκτρόδια- Ταινία μαγνησίου ● Ηλεκτρ<br />
όδια- Αργίλιο ● Ηλεκτρόδια- Ορείχαλκος ● Ηλεκτρόδια- Χαλκός ●<br />
Ηλεκτρόδια- Ψευδάργυρος ● Ηλεκτρόδια- Άνθρακας ● Σύστημα με<br />
ψηφιακό ρολόι ● LED ● Καλώδια ● Σωλήνας από λάτεξ ● Πλαστικ<br />
ός σωλήνας ● Μαλλί χάλυβα ● Χαρτί pH (χαρτί ένδειξης) ● Χωνί<br />
Εγχειρίδιο οδηγιών ● Κουτάλι μεζούρα ● Κλιπ ● Τετράγωνο από<br />
πολυστυρένιο ● Χρειάζεται μπαταρίες 1,5 AA V (δεν περιλαμβάνο<br />
νται) ● Χρειάζονται κάποια αντικείμενα από το σπίτι.<br />
ΕΙΣΑΓΩΓΗ<br />
Αυτό το κιτ δείχνει πως παράγεται ηλεκτρισμός με φυσικά υλικά μέ<br />
σω απλών χημικών αντιδράσεων σε κάποια μέταλλα. Όπως μια μ<br />
παταρία ψευδάργυρου και μια ράβδος άνθρακα που τοποθετο<br />
ύνται μέσα σε ένα χημικό πολτό.<br />
Κατασκευάζοντας τη δική σας μπαταρία, συνεχίζετε την ίδια διαδικ<br />
ασία όπως με τις κανονικές μπαταρίες. Το ηλεκτρικό ρεύμα ρέει γι<br />
ατί δημιουργείται μια χημική αντίδραση ανάμεσα στα μέταλλα και σ<br />
τα οξέα των λαχανικών, των φρούτων, κ.λπ.<br />
Σε κάποια πειράματα ένα κομμάτι φρούτου, όπως από ένα λεμόνι,<br />
μπορεί να παράγει πολύ ηλεκτρισμό, αρκετό για να ανάψει ένα<br />
LED ή ένα ρολόι. Σε κάποιες περιπτώσεις, μπορεί να χρειάζεστε 3,<br />
4 ή περισσότερα κομμάτια φρούτου.<br />
Η ΚΟΝΣΟΛΑ ΓΙΑ ΠΕΙΡΑΜΑ<br />
1. Καλώδια ρολογιού<br />
2. Δοκιμαστικοί σωλήνες<br />
3. Καπάκι του τρυβλίου Petri με ρολόι με οθόνη LCD ήδη τοποθε<br />
τημένο.<br />
4. Μικρός δοκιμαστικός σωλήνας<br />
5. Ορθογώνιο δοχείο<br />
6. Καλώδια ρολογιού<br />
7. Ορθογώνιο δοχείο<br />
8. Δοκιμαστικοί σωλήνες<br />
9. Βάσεις για να τοποθετήσετε την κονσόλα όρθια (επιστρέφουν<br />
στη θέση τους).<br />
10. Καπάκι του τρυβλίου Petri με ρολόι με οθόνη LCD ήδη τοποθε<br />
τημένο.<br />
11. Μικρός δοκιμαστικός σωλήνας<br />
12. Πάνω καπάκι της κονσόλας<br />
Προσοχή κατά τον χειρισμό του ρολογιού, αποφύγετε τα υγρά στο<br />
τρύβλιο.<br />
Προετοιμασία των ηλεκτρόδιων.<br />
Χρησιμοποιείστε διαφορετικά ηλεκτρόδια:<br />
Αργίλιο: Al Μαγνήσιο: Mg<br />
Σίδηρος: Fe Ψευδάργυρος: Zn<br />
Άνθρακας: C Χαλκός: Cu<br />
Δοκιμαστικός σωλήνας: P.<br />
ΣΗΜΕΙΩΣΗ: το ηλεκτρόδιο άνθρακα είναι μαύρο, του αργιλίου είνα<br />
ι λαμπερό ασημί και του ψευδάργυρου είναι γκρι ασημί ματ. Η ταιν<br />
ία μαγνησίου έχει παρόμοιο χρώμα με το ηλεκτρόδιο του ψευδάργ<br />
υρου αλλά είναι πιο λεπτή και δεν έχει τρύπες.<br />
Προειδοποίηση: Αυτή η δραστηριότητα πρέπει να πραγματοποιηθ<br />
εί υπό την επίβλεψη ενός ενήλικα. Προσοχή κατά την κοπή των σ<br />
ωλήνων από πλαστικό και λάτεξ.<br />
Κόψτε σε κομμάτια των 6-7 χιλ μ' ένα καλό ψαλίδι. Αυτά τα κομμάτ<br />
ια είναι απαραίτητα για να ενώσετε τα καλώδια με τα ηλεκτρόδια.<br />
Παράδειγμα:<br />
Προετοιμασία των ηλεκτρόδιων άνθρακα.<br />
Βήμα 1: Τοποθετήστε ένα κομμάτι σωλήνα από λάτεξ στο ηλεκτρ<br />
όδιο άνθρακα.<br />
Βήμα 1. Ηλεκτρόδιο άνθρακα με κομμάτι από λάτεξ.<br />
25<br />
Βήμα 2: Εισάγετε το εκτεθειμένο άκρο του καλωδίου στο κομμάτι τ<br />
ου λάτεξ που αγγίζει τον άνθρακα.<br />
Βήμα 2 Εισάγετε το εκτεθειμένο άκρο<br />
του καλωδίου στο κομμάτι του λάτεξ.<br />
Βήμα 3: Διπλώστε την άκρη του καλωδίου προς τα πάνω για να μ<br />
ην φύγει.<br />
Βήμα 3. Άκρη του εκτεθειμένου καλωδίου<br />
που διπλώνει στο κομμάτι του λάτεξ.<br />
Προετοιμασία των ηλεκτρόδιων μαγνησίου.<br />
ΠΡΟΕΙΔΟΠΟΙΗΣΗ: Η ταινία μαγνησίου που συμπεριλ<br />
αμβάνεται είναι λίαν εύφλεκτη. Κρατήστε την μακριά α<br />
πό πηγές θερμότητας, Χρησιμοποιείτε μόνο για το σκο<br />
πό που προορίζεται. Αν πάρει φωτιά, ΜΗΝ ΕΙΣΠΝΕΕ<br />
ΤΕ ΤΟΝ ΚΑΠΝΟ.<br />
Βήμα 1: Χωρίστε την τ<br />
αινία μαγνησίου σε τρί<br />
Πινέζα<br />
α μέρη και κόψτε την<br />
με προσοχή με το ψα<br />
λίδι σε κομμάτια των<br />
33χιλ.<br />
Βήμα 2: Με μια πινέζα<br />
, κάντε δυο τρύπες στ<br />
η άκρη του κάθε ηλεκτ<br />
ρόδιου μαγνησίου<br />
όπως αυτές.<br />
Βήμα 3: Περάστε την<br />
άκρη ενός καλωδίου κ<br />
αι από τις δυο τρ<br />
ύπες, καλύψτε το μαζί<br />
με τις ταινίες μαγνησίο<br />
υ με τον σωλήνα από<br />
λάτεξ. Το ηλεκτρόδιο<br />
μαγνησίου είναι έτοιμ<br />
ο.<br />
Εκτεθειμένη άκρη του καλωδί<br />
ου που περνάει από το κομμ<br />
άτι μαγνησίου.<br />
Καλώδιο και μαγνήσιο σκεπάζο<br />
νται με τον σωλήνα από λάτεξ.<br />
Προετοιμασία των υπόλοιπων ηλεκτρόδιων.<br />
Για τα ηλεκτρόδια ψευδάργυρου και των υπόλοιπων ηλεκτρόδιων,<br />
χρησιμοποιείστε τον πλαστικό σωλήνα όπως παρουσιάζεται παρα<br />
πάνω.<br />
ΣΗΜΕΙΩΣΗ: τα δύο είδη σωλήνα έχουν τρεις σημαντικές λειτουργί<br />
ες:<br />
α) Κρατάει το καλώδιο ηλεκτρόδιου διασφαλίζοντας μια καλή ηλεκτ<br />
ρική επαφή.<br />
β) Προστατεύει αυτή την επαφή από περιττή μόλυνση.<br />
γ) Εμποδίζει να έρθουν σε επαφή μεταξύ τους τα ηλεκτρόδια καθ<br />
ώς τα εισάγετε μαζί, το ένα πάνω στο άλλο, στον ίδιο δοκιμαστικό<br />
σωλήνα.<br />
LED<br />
Το σχέδιο δείχνει πω<br />
ς χρησιμοποιείται<br />
το LED που είναι ενω<br />
μένο με τα ηλεκτρ<br />
όδια.<br />
Ταινία<br />
Μαγνησίου Mg<br />
FLAMMABLE<br />
Piece of magnesium<br />
Ηλεκτρόδιο άνθρακα<br />
Πείραμα 1. Διάλυμα χρωματιστής ένδειξης<br />
Εξοπλισμός: Ποτήρι. Αλάτι. Ηλεκτρόδιο ψευδάργυρου.<br />
Ηλεκτρόδιο άνθρακα. Ταινία μαγνησίου. Χαρτί pH. Κο<br />
υτάλι μεζούρα.. Κονσόλα για πειράματα.<br />
Γεμίστε έναν από τους μεγ<br />
άλους δοκιμαστικούς σωλ<br />
ήνες της κονσόλας για πει<br />
ράματα με αλμυρό νερό κ<br />
αι εισάγετε 3 ταινίες από χ<br />
αρτί pH. Είναι το πορτοκα<br />
λί χαρτί:<br />
Χαρτί pH<br />
FLAMMABLE
Όταν το αλμυρό νερό χρωματιστεί από τις τρεις ταινίες, απομακρ<br />
ύνετέ τες και επαναλάβετε το πείραμα Αρ. 1 σε αυτό το χρωματιστ<br />
ό υγρό.<br />
Εισάγετε τα ηλεκτρόδια μαγνησίου και άνθρακα στο μεγάλο δοκιμ<br />
αστικό σωλήνα με το κίτρινο υγρό και συνδέστε τα δυο καλώδια τ<br />
ων ηλεκτρόδιων.<br />
Mg<br />
Η ΚΟΝΣΟΛΑ ΑΠΟ ΠΑΝΩ<br />
Μπαταρία ΑΑ Χαρτιά pH το ένα πάνω στο άλλο<br />
Μεγάλος δοκιμαστι<br />
κός σωλήνας γεμά<br />
τος με αλμυρό νερ<br />
ό.<br />
Χαρτί pH<br />
Μετά από μερικά λεπτά, το διάλυμα γίνεται βιολετί γύρω από το ηλ<br />
εκτρόδιο του μαγνησίου.<br />
Το διάλυμα κάτω από τον ά<br />
νθρακα επίσης αλλάζει χρ<br />
ώμα, αλλά πολύ πιο αργά.<br />
Τι συμβαίνει; Γιατί; Τι θα είχ<br />
ε συμβεί αν δεν είχατε συνδ<br />
έσει τα καλώδια στα ηλεκτρ<br />
όδια; Και αν στη θέση του<br />
μαγνησίου είχατε χρησιμοπ<br />
οιήσει ψευδάργυρο ή ηλεκτ<br />
ρόδια; Ποια είναι η σχέση τ<br />
ου με τον ηλεκτρισμό;<br />
Το χρώμα στο χαρτί pH υπ<br />
οδεικνύει την παρουσία εν<br />
ός οξέος ή μιας βάσης καθ<br />
ώς αλλάζει χρώμα. Τα οξέα<br />
έχουν πικρή γεύση. Πολλά<br />
φρούτα περιλαμβάνουν οξέ<br />
α, όπως το λεμόνι ή το πορ<br />
τοκάλι. Τα έντονα οξέα καν<br />
ονικά διαβρώνουν τα μέταλ<br />
Κομμάτι πολυστυρένιου για<br />
να κρατήσετε τη μπαταρία και<br />
το χαρτί pH στη θέση τους<br />
2 ταινίες από χαρτί pH<br />
(μουσκεμένες) πάνω στη μπαταρία<br />
C<br />
Το κίτρινο διάλ<br />
υμα γίνεται βιο<br />
λετί.<br />
Έγινε καμία αλλ<br />
αγή;<br />
λα. Μια βάση είναι το αντίθετο του οξέος. Οι ουσίες που είναι βάσε<br />
ις, ονομάζονται επίσης αλκάλια. Μια βάση εξουδετερώνει τα οξέα<br />
και διαμορφώνει ένα άλας. Το βιολετί χρώμα γύρω από το ηλεκτρ<br />
όδιο του μαγνησίου υποδεικνύει ότι έχετε παράγει μια βάση κοντά<br />
σ' ένα ηλεκτρόδιο. Στο τέλος επιτυγχάνεται ένα κοκκινωπό χρώμα<br />
κοντά στο ηλεκτρόδιο άνθρακα. Το υγρό εκεί μετατρέπεται σε οξύ.<br />
Αν δεν συνδεθούν τα καλώδια του ηλεκτρόδιου, φαίνεται σαν να μ<br />
η συμβαίνει τίποτα. Θα προκαλέσετε παρόμοιες αντιδράσεις με άλ<br />
λα ηλεκτρόδια αλλά πιθανόν να αποκτήσετε ένα λιγότερο βασικό δ<br />
ιάλυμα και το χρώμα γύρω από τον ψευδάργυρο ή το ηλεκτρόδιο τ<br />
ου αργιλίου να αλλάξει σε μπλε πριν γίνει βιολετί.<br />
Πείραμα 2. Το χαρτί ένδειξης<br />
Εξοπλισμός: 2 κομμάτια χαρτί pH. Μπαταρία 1,5 AA V. Ένα μικρό<br />
κομμάτι πολυστυρένιο. Κονσόλα για πειράματα<br />
Βάλτε τις ταινίες από χαρτί pH στο διάλυμα του αλμυρού νερού, α<br />
πλά για να μουσκευτούν.<br />
Παρατηρήστε το χρώμα στο μουσκεμένο χαρτί pH.<br />
Ενώστε τις δυο ταινίες από χαρτί pH στη μια άκρη. Τοποθετήστε τι<br />
ς ταινίες στο πλάι της μπαταρίας AA και διπλώστε τις δυο άκρες<br />
ώστε να καλύψετε την πάνω και την κάτω πλευρά της μπαταρίας.<br />
Τοποθετήστε τη μπαταρία με τα χαρτιά pH στην ορθογώνια θήκη<br />
(CR), το λίγο βαθύ κενό στο πάνω μέρος της κονσόλας για το πείρ<br />
αμα. Κρατήστε αυτό το "σύστημα" στη θέση του με ένα μικρό κομμ<br />
άτι πολυστυρένιου, όπως παρουσιάζεται.<br />
26<br />
Περιμένετε δυο ή τρεις ώρες διατηρώντας το χαρτί υγρό (ρίξτε μερι<br />
κές σταγόνες αλμυρό νερό στο χαρτί, αν χρειάζεται).<br />
Στο τέλος του πειράματος, θα δείτε ότι το κάτω χαρτί της μπαταρία<br />
ς αλλάζει σε βιολετί (σε μπλε γύρω γύρω) και το πάνω μέρος, σε κ<br />
όκκινο (σε κίτρινο γύρω γύρω). Γιατί;<br />
Η ίδια χημική αλλαγή με το Πείραμα 1.<br />
Το ηλεκτρικό ρεύμα που περνάει από το αλμυρό νερό δημιο<br />
ύργησε μια χημική αλλαγή στο αλάτι και αυτό άλλαξε το χρώμα στ<br />
ο χαρτί. Το βιολετί χρώμα είναι βασικό και αντιπροσωπεύει το αρν<br />
ητικό, το κόκκινο είναι οξύ και αντιπροσωπεύει το θετικό. Το αρνητ<br />
ικό ρεύμα που ρέει από την αρνητική πλευρά της μπαταρίας και το<br />
κόκκινο χρώμα αντιπροσωπεύουν τη θετική πλευρά της μπαταρία<br />
ς. Η κατεύθυνση κατά την οποία ρέει το ρεύμα ονομάζεται πολικ<br />
ότητα.<br />
Πείραμα 3. Μεταφορά ηλεκτρικού ρεύματος<br />
Εξοπλισμός: Εξοπλισμός για το πείραμα 1. Καρφί ή βίδα από σίδε<br />
ρο ή χάλυβα. Διάλυμα χαλκού.<br />
Προετοιμασία για το διάλυμα χαλκού. Χρειάζεστε:<br />
- Κονσόλα για πειράματα<br />
- Ξύδι<br />
- Ηλεκτρόδια χαλκού<br />
Η κονσόλα έχει διάφορες θήκες: 2 μεγάλους δοκιμαστικούς σωλήν<br />
ες, 1 μικρό δοκιμαστικό σωλήνα και 1 ορθογώνια θήκη. Έχουμε ήδ<br />
η χρησιμοποιήσει τους μεγάλους σωλήνες και την ορθογώνια θήκ<br />
η. Τώρα θα χρησιμοποιήσουμε το μικρό.<br />
Γεμίστε τον μικρό δοκιμαστικό σωλήνα με ξύδι καθώς και το ορθογ<br />
ώνιο δοχείο σχεδόν μέχρι το χείλος. Τοποθετήστε κάθετα ένα από<br />
τα ηλεκτρόδια χαλκού μέσα στο μικρό δοκιμαστικό σωλήνα και στ<br />
ηρίξτε το δεύτερο ηλεκτρόδιο χαλκού μέσα στην ορθογώνια θήκη<br />
όπως φαίνεται στην εικόνα.<br />
Ηλεκτρόδιο χαλκού<br />
Ξύδι<br />
Σημείωση: Δεν χρειάζεται να χρησιμοποιήσετε ηλεκτρόδια γι' αυτό<br />
το πείραμα. Αρκεί ένα χάλκινο νόμισμα, μερικά καλώδια χαλκού ή<br />
κάποιο άλλο μικρό χάλκινο αντικείμενο, με την προϋπόθεση ότι είν<br />
αι από χαλκό και όχι από σίδηρο που έχει βαφτεί με χαλκό. Αφήστ<br />
ε το μείγμα να "κάτσει" ένα ολόκληρο βράδυ ή και περισσότερο, χ<br />
ωρίς να το μετακινείσετε. Μετά από 24 ώρες, θα δείτε ότι το μείγμα<br />
αλλάζει χρώμα μεταξύ μπλε και πράσινο.<br />
Προσοχή: αυτό το υγρό είναι ΔΗΛΗΤΗΡΙΩΔΕΣ, μην χρησιμοποιείτ<br />
ε τίποτα που μπορεί να έρθει σε επαφή με τρόφιμα.<br />
Για το πείραμα αυτό, χρειάζεστε ένα καρφί από σίδηρο, ή ακόμη κ<br />
αλύτερα, μια βίδα από σίδηρο ή χαλκό. Τόσο το καρφί όσο και η β<br />
ίδα πρέπει να είναι απόλυτα καθαρά. Εισάγετε το ηλεκτρόδιο χαλκ<br />
ού και τη βίδα από σίδηρο στο CR με το μπλε υγρό όπως παρουσ<br />
ιάζεται στην εικόνα. Περιμένετε μισή ώρα, μια μέρα, μια εβδομάδα,<br />
εκατό χρόνια ...Τι πιστεύετε ότι θα συμβεί; Τι συμβαίνει στην πραγ<br />
ματικότητα;<br />
Καρφί ή βίδα<br />
από σίδηρο<br />
Ηλεκτρόδιο χαλκού<br />
Μπλε υγρό<br />
Η βίδα από σίδηρο και το ηλεκτρόδιο χαλκού αποτελούν μια ηλεκτ<br />
ρική ένωση. Παράγεται ηλεκτρική ενέργεια. Στο κεφάλι της βίδας α<br />
πό σίδηρο δημιουργείται ένα καφέ "μούσι" από σκόνη χαλκού<br />
(αυτό που περιμέναμε). Κάθε φορά δημιουργείται περισσότερη σκ<br />
όνη.<br />
(Από πού προέρχεται;)<br />
Το μπλε υγρό παραμένει μπλε. (Γιατί;) Παρακάτω δίνεται μια απλή<br />
εξήγηση:
Ο χαλκός βγαίνει από το διάλυμα χαλκού και κάθεται στο κεφάλι τ<br />
ης βίδας. Λόγω της ηλεκτρικής ενέργειας που παράγεται από την<br />
ένωση του Cu/Fe. Αυτό συμβαίνει μέχρι να τελειώσει ο χαλκός, να<br />
στεγνώσει το νερό ή το "μούσι" χαλκού να αγγίξει το ηλεκτρόδιο χ<br />
αλκού.<br />
Πείραμα 4. Το ψηφιακό ηλεκτρικό ρολόι<br />
Εξοπλισμός: Κονσόλα για πειράματα. Σύστημα με ρολόι LCD. Διά<br />
λυμα (αλμυρό νερό, χυμός φρούτων ή λαχανικών).<br />
Αν βγάλετε τα καλώδια κατά λάθος, το ρολόι θα αποσυνδεθεί. Το<br />
ποθετήστε τα καλώδια μέσα από την εγκοπή και κλείστε με προσο<br />
χή το τρυβλίο Petri. Είναι σημαντικό να παραμείνει κλειστό για να<br />
μην βραχεί το ρολόι.<br />
e.g.:<br />
ΗΛΕΚΤΡΟΔΙΑ ΥΛΙΚΟ ΔΙΑΛΥΜΑ ΩΡΑ ΕΝΑΡΞΗΣ ΗΜΕΡΟΜΗ ΩΡΑ ΛΗΞΗΣ<br />
ΝΙΑ<br />
Χαλκός και ψευδάργυρος<br />
λεμόνι<br />
Εγκοπή για τα καλώδια<br />
Προετοιμάστε την "πηγή τροφοδοσίας" με οποιαδήποτε φυσική π<br />
ηγή ενέργειας που επιθυμείτε. Ποιοι συνδυασμοί βοηθούν το ρολ<br />
όι να λειτουργήσει για περισσότερο καιρό; Σημειώστε τα συμπερά<br />
σματά σας στον παρακάτω πίνακα (όπως στο παράδειγμα):<br />
απορρυπαντικό 08:00 Πέμπτη 12/1 11:46<br />
ΗΜΕΡΟΜΗ<br />
ΝΙΑ<br />
Κυριακή<br />
15/1<br />
Ελέγξτε αν έχετε αρκετή ηλεκτρική ενέργεια παρατηρώντας αν ανά<br />
βει το LED. Θυμηθείτε ότι το LED λειτουργεί μόνο όταν είναι συνδε<br />
δεμένο στη σωστή κατεύθυνση. Ο ίδιος κανόνας χρησιμοποιείτε γι<br />
α το ρολόι.<br />
Όταν καταφέρετε να ενεργοποιήσετε το ρολόι, ανοίξτε το τρυβλίο<br />
Petri και θα δείτε δυο μικρούς μεταλλικούς δίσκους στο πίσω μέρο<br />
ς του ρολογιού με οθόνη LCD. Είναι για να ρυθμίσετε την ώρα<br />
όπως στα ρολόγια με οθόνη LCD ή στο ρολόι χειρός.<br />
Κοιτάξτε την οθόνη LCD από την πίσω πλευρά. Η επαφή στη δεξι<br />
ά πλευρά είναι η επαφή λειτουργίας. Πατήστε την και θα εμφανιστ<br />
εί η λειτουργία. Πατήστε δυο φορές και θα εμφανιστεί ο αριθμός<br />
12: A. Η επαφή στην αριστερή πλευρά είναι για να ρυθμίσετε την<br />
ώρα, πατήστε την επαφή της λειτουργίας και μετά τη ρυθμιζόμενη<br />
επαφή για να ρυθμίσετε τα λεπτά.<br />
Μόλις τελειώσετε, κλείστε με προσοχή το καπάκι του τρυβλίου<br />
Petri.<br />
Πίσω όψη της ψηφιακής λειτουργίας<br />
27<br />
VISTA POSTERIORE DELLA MODALITÀ DIGITALE<br />
Χρησιμοποιείστε<br />
ένα κλιπ ή ένα σ<br />
τυλό για να ρυθμ<br />
ίσετε την ώρα<br />
Χρησιμοποιείστε έν<br />
α κλιπ ή ένα στυλό<br />
για να αλλάξετε τη<br />
λειτουργία<br />
Θυμηθείτε: αν το ρολόι σταματήσει, θα πρέπει να το ξαναρυθμίσετ<br />
ε.<br />
Πείραμα 5. Η λάμπα ή το ρολόι από λεμόνι<br />
Εξοπλισμός: Ηλεκτρόδιο αργιλίου. Ηλεκτρόδιο μπρούντζου. Ηλεκτ<br />
ρόδια χαλκού. Ηλεκτρόδια ψευδάργυρου. 3 – 4 λεμόνια.<br />
Πειραματιστείτε με διάφορα είδη "λάμπας" και ρολογιών. Μπορείτε<br />
να κατασκευάσετε μια λάμπα από λεμόνι, όπως σ' αυτό το παράδε<br />
ιγμα.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
ΡΟΛΟΙ ΑΠΟ ΛΕΜΟΝΙ<br />
Zn<br />
Cu<br />
Brass<br />
Αυτό το πείραμα, όπως σχεδόν όλα, λειτουργεί μόνο αν τα καλ<br />
ώδια είναι σε επαφή ΠΛΗΡΩΣ με όλα τα ηλεκτρόδια. Αν ένα δεν έχ<br />
ει επαφή, το LED δεν ανάβει. Βεβαιωθείτε ότι τα καλώδια και τα ηλ<br />
εκτρόδια είναι πάρα πολύ καθαρά. Αν χρειάζεται, δοκιμάστε προσ<br />
θέτοντας άλλο λεμόνι και άλλο ζευγάρι καλωδίων. Βεβαιωθείτε ότι<br />
τα λεμόνια είναι ζουμερά. Αν χρειάζεται, προσθέστε νερό.<br />
Al<br />
Al
(RU) Производи экологически чистую электроэнергию самост<br />
оятельно! Всего лишь с помощью энергии одного лимона и эт<br />
ого набора ты сможешь заставить работать часы. Займись на<br />
укой!<br />
N ELECTRICITY<br />
ВНИМАНИЕ!<br />
Oпределенныe опыты должны проводиться под присмотром в<br />
зрослых.<br />
Oсторожнo обращaйтесь c деталями c заocтренными краями.<br />
Входящая в комплект полоска магния легко воспламеняется.<br />
Ее следует держать подальше от тепла. Использовать только<br />
так, как указано. При ее воспламенении НЕ ВДЫХАТЬ ДЫМ.<br />
КОМПОНЕНТЫ<br />
● Консоль для опытов ● Электроды- Полоска магния ● Элект<br />
роды- Aлюминий ● Электроды- Латунь ● Электроды- Медь ●<br />
Электроды- Цинк ● Электроды- Углерод ● Модуль цифровых<br />
часов ● Светодиод ● Провода ● Трубка из резины (латекса) ●<br />
Пластмассовая трубка ● Стальная вата ● Бумага pH<br />
(лакмусовая бумага) ● Воронка ● Руководство по эксплуатаци<br />
и ● Мерная ложка ● Скрепка ● Квадрат из полистирена ● Пот<br />
ребуются батарейки AA 1,5 В (в комплект не входят) ● Потреб<br />
уются некоторые продукты, которые можно найти в домашне<br />
м обиходе<br />
ВВЕДЕНИЕ<br />
Hабор демонстрирует, как вырабатывать электричество с исп<br />
ользованием природных материалов посредством простых хи<br />
мических реакций с некоторыми металлами. Например, с пом<br />
ощью цинковой батарейки и палочки из углерода, которые вc<br />
тавляются в химическyю пасту.<br />
В изготовленной тобой батарейке происходит тот же процесс,<br />
что и в oбычных батарейках. Электричество возникает потом<br />
у, что между металлами и кислотами, содержащимися в овощ<br />
ах, фруктах и т.д., происходит химическая реакция.<br />
В некоторых опытax всего один фрукт, например, один лимон<br />
, может произвести много электричества, которого достаточн<br />
о для того, чтобы заработали светодиод или часы. В других с<br />
лучаях тебе понадобятся 3, 4 или более фруктов.<br />
КОНСОЛЬ ДЛЯ ОПЫТОВ<br />
1. Провода часов<br />
2. Пробирки<br />
3. Крышка чашки Петри с модулем часов c жидко<br />
-кристаллическим экраном (LCD), ycтaновленным на мест<br />
о<br />
4. Маленькая пробирка<br />
5. Прямоугольная емкость<br />
6. Провода часов<br />
7. Прямоугольная емкость<br />
8. Пробирки<br />
9. Ножки для установки консоли (складные)<br />
10. Крышка чашки Петри с модулем часов c жидко<br />
-кристаллическим экраном (LCD), ycтaновленным на мест<br />
о<br />
11. Маленькая пробирка<br />
12. Верхняя крышка консоли<br />
Осторожно обращаться с часами, чтобы не намочить механиз<br />
м.<br />
Изготовление электродов.<br />
Используй разные электроды:<br />
Aлюминий: Al Maгний: Mg<br />
Железо: Fe Цинк: Zn<br />
Углерод: C Медь: Cu<br />
Пробирка: P.<br />
ПРИМЕЧАНИЕ: углеродный электрод - чернoго цвета, алюми<br />
ниевый - блестящего серебристого, а цинковый - серo-сеpебр<br />
истого матового цвета. Цвет магниевoй полоски похож на цве<br />
т цинкового электрода, толькo онa тоньше и без дырочек.<br />
Внимание! Для этиx занятий требуется присмотр взрослых. С<br />
ледует быть осторожным при разрезании резиновых и пластм<br />
ассовых трубок.<br />
Их следует нарезать хорошими ножницами на куски прибл. по<br />
6-7 мм. Они необходимы для присоединения проводов к элек<br />
тродам. Пример:<br />
Изготовление углеродных электродов<br />
Шаг 1: Размести кусок резиновой трубки в углеродный электр<br />
од.<br />
Шаг 1. Углеродный электрод c куском резины.<br />
28<br />
Шаг 2: Вставь видимый конец провода в кусок резины так, что<br />
бы он касался углерода.<br />
Шаг 2 . Вставь видимый конец провода в кусок резины.<br />
Шаг 3: Согни конец провода вверх, чтобы он не выходил.<br />
Шаг 3. Согнутый видимый конец провода в кускe резины.<br />
Изготовление магниевых электродов<br />
ВНИМАНИЕ! Входящая в комплект полоска магния<br />
легко воспламеняется. Ее следует держать подаль<br />
ше от тепла. Использовать только так, как указано.<br />
При ее воспламенении НЕ ВДЫХАТЬ ДЫМ.<br />
Шаг 1: Раздели ма<br />
гниевую полоску н<br />
Кнопка<br />
а три части и осто<br />
рожно разрежь ее<br />
ножницами на кус<br />
очки по 33 мм.<br />
Шаг 2: Кнопкой пр<br />
околи две дырочк<br />
и на одном концe к<br />
аждого магниевог<br />
о электрода, как п<br />
оказано на рисунк<br />
е.<br />
Шаг 3: Проведи ко<br />
нец провода через<br />
обе дырочки, накр<br />
ой его и магниевы<br />
е полоски резинов<br />
ой трубкой. Магни<br />
евый электрод гот<br />
ов.<br />
Изготовление остальных электродов<br />
Для цинкового и других электродов пользуйтесь пластмассов<br />
ой трубкой, как показано на рисунке вверху.<br />
ПРИМЕЧАНИЕ: оба вида трубок выполняют три важные функ<br />
ции:<br />
a) Прикрепление провода к электродy, что обеспечивает хоро<br />
ший электрический контакт.<br />
б) Предохранение этого контакта от ненужного загрязнения.<br />
в) Предотвращение соприкосновения электродов, когда они в<br />
месте вставляются в однy и ту же пробиркy, один над другим.<br />
На рисунке показан<br />
о, как пользоваться<br />
Светодиод<br />
светодиодом, подкл<br />
юченным к электрод<br />
aм.<br />
Полоска Mg<br />
Опыт 1. Раствор цветного индикатора<br />
Оборудование: Стакан. Соль. Цинковый электрод.<br />
Углеродный электрод.Полоска магния. Лакмусовая<br />
бумага. Мерная ложка. Консоль для проведения оп<br />
ытов.<br />
Наполни соленой водой<br />
одну из длинных пробиро<br />
к консоли для опытов и п<br />
омести в нее 3 полоски л<br />
акмусовой бумаги. Это о<br />
ранжевая бумага:<br />
FLAMMABLE<br />
Видимый конец провода пр<br />
оведен через магниевую де<br />
таль.<br />
Провод и магний cкрыты по<br />
д резиновой трубкой.<br />
Углеродный электрод<br />
FLAMMABLE<br />
Длинная<br />
пробирка,<br />
наполненная<br />
соленой водой
Когда соленая вода окрасится oт трех полосок, вынь их и повт<br />
ори опыт № 1 в этой окрашенной жидкости.<br />
Вставь магниевый и углеродный электроды в длинную пробир<br />
ку c желтой жидкостью и подключи два провода электродов.<br />
Mg<br />
Длинная пробир<br />
ка, наполненная<br />
соленой водой<br />
Лакмусовая<br />
бумага<br />
Через несколько минут раствор вокруг магниевого электрода<br />
станет фиолетовым.<br />
Раствор под углеродом тоже поменяет cвой цвет, но только н<br />
амного медленнее.<br />
Что происходит? Поче<br />
му? Что бы произошло<br />
, если бы провода не б<br />
ыли подключены к эле<br />
ктродам? А если вмест<br />
о магния ты использов<br />
ал бы цинк или электр<br />
оды? Какое отношение<br />
это имеет к электриче<br />
ствy?<br />
Изменившийся цвет л<br />
акмусовой бумаги указ<br />
ывает на присутствие<br />
кислоты или основани<br />
я. Кислота - это горько<br />
е вещество. Кислоты с<br />
одержатся во многих<br />
фруктах, например, в<br />
лимоне или апельсине<br />
. Сильная кислота обы<br />
чно разъедает металл<br />
КОНСОЛЬ СВЕРХУ<br />
Батарейка AA Полоски лакмусовой бумаги одна на другoй<br />
Кусочек полистирена<br />
для удержания батарейки<br />
и лакмусовой бумаги на месте<br />
2 полоски лакмусовой бумаги<br />
(смоченные) на батарейке<br />
C<br />
Желтый раств<br />
ор станет фи<br />
олетовым<br />
Что-нибудь из<br />
менилось?<br />
ы. Основание - противоположность кислоты. Вещества, являю<br />
щиеся основаниями, также называются щелочами. Основание<br />
нейтрализует кислоту и образует соль. Фиолетовое пятно вок<br />
руг магниевого электрода указывает на то, что y тебя вблизи<br />
электрода получилось основание. В завершение вблизи углер<br />
одного электродa получается пятно краcнoватого цвета. Жидк<br />
ость там превращается в кислоту.<br />
Если провода не подключены к электродy, кажется, что ничег<br />
о не происходит. Cxoжие реакции ты получишь c другими элек<br />
тродами, нo, возможно, раствор y тебя получится не таким ос<br />
новным, и цвет пятна вокруг цинка или алюминиевого электро<br />
да, скорее всего, станет синим, a не фиолетовым.<br />
Опыт 2. Лакмусовая бумага<br />
Оборудование: 2 куска лакмусовой бумаги. Батарейка AA 1,5<br />
В. Маленький кусок полистирена. Консоль для проведения оп<br />
ытов<br />
Помести полоски лакмусовой бумаги в раствор coленой воды,<br />
только для того, чтобы они намокли.<br />
Обрати внимание на цвет смоченной лакмусовой бумаги.<br />
Соедини обе полоски лакмусовой бумаги с одного конца. Пол<br />
ожи полоски на боковую сторону батарейки AA и согни oба кo<br />
нца, накрыв верхнюю и нижнюю часть батарейки.<br />
29<br />
Помести батарею c полосками лакмусовой бумаги в прямоуго<br />
льную емкость (CR) - неглубокoe отверстие на верхней части<br />
консоли для опытов. Удерживай эту "систему" на местe при п<br />
омощи кусочка полистирена, как показано.<br />
Подожди два-три часа, поддерживая бумагу во влажном сост<br />
оянии (капни на бумагу несколько капель соленой воды, ecли<br />
потребуется).<br />
В конце опыта ты увидишь, что бумага внизу батарейки стане<br />
т фиолетовой (oкруженной синим), a сверху - красной (oкруже<br />
нной желтым). Почему?<br />
Это - тo же самое химическое изменение, что и в опыте 1.<br />
Электрический ток, проходящий через соленую воду, вызвал<br />
в соли химическое изменение, в результате чего изменился ц<br />
вет бумаги. Фиолетовый цвет является основным и указывает<br />
на отрицательный заряд; красный цвет - кислотный и указыва<br />
ет на положительный заряд. Отрицательный ток, идущий с от<br />
рицательной стороны батарейки, и красный цвет указывают н<br />
а положительную сторону батарейки. Направление движения<br />
тока называется полярностью.<br />
Опыт 3. Передача электричества<br />
Оборудование: Оборудование опыта 1. Железный либо сталь<br />
ной гвоздь или винт. Раствор меди.<br />
Как приготовить раствор меди. Тебе понадобятся:<br />
- Консоль для опытов<br />
- Уксус<br />
- Медные электроды<br />
На консоли еcть несколько отделений: 2 длинные пробирки, 1<br />
короткая и 1 прямоугольное отделение. Мы уже пользовались<br />
длинными пробирками и прямоугольным отделением. Теперь<br />
мы будем использовать короткую.<br />
Наполнить yксусом почти до краев короткую пробирку и прям<br />
оугольную емкость. Поместить один из медных электродов в<br />
вертикальнoм положении в короткую пробирку и опереть втор<br />
ой медный электрод в прямоугольном отделении, как показан<br />
о на рисунке.<br />
Примечание: использование электродов для этого опыта не я<br />
вляется абсолютно необходимым. Можно использовать медн<br />
ую монету, медный провод или любой другой маленький медн<br />
ый предмет, при условии, что он изготовлен из меди, a не из<br />
железа, покрытого медью. Оставь эту смесь на ночь или на б<br />
олее длительное время, не размешивая. Через 24 часа ты за<br />
метишь, что смесь приняла синеватo-зеленоватый цвет.<br />
Внимание! Полученная жидкость ЯДОВИТА, не пользоваться<br />
ничем, что может вступить в контакт с продуктами питания.<br />
Для этого oпыта тебе понадобится железный гвоздь или, что<br />
еще лучше, железный либо стальной винт. Гвоздь или винт д<br />
олжны быть полностью чистыми. Помести медный электрод и<br />
железный винт в прямоугольную емкость (CR) c синеватой жи<br />
дкостью, как показано на рисунке. Подожди полчаса, день, не<br />
делю, cто лет... Как ты думаешь, что произойдет? Что происх<br />
одит на самом деле?<br />
Медный<br />
электрод<br />
Синеватая<br />
жидкость<br />
Медный электрод<br />
Уксус<br />
Железный гвоздь<br />
или винт
Железный винт и медный электрод составляют электрически<br />
й комплект. Вырабатывается электричество. На головке желе<br />
зного винта образуется коричневая "бородкa" из порошка мед<br />
и (чeго мы и ожидали). Постепенно образуется все больше и<br />
больше порошка.<br />
(Откуда он взялся?)<br />
Синяя жидкость остается синей. (Почему?) Объяcняется это<br />
очень просто:<br />
Медь выделяеся из медного раствора и откладывается на го<br />
ловке винта. Благодаря электричеству, произведенному комп<br />
лектом Cu/Fe. Это будет происходить до тех пор, пока нe зако<br />
нчится медь, не испарится вода или пока медная "бородкa" н<br />
е коснется медного электрода.<br />
Опыт 4. Электрические цифровые часы<br />
Оборудование: Консоль для опытов. Модуль часов с ЖК<br />
-экраном. Раствор (соленая вода, фруктовый или овощной со<br />
к).<br />
Если ты случайно вынешь провода, то часы отключатся. Про<br />
веди провода через прорезь и осторожно закрой чашку Петри<br />
.Она обязательно должна быть закрытой, чтобы часы не нам<br />
окли.<br />
Подготовь "источник питания" c любым природным источнико<br />
м энергии по своему желанию. Какие сочетания обеспечиваю<br />
т более продолжительную работу часов? Запиши свои заклю<br />
чения в следующyю таблицy (как на примере):<br />
e.g.:<br />
Прорезь для<br />
проводов<br />
ЭЛЕКТРОДЫ МАТЕРИАЛ РАСТВОР ВРЕМЯ НАЧАЛА ДАТА ВРЕМЯ ДАТА<br />
ОКОНЧАНИЯ<br />
Медь и цинк лимон стиральный по 08:00 часов четверг 11:46 часов<br />
рошок<br />
12/1<br />
воскресень<br />
е 15/1<br />
Проверь, есть ли у тебя достаточно электричества, наблюдая<br />
, зажeгся ли светодиод. Помни, что он работает только в том<br />
случае, если он подключен в правильном направлении. То же<br />
правило распространяется и на модуль часов.<br />
Как только часы включатся, открой чашку Петри, и ты увидиш<br />
ь две маленькие металлические пластинки на обороте модул<br />
я часов с ЖК-экраном. Они служат для настройки времени, ка<br />
к в часах c ЖК-экраном или наручных часах.<br />
Посмотри на ЖК-модуль с обратной стороны. Контакт справа<br />
- это контакт режима. Нажми на него, и появится режим. Наж<br />
ми на него два раза и появится число 12: A. Контакт слева сл<br />
ужит для настройки времени, нажми на контакт режима, а зат<br />
ем на контакт настройки, чтобы настроить минуты.<br />
Закончив, осторожно закрой крышку чашки Петри.<br />
30<br />
Используй скре<br />
пку или ручку д<br />
ля настройки вр<br />
емени<br />
Цифровой режим (вид сзади)<br />
Используй скрепк<br />
у или ручку для из<br />
менения режима<br />
Помни: если часы остановятся, их придется снова нacтроить.<br />
Опыт 5. Лимонная лампа или лимонные часы<br />
Оборудование: Алюминиевый электрод. Латунный электрод.<br />
Медные электроды. Цинковые электроды. 3 – 4 лимона.<br />
Проведи опыты c различными типами "ламп" и часов. Ты мож<br />
ешь изготовить лимонную лампу, как показано.<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
ЛИМОННЫЕ ЧАСЫ<br />
Zn<br />
Cu<br />
Brass<br />
Этот опыт, как и почти все остальные, удается только в том с<br />
лучае, ecли у проводов ecть ОТЛИЧНЫЙ контакт co всеми эл<br />
ектродами. Если один из них "не контачит", то светодиод не з<br />
агорается. Убедись в том, что провода и электроды безукориз<br />
ненно чисты. При необходимости добавь еще один лимон и д<br />
ругую пару проводов. Убедись в том, что лимоны сочные. При<br />
необходимости добавь воды.<br />
Al<br />
Al
(CH) 你自己就能生产出清洁的电能! 只需要一只柠檬的能量和这<br />
套用具,你就可以让一个钟表运转起来了。 快来体验科学吧!<br />
N ELECTRICITY<br />
警告:<br />
有些实验需要成年人的监督。<br />
请谨慎使用有锋利边缘的用具。<br />
附带的镁条极易燃。请将它远离热源。勿用不同于指示的方式使用<br />
它。如果它燃烧了,勿吸入烟雾。<br />
物品清单<br />
实验操作台 ● 电极- 镁条 ● 电极- 铝 ● 电极- 黄铜 ● 电极- 铜 ● 电<br />
极- 锌 ● 电极- 碳 ● 数字时钟机芯 ● LED ● 电线 ● 橡胶管(乳胶)<br />
● 塑料管 ● 钢丝绒 ● PH 试纸(指示纸) ● 漏斗 ● 使用说明手册 ●<br />
计量勺 ● 回形针 ● 聚苯乙烯方块 ● 需要 1.5 V AA 干电池(未附带<br />
) ● 需要某些家居用品<br />
介绍<br />
这套工具展示如何用一些金属和天然材料使之产生简单的化学反应<br />
来制造电能。就像干电池是由放置在糊状化学物质之间的锌和一根<br />
碳棒构成。<br />
按照普通干电池的生产步骤,制造出你自己的干电池。电流能流动<br />
是因为金属和蔬菜水果等之间有化学反应。<br />
在某些实验中,一个水果比如一个柠檬就能生产很多电能,足以让<br />
一盏 LED 灯亮起或让时钟运转。在某些实验中需要使用超过一个<br />
水果,比如说 3、4 个。<br />
实验操作台<br />
1. 时钟电线<br />
2. 实验管<br />
3. 已经装有 LCD 时钟培养皿的盖子<br />
4. 小试管<br />
5. 长方形容器<br />
6. 时钟电线<br />
7. 长方形容器<br />
8. 实验管<br />
9. 让控制台立起来的脚(卡紧)<br />
10. 已经装有 LCD 时钟培养皿的盖子<br />
11. 小试管<br />
12. 控制台的顶盖<br />
请谨慎操作时钟,避免把它打湿。<br />
准备电极。<br />
你会用到不同电极:<br />
铝: Al 镁: Mg<br />
铁: Fe 锌: Zn<br />
碳: C 铜: Cu<br />
试管: P.<br />
提示:碳电极是黑色,铝电极是亮银色,锌电极是亚光银灰色。镁<br />
条的颜色与锌电极的类似,但是它更薄并且没有孔。<br />
警告: 此活动需要成年人的监护。剪切橡胶管和塑料管时请小心<br />
。<br />
用优质剪刀剪成 6-7 毫米的段。这些管用来把电线连上电极。例如<br />
:<br />
准备碳电极<br />
步骤 1: 放一段橡胶管在碳电极上。<br />
步骤 1。 套有橡胶管的碳电极。<br />
步骤 2: 把电线裸露的一端塞进橡胶管来接触到碳。<br />
步骤 2。把电线裸露的端头塞进橡胶管。<br />
步骤 3: 把电线的端头向上折来避免它松脱。<br />
步骤 3。 把电线裸露的端头折到橡胶管上。<br />
31<br />
准备镁电极<br />
警告: 附带的镁条极易燃。 请将它远离热源。 勿用<br />
不同于指示的方式使用它。 如果它燃烧了,勿吸入<br />
烟雾。<br />
步骤 1: 用剪刀小心地<br />
把镁条剪成各 33 厘米<br />
的三段。<br />
步骤 2: 用一个图钉在<br />
三段镁电极的一端各扎<br />
两个小孔。<br />
步骤 3: 把电线的一端<br />
穿过两个孔,用橡胶管<br />
盖住电线的端头和镁条<br />
。镁电极就准备好了。<br />
准备其它电极<br />
对于锌电极和其它电极,如上图所示使用塑料管。<br />
提示:这两种管有三个重要功能:<br />
a) 把电线固定在电极上来保证良好地接触到电。<br />
b) 罩起来以避免可能的污染。<br />
c) 当把两种电极一个放在另一个上面装进同一根试管时,要避免两<br />
个电极接触。<br />
图片显示应如何使用<br />
LED<br />
和电极连接起来的 LED。<br />
镁条<br />
实验 1.着色指示溶液<br />
装备:杯子。盐。锌电极。碳电极镁条。PH 试纸。计<br />
量勺。实验操作台。<br />
给控制台的一根长试管灌盐<br />
水并放入 3 条 PH 试纸。试<br />
纸是橙红色:<br />
图钉<br />
电线裸露的一端穿过镁条。<br />
用橡胶管套住电线和镁<br />
镁条<br />
PH 试纸<br />
当盐水被这三条试纸染色后,就把试纸拿出来,然后在这已经被染<br />
色的液体中重复实验 1。<br />
把镁电极和碳电极放入有黄色液体的长试管中,再把电极的两条电<br />
线连接起来。<br />
装了盐水的长试<br />
管<br />
PH 试纸<br />
FLAMMABLE<br />
FLAMMABLE
几分钟后,镁电极周围的溶液会变成紫色。<br />
碳电极下面的溶液也会变色,但是速度慢很多。<br />
发生了什么?为什么?如果<br />
你没有连接电极的电线,将<br />
会发生什么?假如你使用的<br />
是锌或电极而不是镁?这些<br />
和电能有什么关系?<br />
PH 试纸的颜色表明变色时存<br />
在酸或碱。酸是一种有苦味<br />
的物质。很多水果例如柠檬<br />
和橙子都含有酸。通常情况 Mg<br />
下强酸会腐蚀金属。碱和酸<br />
相对立。碱性物质也被成为<br />
碱基。碱能中和酸并产生盐<br />
。镁电极周围的紫色表明你<br />
在电极旁制造出了碱。最后<br />
碳电极旁会变成红色。那里<br />
的液体变成了酸性液体。<br />
如果不连接电极的电线,就<br />
不会产生任何反应。你能用<br />
其它电极制造出相似的反应<br />
C<br />
,但是可能溶液的碱性没有<br />
那么强,锌或铝电极周围的<br />
颜色会先是蓝色再是紫红色<br />
。<br />
从上面看控制台<br />
AA 干电池 两端贴在一起的 PH 试纸<br />
贴在干电池上的 2 条<br />
PH 试纸(浸湿)<br />
黄色溶液变成<br />
紫色<br />
生产了什么变化<br />
吗?<br />
实验 2. 指示纸<br />
装备:2 段 PH 纸。1.5 V AA 干电池。一小块聚苯乙烯。实验操作<br />
台<br />
把 PH 试纸条浸入盐水溶液里然后拿出来,浸湿了即可。<br />
注意看被浸湿的 PH 纸的颜色。<br />
把两条 PH 试纸各自的一端连在一起。把连在一起的试纸贴在 AA<br />
干电池的侧面,折试纸的两端来盖住干电池的上面和下面。<br />
把贴了 PH 试纸的干电池放进长方形容器(CR),即位于实验操<br />
作台顶部有点深的凹槽里。如图所示,用小块的聚苯乙烯把这套"<br />
组件"卡紧。<br />
用来卡紧干电池和<br />
PH 试纸的小块聚苯乙烯<br />
把纸浸湿,等待两至三小时(如有必要可以在纸上滴几滴盐水)。<br />
实验快结束时,你会看到干电池下面的纸变成了紫色(周围是蓝色<br />
),上面的变成了红色(周围是黄色)。为什么?<br />
这和实验 1 里产生的化学反应一样。<br />
穿过盐水的电流和盐产生了化学反应,改变了试纸的颜色。紫色是<br />
碱性,指示负极;红色是酸性,指示正极。负极电流起始于干电池<br />
的负极方向,红色指示电池的正极。电能流出的方向被成为极。<br />
实验 3. 电能传输<br />
装备:实验 1 的装备。铁或钢的钉子或螺丝。铜溶液。<br />
怎样准备铜溶液。你需要:<br />
- 实验操作台<br />
- 醋<br />
- 铜电极<br />
控制台有几个容器:2 根长试管、1 根短试管和 1 个长方形容器。<br />
我们已经使用了长试管和长方形容器。现在我们使用短试管。<br />
给短试管和长方形容器装醋,直到几乎满到边缘为止。把短试管里<br />
的一根铜电极立起来,并如图所示地在长方形容器中支撑起第二个<br />
铜电极。<br />
32<br />
提示:这个实验并不一定需要使用电极。铜币、铜线或其它小铜制<br />
品都可以,只要它是由铜制成而不是镀铜的铁即可。把混合物静置<br />
一晚或更长时间,不要动它。24 小时后,你就会看到混合物变成<br />
介于蓝色和绿色的一种颜色了。<br />
注意: 这种液体有毒,切勿让它接触到食物。<br />
这个实验需要一颗铁钉,最好是一颗铁或钢的螺丝。钉子或螺丝都<br />
要完全干净。如图所示把铜电极和铁螺丝放进有蓝色液体的长方形<br />
容器里。等待半小时,一天,一个星期,一百年... 你猜会发生什么<br />
?实际上发生了什么呢?<br />
铜电极<br />
蓝色液体<br />
铜电极<br />
醋<br />
铁钉或铁螺丝<br />
铁螺丝与铜电极在一起能组成一个电偶。能产生电能。铁螺丝的头<br />
变成棕色的铜粉"胡须"(这就是我们期待的)。每次都能形成更多<br />
粉末。<br />
(它是从哪里来的?)<br />
蓝色液体保持蓝色不变。(为什么?)原因很简单:<br />
铜从铜溶液中分离出来,附在了螺丝头上。这是由于铜/铁混合物<br />
产生了电能。这个现象会持续到铜散尽、水干枯或铜"胡须"碰到了<br />
铜电极为止。<br />
实验 4.数字电子时钟<br />
装备:实验操作台。LCD 时钟机芯。溶液(盐水、果汁或蔬菜汁<br />
)。<br />
如果你不小心把电线弄掉了,时钟就断开连接了。把电线穿过槽,<br />
小心地关上培养皿。必须一直关紧以免时钟被打湿。<br />
电线槽<br />
用你想要的任何天然能量来源准备"能量源"。什么组合能让时钟运<br />
行更长时间?在下表中记录你的总结(可参考示例):
e.g.:<br />
电极 材料 溶液 开始时间 日期 终止时间 日期<br />
铜和锌 柠檬 洗涤剂 08:00 h 1 月 12 日 11:46 h<br />
星期四<br />
用回形针或圆珠<br />
笔调整时间<br />
数字机芯的背面<br />
1 月 15 日<br />
星期天<br />
通过观察 LED 是否亮着来检查你是否有足够的电能。注意 LED 只<br />
在连接方向正确的情况下才能运行。这个规则也适用于时钟机芯。<br />
时钟亮起后,打开培养皿,你将会看到 LCD 时钟机芯的背面有两<br />
块小金属板。它们用来调整时间,就像 LCD 时钟或手镯表一样。<br />
从背面看 LCD 机芯。右边的触点是模式触点。按它就会显示模式<br />
。按它两次就会出现数字 12:A. 左边的触点用来调整时间,按模式<br />
触点,然后按调整触点来设定时间。<br />
最后,小心地关上培养皿的盖子。<br />
请记住:如果时钟停了,你就要重新调整它。<br />
用回形针或圆珠笔<br />
改变模式<br />
33<br />
实验 5. 柠檬灯或时钟<br />
装备:铝电极。黄铜电极。铜电极。锌电极。3 – 4 个柠檬。<br />
用不同类型的"灯"和时钟做实验。你可以制造出一盏示例里那样的<br />
柠檬灯。<br />
Zn<br />
Zn<br />
Cu<br />
Cu<br />
Zn<br />
Zn<br />
柠檬时钟<br />
Cu<br />
Brass<br />
Cu<br />
Brass<br />
这个实验和几乎所有其它实验一样,只有当电线和电极完好地连接<br />
时才能运行。如果有一根线没连好,LED 就不会亮。电线和电极必<br />
须保持非常干净。如果有需要,可以添加一个柠檬和一对电线。柠<br />
檬的水分必须充足。如有需要,就添加水。<br />
Al<br />
Al
1<br />
3<br />
2<br />
FLAMMABLE<br />
34<br />
33<br />
.<br />
.<br />
.<br />
4<br />
3<br />
7 6<br />
5.1<br />
1<br />
2<br />
3<br />
1<br />
2<br />
3<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
10<br />
11<br />
12<br />
(<br />
(<br />
(
Mg<br />
C<br />
Углеродный электрод<br />
35<br />
24<br />
2<br />
3<br />
.<br />
1<br />
1<br />
2<br />
2<br />
3<br />
1<br />
2
Zn<br />
Cu<br />
Zn<br />
Cu<br />
Brass<br />
Al<br />
36<br />
Zn<br />
Cu<br />
4<br />
3<br />
Zn<br />
08:00<br />
12<br />
Cu<br />
12 1<br />
Brass<br />
4<br />
11:46 15 1<br />
5<br />
Al
1<br />
2<br />
3<br />
FLAMMABLE<br />
37<br />
1.5<br />
6-7<br />
33<br />
1<br />
2<br />
3<br />
1<br />
2<br />
3<br />
(<br />
1<br />
2<br />
3<br />
4<br />
5<br />
6<br />
7<br />
8<br />
9<br />
10<br />
11<br />
12<br />
)
Mg<br />
C<br />
38<br />
1<br />
3<br />
24<br />
2<br />
1<br />
1<br />
1<br />
2<br />
3<br />
2<br />
2
Zn<br />
Cu<br />
Zn<br />
● (ES) Guardar esta información para futuras referencias. ● (EN) Please retain this information for future reference. ● (FR)<br />
Renseignements à conserver. ● (DE) Hebe alle Informationen für zukünftige Kommunikation auf. ● (IT) Istruzioni da conservare. ●<br />
(PT) Guarde esta informação para futuras referências. ● (RO) Păstraţi această informaţie pentru viitoare referinţe. ● (PL) Zatrzymać<br />
tę informację do późniejszego wglądu. ● (TR) Bu bilgileri, ileride ihtiyaç duyabileceğinizi göz önünde bulundurarak muhafaza ediniz. ●<br />
(EL) Κρατήστε αυτές τις πληροφορίες για μελλοντική χρήση. ● (RU) Сохраните эту информацию для последующих справок. ● (CN)<br />
把此说明保存好以备日后查阅。 ● (JP) 必要な時に読めるよう、この説明書は大切に保管して下さい。<br />
. ידיתע ןויעל הלא תוארוה רומשל שי (HE) ● .ﻞﺒﻘﺘﺴﻤﻟا ﻲﻓ ﻊﺟﺮﻤﻛ تﺎﻣﻮﻠﻌﻤﻟا هﺬﻫ ﻰﻠﻋ ﻆﻓﺎﺣ (AR) ●<br />
LEMON CLOCK<br />
ref: <strong>54023</strong>-130611<br />
Cu<br />
Brass<br />
Al<br />
39<br />
3-4<br />
Zn<br />
Cu<br />
Zn<br />
<strong>Imaginarium</strong>, S.A.<br />
Plataforma Logística<br />
PLA-ZA, C./ Osca, nº4<br />
50197 Zaragoza - España<br />
CIF A-50524727<br />
11:46<br />
08:00 12.1<br />
12<br />
Cu<br />
Brass<br />
4<br />
5<br />
15.1<br />
Al