54023 Lemon Clock Manual(v5) - Imaginarium
54023 Lemon Clock Manual(v5) - Imaginarium
54023 Lemon Clock Manual(v5) - Imaginarium
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Fülle eines der langen<br />
Reagenzgläser der<br />
Experimentenkonsole mit<br />
Salzwasser und lege drei<br />
Streifen PH-Papier hinein.<br />
Nimm das orangefarbene<br />
PH-Papier<br />
Papier:<br />
Wenn das Salzwasser von den drei Streifen gefärbt ist, nimm die<br />
Streifen heraus und wiederhole das Experiment 1 mit dieser<br />
farbigen Flüssigkeit.<br />
Führe die Magnesium- und Kohlenstoffelektroden in das lange<br />
Reagenzglas mit der gelben Flüssigkeit und schließe die beiden<br />
Elektrodenkabel an.<br />
Nach einigen Minuten wird die Lösung rund um die<br />
Magnesiumelektrode violett.<br />
Die Lösung unter der<br />
Kohlenstoffelektrode wechselt<br />
auch die Farbe, aber viel<br />
langsamer.<br />
Was geschieht? Warum? Was<br />
würde passieren, wenn du die<br />
Kabel nicht an die Elektroden<br />
anschließen würdest? Und was,<br />
wenn du Zink oder Elektroden<br />
benutzen würdest? Was hat das<br />
mit Elektrizität zu tun?<br />
Die Farbe des PH-Papiers zeigt<br />
mit dem Farbwechsel das<br />
Vorhandensein einer Säure<br />
oder Base an. Eine Säure ist ein<br />
bitterer Stoff. Viele Früchte<br />
enthalten Säuren,<br />
beispielsweise Zitronen und<br />
Apfelsinen. Eine starke Säure<br />
Mg<br />
C<br />
Mit Salzwasser<br />
gefülltes langes<br />
Reagenzglas<br />
PH-Papier<br />
Die gelbe<br />
Lösung wird<br />
violett<br />
Verändert sich<br />
etwas?<br />
zerfrisst normalerweise die Metalle. Eine Base ist das Gegenteil<br />
einer Säure. Basische Stoffe werden auch Alkali genannt. Eine<br />
Base neutralisiert eine Säure und bildet ein Salz. Die violette<br />
Farbe rund um die Magnesiumelektrode zeigt, dass du eine Base<br />
in der Nähe der Elektrode erzeugt hast. Zum Schluss entsteht<br />
eine rötliche Farbe nahe bei der Kohlenstoffelektrode. Dort wird<br />
die Flüssigkeit sauer.<br />
Wenn die Elektrodenkabel nicht angeschlossen werden, sieht es<br />
so aus, als würde gar nichts geschehen. Mit anderen Elektroden<br />
kannst du ähnliche Reaktionen hervorbringen. Aber es ist<br />
möglich, dass eine Lösung weniger basisch wird und die Farbe<br />
um die Zink- oder Aluminiumelektrode sich erst blau färbt, bevor<br />
sie violett wird.<br />
Experiment 2. Das Indikatorpapier<br />
Material: 2 Stück PH-Papier. 1,5 AA V Batterie. Ein kleines Stück<br />
Polystyrol.Konsole für Experimente<br />
Steck die PH-Papierstreifen nur zum Anfeuchten in die<br />
Salzwasserlösung.<br />
Sieh dir die Farbe des feuchten PH-Papiers genau an.<br />
Lege die beiden PH-Papierstreifen an einer Seite übereinander.<br />
Leg die Streifen um die Seite der AA Batterie und falte die beiden<br />
Enden so, dass sie die Ober- und Unterseite der Batterie<br />
bedecken.<br />
Leg die Batterie mit den PH-Papierstücken in das rechteckige<br />
Fach (CR), die flache Öffnung des Oberteils der<br />
Experimentenkonsole. Befestige diesen Aufbau mit dem kleinen<br />
Stück Polystyrol, wie es auf der Abbildung gezeigt wird.<br />
Warte zwei bis drei Stunden und halte das Papier feucht<br />
(eventuell musst du das Papier mit ein paar Tropfen Salzwasser<br />
besprenkeln).<br />
Zum Ende des Experiments siehst du, dass das Papier an der<br />
Unterseite der Batterie violett wird (von Blau umgeben) und die<br />
11<br />
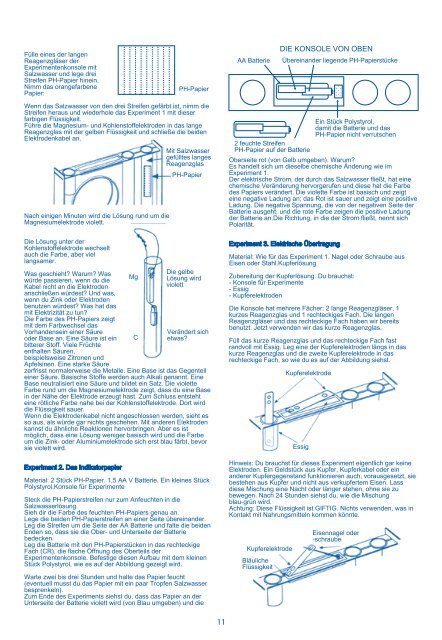
DIE KONSOLE VON OBEN<br />
AA Batterie Übereinander liegende PH-Papierstücke<br />
Ein Stück Polystyrol,<br />
damit die Batterie und das<br />
PH-Papier nicht verrutschen<br />
2 feuchte Streifen<br />
PH-Papier auf der Batterie<br />
Oberseite rot (von Gelb umgeben). Warum?<br />
Es handelt sich um dieselbe chemische Änderung wie im<br />
Experiment 1.<br />
Der elektrische Strom, der durch das Salzwasser fließt, hat eine<br />
chemische Veränderung hervorgerufen und diese hat die Farbe<br />
des Papiers verändert. Die violette Farbe ist basisch und zeigt<br />
eine negative Ladung an; das Rot ist sauer und zeigt eine positive<br />
Ladung. Die negative Spannung, die von der negativen Seite der<br />
Batterie ausgeht, und die rote Farbe zeigen die positive Ladung<br />
der Batterie an.Die Richtung, in die der Strom fließt, nennt sich<br />
Polarität.<br />
Experiment 3. Elektrische Übertragung<br />
Material: Wie für das Experiment 1. Nagel oder Schraube aus<br />
Eisen oder Stahl.Kupferlösung<br />
Zubereitung der Kupferlösung. Du brauchst:<br />
- Konsole für Experimente<br />
- Essig<br />
- Kupferelektroden<br />
Die Konsole hat mehrere Fächer: 2 lange Reagenzgläser, 1<br />
kurzes Reagenzglas und 1 rechteckiges Fach. Die langen<br />
Reagenzgläser und das rechteckige Fach haben wir bereits<br />
benutzt. Jetzt verwenden wir das kurze Reagenzglas.<br />
Füll das kurze Reagenzglas und das rechteckige Fach fast<br />
randvoll mit Essig. Leg eine der Kupferelektroden längs in das<br />
kurze Reagenzglas und die zweite Kupferelektrode in das<br />
rechteckige Fach, so wie du es auf der Abbildung siehst.<br />
Hinweis: Du brauchst für dieses Experiment eigentlich gar keine<br />
Elektroden. Ein Geldstück aus Kupfer, Kupferkabel oder ein<br />
anderer Kupfergegenstand funktionieren auch, vorausgesetzt, sie<br />
bestehen aus Kupfer und nicht aus verkupfertem Eisen. Lass<br />
diese Mischung eine Nacht oder länger stehen, ohne sie zu<br />
bewegen. Nach 24 Stunden siehst du, wie die Mischung<br />
blau-grün wird.<br />
Achtung: Diese Flüssigkeit ist GIFTIG. Nichts verwenden, was in<br />
Kontakt mit Nahrungsmitteln kommen könnte.<br />
Kupferelektrode<br />
Bläuliche<br />
Flüssigkeit<br />
Kupferelektrode<br />
Essig<br />
Eisennagel oder<br />
-schraube