Fest/Flüssig-Phasengleichgewicht binärer Systeme
Fest/Flüssig-Phasengleichgewicht binärer Systeme
Fest/Flüssig-Phasengleichgewicht binärer Systeme
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 1<br />
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong><br />
In diesem Experiment geht es um das Gleichgewicht zwischen festen und flüssigen Phasen in<br />
einem Zwei-Komponenten-System. Je nach Stoffmengenverhältnissen (Molenbruch) handelt<br />
es sich dabei um die Temperaturabhängigkeit der Löslichkeit fester Stoffe in einem Lösemittel<br />
(bei gesättigten Lösungen) oder um die Konzentrationsabhängigkeit des Gefrierpunkts der<br />
Lösung (bei nicht gesättigten Lösungen.<br />
Stichworte<br />
Phasendiagramm, thermodynamische Freiheitsgrade, Gibbssche Phasenregel, Eutektikum,<br />
Gefrierpunktserniedrigung, kolligative Eigenschaften, Löslichkeit, Sättigung, Gleichgewicht,<br />
Entropie, freie Gibbssche Enthalpie, chemisches Potential<br />
Theoretischer Teil<br />
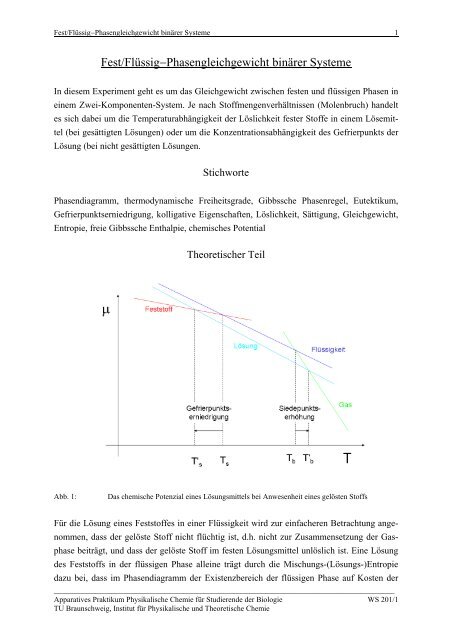
Abb. 1: Das chemische Potenzial eines Lösungsmittels bei Anwesenheit eines gelösten Stoffs<br />
Für die Lösung eines <strong>Fest</strong>stoffes in einer <strong>Flüssig</strong>keit wird zur einfacheren Betrachtung angenommen,<br />
dass der gelöste Stoff nicht flüchtig ist, d.h. nicht zur Zusammensetzung der Gasphase<br />
beiträgt, und dass der gelöste Stoff im festen Lösungsmittel unlöslich ist. Eine Lösung<br />
des <strong>Fest</strong>stoffs in der flüssigen Phase alleine trägt durch die Mischungs-(Lösungs-)Entropie<br />
dazu bei, dass im Phasendiagramm der Existenzbereich der flüssigen Phase auf Kosten der<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 2<br />
gasförmigen und der festen Phase zunimmt: Es kommt, aus rein entropischen Gründen, zur<br />
Siedepunktserhöhung und zur Gefrierpunktserniedrigung (s. Abb. 1).<br />
Beide hier untersuchte Phänomene - die Gefrierpunktserniedrigung und die Temperaturabhängigkeit<br />
der Löslichkeit - werden durch ein Schmelzdiagramm mit Eutektikum beschrieben,<br />
wie es schematisch in Abbildung 2 für ein Lösemittel A und einen gelösten <strong>Fest</strong>stoff B<br />
dargestellt ist. Dabei wurde vereinfachend angenommen, dass die Komponenten im flüssigen<br />
Zustand (d.h. für T > TB) vollkommen mischbar sind.<br />
TA und TB bezeichnen die Schmelzpunkte der reinen Stoffe. E ist der eutektische Punkt mit<br />
der eutektischen Temperatur TE und der Zusammensetzung xE. Der linke Ast der Schmelzpunktskurve<br />
(TA-E) ist die Gefrierpunktskurve des Lösemittels. Hier befinden sich die Lösung<br />
und die reine feste Phase des Lösungsmittels im Gleichgewicht. Der rechte Ast der<br />
Schmelzpunktskurve (E-TB) ist die Löslichkeitskurve des gelösten Stoffs. Hier befinden die<br />
Lösung und der reine <strong>Fest</strong>stoff B im Gleichgewicht. Oberhalb der Schmelzpunktskurve (L)<br />
liegt nur eine Phase, die flüssige Lösung, vor, während unterhalb der Schmelzpunktskurve das<br />
Zweiphasengebiet C liegt, in dem kein thermodynamisches Gleichgewicht herrscht. Dort liegen<br />
entweder Lösung und festes (gefrorenes) Lösemittel (C1), gesättigte Lösung und <strong>Fest</strong>stoff<br />
(C2) oder reines, festes (gefrorenes) Lösemittel und reiner <strong>Fest</strong>stoff (C3) nebeneinander vor.<br />
Am eutektischen Punkt E liegen drei Phasen im Gleichgewicht vor: das reine feste Lösemittel,<br />
der reine <strong>Fest</strong>stoff und die flüssige Lösung mit dem Molenbruch xE. Durch Vertauschung<br />
der Achsen (T ↔ x) und Umrechnung des Molenbruchs x auf das Massenverhältnis w erhält<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 3<br />
man oberhalb der eutektischen Temperatur TE aus dem oben abgebildeten Schmelzdiagramm<br />
die nachfolgend dargestellten Löslichkeitskurven von Salzen:<br />
Abb. 3: Temperaturabhängigkeit der Löslichkeit einiger Salze<br />
Löslichkeitsgleichgewicht<br />
Die Temperaturabhängigkeit der Sättigungskonzentration xB des gelösten Stoffes B ist - unter<br />
den nachfolgend aufgeführten Voraussetzungen: ideal verdünnte Lösungen, Temperaturunabhängigkeit<br />
von Schmelzwärme und Schmelzentropie - mit seiner molaren Schmelzwärme<br />
(heat of fusion) ΔHB,m verknüpft:<br />
ΔH<br />
Bm , ⎛ 1 1 ⎞<br />
− ⎜ − ⎟<br />
R T T0⎠<br />
xB( T) = xB( T0) ⋅e ⎝<br />
bzw.<br />
ΔH<br />
Bm ,<br />
ln x B =− + const<br />
RT<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie<br />
(1a)<br />
(1b)
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 4<br />
Gefrierpunktserniedrigung<br />
Da das Phänomen der Gefrierpunktserniedrigung eine kolligative Eigenschaft des gelösten<br />
Stoffes ist, d.h. nur von der Molalität yB der gelösten Teilchen B im Lösemittel A und nicht<br />
von der Art der Teilchen B abhängt, kann es zur Molmassenbestimmung herangezogen werden:<br />
Die Masse mB der eingewogenen Substanz B wird durch eine Wägung, die Teilchenzahl<br />
durch die Gefrierpunktserniedrigung ΔT bestimmt.<br />
ΔT = KKyB (2)<br />
KK wird als kryoskopische Konstante bezeichnet. Sie ist spezifisch ausschließlich für das Lösungsmittel,<br />
nicht für den gelösten Stoff. Da die Stoffmenge nB durch das Verhältnis der Masse<br />
mB zur Molmasse MB gegeben ist, ergibt sich für den Zusammenhang zwischen Molmasse<br />
MB und Gefrierpunktserniedrigung ΔT:<br />
m K<br />
M<br />
m T<br />
B K<br />
B = ⋅ (3)<br />
A Δ<br />
Ausführung und Auswertung der Messung<br />
1) Bestimmen Sie die Temperaturabhängigkeit der Sättigungskonzentration von Benzoesäure<br />
zwischen 30 °C und 65 °C in 5°-Intervallen und berechnen Sie daraus die molare<br />
Schmelzwärme von Benzoesäure.<br />
2) Bestimmen Sie die Molmasse eines unbekannten, in Wasser löslichen organischen<br />
Stoffes durch Messung seiner Gefrierpunktserniedrigung.<br />
Schmelzwärmebestimmung von Benzoesäure<br />
Zur Schmelzwärmebestimmung von Benzoesäure benötigen Sie gesättigte Benzoesäurelösungen.<br />
Erwärmen Sie dazu je 250 ml der vorbereiteten, bei Raumtemperatur gesättigter Benzoesäurelösung)<br />
in 2 Bechergläsern. Achten Sie darauf, dass genügend feste Benzoesäure vorhanden<br />
ist, um Sättigung auch bei hohen Temperaturen sicherzustellen. Nach Erwärmen und<br />
Umrühren setzen Sie die Bechergläser in ein thermostatisiertes Wasserbad, dessen Temperatur<br />
kleiner als die der Lösung ist und im Bereich der höchsten Messtemperatur liegen soll.<br />
Nach etwa 20 Minuten hat sich die zur Temperatur des Thermostaten gehörige Sättigungskonzentration<br />
eingestellt. Zur Konzentrationsbestimmung entnehmen Sie 20 ml Lösung mit<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 5<br />
einer Vollpipette, an deren Spitze ein Glasrohr mit einer Glasfritte angesetzt wird, und titrieren<br />
Sie mit 0.1 n NaOH gegen Phenolphthalein. Die Glasfritte verhindert das Einsaugen kristalliner<br />
Benzoesäure. Entnehmen Sie zwei weitere Proben nach jeweils einigen Minuten und<br />
bilden Sie den Mittelwert. Messen Sie in gleicher Weise die Sättigungskonzentrationen für<br />
die übrigen, tieferen Temperaturen. In der Pipette auskristallisierte Benzoesäure überführen<br />
Sie<br />
in das Titrationsgefäß, indem Sie die Pipette mit heißem dest. Wasser ausspülen.<br />
Tragen Sie den Logarithmus der gemessenen Sättigungskonzentrationen gegen l/T auf und<br />
legen Sie mittels linearer Regression eine Ausgleichsgerade durch die acht Messpunkte.<br />
Aus<br />
der<br />
Steigung ergibt sich die gesuchte molare Schmelzwärme gemäß Gl. (1b).<br />
Molmassenbestimmung<br />
Zur Molmassenbestimmung verwenden Sie die in Abb. 4 dargestellte Apparatur. Der Versuchsaufbau<br />
besteht aus einem zweiteiligen Versuchsgefäß und einem Kühlthermostaten. Der<br />
Einsatz A dient zur Aufnahme der Probe (Lösungsmittel bzw. Lösung) sowie eines Pt100-<br />
Widerstandsthermometers. Ein Magnetrührer sorgt für eine gute Durchmischung der Lösung.<br />
Ein Messverstärker erzeugt ein Spannungssignal, das dem Widerstand proportional ist und<br />
von einem Digital-Multimeter registriert wird. Der Messverstärker ist so konfiguriert, dass er<br />
Temperaturen im hier interessierenden Bereich zwischen ca. −10 ºC und + 10 ºC in eine<br />
Gleichspannung von 0 V bis 5 V umwandelt. Das Programm Digiscop überträgt die im Multimeter<br />
digitalisierten Daten an den Computer, stellt die Messwerte als Temperaturverlaufs-<br />
kurve<br />
in Echtzeit dar und speichert die Daten im ASCII-(Text-)Format.<br />
Zur Auswertung müssen Sie die vom Computer aufgezeichneten Spannungswerte in Temperaturwerte<br />
umrechnen. Führen Sie dazu eine Kalibrier-Messreihe durch, bei der Sie (mindestens)<br />
drei verschiedene (konstante) Temperaturen sowohl mit einem Thermometer als auch<br />
mit dem Pt100-Widerstand messen und die mit dem Thermometer gemessenen Temperaturwerte<br />
T mit den aufgezeichneten Spannungswerten U vergleichen. Sie können die Kalibriermessungen<br />
zu einem beliebigen Zeitpunkt vornehmen - vor, nach oder während der eigentlichen<br />
Messungen. Temperieren Sie entweder Wasser durch unterschiedliche Zugabe von Eis<br />
oder verwenden Sie den Kältethermostaten, der den Kühlmantel C versorgt. Achten Sie in<br />
jedem Fall auf konstante und homogene Temperatur im System (Geduld!), damit der Pt100-<br />
Widerstand und das Thermometer dieselbe Temperatur messen. Legen Sie durch die Messpunkte<br />
eine Ausgleichsgerade T(U), mittels derer Sie die anschließend aufgenommenen Temperatur-Zeit-Kurven<br />
auswerten. Geben Sie die Geradengleichung für T(U) explizit an und<br />
bestimmen Sie den Fehler für den Umrechnungsfaktor von Spannung in Temperatur aus der<br />
linearen Regressionsanalyse.<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 6<br />
Widerstands-<br />
Thermometer<br />
Abb. 4: Apparatur zur Messung der Gefrierpunktserniedrigung<br />
Nehmen Sie zweimal die Temperatur-Zeit-Kurve des Abkühlvorganges auf. . Die Temperatur-Zeit-Kurve<br />
wird etwa den in Abbildung 5 dargestellten Verlauf zeigen. Bestimmen Sie<br />
daraus die Lage des Gefrierpunktes T0 von Wasser als reinem Lösungsmittel. Nehmen Sie<br />
dann Abkühlkurven mit mB = 0.5, 1.0 und 1.5 g Einwaage auf. Lösen Sie dazu die abgewogenen<br />
Mengen mB in bekannten Mengen mA reinen Wassers und kühlen Sie die Lösung vor.<br />
Füllen Sie dann die Lösung in den Einsatz A und nehmen die Abkühlkurve der Lösung auf,<br />
die einen ähnlichen Verlauf wie in Abbildung 5 zeigen sollte.<br />
Während die Temperatur des zweiphasigen Lösungsmittels (Wasser/Eis) während des gesamten<br />
Gefriervorgangs streng konstant bleibt, sollte sich die zweiphasige Lösung (Eis und Lösung)<br />
weiter abkühlen, bis das Eutektikum erreicht ist. Der Grund ist der zusätzliche thermodynamische<br />
Freiheitsgrad des zweikomponentigen Systems. Allerdings ist dieser Unterschied<br />
wegen der geringen Kühlleistung des Praktikumsaufbaus experimentell nicht beobachtbar.<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie
<strong>Fest</strong>/<strong>Flüssig</strong>−<strong>Phasengleichgewicht</strong> <strong>binärer</strong> <strong>Systeme</strong> 7<br />
Abb. 5: Abkühlkurve des Lösemittels (schwarz) und der Lösung (rot)<br />
Tritt keine Unterkühlung auf, so scheidet sich bei der Temperatur T das feste Lösungsmittel<br />
ab. In der Regel sind jedoch erhebliche Unterkühlungen, in der Skizze bis zur Temperatur T'',<br />
zu beobachten. Arbeiten Sie zur Bestimmung der Gefrierpunktserniedrigung ΔT näherungsweise<br />
mit der Temperatur T', die sich unmittelbar nach Aufheben der Unterkühlung einstellt:<br />
ΔT = T0 − T'. Der steile Temperaturanstieg um ΔTU = T' − T'' ist eine Folge der durch das<br />
Ausfrieren einer gewissen Menge ΔmA des Lösungsmittels freiwerdenden Gitterenergie<br />
ΔmAΔHA. Dabei ist ΔHA die spezifische Schmelzwärme des Lösungsmittels. Bei starker Unterkühlung<br />
bedarf deshalb die Größe mA noch einer Korrektur, die die bei der Aufhebung der<br />
Unterkühlung abgeschiedene Menge ΔmA des festen Lösungsmittels berücksichtigt. ΔmA erhält<br />
man aus der Energiebilanz:<br />
(mA + mB) cL ΔTU = ΔmA ΔHA.<br />
Dabei ist cL die spezifische Wärme der Lösung. Nimmt man an, dass cL in etwa gleich der<br />
spezifischen Wärme c des Lösungsmittels ist, so lässt sich die Größe ΔmA berechnen und zur<br />
Korrektur von mA in der Weise mA' = mA - ΔmA verwenden.<br />
Verwenden Sie den korrigierten Wert mA' an Stelle von mA in ΔT = KK yB, um die Molmasse<br />
MB des unbekannten Stoffes nach Gleichung (9) zu bestimmen. Die Zahlenwerte c, ΔHA und<br />
KK für Wasser entnehmen Sie der Literatur oder Tabellenwerken. Geben Sie die benutzten<br />
Werte sowie die Quelle bei der Auswertung an. Vergleichen Sie Ihren Wert für MB mit dem<br />
tatsächlichen Wert. Wie groß ist die relative Abweichung ?<br />
_________________________________________________________________________________________<br />
Apparatives Praktikum Physikalische Chemie für Studierende der Biologie WS 201/1<br />
TU Braunschweig, Institut für Physikalische und Theoretische Chemie