Funktionale Zelllinien durch neue ... - BIOspektrum
Funktionale Zelllinien durch neue ... - BIOspektrum
Funktionale Zelllinien durch neue ... - BIOspektrum
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
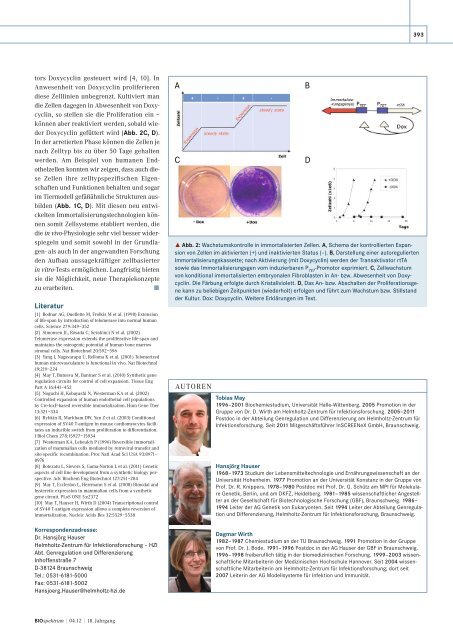
tors Doxycyclin gesteuert wird [4, 10]. In<br />
Anwesenheit von Doxycyclin proliferieren<br />
diese <strong>Zelllinien</strong> unbegrenzt. Kultiviert man<br />
die Zellen dagegen in Abwesenheit von Doxycyclin,<br />
so stellen sie die Proliferation ein –<br />
können aber reaktiviert werden, sobald wieder<br />
Doxycyclin gefüttert wird (Abb. 2C, D).<br />
In der arretierten Phase können die Zellen je<br />
nach Zelltyp bis zu über 50 Tage gehalten<br />
werden. Am Beispiel von humanen Endothelzellen<br />
konnten wir zeigen, dass auch diese<br />
Zellen ihre zelltypspezifischen Eigenschaften<br />
und Funktionen behalten und sogar<br />
im Tiermodell gefäßähnliche Strukturen ausbilden<br />
(Abb. 1C, D). Mit diesen neu entwickelten<br />
Immortalisierungstechnologien können<br />
somit Zellsysteme etabliert werden, die<br />
die in vivo-Physiologie sehr viel besser widerspiegeln<br />
und somit sowohl in der Grundlagen-<br />
als auch in der angewandten Forschung<br />
den Aufbau aussagekräftiger zellbasierter<br />
in vitro-Tests ermöglichen. Langfristig bieten<br />
sie die Möglichkeit, <strong>neue</strong> Therapiekonzepte<br />
zu erarbeiten. ó<br />
Literatur<br />
[1] Bodnar AG, Ouellette M, Frolkis M et al. (1998) Extension<br />
of life-span by introduction of telomerase into normal human<br />
cells. Science 279:349–352<br />
[2] Simonsen JL, Rosada C, Serakinci N et al. (2002)<br />
Telomerase expression extends the proliferative life-span and<br />
maintains the osteogenic potential of human bone marrow<br />
stromal cells. Nat Biotechnol 20:592–596<br />
[3] Yang J, Nagavarapu U, Relloma K et al. (2001) Telomerized<br />
human microvasculature is functional in vivo. Nat Biotechnol<br />
19:219–224<br />
[4] May T, Butueva M, Bantner S et al. (2010) Synthetic gene<br />
regulation circuits for control of cell expansion. Tissue Eng<br />
Part A 16:441–452<br />
[5] Noguchi H, Kobayashi N, Westerman KA et al. (2002)<br />
Controlled expansion of human endothelial cell populations<br />
by Cre-loxP-based reversible immortalization. Hum Gene Ther<br />
13:321–334<br />
[6] Rybkin II, Markham DW, Yan Z et al. (2003) Conditional<br />
expression of SV40 T-antigen in mouse cardiomyocytes facilitates<br />
an inducible switch from proliferation to differentiation.<br />
J Biol Chem 278:15927–15934<br />
[7] Westerman KA, Leboulch P (1996) Reversible immortalization<br />
of mammalian cells mediated by retroviral transfer and<br />
site-specific recombination. Proc Natl Acad Sci USA 93:8971–<br />
8976<br />
[8] Botezatu L, Sievers S, Gama-Norton L et al. (2011) Genetic<br />
aspects of cell line development from a synthetic biology perspective.<br />
Adv Biochem Eng Biotechnol 127:251–284<br />
[9] May T, Eccleston L, Herrmann S et al. (2008) Bimodal and<br />
hysteretic expression in mammalian cells from a synthetic<br />
gene circuit. PLoS ONE 3:e2372<br />
[10] May T, Hauser H, Wirth D (2004) Transcriptional control<br />
of SV40 T-antigen expression allows a complete reversion of<br />
immortalization. Nucleic Acids Res 32:5529–5538<br />
Korrespondenzadresse:<br />
Dr. Hansjörg Hauser<br />
Helmholtz-Zentrum für Infektionsforschung – HZI<br />
Abt. Genregulation und Differenzierung<br />
Inhoffenstraße 7<br />
D-38124 Braunschweig<br />
Tel.: 0531-6181-5000<br />
Fax: 0531-6181-5002<br />
Hansjoerg.Hauser@helmholtz-hzi.de<br />
<strong>BIOspektrum</strong> | 04.12 | 18. Jahrgang<br />
A<br />
C<br />
˚ Abb. 2: Wachstumskontrolle in immortalisierten Zellen. A, Schema der kontrollierten Expansion<br />
von Zellen im aktivierten (+) und inaktivierten Status (–). B, Darstellung einer autoregulierten<br />
Immortalisierungskassette; nach Aktivierung (mit Doxycyclin) werden der Transaktivator rtTA<br />
sowie das Immortalisierungsgen vom induzierbaren P TET -Promotor exprimiert. C, Zellwachstum<br />
von konditional immortalisierten embryonalen Fibroblasten in An- bzw. Abwesenheit von Doxy -<br />
cyclin. Die Färbung erfolgte <strong>durch</strong> Kristallviolett. D, Das An- bzw. Abschalten der Proliferationsgene<br />
kann zu beliebigen Zeitpunkten (wiederholt) erfolgen und führt zum Wachstum bzw. Stillstand<br />
der Kultur. Dox: Doxycyclin. Weitere Erklärungen im Text.<br />
AUTOREN<br />
B<br />
D<br />
Tobias May<br />
1996–2001 Biochemiestudium, Universität Halle-Wittenberg. 2005 Promotion in der<br />
Gruppe von Dr. D. Wirth am Helmholtz-Zentrum für Infektionsforschung. 2005–2011<br />
Postdoc in der Abteilung Genregulation und Differenzierung am Helmholtz-Zentrum für<br />
Infektionsforschung. Seit 2011 Mitgeschäftsführer InSCREENeX GmbH, Braunschweig.<br />
393<br />
Hansjörg Hauser<br />
1968–1973 Studium der Lebensmitteltechnologie und Ernährungswissenschaft an der<br />
Universität Hohenheim. 1977 Promotion an der Universität Konstanz in der Gruppe von<br />
Prof. Dr. R. Knippers. 1978–1980 Postdoc mit Prof. Dr. G. Schütz am MPI für Molekulare<br />
Genetik, Berlin, und am DKFZ, Heidelberg. 1981–1985 wissenschaftlicher Angestellter<br />
an der Gesellschaft für Biotechnologische Forschung (GBF), Braunschweig. 1986–<br />
1994 Leiter der AG Genetik von Eukaryonten. Seit 1994 Leiter der Abteilung Genregulation<br />
und Differenzierung, Helmholtz-Zentrum für Infektionsforschung, Braunschweig.<br />
Dagmar Wirth<br />
1982–1987 Chemiestudium an der TU Braunschweig. 1991 Promotion in der Gruppe<br />
von Prof. Dr. J. Bode. 1991–1996 Postdoc in der AG Hauser der GBF in Braunschweig.<br />
1996–1998 freiberuflich tätig in der biomedizinischen Forschung. 1999–2003 wissenschaftliche<br />
Mitarbeiterin der Medizinischen Hochschule Hannover. Seit 2004 wissenschaftliche<br />
Mitarbeiterin am Helmholtz-Zentrum für Infektionsforschung; dort seit<br />
2007 Leiterin der AG Modellsysteme für Infektion und Immunität.