MO-Schema O
MO-Schema O
MO-Schema O
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
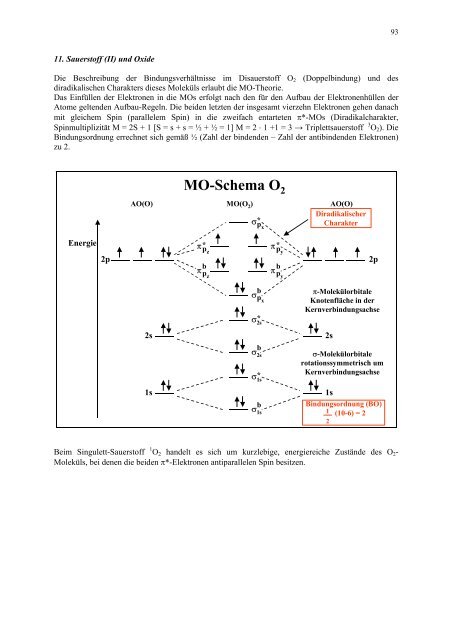
11. Sauerstoff (II) und Oxide<br />
Die Beschreibung der Bindungsverhältnisse im Disauerstoff O2 (Doppelbindung) und des<br />
diradikalischen Charakters dieses Moleküls erlaubt die <strong>MO</strong>-Theorie.<br />
Das Einfüllen der Elektronen in die <strong>MO</strong>s erfolgt nach den für den Aufbau der Elektronenhüllen der<br />
Atome geltenden Aufbau-Regeln. Die beiden letzten der insgesamt vierzehn Elektronen gehen danach<br />
mit gleichem Spin (parallelem Spin) in die zweifach entarteten π*-<strong>MO</strong>s (Diradikalcharakter,<br />
Spinmultiplizität M = 2S + 1 [S = s + s = ½ + ½ = 1] M = 2 ⋅ 1 +1 = 3 → Triplettsauerstoff 3 O2). Die<br />
Bindungsordnung errechnet sich gemäß ½ (Zahl der bindenden – Zahl der antibindenden Elektronen)<br />
zu 2.<br />
Energie<br />
2p<br />
2s<br />
1s<br />
<strong>MO</strong>-<strong>Schema</strong> O 2<br />
AO(O) <strong>MO</strong>(O2 ) AO(O)<br />
Diradikalischer<br />
σ*<br />
px<br />
Charakter<br />
π* pz<br />
π b p z<br />
σ b p x<br />
σ* 2s<br />
b<br />
σ2s σ* 1s<br />
b<br />
σ1s π* py<br />
π b p y<br />
2s<br />
2p<br />
π-Molekülorbitale<br />
Knotenfläche in der<br />
Kernverbindungsachse<br />
σ-Molekülorbitale<br />
rotationssymmetrisch um<br />
Kernverbindungsachse<br />
1s<br />
Bindungsordnung (BO)<br />
1 (10-6) = 2<br />
Beim Singulett-Sauerstoff 1 O2 handelt es sich um kurzlebige, energiereiche Zustände des O2-<br />
Moleküls, bei denen die beiden π*-Elektronen antiparallelen Spin besitzen.<br />
2<br />
93
Elektronenanordnungen und Energieniveaus von Singulett- und Triplett-Sauerstoff:<br />
155 kJ/mol<br />
92 kJ/mol<br />
π * 2. angeregter Zustand<br />
(Lebensdauer < 10 -9 s)<br />
π * 1. angeregter Zustand<br />
(Lebensdauer < 10 -4 s)<br />
π * Grundzustand<br />
Singulett-Sauerstoff 1 O 2<br />
Triplett-Sauerstoff 3 O 2<br />
Singulett-Sauerstoff ist diamagnetisch. Er ist reaktionsfähiger als Triplett-Sauerstoff, ein<br />
wirkungsvolles Oxidationsmittel und er wird besonders in der organischen Chemie für selektive<br />
Oxidationen benutzt. Er kann photochemisch oder chemisch erzeugt werden.<br />
Chemisch entsteht er z. B. durch Abspaltung von O2 aus Verbindungen, die Peroxogruppen enthalten.<br />
Versuch: Umsetzung von H2O2 mit ClO -<br />
+ ClO<br />
H O O H Cl O O H<br />
-<br />
- OH -<br />
schnell<br />
- HCl<br />
Die freiwerdende Energie bei der Umwandlung von 1 O2 in 3 O2 wird als Lichtenergie abgegeben. Man<br />
beobachtet ein rotes Leuchten. Aus zwei 1 O2-Molekülen entstehen durch Elektronenaustausch ohne<br />
Spinumkehr zwei 3 O2-Moleküle.<br />
1O2 (↑↓) + 1 O2 (↑↓) 3 O2 (↑↑) + 3 O2 (↓↓) ∆H = -184 kJ/mol<br />
Dabei wird eine Lichtquant mit der Wellenlänge λ = 633 (orangerot) abgestrahlt.<br />
1 O2<br />
94
Der grüne Blattfarbstoff Chlorophyll liefert bei der Photosynthese Sauerstoff im elektronischen<br />
Grundzustand, Triplettsauerstoff. Zugleich wirkt das Chlorophyll als Photosensibilisator, der einen<br />
Übergang vom Triplettzustand in den ersten angeregten Singulettzustand bewirkt. Dieser<br />
Singulettsauerstoff aber vermag Chlorophyll oxidativ zu zerstören. Die Zellen der Pflanzen enthalten<br />
daher auch das gelbrote β-Carotin, das als Quencher den gebildeten Singulettsauerstoff permanent<br />
wieder deaktiviert. Im Herbst stellen die grünen Pflanzen jedoch ihre β-Carotin-Synthese ein, so dass<br />
nun das Blattgrün oxidativ zerstört wird. Die sonst vom Chlorophyll überdeckten anderen<br />
Blattpigmente wie Carotinoide und Xanthophylle treten nun zu Tage und bewirken die prächtige<br />
Färbung des herbstlichen Laubes.<br />
Das <strong>MO</strong>-<strong>Schema</strong> auf S. 93 zeigt, dass man Elektronen entfernen oder hinzufügen kann. Man kommt<br />
so zu den folgenden Teilchen.<br />
O2 +<br />
Bezeichnung<br />
Bindungsordnung O-O-Abstand [pm] Beispiele<br />
Dioxigenyl 2,5 112 O2[PtF6]<br />
O2 Dioxigen 2,0 121<br />
O2 -<br />
O2<br />
Hyperoxid 1,5 133 RbO2<br />
2-<br />
Peroxid 1,0 149 Na2O2, H2O2<br />
Fügt man mehr als drei Elektronen ein, so kommt es zum Bruch der O-O-Bindung; man erhält Oxide<br />
mit dem Ion O 2- (z. B. Li2O).<br />
Wasserstoffperoxid (H2O2)<br />
Vorkommen<br />
H2O2 wird in Oberflächenwasser, Grundwasser oder in der Atmosphäre unter Einwirkung von Licht<br />
und/oder katalytisch wirkenden Substanzen wie Mineralien oder Metallen aus Sauerstoff über<br />
radikalische Reaktionsmechanismen gebildet. Die natürliche Konzentration von H2O2 in Meerwasser<br />
liegt zwischen 0,5 und 14µg/l, in Süßwasser zwischen 1-30 µg/l. In der Luft variieren die Werte in<br />
einem Bereich von 0,1-1 ppb. Alle aerob lebenden Zellen, von photosynthetisierenden Pflanzen zu<br />
sauerstoffatmenden Lebewesen enthalten H2O2, das kontinuierlich im Stoffwechselprozess aus<br />
Sauerstoff gebildet wird. Da es in höheren Konzentrationen aber als Zellgift wirkt, hat die Natur<br />
Schutzmechanismen in Form von H2O2-zersetzenden Enzymen (Katalasen) entwickelt, die eine<br />
Spaltung in Wasser und Sauerstoff bewirken. Die menschliche Atemluft enthält<br />
300-1000 µg/H2O2/m 3 . Auch organische Peroxide kommen in der Natur vor. Beispiele sind Ascaridol,<br />
Quinghaosu und das Prostagladinperoxid (s. Abb.). Als Kuriosität sei noch angemerkt, dass der<br />
Bombardierkäfer in einer Art Blase im Hinterleib H2O2 in einer Konzentration von bis zu 28,5 %<br />
erzeugen kann, um damit seine Feinde abzuwehren.<br />
95
1) Natürlich vorkommende<br />
organische Peroxide<br />
O COOH<br />
O<br />
H3C<br />
OOH<br />
Prostaglandinperoxid<br />
H3C<br />
O O<br />
O<br />
O<br />
O<br />
Quinghaosu<br />
O O CH3<br />
H3C CH3<br />
Ascaridol<br />
CH3<br />
2) Bombardierkäfer<br />
H2O2 ist eine sirupöse, fast farblose, in dicker Schicht bläuliche Flüssigkeit (Sdp. 150°C, Smp –0,4°C).<br />
Im Handel kommt eine 30%-ige Lösung (Perhydrol).<br />
H 2O 2 hat die Konstitutionsformel H O O H.<br />
Die O–O-Bindung ist schwach. H2O2 ist daher eine metastabile Verbindung. Es zeigt ein starkes<br />
Bestreben, unter großer Wärmeentwicklung in Wasser und Sauerstoff zu zerfallen.<br />
2H2O2 2H2O + O2 ∆H = - 196,2 kJ/mol<br />
Bei Zimmertemperatur ist die Zerfallgeschwindigkeit allerdings unmessbar klein, so dass H2O2 sowohl<br />
in reinem wie in gelöstem Zustande praktisch beständig (metastabil) ist. Durch Katalysatoren<br />
(Schwermetallionen, Fe 3+ , Cu 2+ , MnO2; Pt, alkalisch reagierende Stoffe) wird die<br />
Zersetzungsgeschwindigkeit des Wasserstoffperoxids stark erhöht. Da es bei Lagerung, Transport und<br />
Handhabung von H2O2 zu Kontamination mit Zersetzungskatalysatoren kommen kann, werden<br />
geringe Mengen (ca. 100-1000 ppm) an Stabilisatoren zugesetzt. Stabilisatoren sind z. B.<br />
Chelatbildner (Phosphate), die Metallionen komplexieren und somit die Zersetzungsreaktion hemmen.<br />
96
Struktur des H2O2-Moleküls:<br />
Die vier Atome des H2O2-Moleküls bilden eine verdrillte Kette. Durch die Verdrillung wird die<br />
Abstoßung der freien Elektronenpaare der Sauerstoffatome verringert. Die noch vorhandene<br />
Abstoßung ist die Ursache für die geringe Bindungsenergie der O–O-Bindung.<br />
Die charakteristische Eigenschaft des Wasserstoffperoxids ist seine oxidierende Wirkung. Weniger<br />
ausgeprägt ist die reduzierende Wirkung, die nur gegenüber ausgesprochenen Oxidationsmitteln<br />
auftritt.<br />
Versuche:<br />
a) als Oxidationsmittel<br />
I - + 2H + -I -I 0 -II<br />
+ H<br />
1<br />
2O2 I2 + 2H<br />
2<br />
2O<br />
b) als Reduktionsmittel<br />
Nachweis durch Iod-Stärke Reaktion (blau)<br />
-<br />
2MnO4 + 5H2O2 + 6H + Mn 2+ +VII -I +II 0<br />
+ 5O2 + 8H2O violett farblos Glimmspanprobe<br />
Nachweis: Mit Titanylsulfat entsteht unter Gelbfärbung Peroxotitanylsulfat<br />
TiO(SO4) + H2O2 + H2SO4 TiO2(HSO4)2 + H2O<br />
gelb<br />
Darstellung im Labor:<br />
H2O2 ist eine schwache Säure, deren Salze die Peroxide, schon durch Wasser praktisch vollständig zu<br />
Wasserstoffperoxid und Metallhydroxid hydrolysiert werden.<br />
BaO2 + H2SO4 BaSO4 + H2O2<br />
Bariumperoxid<br />
97
Großtechnische Herstellung nach dem Anthrachinon-Autoxidationsprozess (AO-Verfahren):<br />
Wasserstoff (H2) und Sauerstoff (O2) sind die beiden Ausgangsstoffe bei der großtechnischen<br />
Herstellung von H2O2 nach dem AO-Verfahren. Als O2-Quelle verwendet man Luft. H2 fällt als<br />
Nebenprodukt bei verschiedenen chemischen Prozessen oder bei der Erdölraffination an bzw. wird<br />
gezielt vor Ort aus Erdgas in einer Spaltgasanlage erzeugt.<br />
Das Verfahren geht aus von alkylierten Hydrochinonen, die durch Sauerstoff zu den entsprechenden<br />
Chinonen oxidiert werden. Dabei wird quantitativ Wasserstoffperoxid gebildet. Das Chinon kann mit<br />
Wasserstoff und einem Katlaysator (z. B. Palladiummohr) wieder in das Edukt überführt werden.<br />
Neben dem eigentlichen Reaktionsträger braucht man ein geeignetes Lösungsmittelsystem, um die<br />
Reaktanten homogen in Lösung zu halten.<br />
Herstellung von Wasserstoffperoxid<br />
OH<br />
OH<br />
R<br />
+ O 2; - H 2O 2<br />
+ H 2 (Pd)<br />
2-Alkyl-anthrahydrochinon 2-Alkyl-anthrachinon<br />
O<br />
O<br />
R<br />
98
Verwendung:<br />
Ein Großteil des H2O2 wird für die Herstellung von Perboraten und Persalzen und für organischchemische<br />
Synthesen eingesetzt. Fast 70 % finden wegen der Oxidationswirkung Verwendung in den<br />
Bereichen Bleichen und Umwelt. Das stärkste Verbrauchswachstum gab es in den letzten 20 Jahren in<br />
der Papier- und Zellstoffindustrie, wo chlorhaltige Bleichchemikalien (Chlor, Chlordioxid) sukzessive<br />
durch H2O2 ersetzt werden. Im Hinblick auf den Umweltschutz ist H2O2 ein ideales Oxidationsmittel,<br />
da es keine belastenden Nebenprodukte bildet. Überschüssiges H2O2 zerfällt schnell in Wasser und<br />
Sauerstoff.<br />
99














![Fluorapatit Ca [F/(PO ) ]](https://img.yumpu.com/20735277/1/184x260/fluorapatit-ca-f-po-.jpg?quality=85)