A) Organometall-Verbindungen: Struktur, Synthese, Reaktionen
A) Organometall-Verbindungen: Struktur, Synthese, Reaktionen
A) Organometall-Verbindungen: Struktur, Synthese, Reaktionen
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Training zur Chemie-Olympiade, Prof. Bernd Goldfuß, Univ. Köln, www.uni-koeln.de/goldfuss, 09. 05. 2009<br />
A) <strong>Organometall</strong>-<strong>Verbindungen</strong>: <strong>Struktur</strong>, <strong>Synthese</strong>, <strong>Reaktionen</strong><br />
Vier Grund-Reaktionstypen der Organischen Chemie<br />
a) Substitution (S): a + b-c → a-b + c<br />
b) Addition (Add): a + b-c → a-b-c<br />
c) Eliminierung (El): a-b-c → a-b + c<br />
d) Umlagerung (U): a-b-c → a-c-b<br />
a, b, c:<br />
Atome oder<br />
Gruppen<br />
in Molekülen<br />
Drei Grund-Reaktionsmechanismen der Organischen Chemie<br />
- radikalisch z.B. radikalische Substitution (S R<br />
)<br />
- polar z.B. elektrophile aromatische Substitution (S Ar<br />
El)<br />
- pericyclisch z.B. Diels-Alder-Cycloaddition ([4+2]-CycloAdd.)<br />
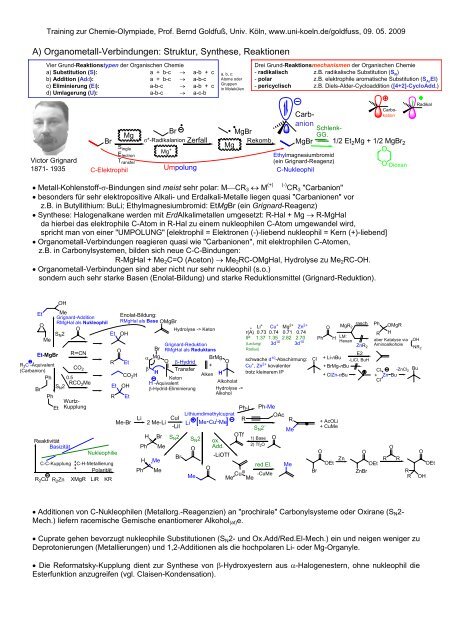
Victor Grignard<br />
1871- 1935<br />
Mg + Br<br />
Carbokation<br />
Carbanion<br />
Schlenk-<br />
GG.<br />
MgBr<br />
MgBr<br />
Mg<br />
Br<br />
σ*-Radikalanion Zerfall Rekomb. 1/2 Et<br />
S ingle<br />
Mg<br />
2 Mg + 1/2 MgBr 2<br />
O<br />
E lectron<br />
Ethylmagnesiumbromid<br />
T ransfer (ein Grignard-Reagenz)<br />
O Dioxan<br />
C-Elektrophil Umpolung<br />
C-Nukleophil<br />
Radikal<br />
• Metall-Kohlenstoff-σ-Bindungen sind meist sehr polar: M⎯CR 3 ↔ M (+) (-) CR 3 "Carbanion"<br />
• besonders für sehr elektropositive Alkali- und Erdalkali-Metalle liegen quasi "Carbanionen" vor<br />
z.B. in Butyllithium: BuLi; Ethylmagnesiumbromid: EtMgBr (ein Grignard-Reagenz)<br />
• <strong>Synthese</strong>: Halogenalkane werden mit ErdAlkalimetallen umgesetzt: R-Hal + Mg → R-MgHal<br />
da hierbei das elektrophile C-Atom in R-Hal zu einem nukleophilen C-Atom umgewandel wird,<br />
spricht man von einer "UMPOLUNG" [elektrophil = Elektronen (-)-liebend nukleophil = Kern (+)-liebend]<br />
• <strong>Organometall</strong>-<strong>Verbindungen</strong> reagieren quasi wie "Carbanionen", mit elektrophilen C-Atomen,<br />
z.B. in Carbonylsystemen, bilden sich neue C-C-Bindungen:<br />
R-MgHal + Me 2 C=O (Aceton) → Me 2 RC-OMgHal, Hydrolyse zu Me 2 RC-OH.<br />
• <strong>Organometall</strong>-<strong>Verbindungen</strong> sind aber nicht nur sehr nukleophil (s.o.)<br />
sondern auch sehr starke Basen (Enolat-Bildung) und starke Reduktionsmittel (Grignard-Reduktion).<br />
OH<br />
Et Me<br />
Grignard-Addition Enolat-Bildung:<br />
RMgHal als Nukleophil RMgHal als Base OMgBr<br />
O<br />
O<br />
Hydrolyse -> Keton<br />
S N 2<br />
Et OH<br />
Me<br />
Grignard-Reduktion<br />
O<br />
RMgHal als Reduktans<br />
Et-MgBr<br />
R CN<br />
R 3 C -Äquivalent<br />
CO<br />
(Carbanion)<br />
2<br />
Ph 0.5<br />
RCO 2 Me<br />
S<br />
Br N 2<br />
Ph<br />
Wurtz-<br />
Et Kupplung<br />
Reaktivität<br />
Basizität<br />
C-C-Kupplung<br />
R<br />
Et<br />
R<br />
Nukleophilie<br />
C-H-Metallierung<br />
Polarität<br />
R 2 Cu R 2 Zn XMgR LiR KR<br />
Et<br />
CO 2 H<br />
OH<br />
Et<br />
Me-Br<br />
α<br />
β<br />
Br<br />
Mg<br />
H<br />
O<br />
β-Hydrid<br />
Transfer<br />
Keton<br />
H -Äquivalent<br />
β-Hydrid-Eliminierung<br />
BrMg O<br />
+<br />
Alken H<br />
Alkoholat<br />
Hydrolyse -><br />
Alkohol<br />
Li + Cu + Mg 2+ Zn<br />
°<br />
2+<br />
r(A) 0.73 0.74 0.71 0.74<br />
IP 1.37 1.35 2.82 2.70<br />
(Ladung/ 3d 10 3d 10<br />
Radius)<br />
schwache d 10 -Abschirmung:<br />
Cu + , Zn 2+ kovalenter<br />
trotz kleinerem IP<br />
Ph-I Ph-Me<br />
Lithiumdimethylcuprat<br />
OAc<br />
Li<br />
CuI<br />
2 Me-Li Li Me Cu I R<br />
Me<br />
R<br />
-LiI<br />
S N 2´ Me<br />
H Br S<br />
OTf<br />
N 2 S 1) Base<br />
N 2<br />
O<br />
ox.<br />
2) Tf<br />
Ph Me 2 O<br />
O<br />
Add.<br />
Br<br />
-LiOTf<br />
H Me<br />
red.El. Me<br />
Ph Me<br />
O<br />
Me CuIII -CuMe<br />
Me<br />
Me<br />
O MgR<br />
rasch 2<br />
Ph H LM:<br />
Hexan<br />
ZnR 2<br />
E2<br />
Cl + Li-nBu<br />
-LiCl, BuH<br />
+ BrMg-nBu<br />
+ ClZn-nBu<br />
Br<br />
+ AcOLi<br />
+ CuMe<br />
O<br />
OEt<br />
Zn<br />
O<br />
OEt<br />
ZnBr<br />
Ph OMgR<br />
R H<br />
aber Katalyse via<br />
Aminoalkohole<br />
Cl<br />
+ Zn<br />
Cl<br />
R<br />
OH<br />
NR 2<br />
-ZnCl 2<br />
Bu<br />
Bu<br />
O<br />
R<br />
R<br />
R<br />
O<br />
OH<br />
OEt<br />
• Additionen von C-Nukleophilen (Metallorg.-Reagenzien) an "prochirale" Carbonylsysteme oder Oxirane (S N 2-<br />
Mech.) liefern racemische Gemische enantiomerer Alkohol (at) e.<br />
• Cuprate gehen bevorzugt nukleophile Substitutionen (S N 2- und Ox.Add/Red.El-Mech.) ein und neigen weniger zu<br />
Deprotonierungen (Metallierungen) und 1,2-Additionen als die hochpolaren Li- oder Mg-Organyle.<br />
• Die Reformatsky-Kupplung dient zur <strong>Synthese</strong> von β-Hydroxyestern aus α-Halogenestern, ohne nukleophil die<br />
Esterfunktion anzugreifen (vgl. Claisen-Kondensation).
Training zur Chemie-Olympiade, Prof. Bernd Goldfuß, Univ. Köln, www.uni-koeln.de/goldfuss, 09. 05. 2009<br />
B) Aufgaben<br />
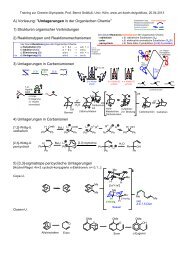
1) Zeichen Sie Lewis-<strong>Struktur</strong>en und erklären Sie welche "Carbanionen"-Äquivalente folgende<br />
<strong>Organometall</strong>-<strong>Verbindungen</strong> besitzen:<br />
n-Butyllithium Methyllithium Ethylmagnesiumbromid<br />
2) Formulieren Sie die <strong>Synthese</strong>n folgender Metallorganyle mit Reaktionsgleichungen<br />
n-Butyllithium:<br />
Methyllithium:<br />
Ethylmagnesiumbromid:<br />
Isopropylzinkchlorid<br />
Lithiumdimethylcuprat<br />
3) Methyllithium reagiert mit Acetaldehyd (Ethanal) als Nukleophil unter C-C-Kupplung, aber<br />
auch als Base unter "Deprotonierung". Formulieren Sie beide <strong>Reaktionen</strong>.<br />
als Nukleophil:<br />
als Base:<br />
4) n-Butyllithium reagiert mit dem Oxiran Cyclohexenoxid als Nukleophil unter C-C-Kupplung,<br />
formulieren Sie:<br />
als Nukleophil:<br />
5) Ethylmagnesiumbromid reagiert mit Ethylacetat als Nukleophil unter C-C-Kupplung, aber<br />
auch als Base unter "Deprotonierung". Formulieren Sie beide <strong>Reaktionen</strong>.<br />
als Nukleophil:<br />
als Base:
Training zur Chemie-Olympiade, Prof. Bernd Goldfuß, Univ. Köln, www.uni-koeln.de/goldfuss, 09. 05. 2009<br />
C) Lösungen<br />
1) Zeichen Sie Lewis-<strong>Struktur</strong>en und erklären Sie welche "Carbanionen"-Äquivalente folgende <strong>Organometall</strong>-<strong>Verbindungen</strong><br />
besitzen:<br />
Li H 3 C-Li<br />
MgBr<br />
n-Butyllithium Methyllithium<br />
Ethylmagnesiumbromid<br />
darin: Butyl-Anion Methyl-Anion Ethyl-Anion<br />
2) Formulieren Sie die <strong>Synthese</strong>n folgender Metallorganyle mit Reaktionsgleichungen<br />
n-Butyllithium: n-Bu-Br + 2 Li Metall → LiBr + n-BuLi<br />
Methyllithium: Me-Br + 2 Li Metall → LiBr + MeLi<br />
Ethylmagnesiumbromid (ein Grignard-Reagenz): Et-Br + Mg Metall → Et-MgBr<br />
Isopropylzinkchlorid: iso-Pr-Cl + Zn Metall → iso-Pr-ZnCl<br />
Lithiumdimethylcuprat: 2 LiMe + CuCl → Li[Me-Cu-Me] + LiCl<br />
3) Methyllithium reagiert mit Acetaldehyd (Ethanal) als Nukleophil unter C-C-Kupplung, aber auch als Base unter<br />
"Deprotonierung". Formulieren Sie beide <strong>Reaktionen</strong>.<br />
H 3 C-Li +<br />
Methyllithium<br />
H 3 C<br />
O<br />
H<br />
H 3 C<br />
O<br />
Acetaldehyd<br />
ist ein C-Elektrophil<br />
und ist α-CH 3 acide<br />
H<br />
als Nu<br />
als Base<br />
H 3 C O<br />
Li<br />
H CH 3<br />
CH 4 +<br />
H 2 C<br />
H 2 O<br />
-LiOH<br />
O<br />
H H 2 C<br />
OH<br />
Isopropanol<br />
O<br />
Li<br />
H<br />
ein Enolat<br />
4) n-Butyllithium reagiert mit dem Oxiran Cyclohexenoxid als Nukleophil unter C-C-Kupplung, formulieren Sie:<br />
Li<br />
n-Butyllithium<br />
+<br />
O<br />
als Nu<br />
Bu<br />
O<br />
Li<br />
H 2 O<br />
-LiOH<br />
Bu<br />
OH<br />
5) Ethylmagnesiumbromid reagiert mit Ethylacetat als Nukleophil unter C-C-Kupplung, aber auch als Base unter<br />
"Deprotonierung". Formulieren Sie beide <strong>Reaktionen</strong>.<br />
EtMgBr<br />
+<br />
ein Grignard-<br />
Reagenz<br />
H 3 C<br />
O<br />
OEt<br />
H 3 C<br />
O<br />
Ethylacetat<br />
(Essigsäureethylester)<br />
ist ein C-Elektrophil<br />
und ist α-CH 3 acide<br />
OEt<br />
als Nu<br />
Add.<br />
als Base<br />
H 3 C<br />
O<br />
EtO Et<br />
C 2 H 6 +<br />
MgBr<br />
H 2 C<br />
-BrMgOEt<br />
O<br />
OEt<br />
H 2 C<br />
ein Ester-Enolat<br />
O<br />
O<br />
Ethylmethylketon<br />
OEt<br />
Folge-<br />
<strong>Reaktionen</strong><br />
MgHBr<br />
Folge-<br />
<strong>Reaktionen</strong>