Proteine
Proteine
Proteine
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
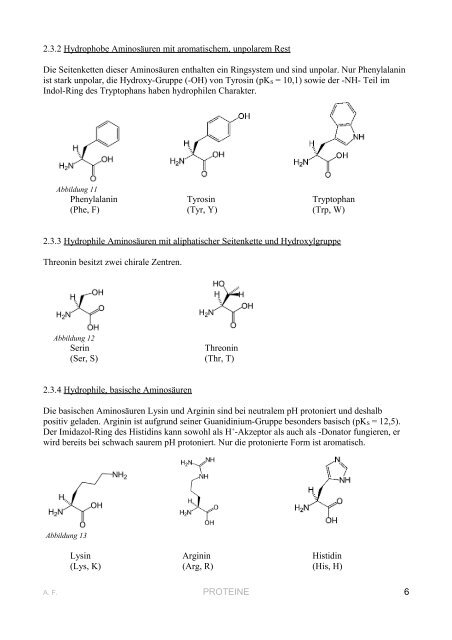
2.3.2 Hydrophobe Aminosäuren mit aromatischem, unpolarem Rest<br />
Die Seitenketten dieser Aminosäuren enthalten ein Ringsystem und sind unpolar. Nur Phenylalanin<br />
ist stark unpolar, die Hydroxy-Gruppe (-OH) von Tyrosin (pK S = 10,1) sowie der -NH- Teil im<br />
Indol-Ring des Tryptophans haben hydrophilen Charakter.<br />
Abbildung 11<br />
Phenylalanin Tyrosin Tryptophan<br />
(Phe, F) (Tyr, Y) (Trp, W)<br />
2.3.3 Hydrophile Aminosäuren mit aliphatischer Seitenkette und Hydroxylgruppe<br />
Threonin besitzt zwei chirale Zentren.<br />
Abbildung 12<br />
Serin<br />
Threonin<br />
(Ser, S) (Thr, T)<br />
2.3.4 Hydrophile, basische Aminosäuren<br />
Die basischen Aminosäuren Lysin und Arginin sind bei neutralem pH protoniert und deshalb<br />
positiv geladen. Arginin ist aufgrund seiner Guanidinium-Gruppe besonders basisch (pK S = 12,5).<br />
Der Imidazol-Ring des Histidins kann sowohl als H + -Akzeptor als auch als -Donator fungieren, er<br />
wird bereits bei schwach saurem pH protoniert. Nur die protonierte Form ist aromatisch.<br />
Abbildung 13<br />
Lysin Arginin Histidin<br />
(Lys, K) (Arg, R) (His, H)<br />
A. F. PROTEINE 6