Stun - Gymnasium Waldstraße
Stun - Gymnasium Waldstraße
Stun - Gymnasium Waldstraße
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
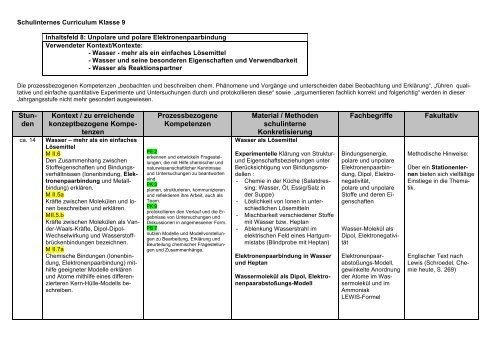
Schulinternes Curriculum Klasse 9<br />
Inhaltsfeld 8: Unpolare und polare Elektronenpaarbindung<br />
Verwendeter Kontext/Kontexte:<br />
- Wasser - mehr als ein einfaches Lösemittel<br />
- Wasser und seine besonderen Eigenschaften und Verwendbarkeit<br />
- Wasser als Reaktionspartner<br />
Die prozessbezogenen Kompetenzen „beobachten und beschreiben chem. Phänomene und Vorgänge und unterscheiden dabei Beobachtung und Erklärung“, „führen qualitative<br />
und einfache quantitative Experimente und Untersuchungen durch und protokollieren diese“ sowie „argumentieren fachlich korrekt und folgerichtig“ werden in dieser<br />
Jahrgangsstufe nicht mehr gesondert ausgewiesen.<br />
<strong>Stun</strong>den<br />
ca. 14<br />
Kontext / zu erreichende<br />
konzeptbezogene Kompetenzen<br />
Wasser – mehr als ein einfaches<br />
Lösemittel<br />
M II.6<br />
Den Zusammenhang zwischen<br />
Stoffeigenschaften und Bindungsverhältnissen<br />
(Ionenbindung, Elektronenpaarbindung<br />
und Metallbindung)<br />
erklären.<br />
M II.5a<br />
Kräfte zwischen Molekülen und Ionen<br />
beschreiben und erklären.<br />
MII.5.b<br />
Kräfte zwischen Molekülen als Vander-Waals-Kräfte,<br />
Dipol-Dipol-<br />
Wechselwirkung und Wasserstoffbrückenbindungen<br />
bezeichnen.<br />
M II.7a<br />
Chemische Bindungen (Ionenbindung,<br />
Elektronenpaarbindung) mithilfe<br />
geeigneter Modelle erklären<br />
und Atome mithilfe eines differenzierteren<br />
Kern-Hülle-Modells beschreiben.<br />
Prozessbezogene<br />
Kompetenzen<br />
PE 2<br />
erkennen und entwickeln Fragestellungen,<br />
die mit Hilfe chemischer und<br />
naturwissenschaftlicher Kenntnisse<br />
und Untersuchungen zu beantworten<br />
sind<br />
PK 3<br />
planen, strukturieren, kommunizieren<br />
und reflektieren ihre Arbeit, auch als<br />
Team.<br />
PK 9<br />
protokollieren den Verlauf und die Ergebnisse<br />
von Untersuchungen und<br />
Diskussionen in angemessener Form.<br />
PB 7<br />
nutzen Modelle und Modellvorstellungen<br />
zu Bearbeitung, Erklärung und<br />
Beurteilung chemischer Fragestellungen<br />
und Zusammenhänge.<br />
Material / Methoden<br />
schulinterne<br />
Konkretisierung<br />
Wasser als Lösemittel<br />
Experimentelle Klärung von Strukturund<br />
Eigenschaftsbeziehungen unter<br />
Berücksichtigung von Bindungsmodellen<br />
:<br />
- Chemie in der Küche (Salatdressing:<br />
Wasser, Öl, Essig/Salz in<br />
der Suppe)<br />
- Löslichkeit von Ionen in unterschiedlichen<br />
Lösemitteln<br />
- Mischbarkeit verschiedener Stoffe<br />
mit Wasser bzw. Heptan<br />
- Ablenkung Wasserstrahl im<br />
elektrischen Feld eines Hartgummistabs<br />
(Blindprobe mit Heptan)<br />
Elektronenpaarbindung in Wasser<br />
und Heptan<br />
Wassermolekül als Dipol, Elektronenpaarabstoßungs-Modell<br />
Fachbegriffe<br />
Bindungsenergie,<br />
polare und unpolare<br />
Elektronenpaarbindung,<br />
Dipol, Elektronegativität,<br />
polare und unpolare<br />
Stoffe und deren Eigenschaften<br />
Wasser-Molekül als<br />
Dipol, Elektronegativität<br />
Elektronenpaarabstoßungs-Modell,<br />
gewinkelte Anordnung<br />
der Atome im Wassermolekül<br />
und im<br />
Ammoniak<br />
LEWIS-Formel<br />
Fakultativ<br />
Methodische Hinweise:<br />
Über ein Stationenlernen<br />
bieten sich vielfältige<br />
Einstiege in die Thematik.<br />
Englischer Text nach<br />
Lewis (Schroedel, Chemie<br />
heute, S. 269)