Versuch 1.2.4
Versuch 1.2.4
Versuch 1.2.4
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
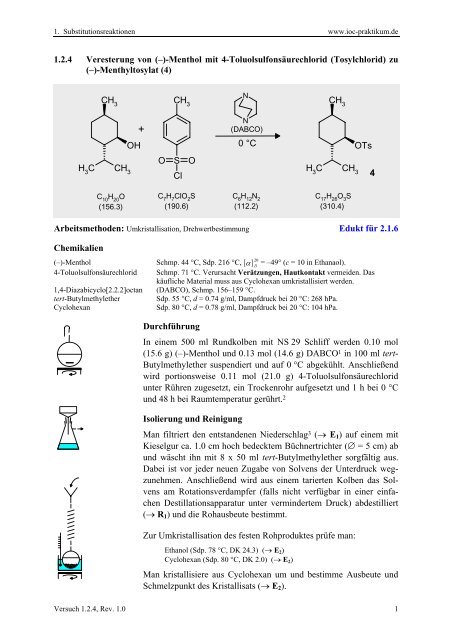
<strong>1.2.4</strong> Veresterung von (–)-Menthol mit 4-Toluolsulfonsäurechlorid (Tosylchlorid) zu<br />
(–)-Menthyltosylat (4)<br />
CH 3<br />
CH 3<br />
N<br />
+<br />
N<br />
(DABCO)<br />
CH 3<br />
OH<br />
0 °C<br />
OTs<br />
O S O<br />
H 3<br />
C CH 3<br />
H 3<br />
C CH 3<br />
Cl<br />
4<br />
C 10<br />
H 20<br />
O<br />
(156.3)<br />
C 7<br />
H 7<br />
ClO 2<br />
S<br />
(190.6)<br />
C 6<br />
H 12<br />
N 2<br />
(112.2)<br />
C 17<br />
H 26<br />
O 3<br />
S<br />
(310.4)<br />
Arbeitsmethoden: Umkristallisation, Drehwertbestimmung Edukt für 2.1.6<br />
Chemikalien<br />
(–)-Menthol<br />
20<br />
Schmp. 44 °C, Sdp. 216 °C, [ α ] D<br />
= –49° (c = 10 in Ethanaol).<br />
4-Toluolsulfonsäurechlorid Schmp. 71 °C. Verursacht Verätzungen, Hautkontakt vermeiden. Das<br />
käufliche Material muss aus Cyclohexan umkristallisiert werden.<br />
1,4-Diazabicyclo[2.2.2]octan (DABCO), Schmp. 156–159 °C.<br />
tert-Butylmethylether Sdp. 55 °C, d = 0.74 g/ml, Dampfdruck bei 20 °C: 268 hPa.<br />
Cyclohexan<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
In einem 500 ml Rundkolben mit NS 29 Schliff werden 0.10 mol<br />
(15.6 g) (–)-Menthol und 0.13 mol (14.6 g) DABCO 1 in 100 ml tert-<br />
Butylmethylether suspendiert und auf 0 °C abgekühlt. Anschließend<br />
wird portionsweise 0.11 mol (21.0 g) 4-Toluolsulfonsäurechlorid<br />
unter Rühren zugesetzt, ein Trockenrohr aufgesetzt und 1 h bei 0 °C<br />
und 48 h bei Raumtemperatur gerührt. 2<br />
Isolierung und Reinigung<br />
Man filtriert den entstandenen Niederschlag 3 (→ E 1 ) auf einem mit<br />
Kieselgur ca. 1.0 cm hoch bedecktem Büchnertrichter (∅ = 5 cm) ab<br />
und wäscht ihn mit 8 x 50 ml tert-Butylmethylether sorgfältig aus.<br />
Dabei ist vor jeder neuen Zugabe von Solvens der Unterdruck wegzunehmen.<br />
Anschließend wird aus einem tarierten Kolben das Solvens<br />
am Rotationsverdampfer (falls nicht verfügbar in einer einfachen<br />
Destillationsapparatur unter vermindertem Druck) abdestilliert<br />
(→ R 1 ) und die Rohausbeute bestimmt.<br />
Zur Umkristallisation des festen Rohproduktes prüfe man:<br />
Ethanol (Sdp. 78 °C, DK 24.3) (→ E 2 )<br />
Cyclohexan (Sdp. 80 °C, DK 2.0) (→ E 2 )<br />
Man kristallisiere aus Cyclohexan um und bestimme Ausbeute und<br />
Schmelzpunkt des Kristallisats (→ E 2 ).<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 1
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
Ausbeute an 4: 65–75%, Schmp. 93 °C. Das (–)-Menthyltosylat 4<br />
wird in <strong>Versuch</strong> 2.1.6 weiter umgesetzt.<br />
1 Welche Funktion hat die Substanz? Welches Reagens wirkt ähnlich?<br />
2 Weshalb benötigt die Reaktion so lange Zeit?<br />
3 Um welchen Feststoff handelt es sich?<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 :<br />
E 2 :<br />
R 1 :<br />
Filter und Rückstand → Entsorgung (Org. Feststoffe).<br />
Mutterlaugen → Entsorgung (RH).<br />
Abdestilliertes Lösungsmittel → Recycling (tert-Butylmethylether).<br />
Auswertung des <strong>Versuch</strong>s<br />
1 H-NMR-Spektrum von 4 (300 MHz, CDCl 3 ): δ = 0.52 (3 H), 0.82 (3 H), 0.87 (3 H), 0.73–1.05 (2 H), 1.16 (1<br />
H), 1.30–1.49 (2 H), 1.57–1.69 (2 H), 1.89 (1 H), 2.13 (1 H), 2.43 (3 H), 4.39 (1 H), 7.31 (2 H), 7.89 (2 H).<br />
4.4<br />
2.0<br />
1.5<br />
1.0<br />
8.0 6.0 4.0 2.0 [ppm] 0.0<br />
13 C-NMR-Spektrum (75.5 MHz, CDCl 3 ) von 4: δ = 15.3 (CH 3 ), 20.9 (CH 3 ), 21.6 (CH 3 ), 21.9 (CH 3 ), 23.0<br />
(CH 2 ), 25.5 (CH), 31.7 (CH), 33.8 (CH 2 ), 42.0 (CH 2 ), 47.6 (CH), 83.7 (CH), 127.7 (CH), 129.7 (CH), 134.9 (C),<br />
144.3 (C).<br />
LM<br />
160 140<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 2
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
IR-Spektrum von 4 (KBr):<br />
100<br />
T [%]<br />
50<br />
3055<br />
2865<br />
1450<br />
2960 2930<br />
1357<br />
1178<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
1597<br />
* Bestimmen Sie den Drehwert von 4 (Lit.: [ α ]<br />
20 D<br />
= −70° (c = 15 in CHCl 3 ) [2] ).<br />
* Formulieren Sie den zu 4 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
CH 3<br />
OTos<br />
H 3<br />
C<br />
H 3<br />
C<br />
H 3<br />
C<br />
A B C<br />
* Mit welchen spektroskopischen Daten und einfachen <strong>Versuch</strong>en lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Nach dieser Arbeitsvorschrift lassen sich primäre und sekundäre Alkohole umsetzen. Beim Umsatz kurzkettiger<br />
Alkohole entsteht in der Regel kein festes Produkt. In diesen Fällen müssen die ölig anfallenden Produkte im<br />
Ölpumpenvakuum aus einer Feststoffdestillationsapparatur destilliert werden.<br />
DABCO ersetzt das toxische Pyridin, das bisher bei diesen Reaktionen eingesetzt wurde. [1]<br />
[1] S. Hünig, J. Hartung, R. Kreuer, M. Schwarz, H. Wenner, Synthesis 1997, 1433–1438.<br />
[2] W. Hückel, C.-M. Jennewein, Liebigs. Ann. Chem. 1965, 683, 100–117.<br />
<strong>Versuch</strong> <strong>1.2.4</strong>, Rev. 1.0 3