Versuch 1.5.2
Versuch 1.5.2
Versuch 1.5.2
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
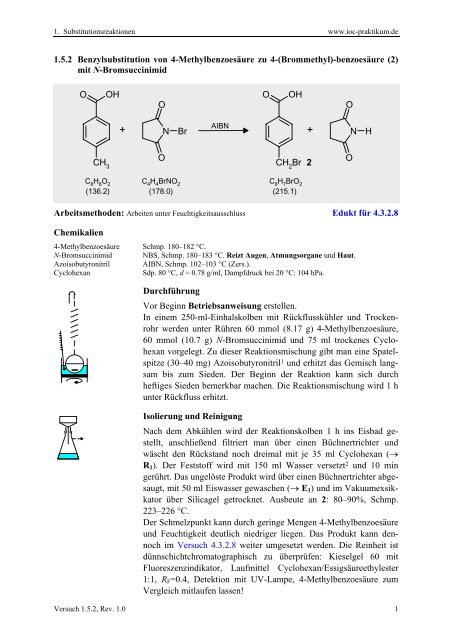
<strong>1.5.2</strong> Benzylsubstitution von 4-Methylbenzoesäure zu 4-(Brommethyl)-benzoesäure (2)<br />
mit N-Bromsuccinimid<br />
O<br />
CH 3<br />
OH<br />
+<br />
O<br />
O<br />
N<br />
Br<br />
AIBN<br />
O<br />
OH<br />
CH 2<br />
Br<br />
+<br />
2<br />
O<br />
O<br />
N<br />
H<br />
C 8<br />
H 8<br />
O 2<br />
(136.2)<br />
C 4<br />
H 4<br />
BrNO 2<br />
(178.0)<br />
C 8<br />
H 7<br />
BrO 2<br />
(215.1)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss Edukt für 4.3.2.8<br />
Chemikalien<br />
4-Methylbenzoesäure<br />
N-Bromsuccinimid<br />
Azoisobutyronitril<br />
Cyclohexan<br />
Schmp. 180–182 °C.<br />
NBS, Schmp. 180–183 °C. Reizt Augen, Atmungsorgane und Haut.<br />
AIBN, Schmp. 102–103 °C (Zers.).<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250-ml-Einhalskolben mit Rückflusskühler und Trockenrohr<br />
werden unter Rühren 60 mmol (8.17 g) 4-Methylbenzoesäure,<br />
60 mmol (10.7 g) N-Bromsuccinimid und 75 ml trockenes Cyclohexan<br />
vorgelegt. Zu dieser Reaktionsmischung gibt man eine Spatelspitze<br />
(30–40 mg) Azoisobutyronitril 1 und erhitzt das Gemisch langsam<br />
bis zum Sieden. Der Beginn der Reaktion kann sich durch<br />
heftiges Sieden bemerkbar machen. Die Reaktionsmischung wird 1 h<br />
unter Rückfluss erhitzt.<br />
Isolierung und Reinigung<br />
Nach dem Abkühlen wird der Reaktionskolben 1 h ins Eisbad gestellt,<br />
anschließend filtriert man über einen Büchnertrichter und<br />
wäscht den Rückstand noch dreimal mit je 35 ml Cyclohexan (→<br />
R 1 ). Der Feststoff wird mit 150 ml Wasser versetzt 2 und 10 min<br />
gerührt. Das ungelöste Produkt wird über einen Büchnertrichter abgesaugt,<br />
mit 50 ml Eiswasser gewaschen (→ E 1 ) und im Vakuumexsikkator<br />
über Silicagel getrocknet. Ausbeute an 2: 80–90%, Schmp.<br />
223–226 °C.<br />
Der Schmelzpunkt kann durch geringe Mengen 4-Methylbenzoesäure<br />
und Feuchtigkeit deutlich niedriger liegen. Das Produkt kann dennoch<br />
im <strong>Versuch</strong> 4.3.2.8 weiter umgesetzt werden. Die Reinheit ist<br />
dünnschichtchromatographisch zu überprüfen: Kieselgel 60 mit<br />
Fluoreszenzindikator, Laufmittel Cyclohexan/Essigsäureethylester<br />
1:1, R F =0.4, Detektion mit UV-Lampe, 4-Methylbenzoesäure zum<br />
Vergleich mitlaufen lassen!<br />
<strong>Versuch</strong> <strong>1.5.2</strong>, Rev. 1.0 1
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
1 Welche Funktion hat das Azoisobutyronitril? (Formel, Reaktion in siedendem Cyclohexan?)<br />
2 Was bewirkt diese Prozedur?<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
R 1 : Lösungsmittel mit Spuren organischer Verunreinigungen → Recycling (Cyclohexan).<br />
E 1 : Wässrige Lösung mit Spuren organischer Verbindungen → Entsorgung (H 2 O mit RHal/Halogenid).<br />
Auswertung des <strong>Versuch</strong>s<br />
1 H-NMR-Spektrum von 2 (300 MHz, DMSO-d 6 ): δ = 4.75 (2 H), 7.54 (2 H), 13.15 (1 H).<br />
x10<br />
14.0<br />
12.0<br />
LM<br />
9.0 8.0 7.0 6.0 5.0 4.0 3.0 2.0 [ppm] 0.0<br />
13 C-NMR-Spektrum (75.5 MHz, DMSO-d 6 ) von 2: δ = 33.29 (CH 2 ), 129.45 (CH), 129.68 (CH), 130.50 (C),<br />
142.86 (C), 166.85 (C).<br />
LM<br />
131 129<br />
180 160 140 120<br />
100 80<br />
60 40 20 [ppm] 0<br />
IR-Spektrum von 2 (KBr):<br />
100<br />
T [%]<br />
50<br />
3200 - 2400<br />
1680<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 2 führenden Reaktionsmechanismus.<br />
<strong>Versuch</strong> <strong>1.5.2</strong>, Rev. 1.0 2
1. Substitutionsreaktionen www.ioc-praktikum.de<br />
Weitere denkbare Reaktionsprodukte:<br />
HO O HO O HO O<br />
Br<br />
HO<br />
O<br />
Br<br />
CH 3<br />
CH 3<br />
Br<br />
H<br />
Br<br />
Br<br />
Br<br />
Br<br />
A B C D<br />
* Mit welchen spektroskopischen Daten und einfachen <strong>Versuch</strong>en lassen sich A – D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
N-Bromsuccinimid eignet sich generell zur radikalischen Substitution allylischer und benzylischer Wasserstoffatome.<br />
In letzterem Fall hat sich zur Aktivierung sichtbares Licht am besten bewährt. [1,2]<br />
[1] Sh. Futamura, Z.-M. Zong, Bull. Chem. Soc. Jpn. 1992, 65, 345–348.<br />
[2] J.G. Traynham, Y.-S. Lee, J. Am. Chem. Soc. 1974, 96, 3590–3594.<br />
<strong>Versuch</strong> <strong>1.5.2</strong>, Rev. 1.0 3