Lösung hier - PatrickReinke.de
Lösung hier - PatrickReinke.de
Lösung hier - PatrickReinke.de
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Anorganische Chemie Tutorium Übung 7: RedOx-Chemie 2<br />
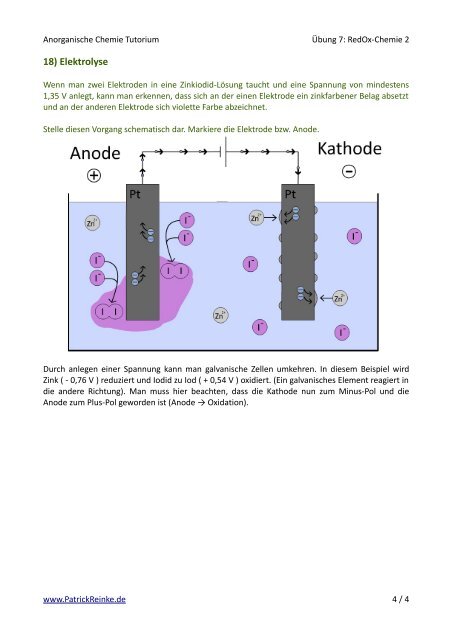
18) Elektrolyse<br />
Wenn man zwei Elektro<strong>de</strong>n in eine Zinkiodid-Lösung taucht und eine Spannung von min<strong>de</strong>stens<br />
1,35 V anlegt, kann man erkennen, dass sich an <strong>de</strong>r einen Elektro<strong>de</strong> ein zinkfarbener Belag absetzt<br />
und an <strong>de</strong>r an<strong>de</strong>ren Elektro<strong>de</strong> sich violette Farbe abzeichnet.<br />
Stelle diesen Vorgang schematisch dar. Markiere die Elektro<strong>de</strong> bzw. Ano<strong>de</strong>.<br />
Durch anlegen einer Spannung kann man galvanische Zellen umkehren. In diesem Beispiel wird<br />
Zink ( - 0,76 V ) reduziert und Iodid zu Iod ( + 0,54 V ) oxidiert. (Ein galvanisches Element reagiert in<br />
die an<strong>de</strong>re Richtung). Man muss <strong>hier</strong> beachten, dass die Katho<strong>de</strong> nun zum Minus-Pol und die<br />
Ano<strong>de</strong> zum Plus-Pol gewor<strong>de</strong>n ist (Ano<strong>de</strong> → Oxidation).<br />
www.<strong>PatrickReinke</strong>.<strong>de</strong> 4 / 4