Ãbersicht über verschiedene Eigenherstellungsverfahren von ...
Ãbersicht über verschiedene Eigenherstellungsverfahren von ...
Ãbersicht über verschiedene Eigenherstellungsverfahren von ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Übersicht über <strong>verschiedene</strong> <strong>Eigenherstellungsverfahren</strong> <strong>von</strong> Thrombozytenkonzentraten<br />
Einleitung<br />
<strong>von</strong> Dr. Dr. Gernot Weibrich, Philipp Streckbein, Thilo Weibrich, Mainz<br />
Derzeit sind auf dem deutschen Markt fünf <strong>verschiedene</strong> <strong>Eigenherstellungsverfahren</strong> für die Herstellung <strong>von</strong><br />
Thrombozytenkonzentraten durch den präprothetisch tätigen Chirurgen verfügbar. Aufgrund der<br />
<strong>verschiedene</strong>n Möglichkeiten der Herstellungstechnik wird dabei zwischen den weitgehend offenen und den<br />
halbgeschlossenen Verfahren unterschieden. Im Folgenden werden die <strong>verschiedene</strong>n Verfahren vorgestellt,<br />
der jeweilige Herstellungsprozess beschrieben und die Vor- sowie Nachteile der Systeme genannt.<br />
Bei der Gewinnung <strong>von</strong> Thrombozytenkonzentraten werden üblicherweise die Blutkomponenten mittels<br />
Zentrifugation entsprechend der Schwerkraft aufgetrennt. Oft geschieht dies mittels zweier unterschiedlich<br />
harter Zentrifugationsvorgänge.<br />
Nach der ersten Zentrifugation (soft spin) finden sich basal die Erythrozyten, darüber der so genannte "buffy<br />
coat" (mit vielen Leukozyten, ca. 25 Prozent der Thrombozyten) und darüber das plättchenreiche Plasma,<br />
welches die restlichen Thrombozyten enthält (nach der Nomenklatur der amerikanischen Blutbank das<br />
"eigentliche" PRP ¿ Platelet-rich Plasma) (Vengelen-Tylor V 1999).<br />
Bei der zweiten Zentrifugation (hard spin) des plättchenreichen Plasmas (für die Indikation<br />
Knochenoptimierung meist mit Buffy coat und 1 mm Erythrozytenschicht) werden die Thrombozyten vom<br />
Plasma abgetrennt und das plättchenarme Plasma (PPP ¿ Platelet-poor plasma) vom basal liegenden<br />
Thrombozytenpellet abgetrennt. Anschließend wird durch Vermischen des Thrombozytenpellets in einer<br />
geringen Menge PPP das Thrombozytenkonzentrat hergestellt.<br />
Als Bezeichnung für dieses Thrombozytenkonzentrat hat sich in der nationalen und internationalen<br />
zahnmedizinischen Literatur die medizinisch eigentlich inkorrekte Bezeichnung "Patelet-rich Plasma" - PRP<br />
eingebürgert.<br />
Bei der Herstellung <strong>von</strong> Thrombozytenkonzentraten zur Optimierung der Knochenregeneration werden meist<br />
auch die neu gebildeten Thrombozyten mit verwendet, die, wie Reeder und Mitarbeiter zeigen konnten, nach<br />
der ersten Zentrifugation im obersten Millimeter der Erythrozytenschicht enthalten sind (Reeder, G. et al.<br />
1993). Auch die Leukozyten im Buffy coat sollten nach Auffassung mehrerer Autoren nicht verworfen<br />
werden, um deren Wachstumsfaktorengehalte und immunologische Eigenschaften nicht zu verlieren.<br />
Derzeit sind <strong>verschiedene</strong> <strong>Eigenherstellungsverfahren</strong> für Thrombozytenkonzentrate (PRP) in Deutschland<br />
verfügbar, welche im Folgenden vorgestellt werden sollen.<br />
PRP-Kit<br />
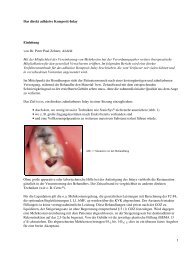
Die Fa. Curasan bietet seit Ende 1998 den PRP-Kit in Deutschland an. Damit war sie der erste Anbieter auf<br />
dem deutschen Markt, welcher ein Set zur Eigenherstellung <strong>von</strong> Platelet-rich Plasma kommerziell anbot<br />
(Abb. 1). Ergänzend wird <strong>von</strong> der Firma zur Herstellung <strong>von</strong> PRP mit dem PRP-Kit eine konventionelle<br />
Laborzentrifuge (Labofuge 300, Fa. Heraeus) vertrieben (Abb. 2).<br />
1
Abb. 1: Bestandteile des PRP-Kits (Fa. Curasan) im Einzelnen<br />
Abb. 2: Heraeus Labofuge 300<br />
Zur Herstellung <strong>von</strong> PRP werden 8,5 ml Zitratblut in einer herkömmlichen Laborzentrifuge für zehn Minuten<br />
bei 2.400 Umdrehungen pro Minute zentrifugiert. Es entsteht eine Auftrennung in Erythrozytenschicht, buffy<br />
coat und Thrombozyten enthaltendes Plasma. Anschließend wird das gelbe, die Thrombozyten enthaltende<br />
Plasma mit einer langen Kanüle unter gleichzeitiger Anwendung einer Lufteinlasskanüle mit Sterilfilter in<br />
eine weitere Monovette überführt. Um die Thrombozyten in einem Pellet zu konzentrieren, erfolgt in dieser<br />
Monovette ein zweiter Zentrifugationsschritt für 15 Minuten bei 3.600 Umdrehungen pro Minute.<br />
Der Plasmaüberstand, welcher jetzt nur noch sehr wenige Thrombozyten enthält, wird dann - ebenfalls<br />
wieder unter Verwendung einer langen Kanüle und einer Lufteinlasskanüle - auf etwa 0,3 bis 0,5 ml<br />
reduziert. Das entstandene Thrombozytenpellet wird anschließend mit Hilfe eines konventionellen<br />
Laborrüttlers in dem verbleibenden 0,3 bis 0,5 ml thrombozytenarmen Plasma resuspendiert, wodurch das<br />
Thrombozytenkonzentrat entsteht.<br />
Kritisch beurteilt werden muss die fragliche Zulassung <strong>von</strong> verwendeter Zentrifuge sowie eingesetzten<br />
Monovetten für therapeutische Zwecke. Auch birgt die Verwendung <strong>von</strong> 9 cm langen Kanülen "frei Hand"<br />
eine erhöhte Verletzungsgefahr für Anwender.<br />
Der Vacutainer PRP-Kit<br />
Der Friadent-Schütze-PRP-Kit besteht aus den gleichen Materialien wie der PRP-Kit <strong>von</strong> Curasan, es besteht<br />
jedoch zusätzlich die Alternative, statt der <strong>von</strong> Curasan favorisierten Sarstedt Monovetten so genannte<br />
Vacutainer (silikonisierte Glasröhrchen) zu verwenden, welche die unerwünschte Thrombozytenanhaftung an<br />
die Monovettenwand reduzieren sollen. Die Vorgehensweise zur PRP-Herstellung ist ebenfalls analog.<br />
Ergänzend wird auch <strong>von</strong> Friadent-Schütze zur Herstellung <strong>von</strong> PRP mit dem PRP-Kit eine konventio−nelle<br />
Laborzentrifuge angeboten.<br />
2
Platelet Concentrate Collection System<br />
Das Platelet Concentrate Collection System (PCCS, Fa. 3i - Implant Innovations Incorporated) war das<br />
zweite in Deutschland verfügbare System zur Eigenherstellung <strong>von</strong> PRP durch den Chirurgen. Es ist ein<br />
halbgeschlossenes Verfahren und für therapeutische PRP-Herstellung entwickelt und zugelassen.<br />
Zur Herstellung <strong>von</strong> PRP liefert die Fa. 3i ® ein Set zum Einmalgebrauch (Abb. 3). Dieses beinhaltet als<br />
wesentliche Bestandteile eine Einwegvorrichtung zur Herstellung <strong>von</strong> Thrombozytenkonzentrat (PRP),<br />
bestehend aus zwei flexiblen Plastik-Doppelbeuteln, die an der Unterseite einer Kunststoffplatte befestigt<br />
sind. Die vier dazugehörenden Einfüll- bzw. Entnahmeventile der einzelnen Beutelabschnitte befinden sich<br />
auf der Oberseite der Platte. Ergänzend wird <strong>von</strong> 3i ® eine Zentrifuge der Firma International Equipment<br />
Company (IEC Modell 7427) vertrieben (Abb. 4).<br />
Abb. 3: Bestandteile des PCCS-Systems<br />
Abb. 4: Aufsicht auf Rotorsystem und spezielle Doppel-Becher-Einsätze der<br />
IEC-Centra ® -CL-2-Zentrifuge<br />
Zur Vorbereitung der Blutentnahme werden mit der 20-Gauge-Kanüle 6 ml ACD-A in eine 60-ml-Spritze<br />
aufgezogen und mit 54 ml Vollblut aufgefüllt.<br />
Nach dem Einfüllen des Blutes in den zuvor in die Zentrifuge eingebrachten PCCS-Beutel erfolgt die erste<br />
Zentrifugation für drei Minuten und 45 Sekunden bei 3.000 U/min. Nach der ersten Zentrifugation wird der<br />
mit dem Vollblut beladene Behälter vorsichtig aus der Zentrifuge entnommen und das Thrombozyten<br />
enthaltene Plasma, der buffy coat und eine kleine Menge roter Blutkörperchen (ca. 1 ml) in den zweiten<br />
Doppelbehälter überführt.<br />
Anschließend erfolgt zur Trennung <strong>von</strong> thrombozytenarmem Plasma und Thrombozyten der zweite<br />
Zentrifugationsschritt für 13 Minuten bei 3.000 U/min. Danach wird der nicht benötigte Überschuss an<br />
thrombozytenarmen Plasma (Platelet-poor Plasma, PPP) in den ersten Doppelbeutel zurückgeführt. Die so im<br />
zweiten Doppelbeutel verbliebenen Bestandteile (Thrombozyten, Platelet-poor Plasma, buffy coat und einige<br />
Erythrozyten) (Abb. 5) werden anschließend manuel resuspendiert, wodurch das gewünschte<br />
Thrombozytenkonzentrat (ca. 7 ml PRP) entsteht, welches in eine sterile Spritze aufgezogen wird (Abb. 6).<br />
3
Abb. 5: Dreifachschichtung nach zweiter Zentrifugation: gelbes Platelet-poor<br />
Plasma (PPP) (oben), weiß-gelbliches Thrombozyten-Pellet (mittig), rötliche<br />
Rest-Erythrozyten-Schicht (unten)<br />
Abb. 6: Ca. 7 ml PRP können am Ende der Zentrifugation mit der Spritze<br />
entnommen werden<br />
Smart-PReP-System<br />
Das Smart-PReP-System (Fa. Harvest) ist das zweite halbgeschlossene Verfahren auf dem deutschen Markt<br />
und seit Beginn des Jahres 2001 verfügbar. Seit April 2001 wird optional auch ein System zur Herstellung<br />
<strong>von</strong> "Prokoagulanz" (Gemisch aus Thrombin enthaltendem Serum und Calciumchlorid) als<br />
Thrombozytenaktivator angeboten.<br />
Die zur Herstellung des PRP aus Vollblut benötigten Materialien werden <strong>von</strong> Firma Harvest Technologies<br />
Corporation ebenfalls in Einwegsets geliefert (PRP-1 tray pack). Der PRP-1 tray pack (Abb. 7) ist geeignet,<br />
um 50 ml Vollblut zur Herstellung <strong>von</strong> 7 bis 10 ml PRP zu verarbeiten. Vorgefertigte Distanzhülsen zur<br />
Wahl des gewünschten PRP-Volumens zur Herstellung <strong>von</strong> 7 oder 10 ml sind im PRP-1 tray pack enthalten.<br />
Optional wird neben dem PRP-1 tray pack <strong>von</strong> der Firma Harvest Technologies Corporation der PRP-2 tray<br />
pack angeboten, welcher geeignet ist, 100 ml Vollblut zu verarbeiten, wodurch ungefähr 10 bis 20 ml PRP<br />
gewonnen werden können.<br />
Zusätzlich vertreibt die Firma Harvest Technologies Corporation die zur PRP-Herstellung empfohlene<br />
Zentrifuge SMP-1000i (Abb. 8).<br />
Zur Herstellung <strong>von</strong> Platelet-rich Plasma mit dem Smart-PReP-System werden zunächst 7 ml des<br />
Zitratantikoagulanz (ACD-A) in die 60-ml-Spritze gefüllt. Zusätzlich werden 2 ml ACD-A in den (kleineren)<br />
Plasmaraum des Doppelbehälters eingefüllt. Anschließend werden bei Männern 48 ml und bei Frauen 53 ml<br />
Vollblut in die 60-ml-Spritze venös entnommen und in den Doppelbehälter gefüllt (Abb. 9).<br />
4
Abb. 7: PRP-1 tray pack (links) mit optionalem PD-1i-Kit zur<br />
Herstellung <strong>von</strong> autologem Prokoagulanz (rechts)<br />
Abb. 8: Zentrifuge SMP-1000i<br />
Abb. 9: Doppelbehälter des Smart-PReP-Systems zur<br />
PRP-Herstellung<br />
5
Abb. 10: Dünnes weißes Thrombozytenpellet über der<br />
Erythrozytenschicht am Boden des Plasmaraumes nach dem<br />
Zentrifugenlauf (rechte Kammer)<br />
Abb. 11: 7 (oder 10) ml PRP können aus dem Smart-PReP-System<br />
entnommen werden<br />
Nach nur einem (allerdings automatisiert zweistufig durchgeführten) Zentrifugationsvorgang <strong>von</strong> insgesamt<br />
12 Minuten Gesamtdauer enthält der Plasmaraum des Doppelbehälters dann oberhalb einer dünnen Schicht<br />
Erythrozyten das Thrombozytenpellet und das thrombozytenarme Plasma (PPP) (Abb. 10). Der Blutraum<br />
enthält den größten Teil der Erythrozyten (27 ml).<br />
Nach Entnahme des Doppelbehälters wird das überschüssige PPP, das nicht für die Resuspension des<br />
Thrombozytenpellets erforderlich ist, mit einer stumpfen Kanüle in eine Spritze aspiriert und in der<br />
Indikation der präprothetischen Chirurgie meist verworfen. Nach Resuspension des verbliebenen Volumens<br />
entsteht je nach verwendeter Distanzscheibe 7 oder 10 ml Thrombozytenkonzentrat (Abb. 11).<br />
PRGF-Kit nach Anitua<br />
Mit dem PRGF (Plasma Rich in Growth Factors)-System (G.A.C. Medicale San Antonio, 15-5°, 01005<br />
Vitoria-Espana) steht seit Herbst 2001 ein weiteres System zur Gewinnung <strong>von</strong> autologem<br />
thrombozytenreichem Plasma (PRP) zur Verfügung Die vorgestellte Technik gewinnt mittels einer<br />
Zentrifuge aus einer geringen Menge Eigenblut drei unterschiedliche Thrombozyten enthaltende<br />
Plasmafraktionen, das "Plasma Poor in Growth Factors" (PPGF), das "Plasma with Growth Factors" (PGF)<br />
und das "Plasma Rich in Growth Factors" (PRGF).<br />
Die zur Herstellung des PRGF (Plasma Rich in Growth Factors) aus Vollblut benötigten Materialien<br />
einschließlich der Zentrifuge (Bti. Implant Company S.L. Spain) (Abb. 12) werden als "Starter-Paket" mit<br />
Materialien für ca. 30-50 Patienten vertrieben (Fa. Wieland, Deutschland). Optional ist zusätzlich ein<br />
Thermogerät erhältlich, das die Bildung des Koagulums durch Erwärmung des PRGF auf Körpertemperatur<br />
beschleunigt.<br />
6
Abb. 12: Zentrifuge (Bti. Implant Company S.L. Spain) zum Anitua PRGF-<br />
System<br />
Abb. 13: Mit Blut gefüllter Zitrat- Vacutainer<br />
Abb. 14: Nach der Zentrifugation entsteht basal die rote Erythrozytenschicht,<br />
darüber eine sehr dünne, kaum zu sehende Buffy-Coat-Schicht (Pfeil) und<br />
oben die gelbe Plasma-Schicht<br />
Abb. 15: Das Plasma wird manuell mit zwei verschieden großen Pipetten<br />
aufgeteilt<br />
7
Abb. 16: Aus drei Vacutainern Vollblut gewinnt man 1,5 ml PPGF (links), 1,5<br />
ml PGF (Mitte) sowie eine individuell unterschiedlich große Menge PRGF<br />
(rechts)<br />
Zur Herstellung <strong>von</strong> Plasma Rich in Growth Factors werden dem Patienten, abhängig <strong>von</strong> der benötigten<br />
Menge PRGF, präoperativ 10 bis 30 ml venöses Blut in zwei bis sechs sterile Vacutainerröhrchen mit<br />
3,8-prozentigem Natriumzitrat entnommen (Abb. 13). Nach Einbringen der gefüllten Vacutainerröhrchen<br />
erfolgt eine Zentrifugation für 8 Minuten bei 1.800 U/min, wodurch sich Erythrozyten-, Buffy-coat- und<br />
Plasmaschicht entwickeln (Abb. 14).<br />
Die Trennung der Plasmaschicht in drei Fraktionen geschieht manuell durch vorsichtiges Abpipettieren. Die<br />
Fraktion 1 (erste bzw. obere 0,5 ml) entspricht dem PPGF, die Fraktion 2 (nächste 0,5 ml) ist das PGF und<br />
Fraktion 3 (noch im Röhrchen befindliches Restplasma oberhalb der Buffy-coat- und Erythrozytenschicht)<br />
wird PRGF genannt.<br />
Die Fraktionen 1 und 2 werden mit Hilfe der 0,5-ml-Pipette entnommen und in zwei zuvor zu öffnende sterile<br />
rote Vacutainerröhrchen (ohne Zusatz) überführt. Die dritte Plasmafraktion wird je nach Hämatokrit<br />
zwischen fünf- und 15-mal mit einer 0,1- ml-Pipette (0,5 bis 1,5 ml Gesamtvolumen PRGF pro entnommenes<br />
Vacutainerröhrchen Vollblut) abpipettiert (Abb. 15) und in ein drittes steriles, geöffnetes<br />
Vacutainer-Glasröhrchen überführt.<br />
Diese Vorgehensweise wird bei allen zentrifugierten Vacutainerröhrchen analog durchgeführt, wodurch man<br />
am Ende drei Vacutainerröhrchen mit den drei Plasmafraktionen erhält (Abb. 16). Die Menge des nach der<br />
Zentrifugation gewonnenen Plasmas unterliegt einer gewissen individuellen, vom Hämatokrit abhängigen<br />
Variabilität. Für jedes entnommene Vacutainerröhrchen Vollblut resultieren 0,5 ml PGF und 0,5 ml PPGF<br />
und je nach Hämatokrit ca. 0,5 bis1,5 ml PRGF.<br />
Nach Herstellung der <strong>verschiedene</strong>n Plasmafraktionen kann zur Verbesserung des intraoperativen Handlings<br />
optional die Bildung des Plättchenagglutinates beschleunigt werden.<br />
Durch Zugabe <strong>von</strong> 0,05 ml Calciumchlorid (10 %) pro 1 ml PRGF bildet sich bei Raumtemperatur innerhalb<br />
<strong>von</strong> 5 bis 8 Minuten (Herstellerangaben) ein Koagel. Die Koagelbildung ist abhängig <strong>von</strong> der<br />
Thrombozytenanzahl und der Verarbeitungstemperatur. Bei einer Temperatur <strong>von</strong> 37 °C (durch das optionale<br />
Thermo-Gerät möglich) bildet sich das Koagel laut Herstellerangaben bereits innerhalb <strong>von</strong> 2 bis 3 Minuten.<br />
Fazit<br />
Auf dem deutschen Markt sind <strong>verschiedene</strong> <strong>Eigenherstellungsverfahren</strong> zur Gewinnung eines autologen<br />
Thrombozytenkonzentrates (Platelet-Rich-Plasma/PRP) verfügbar. Diese Verfahren erfordern einen<br />
8
unterschiedlich hohen Grad an Sterilitätskautelen und reichen <strong>von</strong> völlig offenen Herstellungsverfahren über<br />
die halbgeschlossenen zu den weitgehend geschlossenen Produktionsmethoden. Bei der Entscheidung für das<br />
individuell auszuwählende Herstellungssystem sind <strong>verschiedene</strong> Kriterien für den jeweiligen Zahnarzt <strong>von</strong><br />
Bedeutung. Zu nennen sind hier beispielsweise die Erfahrung des Zahnarztes und des Mitarbeiterteams mit<br />
dem sterilen Arbeiten sowie die Häufigkeit der PRP-Anwendung. Weitere Studien werden zeigen in wieweit<br />
Unterschiede in der Zusammensetzung des hergestellten Produktes Bedeutung für die resultierende<br />
biologische Wirkung haben. Die klinische Anwendung <strong>von</strong> PRP sollte bei derzeitig nur begrenztem<br />
Kenntnisstand über die erforderlichen Rahmenbedingungen und daraus resultierenden biologischen<br />
Auswirkungen weitestgehend auf klinische Studien begrenzt werden.<br />
Korrespondenzadresse:<br />
Johannes-Gutenberg-Universität Mainz<br />
Klinik für Mund-, Kiefer- u. Gesichtschirurgie<br />
Dr. Dr. Gernot Weibrich<br />
Augustusplatz 2<br />
55131 Mainz<br />
9