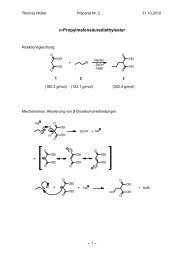
Musterprotokoll - Institut für Organische Chemie
Musterprotokoll - Institut für Organische Chemie
Musterprotokoll - Institut für Organische Chemie
- Keine Tags gefunden...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
OC-F Assistent (Datum, Unterschrift): ________________________________<br />
Stand WS2010<br />
Synthese von<br />
cis,cis,cis-1,5,9-Cyclododecatrien<br />
Protokoll<br />
zum<br />
...... Praktikum<br />
unter Anleitung von<br />
.......<br />
AK Prof. Dr. .......<br />
bearbeitet und vorgelegt von<br />
........<br />
CAU Kiel<br />
WS 201......<br />
(Kommentare und Tipps sind kursiv geschrieben.)
(Praktikant) / (Praktikantin) ....Praktikum - 2 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
1 Einleitung und wissenschaftlicher Hintergrund<br />
Spätestens seit Reppe et al. 1948 ihre Ergebnisse zum Einfluss von Nickel auf die<br />
Cyclotrimerisierung von Ethin(-derivaten) zu Benzol(-derivaten) veröffentlichten,<br />
besteht großes Interesse an der Aufklärung des zugehörigen Mechanismus. [1]<br />
(Ein guter Anfang einer Einleitung ist oft schwierig. Er sollte Interesse wecken,<br />
informativ sein.)<br />
(Die Einleitung und der wissenschaftliche Hintergrund müssen das Wichtigste<br />
zusammen fassen und dürfen weder abschweifen, noch Trivialitäten erklären. Dieser<br />
Teil sollte möglichst kurz und knackig sein.)<br />
(Für das ganze Protokoll gilt: das Protokoll muss in eigenen Worten geschrieben<br />
sein. Übernommene Zitate müssen kenntlich gemacht werden und mit einem<br />
Literaturverweis versehen sein! Verletzen Sie kein copyright!)<br />
Diese Diskussion führte zwischen 1960 und 1980 zu einer Vielzahl synthetisch<br />
zugänglicher und spektroskopisch untersuchter Molekülsysteme, die räumliche<br />
Wechselwirkung zwischen den Ethen- bzw. Ethin-Einheiten zeigen.<br />
Einen maßgeblichen Beitrag dazu lieferten die ersten binären Nickel(0)-Komplexe<br />
1 - 3, die von Wilke et al. synthetisiert und untersucht wurden. [2]<br />
(Molekülen wird bei ihrer ersten Erwähnung in Abbildungen eine Nummer<br />
zugeordnet. Man beginnt mit 1 und fährt aufsteigend fort. Im Text werden die<br />
Nummern dann in Klammern gesetzt, wenn der vollständige Name davor steht. Wird<br />
nur ein Teil des Namens, z. B. „Amid 50“ für Benzoesäureamid (50), verwendet,<br />
steht die Nummer ohne Klammern.)
(Praktikant) / (Praktikantin) ....Praktikum - 3 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Ni<br />
Ni<br />
Ni<br />
1 2 3<br />
Abb. 1. Gezeigt sind die ersten binären Alken-Nickel(0)-Komplexe trans,trans,trans-1,5,9-<br />
Cyclododecatriennickel(0) (1), cis,cis,cis-1,5,9-Cyclododecatriennickel(0) (2) und Tris(ethen)nickel(0)<br />
(3).<br />
(Untertexte zu Abbildungen sollten ausreichend Information enthalten. NICHT nur<br />
„Abb 1. Gezeigt ist Komplex 2.“ Untertexte stehen linksbündig und werden mit<br />
Blocksatz geschrieben, wie der Rest des Textes. Die Abbildung selbst wird zentriert.<br />
Moleküle in Abb. sollen gleich groß gezeichnet werden, ebenso soll der Text in Abb.<br />
die gleiche Schriftgröße wie der Rest des Protokolls haben. In Zeichnungen soll aus<br />
Klarheitsgründen ausschließlich eine Serifen-freie Schrift verwendet werden, beim<br />
Text ist es Geschmackssache.)<br />
Ein Artikel von Herges und Papafilippopoulos bietet einen weiteren Ansatz zur<br />
Klärung des Mechanismus. [3] Mittels moderner quantenchemischer Rechenverfahren<br />
und der AICD-Methode (anisotropy of the induced current density) zur Darstellung<br />
delokalisierter Elektronen konnte gezeigt werden, dass die allgemein verwendete<br />
strukturelle Darstellung von planarem Tris(ethen)nickel(0) (3) unzureichend ist.<br />
Die berechneten Abstände zwischen den einzelnen Etheneinheiten liegen deutlich<br />
unterhalb ihrer van-der-Waals-Radien, woraus sich eine nicht vernachlässigbare<br />
Wechselwirkung ergibt. Die Bindungsordnung innerhalb jeder Ethyleneinheit ist<br />
erniedrigt (Bindungsordnung < 2), wohingegen die Bindungsordnung zwischen<br />
benachbarten Einheiten von Null verschieden ist (through space-Wechselwirkung,<br />
Homokonjugation). Demnach befindet sich der Nickel(0)-Komplex 3 „auf dem Weg<br />
zur Trimerisierung“.<br />
Um einen experimentellen Beweis der Homokonjugation zu erhalten, sollen<br />
Modellsysteme sowohl für planares Tris(ethen)nickel(0) (3) als auch für das<br />
entsprechende upright-Konformer (Ethen senkrecht zur Zeichenebene) dargestellt<br />
werden.
(Praktikant) / (Praktikantin) ....Praktikum - 4 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Als mögliche Modellsysteme können die Komplexe trans,trans,trans-1,5,9-<br />
Cyclododecatriennickel(0) (1) a und cis,cis,cis-1,5,9-Cyclododecatriennickel(0) (2)<br />
dienen. Während 1 aus kommerziell erhältlichem trans,trans,trans-1,5,9-CDT (4) und<br />
in situ erzeugtem Nickel(0) direkt zugänglich ist, ist der Ligand cis,cis,cis-1,5,9-CDT<br />
(5) durch vorherige Konfigurationsumkehr aus 4 herzustellen. [4] Eine<br />
Alternativsynthese des Liganden 5 geht von großtechnisch verfügbarem<br />
cis,trans,trans-1,5,9-CDT (6) aus. [5]<br />
4 5 6<br />
Abb. 2. Gezeigt sind die möglichen Ausgangsmaterialien für die Synthesen von trans,trans,trans-<br />
1,5,9-CDT (4), cis,cis,cis-1,5,9-CDT (5) und cis,trans,trans-1,5,9-CDT (6).<br />
2 Aufgabenstellung<br />
Die Zielverbindung cis,cis,cis-1,5,9-CDT (5) soll aus den Tribromiden 7a und 7b<br />
hergestellt werden. Dazu wird eine Variation [6] der literaturbekannten Synthese von<br />
Untch und Martin [4] angewendet.<br />
a<br />
Cyclododecatrien wird im Folgenden als CDT abgekürzt.
(Praktikant) / (Praktikantin) ....Praktikum - 5 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
3 Syntheseübersicht<br />
Allen literaturbekannten Synthesen von cis,cis,cis-1,5,9-CDT (5) gemein ist eine<br />
einleitende vollständige Bromierung des jeweiligen Ausgangsmaterials. Hierdurch<br />
ergibt sich eine Konfigurationsumkehr der trans- in die gewünschten cis-<br />
Doppelbindungen. Ausgehend von diesen einleitenden Schritten ist die Synthese des<br />
CDT 5 aus den Tribromiden 7a und 7b bzw. aus dem Alkin 8 auf zwei Wegen<br />
möglich.<br />
Br<br />
Br<br />
+<br />
Br<br />
Br<br />
Br<br />
Br<br />
7a<br />
7b<br />
8<br />
1. sek-BuLi<br />
2. H 2 O<br />
H 2 , Pd / BaSO 4 ,<br />
vergiftet<br />
5<br />
Abb. 3. Zwei mögliche Synthesewege zu cis,cis,cis-1,5,9-CDT (5).
(Praktikant) / (Praktikantin) ....Praktikum - 6 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
3.1 Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (5) aus cis,cis-1,5-<br />
Cyclo-dodeca-1,5-dien-9-in (8)<br />
a) H 2 , Pd / BaSO 4 ,<br />
vergiftet<br />
8 5<br />
Abb. 4. Synthese des all-cis-Liganden 5 aus dem Dien-in 8 durch cis-selektive Hydrierung der<br />
Dreifachbindung.<br />
Bei der Herstellungsmethode nach Haufe et al. [5] wird selektiv die Dreifachbindung in<br />
8 neben den bereits cis-konfigurierten Doppelbindungen katalytisch hydriert. Da die<br />
Reaktivität der Doppelbindungen nur wenig geringer ist als die des betrachteten<br />
Alkin-Segments, ist es nötig, den Palladium(0)-Katalysator mittels Blei(II)acetat<br />
partiell zu vergiften. Zudem ist die Kontrolle des Wasserstoffverbrauchs<br />
entscheidend, um eine Folgereaktion des entstandenen Triens 5 zu vermeiden.<br />
3.2 Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (5) aus 1,5,9-Tribromcyclododeca-1,5,9-trien<br />
(7a) und 1,5,10-Tribromcyclododeca-1,5,9-trien<br />
(7b)<br />
Br<br />
Br<br />
+<br />
Br<br />
a) sek-BuLi<br />
b) H 2 O<br />
Br<br />
Br<br />
7a 7b 5<br />
Br<br />
Abb. 5. Synthese des all-cis-Liganden 5 aus den Tribromiden 7a und 7b durch Brom-Lithium-<br />
Austausch und Hydrolyse des lithiumorganischen Zwischenprodukts mit Wasser.
(Praktikant) / (Praktikantin) ....Praktikum - 7 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Durch Reaktion mit sek-Butyllithium ist es möglich, die Bromatome in 7 zunächst<br />
durch Lithium-Atome auszutauschen. Anschließende Hydrolyse der Lithiumorganischen<br />
Intermediate führt zur Protonierung. [6] Der Angriff des Protons findet am<br />
Punkt der höchsten Elektronendichte der C-Li-Bindung statt, so dass die Reaktion<br />
unter vollständigem Konfigurationserhalt verläuft. Die Verwendung von sek-<br />
Butyllithium verhindert weitgehend einen konkurrierenden Angriff des ebenfalls<br />
vorliegenden Butyl-Elektrophils aus entstehendem Butylbromid. Letzteres reagiert<br />
bevorzugt mit einem weiteren Äquivalent Butyllithium zu Lithiumbromid<br />
(Niederschlag) und einem Buten-Butan-Gemisch (Gasentwicklung).<br />
(Bei entscheidenden Synthesestufen wird zusätzlich ein ausführlicher Mechanismus<br />
angegeben und diskutiert. MINDESTENS jedoch einer pro Protokoll.)<br />
zusätz. freie<br />
3d-Orbitale<br />
Bu<br />
Br<br />
Br<br />
Li<br />
Li<br />
Bu<br />
Li<br />
Br<br />
+ 2 BuLi<br />
- 3 BuBr<br />
Br<br />
Br<br />
Br<br />
Li<br />
7a 9 10<br />
Li<br />
(Anmerkung: Die Schriftgröße der obigen Zeichnung ist grenzwertig. Es ist zu empfehlen, solch<br />
umfangreiche Reaktionsschemata auf mehreren Zeilen zu verteilen.)<br />
Abb. 6. Mechanismus des Brom-Lithium-Austausch an 7a mit Butyllithium. Über den „at-Komplex“ 9<br />
erfolgt die Umsetzung zum tri-lithiierten Zwischenprodukt 10.<br />
Der einleitende Schritt des Brom-Lithium-Austausches ist ein Angriff des partiell<br />
negativ geladenen sp 3 -Kohlenstoffatoms von Butyllithium an Brom (s. Abb. 5). Dies<br />
ist nur möglich, da Brom als Element der dritten Reihe im PSE bereits über die<br />
Möglichkeit zur Besetzung seiner 3d-Orbitale verfügt. Aus der sp 3 d-Hybridisierung<br />
resultiert ein verzerrt trigonal bipyramidaler „Bromat-Komplex“ 9. Die freien<br />
Elektronenpaare befinden sich dabei in den äquatorialen Positionen, die Butyl-<br />
Gruppe und der makrocyclische Rest in den axialen Positionen.
(Praktikant) / (Praktikantin) ....Praktikum - 8 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Im weiteren Verlauf ergeben sich zwei Reaktionsmöglichkeiten. Erstens die<br />
Ausbildung eines neuen Lithiumorganyls, die monolithiierte Vorstufe von 10, oder<br />
aber zweitens die Rückreaktion zu 7a. Tatsächlich läuft die Reaktion vollständig in<br />
Richtung 10 ab. Eine Triebkraft dafür stellt die elektronische Struktur der neuen<br />
Verbindungen 10 und des gebildeten Butylbromids dar. In 10 ist das, im Vergleich zu<br />
Brom, elektropositive Lithium an ein nunmehr elektronegativeres sp 2 -Kohlenstoffatom<br />
gebunden.<br />
4 Experimenteller Teil<br />
4.1 Allgemeine Arbeitstechniken<br />
(Passen Sie den Experimentellen Teil unbedingt auf IHREN FALL an! Methoden, die<br />
Sie nicht verwendet haben, dürfen hier auch nicht aufgeführt werden!)<br />
NMR-Spektroskopie<br />
Die NMR-Spektren wurden auf folgenden Spektrometern der Firma Bruker, wenn<br />
nicht anders vermerkt bei 300 K, aufgenommen.<br />
Bruker AC 200 1<br />
H-NMR (200.1 MHz)<br />
13<br />
C-NMR (50.3 MHz)<br />
Bruker ARX 300<br />
1 H-NMR (300.1 MHz)<br />
13<br />
C-NMR (75.5 MHz)<br />
Bruker DRX 500 1 H-NMR (500.1 MHz)<br />
13<br />
C-NMR (125.8 MHz)<br />
Bruker AV 600 1<br />
H-NMR (600.1 MHz)<br />
13<br />
C-NMR (150.9 MHz)<br />
Die chemischen Verschiebungen (δ) sind in ppm angegeben.<br />
Sofern nicht anders vermerkt, wurden die 1 H-NMR-Spektren wie folgt auf die<br />
Lösungsmittel-Peaks kalibriert.<br />
Für 1 H-Spektren:<br />
CDCl 3 / TMS CDCl 3 CD 2 Cl 2 DMSO Aceton MeOH D 2 O<br />
0.00 7.26 5.30 2.50 2.05 3.31 4.79<br />
Für 13 C-Spektren:<br />
CDCl 3 / TMS CDCl 3 CD 2 Cl 2 DMSO Aceton MeOH D 2 O<br />
77.00 77.00 53.52 39.52 29.84 49.00 --
(Praktikant) / (Praktikantin) ....Praktikum - 9 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Wenn nötig wurden 2D-Spektren (COSY, HSQC, HMBC, NOESY, ....) für die<br />
vollständige Strukturanalyse aufgenommen.<br />
Massenspektrometrie<br />
Die Massenspektren wurden auf den folgenden Massenspektrometern gemessen:<br />
- 8200 der Firma Finnigan (EI, CI)<br />
- Mariner Biospectrometry (ESI)<br />
- Bruker BiflexTM III (MALDI-TOF)<br />
IR-Spektroskopie<br />
Die IR-Spektren wurden einem FT-IR Spektrometer Paragon 1000 der Firma Perkin<br />
Elmer gemessen. Sowohl Feststoffe, als auch Flüssigkeiten wurden pur aufgetragen<br />
und mit einem MKII Golden Gate Single Reflection ATR System der Firma Smith<br />
Industries gemessen.<br />
UV / Vis-Spektroskopie<br />
Die UV/Vis-Spektren wurden mit einem Lambda 14 Spektrometer der Firma Perkin<br />
Elmer in 10 mm dicken Quarzküvetten gemessen.<br />
Schmelzpunkt<br />
Schmelzpunkte wurden in offenen Kapillarröhrchen in einem Melting Point Gerät der<br />
Firma Büchi bestimmt.<br />
Elementaranalyse<br />
Die Elementaranalysen wurden mit einem Euro EA 3000-Gerät der Firma Euro<br />
Vector im <strong>Institut</strong> für Anorganische <strong>Chemie</strong> der Christian-Albrechts-Universität zu<br />
Kiel gemessen.<br />
Arbeitstechniken<br />
Alle Reaktionen, welche luft- oder feuchtigkeitsempfindliche Reagenzien oder<br />
Intermediate beinhalten, wurden unter Stickstoffatmosphäre, in ausgeheizten<br />
Apparaturen, durchgeführt. Käufliche Ausgangsmaterialien und Reagenzien wurden,<br />
sofern nicht anders vermerkt, wie erhalten eingesetzt. Lösungsmittel wurden, sofern<br />
nicht anders vermerkt, nach gängigen Methoden gereinigt und getrocknet, es sei
(Praktikant) / (Praktikantin) ....Praktikum - 10 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
denn, diese wurden für Extraktionen oder Säulenchromatographien verwendet.<br />
NEt 3 wurde über KOH zum Sieden erhitzt und destilliert.<br />
Et 2 O und THF wurden über Natrium (Indikator Benzophenon) zum Sieden erhitzt und<br />
destilliert.<br />
CH 2 Cl 2 wurden über CaH 2 zum Sieden erhitzt, destilliert und über Molekularsieb 4 Å<br />
unter Inertgas gelagert.<br />
Dünnschichtchromatographie wurde auf Merck Kieselgel 60 F 254 Aluminiumplatten<br />
durchgeführt. Die Identifikation erfolgte mit einer UV-Lampe (254 nm, 366 nm) der<br />
Firma Lamag. Für die Säulenchromatographie wurden Glassäulen (∅ cm ×<br />
Packungshöhe cm) mit Kieselgel der Firma Merck (Korngröße 0.004 – 0.016 mm) als<br />
stationäre Phase verwendet. (bei nicht-UV-aktiven Substanzen Anfärbemethode<br />
beschreiben)<br />
4.2 Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (5) aus 1,5,9-Tribromcyclododeca-1,5,9-trien<br />
(7a) und 1,5,10-Tribromcyclododeca-1,5,9-trien<br />
(7b) [6]<br />
(Hier steht eine Fußnote an der Überschrift. Dies erlauben Verlage bei Publikationen<br />
aber nicht. Vermeiden Sie daher Fußnoten an Überschriften)<br />
5<br />
Die Reaktionsapparatur, bestehend aus einem Schlenkkolben, Tropftrichter und<br />
Blasenzähler, wurde i. Vak. ausgeheizt und anschließend im leichten Argonstrom<br />
abgekühlt. Unter Inertbedingungen wurden 2.06 g (5.20 mmol) eines Gemisches der<br />
Tribromide 7a und 7b in 40 mL trockenem THF gelöst und auf –78 °C gekühlt. In der<br />
Kälte wurden 24.4 mL (31.7 mmol) einer 1.3 M Lösung von sek-Butyllithium in<br />
Cyclohexan langsam zugetropft. Die anfänglich gelbe Reaktionslösung verfärbte sich<br />
unter Gasentwicklung rot-braun. Nach beendeter Zugabe wurde auf 0 °C erwärmt
(Praktikant) / (Praktikantin) ....Praktikum - 11 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
und die Reaktion vorsichtig (!) mit deion. Wasser gestoppt. Die Reaktionslösung<br />
wurde dreimal mit je 100 mL Pentan extrahiert. Die vereinigte org. Phase wurde mit<br />
100 mL einer ges. Natriumchlorid-Lösung gewaschen und über Magnesiumsulfat<br />
getrocknet. Anschließende Filtration über Aluminiumoxid (neutral) und Entfernung<br />
des Lösungsmittels i. Vak. ergab ein farbloses Öl mit intensivem Geruch.<br />
(Es heißt NICHT Ölpumpenvakuum - auch wenn es in manchen Veröffentlichungen<br />
verwendet wird -, da es unspezifisch ist. Das angelegte Vakuum soll – möglichst<br />
genau – durch eine Angabe in mbar beschrieben werden.<br />
Für alle Angaben von Größen ist die Anzahl der signifikanten Stellen zu beachten!<br />
Diese sind nicht identisch mit Nachkommastellen. Bsp:<br />
1.10 g, 1.10•10 3 mg, 0.00110 kg: Es sind jeweils 3 signifikante (auch relevante<br />
oder zählende) Stellen angegeben.<br />
Es heißt NICHT gequencht, sondern z. B. abgebrochen.<br />
Es heißt NICHT abrotiert, sondern abdestilliert.<br />
Es heißt NICHT über Nacht, außer es muss dunkel sein und die Zeit ist egal).<br />
(Wird eine Flash-Säulenchromatographie durchgeführt, ist dies wie folgt anzugeben<br />
z. B.:)<br />
Das Rohprodukt wurde mittels Flash-Säulenchromatographie [7] (Kieselgel, Korngröße<br />
0.040 - 0.063 mm, Cyclohexan / Essigsäurethylester, 4 : 1) gereinigt.<br />
Ausbeute: 0.61 g (3.7 mmol, 72 %) (Lit. [4] : 60 %).<br />
Destillationsprotokoll:<br />
1. Fraktion: Sdp. xx °C (xxx mbar), xx.x g, (Vorfraktion);<br />
2. Fraktion: Sdp. xx °C (xxx mbar), xx.x g;<br />
3. Fraktion: Sdp. xx °C (xxx mbar), xx.x g, (Zwischenfraktion);<br />
…<br />
n. Fraktion:…<br />
Rückstand: xx.x g, Endtemp. des Heizbades: xxx °C.
(Praktikant) / (Praktikantin) ....Praktikum - 12 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
(Auch Vor-, Zwischenfraktionen und Rückstand sind anzugeben!)<br />
DC (Cyclohexan / Essigsäureethylester, 4 : 1): R f = 0.34.<br />
Schmp. -1.5 °C (Das Lösungsmittel aus dem kristallisiert wurde)<br />
Sdp. 108 °C (Druck)<br />
24. 6<br />
Brechungsindex: n D = 1.5100<br />
1<br />
H-NMR (300 MHz, CDCl 3 (oder CD 3 OD, THF, etc.), 300 K, TMS (oder andere<br />
Referenzverbindung)): δ = 5.61 (br. s, 6 H, CH), 2.18 (br. s, 12 H, CH 2 ).<br />
(s für Singulett, d für Dublett, t für Triplett, q für Quartett, dd für Doppel-Dublett, m für<br />
Multiplett. Ein Multiplett wird immer in seinen Grenzen angegeben 5.10 - 4.82,<br />
Ausnahme: Zentrierte Multipletts (m c ). Breite Signale werden zusätzlich mit br.<br />
bezeichnet.<br />
Für die Zuordnung der Signale gibt es mehrere Möglichkeiten. Die Zuordnung sollte<br />
möglichst leicht und selbstverständlich sein:<br />
- Verwenden Sie charakteristische Fragmente, z. B. CH 3 , CHO, O-CH 2 . Müssen<br />
mehrere H-Atome aufgeführt werden, wird das zugeordnete Signale kursiv<br />
herausgehoben, z.B. CH-CH 3 .<br />
- Wenn eindeutig aus dem Namen ableitbar, nummerieren Sie: z. B. 3-H.<br />
- Bei sehr komplexen Verbindungen kann diese abgebildet werden, so dass die<br />
zugeordneten Nummern plausibel werden.<br />
Die Angabe von Kopplungskonstanten ist wie folgt: …7.28 (dd, 3 J = 7.8 Hz, 4 J =<br />
1.4 Hz, 2 H, 2,7-H),…).<br />
13<br />
C-NMR (75.5 MHz, CDCl 3 , 25 °C, TMS, evtl. zusätzlich DEPT135): δ = 130.4 (d,<br />
CH), 28.0 (t, CH 2 ).<br />
(Wenn 1 H-Breitband(BB)-entkoppelte 13 C-Spektren vorliegen - wie meist - und ein<br />
zusätzliches DEPT135 aufgenommen wurde, werden die Signale mit q für Quartett<br />
„CH 3 “, t für Triplett „CH 2 “, d für Dublett „CH“ oder s für Singulett „C“ angegeben. Auch<br />
möglich ist eine Angabe der Art „C q “ für quartäre C-Atome. Ansonsten wird nur die<br />
Verschiebung angegeben. Indiziert werden C-Atome anhand ihrer Position (die<br />
Struktur ist zu nummerieren) z. B. C-1, der sie beinhaltenden Gruppe z. B. OCH 3
(Praktikant) / (Praktikantin) ....Praktikum - 13 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
oder allgemeiner mit z. B. C Aryl . Bei Kombinationen obiger Regeln wird das<br />
signalgebende Kohlenstoffatom kursiv geschrieben, z. B. C Aryl -OCH 3 .)<br />
FT-IR (Film): ̃ν = 3014 (s, sp 2 -C-H), 2938 (vs, aliph. C-H), 2914 (vs, aliph. C-H),<br />
2851 (vs), 1636 (m, C=C), 1454 (s), 1452 (s), 722 cm -1 (m). (vs für very strong; nur<br />
eindeutige Zuordnungen sind erwünscht).<br />
UV/Vis (Cyclohexan): λ max (ε) = 193, 200 (9700) nm.<br />
MS (EI, 70 eV): m/z (%) = 162 (10) [M] +·, 147 (6) [M -H -CH 2 ] + , 133 (23) [M -C 2 H 4 -H] + ,<br />
119 (27) [C 9 H 11 ] + , 93 (59) [C 8 H 9 ] + , 79 (100) [C 6 H 7 ] + .<br />
(Wo immer möglich, Zuordnung angeben. Die Signalintensitäten werden im<br />
prozentualen Verhältnis zum Basispeak angegeben. Der 100 %-Peak und der<br />
Molekülpeak (so vorhanden) sind mindestens anzugeben. Als relevante Signale<br />
werden solche angesehen und beschrieben, deren Intensität eine gedachte Linie<br />
zwischen dem 100 %-Pkt. der Y-Achse und 0%-Pkt. des Molekülsignals auf der X-<br />
Achse übertrifft. Signifikante Fragmente werden zusätzlich genannt. Bei typischen<br />
Isotopensignalen sind im Fragment die Isotope anzugeben, z. B. für C 12 H 15 Br 3 : 402,<br />
400, 398, 396 (6, 10, 10, 6) [M] + )<br />
MS (CI, Isobutan): m/z (%) = 163 (5) [M + H] + .<br />
GC-MS (Säule: Optima1, 25 m . 0.32 mm, Split: 1:20, Flow: 2 mL/min, Helium;<br />
Temperaturprogramm: 50 °C // 5 min // 50 - 150 °C // 5 °C/min // 150 - 250 °C //<br />
10 °C/min): τ R = 17.39 min; (EI, 70 eV) m/z (%) = (siehe oben)<br />
Elementaranalyse C 12 H 18 (162.27): ber. C 88.82, H 11.18; gef.: C 89.05, H 11.14.<br />
5 Fazit<br />
Die Variation der literaturbekannten Synthese von cis,cis,cis-1,5,9-CDT 5 nach Untch<br />
und Martin aus den Tribromiden 7a und 7b ergab das gewünschte Produkt in hoher<br />
Reinheit. Es konnte gezeigt werden, dass der Brom-Lithium-Austausch über sek-<br />
Butyllithium eine deutlich schnellere Reaktionsführung ermöglicht. Zudem ist hierbei<br />
der nach Originalvorschrift anzuschließende Reinigungsschritt über<br />
Komplexierung/Dekomplexierung mit Silbernitrat für eine weitere Umsetzung<br />
überflüssig.
(Praktikant) / (Praktikantin) ....Praktikum - 14 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
6 Literatur<br />
1 W. Reppe, W. J. Schweckendiek, Liebigs Ann. Chem. 1948, 560, 104-116.<br />
2 a) B. Bogdanovic, M. Kröner, G. Wilke, Liebigs Ann. Chem. 1966, 699, 1-23; b)<br />
K. Jonas, P. Heimbach, G. Wilke, Angew. Chem. 1968, 80, 1033; Angew.<br />
Chem. Int. Ed. 1968, 7, 949; c) K. Fischer, K. Jonas, G. Wilke, Angew. Chem.<br />
1973, 85, 620-621; Angew. Chem. Int. Ed. 1973, 12, 565-566.<br />
3 R. Herges, A. Papafilippopoulos, Angew. Chem. 2001, 113, 4809-4813; Angew.<br />
Chem. Int. Ed. 2001, 40, 4671-4674.<br />
4 K. G. Untch, D. J. Martin, J. Am. Chem. Soc. 1965, 87, 3518-3520.<br />
5 H. Trauer, G. Haufe, Z. Chem. 1988, 28, 290-291.<br />
6 D. Peters, aktuelle Arbeiten, Christian-Albrechts-Universität zu Kiel 2004.<br />
7 W. C. Still, M. Kahn, A. Mitra, J. Org. Chem. 1978, 43, 2923-2925.<br />
(Bücher werden wie folgt zitiert (Bsp.): K. P. C. Vollhardt, <strong>Organische</strong> <strong>Chemie</strong>,<br />
1. Aufl., VCH, Weinheim 1988, S. 215-217.<br />
Dissertationen oder Diplomarbeiten wie folgt (Bsp.): M. R. Hopmann, Dissertation,<br />
Technische Universität Berlin 1983.<br />
Das beliebte Organikum wie folgt:<br />
neuere Ausgaben:<br />
K. Schwetlick, Organikum, 23. Aufl., Wiley-VCH, Weinheim 2009, S. 563–564.<br />
ältere Ausgaben:<br />
H. Becker, W. Berger, G. Domschke, Organikum, 22. Aufl., Wiley-VCH, Weinheim<br />
2004, S. 512-513. )
(Praktikant) / (Praktikantin) ....Praktikum - 15 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
Weiteres Beispiel zur 1 H-NMR-Auswertung:<br />
OAc<br />
AcO AcO<br />
OAc<br />
O<br />
O<br />
1<br />
H-NMR (300 MHz, CDCl 3 , 300 K, TMS): δ = 7.09 (d, 3 J = 8.6 Hz, 2 H, H-Ar-2,6), 6.97<br />
(d, 3 J = 8.6 Hz, 2 H, H-Ar-3,5), 5.56 (dd, 3 J = 10.0 Hz, 3 J = 3.5 Hz, 1 H, H-3), 5.47 (d,<br />
3<br />
J = 1.7 Hz, 1 H, H-1), 5.44 (dd, 3 J = 3.5 Hz, 3 J = 1.9 Hz, 1 H, H-2), 5.36 (br. t, 3 J =<br />
ca. 10 Hz, 1 H, H-4), 4.28 (dd, 2 J = 12.1 Hz, 3 J = 5.2 Hz, 1 H, H-6a), 4.11 (ddd,<br />
3<br />
J = 10.1 Hz, 3 J = 5.2 Hz, 3 J = 2.3 Hz, 1 H, H-5), 4.07 (dd, 2 J = 12.1 Hz, 3 J = 2.3 Hz, 1<br />
H, H-6b), 2.30 (s, 3 H, Ar-CH 3 ), 2.19 (s, 3 H, Ac), 2.05 (s, 3 H, Ac), 2.04 (s, 3 H, Ac),<br />
2.03 (s, 3 H, Ac).<br />
Bestimmung der Kopplungskonstanten siehe Abb.
(Praktikant) / (Praktikantin) ....Praktikum - 16 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
einige Tipps zur Formatierung:<br />
1. Keine Kopf- und Fußzeile auf dem Deckblatt:<br />
[Datei > Seite einrichten… > Layout, Kopf- und Fußzeile, erste Seite anders]<br />
2. Textbild: Blocksatz, 1 ½ facher Zeilenabstand, Absätze durch 6pt trennen<br />
3. Sollten Minuszeichen oder ähnliches bei Blocksatz von der Zahl getrennt werden,<br />
hilft dies:<br />
vorher: -78 °<br />
C<br />
Benutzung des gebundenen Bindestrichs:<br />
[Shift + Strg + Bindestrich]<br />
Das Minuszeichen im Nummernfeld funktioniert damit nicht.<br />
nacher:<br />
-78 °C<br />
Analoges gilt für die Benutzung des gebundenen Leerzeichens. Um die Trennung<br />
einer Zahl von der dazugehörigen Einheit zu verhindern, kann die Tastenkombination<br />
[Shift + Strg + Leertaste] verwendet werden. Achtet dabei darauf, dass die Abstände<br />
zwischen den Wörtern der Zeile nicht zu groß werden. Sollte das der Fall sein, nutzt<br />
die manuelle Trennung mit [Strg + Bindestrich].<br />
4. Spezielle Zeichen, wie Wellenzahl bei FT-IR (Film): ̃ν = oder „n 24.6 d“ bei<br />
Brechungsindex: n D<br />
24.6<br />
=, kann man bequem mittels Microsoft-Formeleditor<br />
erstellen (falls nicht anderweitig zugänglich).<br />
[Einfügen > Objekt > Microsoft-Formeleditor]<br />
Damit ist es möglich Tilden, Striche, Pfeile, etc. über oder unter Buchstaben zu<br />
plazieren.<br />
Aber bitte versuchen Sie, den Formeleditor zu vermeiden, da später die Verlage<br />
dies nicht für Manuskripte erlauben. Es gibt häufig auch andere Wege zu<br />
Sonderzeichen.
(Praktikant) / (Praktikantin) ....Praktikum - 17 -<br />
Synthese von cis,cis,cis-1,5,9-Cyclododecatrien (<strong>Musterprotokoll</strong>)<br />
5. Das Protokoll muss geheftet (Tacker) abgegeben werden! Nachträgliches<br />
Tackern kostet 50 Cent.<br />
Liste für Abkürzungen<br />
Einige Wörter werden in Synthesevorschriften generell abgekürzt. In allen anderen<br />
Texten werden jedoch alle Wörter ausgeschrieben.<br />
(Die Abkürzung "abs." ist zu vermeiden, da sie zu unspezifisch ist.<br />
Einheitenabkürzungen tragen KEINEN Punkt, auch min nicht. RT für<br />
Raumtemperatur ist unzulässig. Selbstverständliche Abkürzungen wie Me, Et, Ac<br />
sowie die gängigen Einheiten wie h, d, min stören in einer Abkürzungsliste)<br />
Ausb.<br />
Äquiv.<br />
DC<br />
EA<br />
GC<br />
ges.<br />
Ausbeute<br />
Äquivalente<br />
Dünnschichtchromatographie<br />
Elementaranalyse<br />
Gaschromatographie<br />
gesättigt<br />
i. Vak. im Vakuum<br />
org.<br />
proz.<br />
organische<br />
prozentig<br />
Raumtemp. Raumtemperatur<br />
wässr.<br />
wässrig(e)