carbons%C3%A4uren.pdf
carbons%C3%A4uren.pdf
carbons%C3%A4uren.pdf
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Carbonsäuren
Carbonsäuren<br />
Funktionelle Gruppe:<br />
Allgemeine Formel:<br />
Klassifizierung:<br />
� nach der Anzahl der -COOH Gruppen:<br />
� nach der Natur der R Gruppe:<br />
C<br />
O<br />
OH<br />
R-COOH<br />
, Carboxyl-Gruppe (-COOH)<br />
Monocarbonsäuren<br />
Dicarbonsäuren<br />
.<br />
.<br />
Polycarbonsäuren<br />
gesättigte<br />
ungesättigte<br />
2
Carbonsäuren<br />
Nomenklatur<br />
� IUPAC-Namen (systematische Namen):<br />
� Trivialnamen<br />
Formel<br />
H-COOH<br />
CH 3 -COOH<br />
CH 3 CH 2 -COOH<br />
CH 3 CH 2 CH 2 -COOH<br />
CH 3 (CH 2 ) 16 -COOH<br />
HOOC-CH 2 -COOH<br />
Alkan| Alkan + säure<br />
systematische Namen<br />
Methansäure<br />
Ethansäure<br />
Propansäure<br />
Butansäure<br />
Octadecansäure<br />
Propandisäure<br />
Trivialnamen<br />
Ameisensäure<br />
Essigsäure<br />
Propionsäure<br />
Buttersäure<br />
Stearinsäure<br />
Malonsäure<br />
3
� Molekülstruktur sp 2 hybridisiertes C-Atom<br />
δ–<br />
O<br />
~120°<br />
R C ~120° δ+<br />
O H<br />
δ–<br />
planare Struktur<br />
� starke intermolekulare Wechselwirkung durch Wasserstoffbrücken<br />
R<br />
C<br />
O<br />
O<br />
H<br />
H<br />
O<br />
O<br />
C<br />
R<br />
cyclische Dimere<br />
hohe Siedepunkte; Essigssäure: Sdp. 118 °C<br />
� Löslichkeit<br />
Physikalische Eigenschaften<br />
- Die ersten drei Glieder der Carbonsäurereihe sind mit Wasser<br />
in jedem Verhältnis mischbar.<br />
- höhere Vertreter: abnehmende Löslichkeit in Wasser<br />
C<br />
C<br />
O<br />
O<br />
4
� Acidität<br />
Chemische Eigenschaften<br />
O<br />
R C<br />
R C<br />
•• �<br />
O<br />
O<br />
••<br />
••<br />
R<br />
Säurestärke<br />
••<br />
C<br />
••<br />
O<br />
••<br />
O<br />
••<br />
H<br />
••<br />
O••�<br />
••<br />
R C +<br />
••�<br />
O<br />
••<br />
H +<br />
O<br />
••<br />
�die negative Ladung im Carboxylat-Anion ist delokalisiert<br />
(Mesomerie-Stabilisierung)<br />
� symmetrische, stabile Struktur<br />
R<br />
C<br />
O –1/2<br />
O–1/2<br />
� schwache Säuren, Säuredissoziationskonstante K S ≈ 10 –5<br />
z.B. CH 3 COOH K S = 1.8×10 –5<br />
5
� Vergleich mit den Alkoholen<br />
C<br />
H 3<br />
Chemische Eigenschaften<br />
� elektronenanziehende Substituenten → zunehmende Säurestärke<br />
C<br />
O<br />
OH<br />
Essigssäure<br />
pK S = 4.72<br />
� Reaktion mit Basen<br />
C<br />
H 3<br />
Cl<br />
CH 2<br />
H<br />
C<br />
H<br />
OH<br />
Ethanol<br />
pK S = 16<br />
C<br />
O<br />
O<br />
H<br />
K S = 1.4×10 –3<br />
Cl 2 CH-COOH K S = 5.5×10 –2<br />
Cl 3 C-COOH K S = 0.23<br />
- stark elektronenanziehende >C=O Gruppe!<br />
R-COOH + NaOH R-COONa + H 2 O<br />
Salz der Carbonsäure<br />
6
Chemische Eigenschaften<br />
� Reaktion mit Alkoholen<br />
R-COOH + HO-R’ � R-COO-R’ + H 2 O reversible Reaktion,<br />
Gleichgewichtsgemisch<br />
Carbonsäureester<br />
� Bildung der Säurechloride<br />
R-COOH<br />
SOCl 2<br />
R<br />
– HCl, – SO2 � Decarboxylierung (= Abspaltung von CO 2 )<br />
R-COOH Erhitzen<br />
� Reduktion der Carbonsäuren<br />
–CO 2<br />
C<br />
R-H<br />
O<br />
Cl<br />
H2 /CuCr2O4 R: lange C-Kette<br />
R-COOH R-CH2OH (Fettalkohole)<br />
7
Herstellung der Carbonsäuren<br />
� Oxidation der primären Alkohole (oder Aldehyde)<br />
� Hydrolyse der Ester<br />
R<br />
R-CH 2 OH –2H<br />
C<br />
O<br />
O<br />
� Hydrolyse der Nitrile<br />
R-C≡N<br />
H 2 O<br />
–NH 3<br />
R'<br />
R-CHO<br />
+ O<br />
R-COOH<br />
+ H 2 O R-COOH + R’-OH<br />
R-COOH (in sauren oder alkalischen Lösungen)<br />
8
Einige Vertreter der gesättigten Monocarbonsäuren<br />
H-COOH Ameisensäure; Vorkommen: Ameise, Brennnessel<br />
Herstellung: CO + NaOH<br />
100 °C<br />
Druck<br />
CH 3 -COOH Essigsäure; wasserfreie Essigsäure: Eisessig,<br />
(Weinessig, Holzessig) Schmp. 16 o C<br />
CH 3 CH 2 -COOH Propionsäure; Konservierungsmittel (fungizid)<br />
CH 3 CH 2 CH 2 -COOH Buttersäure; als Ester Bestandteil in Butter<br />
C 15 H 31 COOH Palmitinsäure<br />
C 17 H 35 COOH Stearinsäure<br />
H-COONa<br />
Baktericide Wirkung (Fruchtsäften, Wein- und Bierfässer)<br />
Bestandteile der Fette<br />
(in Esterform)<br />
9
C<br />
H 3<br />
C<br />
H 3<br />
Ungesättigte Carbonsäuren<br />
CH 2 =CH-COOH Acrylsäure<br />
Polymerisierung<br />
C C<br />
C C<br />
H<br />
H COOH<br />
H H<br />
H 3 C-(CH 2 ) 7<br />
COOH<br />
C C<br />
H H<br />
n<br />
Crotonsäure (E-2-Butensäure)<br />
Isocrotonsäure (Z-2-Butensäure)<br />
(CH 2 ) 7 COOH<br />
C<br />
H 2<br />
CH<br />
COOH<br />
CH 2<br />
Ölsäure (Z-form) [C 17 H 33 COOH]<br />
CH<br />
COOH<br />
n<br />
Polyacrylsäure<br />
10
8<br />
15<br />
11 14<br />
Ungesättigte Carbonsäuren<br />
O<br />
12 9<br />
12 9<br />
Im Leinöl, Nußöl, Mohnöl, Hanföl, Fischöl<br />
5<br />
Arachidonsäure<br />
(Precursor der Prostaglandine)<br />
Prostaglandine<br />
COOH<br />
OH<br />
9 9<br />
E 2H<br />
F<br />
OH OH<br />
OH<br />
PGE 2<br />
COOH<br />
C 19 H 31 COOH<br />
1<br />
COOH<br />
1<br />
COOH<br />
9<br />
Linolsäure, C 17 H 31 COOH<br />
oder 9,12-Octadecadiensäure<br />
(Z, Z)<br />
Linolensäure, C 17 H 29 COOH<br />
Prostansäure<br />
OH<br />
PGF 2a<br />
COOH<br />
COOH<br />
11
Prostaglandine<br />
Prostaglandin-F2α-Analoga<br />
Augenheilkunde zur Glaukomtherapie (Grüner Star)<br />
Bimatoprost - Lumigan®<br />
Latanoprost - Xalatan®<br />
Travoprost - Travatan®<br />
Tafluprost - Taflotan®<br />
in Kombination mit Timolol<br />
Bimatoprost - Ganfort®<br />
Latanoprost - Xalacom®<br />
Travoprost - DuoTrav®<br />
Angiologie (Gefäßmedizin)<br />
als vasoaktive Substanzen zur Verbesserung der Durchblutung<br />
Alprostadil - Prostavasin®<br />
Prostazyklin-Analogon<br />
Iloprost - Ilomedin® und Ventavis®<br />
Gastroenterologie<br />
das Prostaglandin-Analogon Misoprostol zur Prävention von<br />
Magenschleimhautschäden mit Diclofenac<br />
Pränatalmedizin Dinoproston - Minoprost E2®,<br />
zur Auslösung von Wehen<br />
Beim instrumentellen Schwangerschaftsabbruch,<br />
12
Gesättigte Dicarbonsäuren<br />
Oxalsäure COOH<br />
O<br />
O<br />
COOH<br />
C<br />
C<br />
OH<br />
OH<br />
feststoff, Schmp. 189.5 °C; Salze: Oxalate<br />
Vorkommen: - in versch. Pflanzen (z.B. Sauerklee)<br />
- in Harn von einigen Tierarten (Ca-oxalat)<br />
Ca 2+<br />
O<br />
O<br />
C<br />
C<br />
O<br />
O<br />
Ca<br />
toxisch!<br />
Calciumoxalat<br />
weisser Niederschlag, unlöslich in Wasser<br />
Anwendung in der volumetrischen Analyse (Permanganometrie)<br />
(Faktorbestimmung der KMnO 4 -Maßlösung)<br />
5 (COOH) 2 + 2 KMnO 4 + 3 H 2 SO 4 = K 2 SO 4 + 2 MnSO 4 + 10 CO 2 + 8 H 2 O<br />
13
Gesättigte Dicarbonsäuren<br />
Malonsäure<br />
COOH<br />
CH 2<br />
COOH<br />
“Malonester”: Malonsäurediethylester<br />
Bernsteinsäure<br />
Schmp. 136 °C, Salze: Malonate<br />
COOC 2 H 5<br />
CH 2<br />
COOC 2 H 5<br />
COOH Schmp. 185 °C, Salze: Succinate<br />
CH 2<br />
CH 2<br />
COOH<br />
Vorkommen:<br />
- in Bernstein<br />
- in Pflanzen (Weintrauben, Tomaten)<br />
- in lebenden Organismen (Mammalien) Zwischenprodukt im Metabolismus<br />
der Kohlenhydrate<br />
14
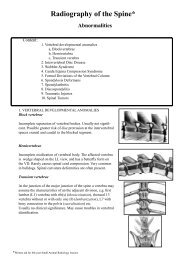
Rekonstruiertes Bernsteinzimmer<br />
im Katharinenpalast in Zarskoje Selo bei Sankt Petersburg<br />
15
Rekonstruiertes Bernsteinzimmer<br />
im Katharinenpalast in Zarskoje Selo bei Sankt Petersburg<br />
16
Gesättigte Dicarbonsäuren<br />
Glutarsäure<br />
im Rübensaft<br />
COOH<br />
( CH2 ) 3<br />
COOH<br />
Adipinsäure<br />
COOH<br />
( CH2 ) 4<br />
COOH<br />
Verwendung: in Herstellung von Polyamidfasern<br />
(z.B. Nylon)<br />
17
Ungesättigte Dicarbonsäuren<br />
Maleinsäure<br />
(cis-Butendisäure)<br />
Fumarsäure<br />
(trans-Butendisäure)<br />
H COOH<br />
H COOH<br />
H<br />
HOOC<br />
–H 2 O<br />
Erhitzen (150 °C)<br />
oder<br />
UV Bestrahlung<br />
COOH<br />
H<br />
C<br />
C<br />
O<br />
O<br />
O<br />
cyclisches Anhydrid<br />
Vorkommen: in Pflanzen<br />
(Erdrauch, Fumaria Officinalis)<br />
kein cyclisches Anhydrid<br />
18
Aromatische Carbonsäuren<br />
Arylcarbonsäuren:<br />
die –COOH Gruppe ist direkt mit dem Benzolring verknüpft<br />
Araliphatische Carbonsäuren:<br />
die -COOH Gruppe in der Seitenkette<br />
Arylcarbonsäuren<br />
Benzoesäure Vorkommen: in verschiedenen Pflanzen<br />
im Harn der pflanzenfressenden<br />
COOH<br />
Säugetiere, in gebundener Form:<br />
Hippursäure<br />
Schmp. 122 o C<br />
pK s = 4,21 stärker, als Essigsäure<br />
Verwendung: Konservierungsmittel<br />
O<br />
C NH-CH2COOH<br />
19
COOH<br />
NO 2<br />
COOH<br />
NH 2<br />
3-Nitrobenzoesäure 2-Aminobenzoesäure<br />
(Anthranilsäure)<br />
COOH<br />
Derivate der Benzoesäure<br />
CH 3<br />
COOH<br />
CH 3<br />
COOH<br />
OH<br />
Salicylsäure<br />
COOH<br />
CH3<br />
COOH<br />
OH<br />
OH<br />
Protocatechusäure<br />
COOH<br />
o-Toluylsäure m-Toluylsäure p-Toluylsäure Gallussäure<br />
HO<br />
OH<br />
OH<br />
20
Aromatische Carbonsäuren<br />
1-Naphthoesäure 2-Naphthoesäure<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
COOH<br />
Phthalsäure Isophthalsäure Terephthalsäuresäure<br />
21
Aromatische Carbonsäuren<br />
COOH<br />
NH2<br />
p-Aminobenzoesäure<br />
Bakterienwuchsstoff<br />
Baustein in Folsäure<br />
COO-CH2CH2-N<br />
NH2<br />
p-Aminobenzoesäureß-diethylaminoethylester<br />
(Procain, Novocain)<br />
Lokalanaesthetikum<br />
C 2H 5<br />
C2H5<br />
22
Aromatische Carbonsäuren<br />
COOH<br />
SO2OH<br />
2-Sulfobenzoesäure<br />
COOH<br />
OH<br />
Salicylsäure<br />
(Antiseptikum<br />
Konservierungmittel)<br />
NH 3<br />
(CH 3 CO) 2 O<br />
O<br />
C<br />
SO2<br />
NH<br />
Saccharin<br />
künstlicher Süßstoff (Na-Salz)<br />
(550mal süßer, als Rohrzucker)<br />
COOH<br />
O<br />
O C CH3<br />
COOH<br />
NH 2<br />
OH<br />
Acetylsalicylsäure<br />
(Aspirin)<br />
p-Aminosalicylsäure<br />
Antipyretikum,<br />
(PAS)<br />
Antineuralgikum,<br />
(Antituberkulotikum)<br />
Entzündungshemmer<br />
Thrombozytenaggregationshemmer<br />
(seit 1977 auf der Liste der unentbehrlichen<br />
Arzneimittel der WHO steht. )<br />
23<br />
Saft der Weidenrinde
Araliphatische Carbonsäuren<br />
CH2COOH CHCOOH<br />
C=C-COOH<br />
OH<br />
H<br />
Phenylessigsäure Mandelsäure trans-Zimtsäure<br />
H<br />
C<br />
OH<br />
C<br />
H<br />
COOH<br />
Z-o-Hydroxyzimtsäure Cumarin<br />
Riechstoff des Waldmeisters<br />
O<br />
O<br />
H<br />
24
Giftige Cumarinderivate<br />
Aflatoxine<br />
Stoffwechselprodukte von<br />
Schimmelpilzgattungen<br />
(Mycotoxine)<br />
sehr starke Carcinogene<br />
Lebertoxische Wirkung 10 µg/kg<br />
O<br />
O<br />
O<br />
O<br />
O<br />
OCH3<br />
Die letale Dosis von Aflatoxin B 1 beträgt bei Erwachsenen<br />
1 bis 10 mg/kg Körpergewicht bei oraler Aufnahme<br />
Grenzwert von 2 µg/kg für Aflatoxine in diversen Lebensmitteln<br />
Aflatoxin B 1<br />
25
L-(-)-Thyroxin<br />
HO<br />
I<br />
I<br />
O<br />
I<br />
I<br />
CH2CHCOOH<br />
NH 2<br />
Bestandteil des Thyreoglobulins der Schilddrüse<br />
(stoffwechselregulierendes Hormon)<br />
26
Substitutionsprodukte aliphatischer Carbonsäuren<br />
Einteilung:<br />
Halogencarbonsäuren<br />
- Halogencarbonsäuren (X-)<br />
- Hydroxycarbonsäuren (HO-)<br />
- Aminosäuren (H 2 N-)<br />
- Oxocarbonsäuren (O=)<br />
Monochloressigsäure ClCH 2 COOH<br />
DichloressigsäureCl 2 CHCOOH<br />
Trichloressigsäure Cl 3 CCOOH<br />
- starke Säure<br />
- use in medical diagnostic:<br />
detection of proteins<br />
27
Substitutionsprodukte aliphatischer Carbonsäuren<br />
2-Chloropropionsäure H C CH COOH<br />
3<br />
3-Chloropropionsaure<br />
δ+<br />
α<br />
δ–<br />
3<br />
2<br />
Cl<br />
H C CH COOH<br />
2 2<br />
Cl<br />
1<br />
3 2 1<br />
Physikalische Eigenschaften: - kristalline Substanzen<br />
- α-halogenierte Carbonsäuren → starke Säuren<br />
CH C<br />
X<br />
O<br />
O<br />
H<br />
-I-Effekt:<br />
das stärker elektronegative Halogenatom (X) zieht die<br />
Bindungselektronen heran, und erleichtert die Ablösung<br />
des Protons, d.h. die Acidität steigt.<br />
28
Substitutionsprodukte aliphatischer Carbonsäuren<br />
Säure pK a<br />
Essigsäure 4.76<br />
Chloressigsäure 2.86<br />
Dichloressigsäure 1.29<br />
Trichloressigsäure 0.65<br />
Erhöhte Reaktivität in nucleophilen Substitutionen<br />
C<br />
H 3<br />
H<br />
HOOC<br />
C<br />
Br<br />
R-2-Brompropionsäure<br />
OH –<br />
* *<br />
Inversion<br />
S N 2 Reaktion<br />
HOC CH 3<br />
H<br />
COOH<br />
stärkerer I-Effekt,<br />
steigende Acidität<br />
S-2-Hydroxypropionsäure<br />
(S-Milchsäure)<br />
Walden-Umkehr<br />
29
Substitutionsprodukte aliphatischer Carbonsäuren<br />
Hydroxysäuren<br />
Hydroxyessigsäure (Glykolsäure) HOCH COOH<br />
2<br />
2-Hydroxypropionsäure (Milchsäure)<br />
3-Hydroxypropionsäure<br />
4-Hydroxybuttersäure<br />
H C CH COOH<br />
3<br />
OH<br />
H C CH COOH<br />
2 2<br />
OH<br />
4 3 2 1<br />
CH2 OH<br />
3<br />
3<br />
2<br />
2<br />
CH 2 CH 2 COOH<br />
1<br />
1<br />
30
Substitutionsprodukte aliphatischer Carbonsäuren<br />
β-Hydroxycarbonsäuren<br />
β<br />
α<br />
HO-CH 2 -CH 2 -COOH CH 2 =CH-COOH<br />
–H 2 O<br />
γ -(und δ)-Hydroxycarbonsäuren:<br />
H 2<br />
γ<br />
C<br />
H 2<br />
β<br />
C<br />
CH 2<br />
OH C<br />
HO O<br />
γ-Hydroxybuttersäure<br />
α<br />
–H 2 O<br />
Acrylsäure<br />
C<br />
H 2<br />
H2 C<br />
O C<br />
CH 2<br />
O<br />
γ-Butyrolacton<br />
Intramolekulare Wasserabspaltung<br />
Lactone: innere Ester<br />
mit Ringstruktur<br />
31
Die wichtigsten Hydroxycarbonsäuren<br />
Glykolsäure HO-CH 2 -COOH<br />
Milchsäure acidum lacticum; Salze: Lactate<br />
Vorkommen: im Pflanzenreich<br />
(in unreifen Weintrauben, im Zuckerrohr)<br />
COOH<br />
COOH<br />
H C<br />
*<br />
OH<br />
HO<br />
*<br />
C H<br />
CH3<br />
CH 3<br />
R-(-) - Milchsäure S-(+) - Milchsäure<br />
Scheele (1780) in der sauren Milch<br />
32
Darstellung:<br />
Vorkommen:<br />
Milchsäure<br />
Verwendung:<br />
Lactobacillus<br />
Lactose (±) - Milchsäure<br />
- in verschiedenen tierischen Organen<br />
- im Muskelsaft (S-(+)-Isomer, Fleischmilchsäure)<br />
Zusatz für alkoholfreie Getränke<br />
33
OH<br />
Die wichtigsten Hydroxycarbonsäuren<br />
Apfelsäure acidum malicum; Salze: Malate<br />
Vorkommen: im Apfel<br />
Weinsäure Salze: Tartrate<br />
Vorkommen: in vielen Früchten<br />
Verwendung: Konservierungsstoff (Lebensmittelindustrie)<br />
Citronensäure acidum citricum; Salze: Citrate<br />
*<br />
*<br />
*<br />
COOH<br />
CH(OH)<br />
CH2<br />
COOH<br />
COOH<br />
CH(OH)<br />
CH(OH)<br />
COOH<br />
Vorkommen: in vielen Früchten (Zitronen, Orangen)<br />
CH2 COOH<br />
im Blut, im Harn<br />
(Zwischenprodukt im Kohlenhydrat Stoffwechsel)<br />
C COOH<br />
CH2 COOH<br />
34
Aldehydcarbonsäuren<br />
Glyoxylsäure<br />
O<br />
C<br />
H<br />
COOH<br />
O<br />
Formylessigsäure C CH 2<br />
H<br />
Oxocarbonsäuren<br />
COOH<br />
Ketocarbonsäuren<br />
CH3<br />
Brenztraubensäure<br />
CH3<br />
C COOH<br />
O<br />
Acetessigsäure<br />
CH3<br />
C CH2COOH<br />
O<br />
Lävulinsäure<br />
C CH2CH2COOH<br />
O<br />
35
Oxalessigsäure<br />
HOOC<br />
HOOC<br />
Oxocarbonsäuren<br />
C CH 2<br />
O<br />
C CH<br />
OH<br />
COOH<br />
Keto-Enol<br />
Tautomerie<br />
COOH<br />
Decarboxylierung der β-Oxocarbonsäuren:<br />
R<br />
C CH 2<br />
O<br />
- CO2<br />
HOOC<br />
2-Oxoglutarsäure<br />
C CH2CH2COOH<br />
COOH R C<br />
O<br />
CH3<br />
O<br />
36