Diazometrie
Diazometrie
Diazometrie
- Keine Tags gefunden...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
QuantifizierungsverfahrenDiazotitrationOximtitrationArgentometrie
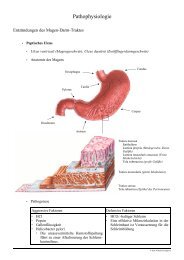
Diazotitration2.5.8. Stickstoff in primären aromatischen AminenDie vorgeschriebene Menge Substanz wird in50 ml verdünnter Salzsäure Roder in einem anderen vorgeschriebenen Lösungsmittelgelöst. Nach Zusatz von3 g Kaliumbromid Rwird die Lösung in einer Eis-Wasser-Mischung gekühlt undlangsam unter andauerndem Rühren mitNatriumnitrit-Lösung (0,1 ml/l)titriert. Der Endpunkt wird elektrometrisch oder mit Hilfe desvorgeschriebenen Indikators bestimmt.
DiazotitrationAllgemeines Prinzip:R-Br++ +NH 2 HNO 2 + H3ON 2 + 3 H2ORReaktionsmechanismus:NH 2++H 3 O+NH 3+ H 2 ONO 2-++ H 3 OHNO 2 + H 2 OHNO 2 + H 3 O + + Br - N OBr -+ 2 H 2 ONitrosylbromid+NH 2 + NOBr+NH 2 N O+ Br -- H 2 O+N N Br -mesomeriestabilisiertesDiazoniumsalz
Endpunktsbestimmung mit IndikatorenFerrocyphenreversible Oxidation des Indikators durch überschüssige salpetrige Säure;Änderung des Redoxpotentials in der LösungNNCNFeCNIINN- e+ eNNCNFeCNNIIINFerrocyphen, Fe 2+(orangegelb)Ferricyphen, Fe 3+(violett)Kaliumiodid-Stärke-PapierKI-Stärkepapier zum Betüpfeln (äußerer Indikator)2 NO 2 + 2I + 4H 2 NO + I 2 + 2H 2 Omit Stärke ⇒ Blaufärbung
Endpunktsbestimmung mit Metanilgelbirreversible Nitrosierung des Indikators durch überschüssiges Nitrit (innerer Indikator)Tropäolin G = Metanilgelbgelbe AzoverbindungNNTropäolin G:= Acid Yellow, Victoriagelb3-(-4-Anilinophenylazo)benzolsulfonsäure-Natriumsalz)Umschlagsbereich: pH (1.2 rot → 2.4 gelb)NHNHNNONN+ H NaNH+ONO-H 2 ONSO 3rotviolettesKationSO 3 HSO 3 Hfarblos bis gelbe NitrosoverbindungNHNNHSO 3 HTropaeolum tropaeum = die Trophäe,Siegeszeichen, weil die Blätter der leuchtendgelbroten Kapuziner-Kresse( tropaeolum =Kressen) schildförmig und die Blüten helmförmigaussehen
Elektrometrische EndpunktsbestimmungBiamperometrisch:2 Pt-ElektrodenAnlegen einer schwachenSpannung:Stromfluss bei:⇒ Oxidation an der Anode⇒ Reduktion an der KathodeAVI(A)V EV (ml)vor dem ÄP (liegen in signifikanter c vor):Kathode:Anode:NH 2 N N,BrBr Cl H 3 O , ,nach dem ÄP (liegen in signifikanter c vor):Kathode:Anode:N N , Br , Cl , H 3 OHNO 2 , NO 2HNO 2(Br 2 )BrHNO 2Potentiometrisch: Pt-Meßelektrode, Ag/AgCl-Bezugselektrode⇒ sigmoide Titrationskurve
Sulfonamide (Sulfanilamide)RH 2 NOSOOHR = H SulfonsäureR = NH 2Sulfanilsäure(4-Aminobenzolsulfonsäure)KZ = KurzzeitsulfonamidMZ = MittelzeitsulfonamidULZ = UltralangzeitsulfonamidOSONH COCH 3Sulfacetamid (Blephamid ® ), KZH 2 NOSONHNOCH 3Sulfamethoxazol (Cotrim ® ), MZHOCOOHO NH 2 NS NHO NSulfadiazin (Sterinor ® ), MZCH 3O NH 2 NS NHO NSulfamerazin (Berlocombin ® ), MZO NH 2 NS NHONH 3 COSulfalen (Longum ® ), ULZO NN NS NHOSulfasalazin (Azulfidine ® )
Sulfonamidartige Strukturen in anderen WSt-KlassenClOHOOCOO SNOHC NH (CH 2 ) 2OCH 3Glibenclamid (Euglucon ® )antidiabetischH 3 CNHFurosemid (Furorese ® )SchleifendiuretikumOSONClNaTosylchloramid-Natrium(Clorina ® )DesinfektionsmittelOSClONHHHOCONSNHOHydrochlorothiazid(Amilorid ® )SaluretikumNHOSClONHHHOH 3 CAcetazolamid (Diamox ® )CarboanhydrasehemmerCOCProbenecid (Probenecid Weimer ® )UrikosurikumOHONSCOOONNNaSaccharin-NatriumSüßstoffSSNOONSONHH
LokalanästhetikaLokalanästhetika vom EstertypOH 2 N C OC 2 H 5OH 2 N C OCH 2 CH 2 N(C 2 H 5 ) 2Benzocain[Anaesthesin ® ]Procain [Novocain ® ]n-H 9 C 4OHN C OCH 2 CH 2 N(CH 3 ) 2Tetracain[Acoin ® ]Lokalanästhetika vom AmidtypCH 3OCH 3NH C CH 2N(C 2 H 5 )Lidocain [Xylocain ® ]
OximtitrationAllgemeines Prinzip:R 1C OR 2+Carbonyl-VerbindungHHNHOHHydroxylaminhydrochloridClR 1C N + H 3 O + ClOHH + H 2 OR 2Oxim• Aldehyde ⇒ Reaktion bei Raumtemperatur, wenige Minuten• Ketone ⇒ bei sterisch gehinderten, mehrere Std. unter Rückfluß erhitzen• Kondensationsreaktion mit Überschuß an Hydroxylamin-HCl ⇒ Oximbildung• Titration der frei werdenden Protonen mit 0.5 N ethanolischer KOH• Indikatoren: Bromphenolblau, Dimethylgelb
OximtitrationBestimmung von:• Campherbaumöl: Campher (Keton), DAB 8OO• Kümmelöl: D-Carvon (Keton), DAB10CHO• Citronenöl: Citral (A = Geranial + B = Neral) (Aldehyd), EuAB 97• Pfefferminzöl: Menthon (Keton), DAB 9O• Reinheitsprüfung von Paraldehyd, EuAB 973H 3 C O CH 3CHO O H 3 C COH
Argentometrie (Fällungsanalyse, Fällungstitration)Argentum = Silber, metron < griech.> = Maß• Teilgebiet der Volumetrie• Stoff + Maßlösung = Ausfällung(Fällungsmittel) (Bilden eines schwerlöslichen Niederschlages)Bedingungen:12Fällung muss schnell erfolgen und zu einem strengstöchiometrisch aufgebauten Niederschlag geringerLöslichkeit führenÄquivalenzpunkt der Fällung muss gut bestimmbar seinGrundlagen:• Löslichkeitsprodukt (LKP): K L
Das Löslichkeitsprodukt (LKP) K LK L -Wert:c (Ag + ) x c (Cl - ) = K L• Maß für die Löslichkeit einer Verbindung• Produkt aus der molaren Konzentration der Kationen undAnionen der gesättigten Lösung eines SalzespK L -Wert:- log K L = pK Lnegativ:positiv:• große Werte des LKP• gute Löslichkeit der Salze• hohe Ionenkonzentration der Lösung im GG• kleine Werte des LKP• schwerlösliche Salze• geringe Ionenkonzentration der Lösung im GG
Fällungstitration von Natriumchlorid mit SilbernitratAnfang der Titration c (Cl - ) >> c (Ag + )C * = zugegebene Reagenzmengec = in Lösung vorliegende Konzentrationmomentane Chlorid-Konzentration beträgt:c (Cl - ) = C 0 -C * (Ag + )Die entsprechende Konzentration an gelöstem Ag + ergibtsich aus dem Löslichkeitsprodukt:K LK Lc (Ag + ) =c (Cl - =) C0 -C *
Reagenzüberschuß c (Ag + ) >> c (Cl - )c (Ag + ) = C * -C 0undK L K Lc (Cl - )= =c (Ag + ) C*-C 0Titrationskurvenlog c (Cl - ) = log C 0+ log (1 - τ ),mit (τ < 1)log c (Cl - )log (Ag + ) = - [pK L+ log C 0+ log (1 - τ )],mit (τ < 1)log c (Ag + )1/2 log K Lτ = 11/2 log K Lτ = 1C * (Ag + )C * (Ag + )
Äquivalenzbereich c (Ag + ) ∼ c (Cl - )Berücksichtigung der Eigendissoziation von AgCl:c (Cl - ) = C 0 -C * + c´(Cl - )xChloridüberschußEinsetzen in das Löslichkeitsprodukt ergibt:ydissoziierterAnteilmit (τ < 1)(x + y ) * y = K Ly = -x 1+2 2 *x 2 + 4 K LÄquivalenzpunkt c (Ag + ) = c (Cl - ) = K L mit (x = 0)
Chloridtitration nach MOHRIndikator: Kaliumchromat-Lösung (K 2 CrO 4 )Titration von Natriumchlorid mit Silbernitrat:INaCl + AgNO 3NaNO 3 + AgClAg + +Cl - AgCl K L = 10 -10 mol 2 /l 2Überschuß an Ag + -Ionen: Bilden von rotbraunem Silberchromat:II 2 Ag + +CrO2-4 Ag 2 CrO 4in saurer Lösung: Bilden von Silberdichromat:K L = 2*10 -12 mol 3 /l 3III 2 CrO 4 2- + 2 H + Cr 2 O 7 2- +H 2 OK L = 2*10 -7 mol 3 /l 3
Titration nach VOLHARDIndikator: Ammonium-Eisen(III)-sulfat-Lösung: NH 4 Fe(SO 4 ) 2• indirekte Titration: nach Zugabe von Silbernitrat-Maßlösungim Überschuss, führt man mit einer Thiocyanat-Maßlösung eineRücktitration durchAusfällen von Silberthiocyanat (farblos):I Ag + +SCN - AgSCN K L = 7*10 -13 mol 2 /l 2Überschuss an SCN - -Ionen: Bilden von tiefrotem Eisenrhodanid:II Fe 3+ +3SCN - Fe(SCN) 3Beachte: AgCl-Niederschlag muss vor der Rücktitration abgetrennt, bzw. mitDibutylphthalat geschützt werden; sonst wird die Erkennung des Umschlagspunktserschwert!III
Titration nach FAJANSIndikator: Eosin (Br - , I - , SCN - ), Fluorescein (Cl - )Titration mit AgNO 3 : Silberhalogenideadsorbieren Chlorid-IonenCl -Cl -Cl -Cl -AgCl-Niederschlagam Äquivalenzpunkt:neutraler NiederschlagAg + Ag + Ag + Ag +Cl - Cl - Cl - Cl -AgCl-NiederschlagInd + Niederschlag = tieffarbiger,neutraler SilberkomplexÜberschreiten des Äquivalenzpunktes:adsorbieren überschüssiger Silber-IonenInd -Ag + Ag + Ag + Ag +Ag + Ag + Ag + Ag +AgCl-Niederschlag
Titration nach BuddeN-unsubstituierte BarbitursäurederivateHNONH+Na 2 CO 3+ Ag +-NaHCO 3HN N - Na +OAg + - - N N Na +O+ Ag +- -Ag + N N- Na + OAg +(löslich)N-methylierte Barbitursäurederivate(unlöslich)+Na 2 CO 3N NHH 3 C-NaHCO 3N N - Na +H 3 COO+ Ag +2 N N - Na + Ag + N N - - N N Na +H - Na +CH3 CH 3 C3OO O- Na +H 3 C+ Ag + Ag + (unlöslich)N N -O- N NOCH 3Ag +(löslich)
BarbiturateH 5 C 2OOHNNHOH 5 C 2OOHNNHPhenobarbital [Luminal®]Primidon [Liskantin®]H 2 C CH CH 2H 5 C 2 C C CHOOHNONCH 3OH 5 C 2H 3 C (CH 2 ) 2HCCH 3 OCH 3Thiopental [Trapanal ® ]HNNHSMethohexital [Brevimythal ® ]
ArgentoacidimetrieAllgemeines Prinzip:X H + Ag + + X Ag +NNH+Bestimmung von:• Purinen• Hydantoinen•Barbituraten•Thiouracilen• AlkinenPyridin:• Stabilisiert den Arzneistoff-Silberkomplex• Verhindert, dass Silberoxid inder alkalischen Lösungausfällt
Theophyllin0.150 g Substanz werden in 100 ml Wasser gelöst. Nach Zusatz von 20 mlSilbernitrat-Lösung wird die Mischung geschüttelt, mit 1 ml Bromthymolblau-Lösung versetzt und mit NaOH-Lösung titriert.H 3 CONONNNH+ H 2 OH 3 CONONNN+ H 3 OSäurestärke des Theophyllins(pKs = 8.6) zu geringCH 3TheophyllinCH 3+ AgTitration in wässriger Lösungnicht möglichH 3 CONONAgNNZugabe von Silbernitrat, GGwird nach rechts verschoben,freigesetzte Protonen werdenmit Natronlauge titriertCH 3Silbertheophyllinat
Phenytoin-Natrium0,180 g Substanz werden in 2 ml Wasser suspendiert. Die Lösung wird mit8 ml Schwefelsäure (0,05 mol/l) versetzt, 1 min lang schwach erhitzt undnach Zusatz von 30 ml Methanol abgekühlt. Die Titration erfolgt mit Hilfeder Potentiometrie unter Verwendung von NaOH-Lösung (0,1 mol/l).Nach Überschreiten des 1. Wendepunkts wird der NaOH-Zusatzunterbrochen, die Lösung mit 5 ml Silbernitrat-Pyridin versetzt, gemischtund die Titration fortgesetzt. Das zwischen den beiden Wendepunktenzugesetzte Volumen Natronlauge wird abgelesen.HN-HHNNHNONHPhenytoinO+HONO+AgONAgNOPhenytoin-Silberkomplex
Phenobarbital0.100 g Substanz in 5 ml Pyridin gelöst, werden nach Zusatz von 0.5 mlThymolphthalein-Lösung R sowie 10 ml Silbernitrat-Pyridin R mit 0.1 Nethanolischer NaOH-Lösung bis zur reinen Blaufärbung titriert.H 3 C OO53N1HPhenobarbitalN H+ 2 Ag + 4ONPyridinH 3 COschwerlöslicherSilberkomplexON AgN OAgNN+2NHPyridinium-Ionen2 + 2OHNHKationensäurez = 22NPyridin+ 2 H 2 O