2. Passivierung Prinzip: Wird an ein Metall ein Potential ... - Userpage
2. Passivierung Prinzip: Wird an ein Metall ein Potential ... - Userpage
2. Passivierung Prinzip: Wird an ein Metall ein Potential ... - Userpage
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
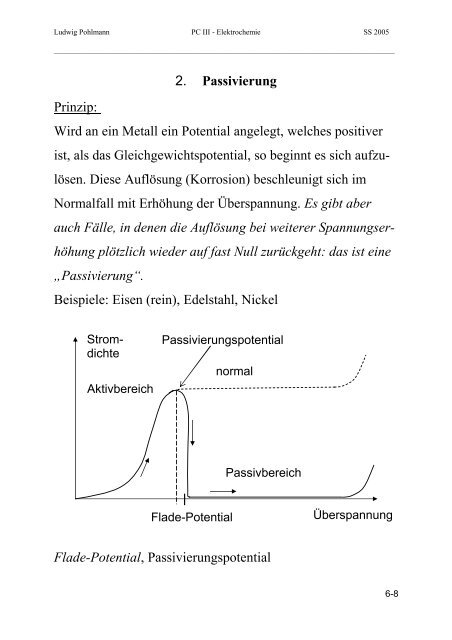
<strong>Prinzip</strong>:<br />
<strong>2.</strong> <strong>Passivierung</strong><br />
<strong>Wird</strong> <strong>an</strong> <strong>ein</strong> <strong>Metall</strong> <strong>ein</strong> <strong>Potential</strong> <strong>an</strong>gelegt, welches positiver<br />
ist, als das Gleichgewichtspotential, so beginnt es sich aufzu-<br />
lösen. Diese Auflösung (Korrosion) beschleunigt sich im<br />
Normalfall mit Erhöhung der Übersp<strong>an</strong>nung. Es gibt aber<br />
auch Fälle, in denen die Auflösung bei weiterer Sp<strong>an</strong>nungser-<br />
höhung plötzlich wieder auf fast Null zurückgeht: das ist <strong>ein</strong>e<br />
„<strong>Passivierung</strong>“.<br />
Beispiele: Eisen (r<strong>ein</strong>), Edelstahl, Nickel<br />
Stromdichte<br />
Aktivbereich<br />
<strong>Passivierung</strong>spotential<br />
Flade-<strong>Potential</strong><br />
normal<br />
Passivbereich<br />
Flade-<strong>Potential</strong>, <strong>Passivierung</strong>spotential<br />
Übersp<strong>an</strong>nung<br />
6-8
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Tr<strong>an</strong>spassive Region: Sauerstoffentwicklung bei sehr hohen<br />
positiven Sp<strong>an</strong>nungen<br />
Reaktivierung: findet bei niedrigeren Sp<strong>an</strong>nungen statt, bildet<br />
<strong>ein</strong>e Hysterese:<br />
Stromdichte<br />
Flade-<strong>Potential</strong>e:<br />
Eisen: +0.58 V gegen NHE<br />
Nickel: +0.36 V<br />
Chrom: -0.22 V<br />
Tit<strong>an</strong>: -0.24 V<br />
Flade-<strong>Potential</strong><br />
Hysterese<br />
Passivbereich<br />
Negativer differentieller elektrischer Widerst<strong>an</strong>d beim Über-<br />
g<strong>an</strong>g zur <strong>Passivierung</strong>! Rdiff = dU/di < 0<br />
Übersp<strong>an</strong>nung<br />
6-9
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Mech<strong>an</strong>ismus der <strong>Passivierung</strong>:<br />
(Faraday 1836, Bonhoeffer, Fr<strong>an</strong>ck, Reddy, 1960iger Jahre)<br />
1. Kl<strong>ein</strong>e positive Übersp<strong>an</strong>nungen: <strong>an</strong>odische Auflösung<br />
des <strong>Metall</strong>s als Salz bzw. Hydroxid; Diffusion der Reak-<br />
tionsprodukte weg von der Oberfläche<br />
<strong>2.</strong> Vergrößerung der Übersp<strong>an</strong>nung: es löst sich mehr<br />
<strong>Metall</strong> pro Zeit<strong>ein</strong>heit der diffusive Wegtr<strong>an</strong>sport wird<br />
geschwindigkeitslimitierend die Konzentration der<br />
Produkte überschreitet das Löslichkeitsprodukt und es<br />
bildet sich <strong>ein</strong> fester Film von Salz oder Hydroxid/Oxid<br />
3. Selbstbeschleunigte Filmbildung: durch Keimbildung<br />
und Keimwachstum<br />
4. Der entstehende Film muss zusammenhängend (dicht)<br />
und leitfähig (Elektronenleiter oder Halbleiter) s<strong>ein</strong> (des-<br />
halb k<strong>ein</strong> Ionentr<strong>an</strong>sport durch den Film!).<br />
Beispiel Eisen: -Fe2O3 , Dicke 2-5 nm<br />
6-10
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Diese Art der <strong>Passivierung</strong> findet auch ohne <strong>an</strong>gelegte äußere<br />
Sp<strong>an</strong>nung in sauren oxidierenden Medien statt: z.B. konzent-<br />
rierte Salpetersäure, Schwefelsäure + Wasserstoffperoxid<br />
In Punkt 2 (oben) ist der Grund erkennbar, warum gerade<br />
große Übersp<strong>an</strong>nungen bzw. konzentrierte Säuren passivie-<br />
rend wirken, während bei kl<strong>ein</strong>en Übersp<strong>an</strong>nungen bzw. ver-<br />
dünnten Säuren das <strong>Metall</strong> korrodiert!<br />
Eisen in konzentrierter Salpetersäure: spont<strong>an</strong>e <strong>Passivierung</strong>!<br />
6-11
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
3. Elektrochemisches Modell der Nervenleitung<br />
Erregungsleitung in Nervenfasern (Axonen): räumlich sich<br />
fortpfl<strong>an</strong>zende Änderung des Membr<strong>an</strong>potentials (Herrm<strong>an</strong>n<br />
1872). Hodgkin - Huxley – Modell 1952<br />
Ostwald, Lillie (1900): Räumliche Fortpfl<strong>an</strong>zung der Aktivie-<br />
rung von passivierten Eisendrähten hat viele Analogien!<br />
„Ostwald-Lilliesches Modell der Nervenleitung“<br />
(Heathcote, Bonhoeffer, Fr<strong>an</strong>ck):<br />
1. Eisenstab in konzentrierter Salpetersäure, spont<strong>an</strong> passi-<br />
viert.<br />
<strong>2.</strong> Berührung mit unedlerem <strong>Metall</strong> (Zink): lokale Aktivie-<br />
rung, Gasentwicklung<br />
3. Ausbreitung der Aktivierung mit konst<strong>an</strong>ter Geschwin-<br />
digkeit<br />
4. Dahinter wieder spont<strong>an</strong>e Repassivierung<br />
v = 9 .. 20 cm/s<br />
6-12
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Mech<strong>an</strong>ismus der Aktivierungsausbreitung (Modellsystem: Fe<br />
in schwefelsaurer H2O2-Lösung):<br />
Quellen:<br />
M. Ducci, M. Oetken, "Nerven wie Drahtseile" Elektrochemi-<br />
sche Modellexperimente zur Erregungsleitung am Nerven,<br />
CHEMKON 4/4 (1998); S. 193<br />
"Highlights der Chemie", Käthe-Kollwitz-Gymnasiums Wil-<br />
helmshaven:http://www.kkgwhv-<br />
schule.kwe.de/kkg_chem/che_allg/nerven/nerven.htm<br />
6-13
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Elektrochemische Reaktionen:<br />
1. spont<strong>an</strong>e <strong>Passivierung</strong> durch das starke Oxidationsmittel<br />
Wasserstoffperoxid, dem Eisen werden Elektronen entzogen:<br />
2Fe<br />
H<br />
2<br />
O<br />
+<br />
2<br />
3H<br />
+<br />
2<br />
O<br />
2H<br />
+<br />
+<br />
Fe<br />
2e<br />
2<br />
O<br />
3<br />
+<br />
2H<br />
6H<br />
2<br />
+<br />
O<br />
+<br />
6e<br />
<strong>2.</strong> Zink in Kontakt mit passiviertem Eisen: das unedlere Zink<br />
setzt Elektronen frei, welche auf das Eisen übertragen werden.<br />
Dadurch wird die Oxidschicht <strong>an</strong> der Kontaktstelle reduziert:<br />
Zn<br />
Fe O<br />
2<br />
3<br />
2+<br />
Zn<br />
+ 6H<br />
+<br />
+<br />
2e<br />
+ 2e<br />
2Fe<br />
2+<br />
+<br />
3H<br />
3. Bl<strong>an</strong>kes Eisen wird freigelegt, es entsteht <strong>ein</strong> Lokal-<br />
element Fe-Fe2O3, d.h. die Rolle des Zinks übernimmt das Ei-<br />
sen. Dadurch wird fortschreitend das Oxid vom R<strong>an</strong>de her<br />
aufgelöst:<br />
Fe<br />
Fe<br />
2<br />
O<br />
3<br />
2+<br />
Fe<br />
+ 6H<br />
+<br />
+<br />
2e<br />
+ 2e<br />
aktive<br />
2Fe<br />
Fläche<br />
2+<br />
+<br />
3H<br />
2<br />
2<br />
O<br />
O<br />
passive Fläche<br />
4. Dahinter, nach <strong>ein</strong>iger Zeit Repassivierung des Eisens.<br />
Zeitliche Verzögerung durch Verarmung des Oxidationsmit-<br />
tels. D<strong>an</strong>ach selbstbeschleunigte Filmbildung durch Keimbil-<br />
dung und Keimwachstum.<br />
6-14
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Analogien zwischen Nervenfaser und Modellsystem<br />
Nervenfaser Modell<br />
Axonmembr<strong>an</strong> Eisenoxidschicht ( -Fe2O3) auf<br />
der Oberfläche des Eisenstabes<br />
Axoninneres Elementares Eisen des Stabes<br />
Extrazelluläre Gewebeflüssigkeit Schwefelsaure Wasserstoffperoxid-Lösung<br />
Ruhemembr<strong>an</strong>potential <strong>Potential</strong> des passiven Eisens<br />
Zellmembr<strong>an</strong> der Nervenfaser ist<br />
im Ruhezust<strong>an</strong>d für Na + Undurchlässigkeit der Eisenoxid-<br />
-Ionen<br />
nicht permeabel<br />
schicht für Ionen und Moleküle<br />
Depolarisation Elektronenzufuhr durch Kontakt<br />
mit <strong>ein</strong>er Zinkelektrode<br />
Reizung führt zur Zunahme der<br />
Durchlässigkeit für Na + Reduktion der Eisenoxidschicht<br />
-Ionen durch Elektronenzufluß<br />
Aktionspotential <strong>Potential</strong>änderung am Eisenstab<br />
bei Aktivierung<br />
Weiterleitung des Aktionspotenti- Kontinuierliche Fortpfl<strong>an</strong>zung eials<br />
durch Lokalströme zwischen ner Aktivitätszone durch Lokal-<br />
erregtem und unerregtem Bereich ströme zwischen aktivem und passivem<br />
Bereich<br />
Repolarisation <strong>Potential</strong>änderung durch<br />
Repassivierung<br />
Refraktärzeit K<strong>ein</strong>e Aktivierung repassivierter<br />
Bereiche durch Lokalströme<br />
Axon wird bei <strong>ein</strong>em Reiz von Längerer Kontakt zur Zinkelekt-<br />
vielen auf<strong>ein</strong><strong>an</strong>der folgenden Porode löst periodisch Aktiv-Wellen<br />
tentialwellen durchlaufen aus<br />
6-15
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
Oszillierende <strong>Passivierung</strong> des Eisens<br />
Wenn r<strong>ein</strong>es Eisen in 8-molare Salpetersäure getaucht wird,<br />
so treten spont<strong>an</strong> Schwingungen zwischen aktivem und passi-<br />
viertem Zust<strong>an</strong>de auf (Herschel 1834)!<br />
pulsierende Gasentwicklung, messbare Oszillationen des<br />
Eisenpotentials:<br />
(aus: Diss. Matthias Ducci)<br />
Oszillationsmech<strong>an</strong>ismus:<br />
1. aktiver Zust<strong>an</strong>d, Eisen löst sich auf. Gleichzeitig wird<br />
das Nitrat zu NO reduziert:<br />
Fe<br />
NO<br />
3<br />
2+<br />
Fe<br />
+ 4H<br />
+ 2e<br />
+ 3e<br />
+<br />
kathodische<br />
Teilreaktion<br />
NO + 2H<br />
O <strong>an</strong>odische Teilreaktion<br />
<strong>Potential</strong> wird positiver, pH nimmt zu (basischer)<br />
2<br />
6-16
Ludwig Pohlm<strong>an</strong>n PC III - Elektrochemie SS 2005<br />
_________________________________________________________________________________________<br />
<strong>2.</strong> Da das <strong>Passivierung</strong>spotential mit dem pH-Wert ab-<br />
nimmt, wird der <strong>Passivierung</strong>sbereich erreicht: selbstbe-<br />
schleunigte Bildung <strong>ein</strong>es Fe2O3-Passivfilmes:<br />
+<br />
2Fe + 3H2O<br />
Fe2O3<br />
+ 6H<br />
+ 6e<br />
alle Reaktionen kommen zum Erliegen!<br />
3. Protonen diffundieren aus der Lösung wieder zur Ober-<br />
fläche, der pH-Wert sinkt wieder bis unter den Punkt ei-<br />
ner stabilen Passivschicht.<br />
4. Der Fe2O3-Passivfilm löst sich wieder auf und es bildet<br />
sich überall bl<strong>an</strong>kes Eisen.<br />
5. Wiederholung bei Punkt 1.<br />
Andere Beispiele oszillierender <strong>Metall</strong>auflösung:<br />
Eisen in HNO3 plus AgNO3<br />
Eisen in H2SO4 plus Dichromat<br />
Andere <strong>Metall</strong>e: Hg, Ni, Co, Cu<br />
6-17










![[UNBEGRENZTE MÖGLICHKEITEN?] - Userpage](https://img.yumpu.com/22343335/1/184x260/unbegrenzte-moglichkeiten-userpage.jpg?quality=85)





