Übungen –Blatt 3: Lösungen elektrophile Additionen, elektrophile ...
Übungen –Blatt 3: Lösungen elektrophile Additionen, elektrophile ...
Übungen –Blatt 3: Lösungen elektrophile Additionen, elektrophile ...
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Übungen</strong> <strong>–Blatt</strong> 3: <strong>Lösungen</strong><br />
<strong>elektrophile</strong> <strong>Additionen</strong>, <strong>elektrophile</strong> aromatische Substitution, Stereochemie<br />
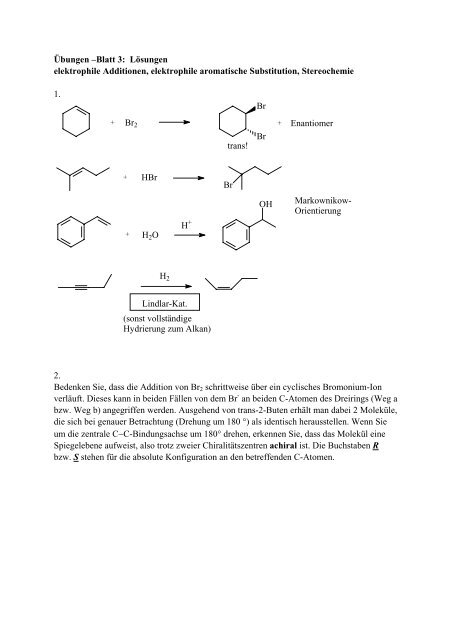
1.<br />
+ Br 2<br />
+ HBr<br />
+ H2O<br />
H2<br />
H +<br />
Lindlar-Kat.<br />
(sonst vollständige<br />
Hydrierung zum Alkan)<br />
trans!<br />
Br<br />
Br<br />
Br<br />
OH<br />
+ Enantiomer<br />
Markownikow-<br />
Orientierung<br />
2.<br />
Bedenken Sie, dass die Addition von Br2 schrittweise über ein cyclisches Bromonium-Ion<br />
verläuft. Dieses kann in beiden Fällen von dem Br - an beiden C-Atomen des Dreirings (Weg a<br />
bzw. Weg b) angegriffen werden. Ausgehend von trans-2-Buten erhält man dabei 2 Moleküle,<br />
die sich bei genauer Betrachtung (Drehung um 180 °) als identisch herausstellen. Wenn Sie<br />
um die zentrale C−C-Bindungsachse um 180° drehen, erkennen Sie, dass das Molekül eine<br />
Spiegelebene aufweist, also trotz zweier Chiralitätszentren achiral ist. Die Buchstaben R<br />
bzw. S stehen für die absolute Konfiguration an den betreffenden C-Atomen.
H3C<br />
H<br />
C<br />
C<br />
H<br />
CH 3<br />
H3C<br />
C C<br />
CH3<br />
H H<br />
+ Br 2<br />
+ Br2<br />
H 3C<br />
H<br />
Br<br />
C<br />
C<br />
b<br />
Br<br />
H<br />
C<br />
a<br />
C<br />
a<br />
CH3<br />
b<br />
CH3<br />
Br<br />
CH 3<br />
Br<br />
a<br />
b<br />
a<br />
b<br />
H3C<br />
H3C<br />
Br<br />
C<br />
S<br />
CH3<br />
C<br />
R<br />
Br<br />
beide Moleküle<br />
sind identisch!<br />
Br<br />
C<br />
S CH3<br />
C<br />
R<br />
Br<br />
H<br />
Br<br />
C<br />
CH3<br />
R<br />
H<br />
C<br />
R<br />
Br<br />
CH3 beide Moleküle<br />
sind Enantiomere!<br />
H<br />
Br<br />
S<br />
C<br />
CH3<br />
C<br />
CH3 S<br />
Br<br />
Ausgehend von cis-2-Buten erhält man dagegen zwei Enantiomere, wie man durch Drehung<br />
eines der beiden Moleküle um 180° (man erkennt dann gut Bild und Spiegelbild!) oder durch<br />
Bestimmung der absoluten Konfiguration (R,R bzw. S,S) erkennt. Beide Verbindungen sind<br />
demnach chiral.<br />
c)<br />
+ Br2<br />
Das Produkt der 1,2-Addition enthält ein Chiralitätszentrum an C3.<br />
b<br />
Br<br />
a<br />
Br<br />
Br<br />
a<br />
Br<br />
Br<br />
"1,2"-Addition<br />
b<br />
Br<br />
Br<br />
"1,4"-Addition<br />
Br<br />
Br
3.<br />
HC C CH3<br />
H3C C C CH3<br />
HBr<br />
H3C C C CH2 CH3<br />
Br 2<br />
CH 2Cl 2<br />
( = LM)<br />
Überschuss<br />
HBr<br />
Br<br />
H 2C C CH 3<br />
Br<br />
H3C C C CH3<br />
Br<br />
Br<br />
H3C C C CH2 CH3<br />
Br H<br />
H Br<br />
4.<br />
Es kann von einem Alkin ausgegangen werden, an das im ersten Schritt unter Säurekatalyse<br />
ein Molekül Wasser addiert wird. Dabei entsteht ein Enol, das im Folgeschritt zum stabileren<br />
Keton isomerisiert. Prinzipiell kommen als Edukte zwei verschiedene Alkine in Frage; das<br />
unsymmetrische Alkin 1 liefert aber neben dem gewünschten Keton Hexan-3-on in etwa<br />
gleicher Menge auch Hexan-2-on, während bei der Reaktion ausgehend vom 3-Hexin (2) nur<br />
ein Keton, nämlich das Hexan-3-on entstehen kann:<br />
1<br />
2<br />
+ H2O<br />
+ H2O<br />
+<br />
H OH<br />
H +<br />
+<br />
OH<br />
OH<br />
H<br />
+<br />
H<br />
Br<br />
H3C C C CH2 CH3<br />
O<br />
Hexan-2-on<br />
O<br />
Hexan-3-on<br />
O<br />
Hexan-3-on<br />
5.<br />
a) Phenole sind stärkere Säuren als aliphatische Alkohole, da das nach Deprotonierung<br />
entstehende Anion (das Phenolat-Ion) mesomeriestabilisiert ist. Während die Ladung in einem<br />
Alkoholat-Ion, wie z.B. in dem gezeigten Cyclohexanolat-Ion am Sauerstoff lokalisiert ist,<br />
kann sie im Phenolat zusätzlich über das gesamte aromatische Ringsystem verteilt werden.
pKS ca. 17<br />
pKS ca. 10<br />
OH O<br />
OH<br />
+ H +<br />
keine Stabilisierung der negativen<br />
Ladung durch Delokalisation<br />
O<br />
Stabilisierung der negativen<br />
Ladung durch Delokalisation<br />
O O O<br />
b) Die phenolische OH-Gruppe ist stark aktivierend und dirigiert nach o/p. Es kann zunächst<br />
eine <strong>elektrophile</strong> Substitution mit Brom in ortho- bzw. para-Stellung (etwas bevorzugt)<br />
erfolgen; für die Bildung des para-Produktes sind der σ-Komplex mit allen mesomeren<br />
Grenzstrukturen gezeigt. Analoge Grenzstrukturen lassen sich für das ortho-Substitutionsprodukt<br />
(das 2-Brom-6-chlorphenol) zeichnen. Mit einem Überschuss an Brom kann die<br />
jeweils verbliebene freie ortho- bzw. para-Position substituiert werden; es resultiert das 2,4-<br />
Dibrom-6-chlorphenol.<br />
Br<br />
OH<br />
OH<br />
Cl<br />
+ Br 2<br />
+ Br2<br />
(analog)<br />
Cl<br />
2-Brom-6-chlorphenol<br />
+ H +<br />
Br<br />
OH<br />
H Br<br />
Cl<br />
+ Br 2 OH<br />
Br<br />
Br<br />
Cl<br />
OH<br />
H Br<br />
+<br />
Br 2<br />
+ H +<br />
2,4-Dibrom-6-chlorphenol<br />
Br<br />
Cl<br />
OH<br />
Br<br />
Cl<br />
OH<br />
H Br<br />
+ H +<br />
Br<br />
Cl<br />
4-Brom-2-chlorphenol<br />
OH<br />
H Br<br />
+ H +<br />
Cl
6.<br />
a)<br />
E-4-Brom-4-Chlor-3-ethylbutan-1-ol<br />
.b)<br />
HS<br />
O<br />
O<br />
H O<br />
S<br />
N S<br />
HO N R<br />
NH2<br />
H<br />
O<br />
OH<br />
COOH<br />
H 3C<br />
R<br />
R<br />
OH CH3 S<br />
c) Es sind 8 Chiralitätszentren vorhanden. Da keine Symmetrieebene auftreten kann (� keine<br />
meso-Form), sind insgesamt 2 8 = 256 Stereoisomere möglich.<br />
CH 3