Giáo án Hóa 9 (Học kì I) soạn theo định hướng phát triển năng lực học sinh năm học 2017-2018 GV Nguyễn Thị Hoa - Đà Nẵng
https://app.box.com/s/aa43m60l9utrgelp6eti1fq1wlwyqw9q
https://app.box.com/s/aa43m60l9utrgelp6eti1fq1wlwyqw9q
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Ngày <strong>soạn</strong>: 01/ 9/ <strong>2017</strong><br />
Tiết 1 ÔN TẬP NỘI DUNG TRỌNG TÂM HÓA 8<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Giúp <strong>học</strong> <strong>sinh</strong> hệ thống lại các kiến thức lý thuyết và bài tập hóa <strong>học</strong> đã<br />
<strong>học</strong> ở lớp 8.<br />
* Về kĩ <strong>năng</strong>: Rèn luyện các kỹ <strong>năng</strong> nhớ lý thuyết, tính to<strong>án</strong> và giải bài tập hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Giáo</strong> dục lòng yêu thích môn <strong>học</strong>, ý chí quyết tâm vươn lên <strong>học</strong> tập hóa <strong>học</strong><br />
tốt hơn.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP : Hoạt động nhóm; đàm thoại.<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong> : Hệ thống câu hỏi, bài tập, phiếu bài tập<br />
HS: Ôn tập lại các kiến thức ở lớp 8.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Không<br />
2. Bài mới:<br />
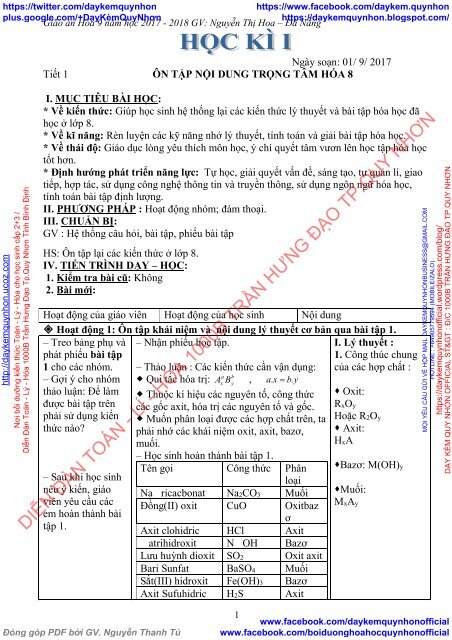
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Ôn tập khái niệm và nội dung lý thuyết cơ bản qua bài tập 1.<br />
– Treo bảng phụ và<br />
<strong>phát</strong> phiếu bài tập<br />
1 cho các nhóm.<br />
– Nhận phiếu <strong>học</strong> tập.<br />
– Thảo luận : Các kiến thức cần vận dụng:<br />
I. Lý thuyết :<br />
1. Công thúc chung<br />
của các hợp chất :<br />
– Gợi ý cho nhóm Qui tắc hóa trị: ,<br />
thảo luận: Để làm Thuộc kí hiệu các nguyên tố, công thức Oxit:<br />
được bài tập trên các gốc axit, hóa trị các nguyên tố và gốc.<br />
RxOy<br />
phải sử dụng kiến Muốn phân loại được các hợp chất trên, ta Hoặc R2Oy<br />
thức nào? phải nhớ các khái niệm oxit, axit, bazơ, Axit:<br />
muối.<br />
HxA<br />
– <strong>Học</strong> <strong>sinh</strong> hoàn thành bài tập 1.<br />
Tên gọi Công thức Phân Bazơ: M(OH)y<br />
– Sau khi <strong>học</strong> <strong>sinh</strong><br />
loại<br />
nêu ý kiến, giáo Na ricacbonat Na2CO3 Muối Muối:<br />
viên yêu cầu các Đồng(II) oxit CuO Oxitbaz<br />
MxAy<br />
em hoàn thành bài<br />
ơ<br />
tập 1.<br />
Axit clohidric HCl Axit<br />
atrihidroxit N OH Bazơ<br />
Lưu huỳnh dioxit SO2 Oxit axit<br />
Bari Sunfat BaSO4 Muối<br />
Sắt(III) hidroxit Fe(OH)3 Bazơ<br />
Axit Sufuhidric H2S Axit<br />
a b<br />
A x<br />
By<br />
a . x = b.<br />
y<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
1<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Chì(II) Nitrat Pb(NO3)2 Muối<br />
Axit Sunf ric H2SO4 xit<br />
Hoạt động 2: Ôn lại các công thức thường dùng.<br />
– Yêu cầu các – Thảo luận nhóm (3 phút). 2. Các công thức thường dùng.<br />
nhóm <strong>học</strong> <strong>sinh</strong> – Các công thức thường<br />
m<br />
m<br />
n = → m = n.<br />
M → M =<br />
hệ thống lại dùng:<br />
M<br />
n<br />
công thức<br />
m<br />
m<br />
V<br />
n = → m = n.<br />
M → M = n<br />
M<br />
n<br />
khí<br />
= → V = n.22,4<br />
thường dùng<br />
22,4<br />
V<br />
n .22,4<br />
làm bài tập.<br />
khí<br />
= → V = n<br />
M<br />
A<br />
M<br />
A<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
– Yêu cầu đại<br />
diện nhóm trình<br />
bày<br />
22,4<br />
M<br />
A<br />
d<br />
A / B<br />
= ; d<br />
A / kk<br />
=<br />
M<br />
B<br />
M<br />
29<br />
n n<br />
CM = → V = → n = CM<br />
. V<br />
V C<br />
mct<br />
C % = 100 %<br />
m<br />
dd<br />
M<br />
Hoạt động 3: Ôn lại một số dạng bài tập cơ bản ở lớp 8.<br />
A<br />
d<br />
A / B<br />
= =<br />
M<br />
; d<br />
A / kk<br />
B<br />
– Đưa bài tập 2 & 3 lên bảng.<br />
– Chú ý. II. Bài tập :<br />
– Gọi <strong>học</strong> <strong>sinh</strong> nhắc lại các bước làm<br />
Bài tập 2:<br />
chính<br />
– Trả lời:<br />
Bài tập 2:<br />
các bước<br />
Tính % các nguyên tố trong NH4NO3 tính <strong>theo</strong><br />
Bài tập 3: Hợp chất A có M là 142g. công thức<br />
% về khối lượng của các nguyên tố trong hóa <strong>học</strong>:<br />
A là:%Na = 32,39%%S = 22,54% ; còn + Tính<br />
lại oxi Hãy xác <strong>định</strong> công thức của A. khối<br />
Bài tập về nhà<br />
lượng Bài tập 3:<br />
Bài tập 4: Hòa tan 2,8g Fe bằng dd mol. Giả sử công thức A là NaxSyOz.<br />
HCl 2M vừa đủ.<br />
+ Tính % Ta có:<br />
a. Tính Vdd HCl cần dùng.<br />
các<br />
b. Tính V khí thoát ra (đkc).<br />
nguyên<br />
c. Tính CM dd thu được(coi Vdd không tố.<br />
Vậy A là<br />
đổi)<br />
Bài tập 5: Hòa tan m1 gam bột Zn cần Giả sử<br />
dùng vừa đủ m2 gam dd HCl. Phản ứng công thức Na2SO4<br />
kết thúc, thu được 0,896l khí (đkc). của (A) là<br />
a. Tính m1 và m2.<br />
NaxSyOz.<br />
b. Tính nồng độ % dd sau phản ứng.<br />
4. Kiểm tra – đ<strong>án</strong>h giá:<br />
5. Hướng dẫn <strong>học</strong> ở nhà: Xem trước bài Tính chất hóa <strong>học</strong> của axit. Một số oxit quan<br />
trọng<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
29<br />
n n<br />
CM = → V = → n = CM<br />
. V<br />
V C<br />
mct<br />
C % = 100 %<br />
m<br />
M<br />
dd<br />
NH4NO3<br />
M<br />
= 80( g)<br />
28<br />
% N = 100%<br />
= 35%<br />
80<br />
4<br />
% H = 100%<br />
= 5%<br />
80<br />
48<br />
% O = 100%<br />
= 60%<br />
80<br />
23x<br />
100%<br />
= 32,39% → x = 2<br />
142<br />
32y<br />
100%<br />
= 22,54% → y = 1<br />
142<br />
16z<br />
100%<br />
= 45,07% → z = 4<br />
142<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
2<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Tiết 2<br />
Ngày <strong>soạn</strong>: 03/ 9/ <strong>2017</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
Những tính chất hóa <strong>học</strong> của oxit bazơ, oxit axit và những PTHH tương ứng .<br />
Cơ sở để phân loại oxit axit và oxit bazơ là dựa vào tính chất hóa <strong>học</strong> của chúng.<br />
* Về kĩ <strong>năng</strong> : Vận dụng tính chất hóa <strong>học</strong> của oxit để giải các bài tập <strong>định</strong> tính và <strong>định</strong><br />
lượng.<br />
* Về thái độ : Giúp <strong>học</strong> <strong>sinh</strong> yêu thích môn hóa <strong>học</strong><br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP : Hoạt động nhóm; thực hành; đàm thoại.<br />
III. CHUẨN BỊ:<br />
- <strong>GV</strong>: Dụng cụ : giá ống nghiệm, ống nghiệm, kẹp gỗ, cốc thủy tinh, ống hút.<br />
<strong>Hóa</strong> chất: CuO, CaO, H2O, dung dịch HCl, quỳ tím.<br />
- HS:Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Không<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tìm hiểu tính chất hóa <strong>học</strong> của oxit.<br />
? Nhắc lại oxit axit và oxit bazơ.?<br />
** HDHS thí nghiệm: 1& 2<br />
? Hãy quan sát, kết luận và viết<br />
PTHH?<br />
– Nhắc lại khái<br />
niệm oxit axit<br />
và oxit bazơ.<br />
– TN quan sát,<br />
nhận xét hiện<br />
I. Tính chất hh của oxit:<br />
1. Tính chất hh của oxit bazơ:<br />
a. Một số oxit bazơ + nước dung<br />
dịch bazơ (kiềm).<br />
1. Cho vào (1) bột CuO & (2) tượng: CaO( r) + H2 O( l)<br />
→<br />
mẫu CaO.<br />
1• Ở (1) không<br />
• Thêm 2 – 3 ml nước cất. hiện tượng, ở<br />
Ca( OH ) 2(dd)<br />
• Dùng ống hút nhỏ chất lỏng có (2) vôi sống<br />
b. Oxit bazơ + dd axit muối +<br />
trong 2 ống trên vào 2 mẫu giấy nhão ra, tỏa<br />
nước.<br />
quỳ tím.<br />
nhiệt, quỳ tím<br />
– Lớp 9:gặp oxit bazơ + nước ở xanh. CuO( r)<br />
+ HCl →<br />
điều kiện thường : Na2O, CaO, – K/luận: 1.a.<br />
CuCl<br />
K2O, BaO,… viết PTHH. 2• Bột CuO<br />
2( ddxl )<br />
+ H2O<br />
2. Cho vào (1) bột CuO & (2)<br />
mẫu CaO.<br />
• Nhỏ 2 – 3 ml dd HCl vào lắc<br />
đen tan dd<br />
xanh lam.<br />
• Bột CaO<br />
c. Một số oxit bazơ + oxit axit <br />
muối.<br />
nhẹ.<br />
trắng tan dd BaO( r )<br />
+ CO2( k )<br />
→ BaCO3( r )<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
3<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
– Thông báo thực nghiệm : một trong suốt.<br />
số oxit bazơ: CaO, BaO, Na2O, – Viết PTHH 2. Tính chất hóa <strong>học</strong> của oxit axit.<br />
K2O,… + oxit axit muối. - K/luận: 1.b. a. Nhiều oxit axit (trừ SiO2) + nước<br />
?Viết PTHH<br />
dung dịch axit.<br />
**Gọi <strong>học</strong> <strong>sinh</strong> viết PTHH: P2O5, - K/luận: 2.a. P2 O5( r) + 3H 2<br />
O( l) → 2H3PO4( dd )<br />
SO2, SO3 tác dụng với H2O.<br />
b. Oxit axit + dung dịch bazơ <br />
– Từ đó rút ra kết luận gì? – Trả lời: trên muối + nước.<br />
* Lưu ý trừ SiO2<br />
mặt xuất hiện CO2( kk )<br />
+ Ca( OH )<br />
2<br />
→<br />
– Liên hệ thực tế: Nước vôi trong lớp v<strong>án</strong> trắng,<br />
CaCO3( r) + H<br />
2<br />
O( l)<br />
để lâu ngày trong kk có hiện lâu ngày lắng<br />
tượng gì? Viết phương trình HH? xuống đáy. * Oxit axit + dung dịch bazơ <br />
– Thông báo: oxit axit: SO2, - K/luận: 2.b. muối axit<br />
P2O5,… cũng có phản ứng tương – So s<strong>án</strong>h<br />
tự.<br />
c. Oxit axit + một số oxit bazơ <br />
– Từ đó, em rút ra kết luận gì?<br />
muối.<br />
* Bổ sung phản ứng tạo muối<br />
axit.<br />
- Trả lời 2.c.<br />
? Oxit axit còn có tính chất hóa giống 1.c.<br />
<strong>học</strong> nào khác nữa?<br />
? So s<strong>án</strong>h tính chất hóa <strong>học</strong> của<br />
oxit axit và oxit bazơ?<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
SO + Ca( OH ) →Ca( HSO )<br />
2( k ) ( dd ) 3 2(dd)<br />
CaO + CO →CaCO<br />
2<br />
( r ) 2( k ) 3( r )<br />
Hoạt động 2: Khái quát về sự phân loại oxit.<br />
– Giới thiệu 4 loại oxit.<br />
– Gọi <strong>học</strong> <strong>sinh</strong> đọc sgk và cho ví<br />
dụ.<br />
Lồng ghép giáo dục yêu thích<br />
môn <strong>học</strong> . Vai trò và ứng dụng<br />
oxit trong cuộc sống .<br />
– Chú ý và ghi<br />
bài.<br />
– Đọc sgk cho ví<br />
dụ.<br />
II.Khái quát về sự phân loại oxit<br />
<strong>theo</strong> tính chất hóa <strong>học</strong> :<br />
1. Oxit bazơ: Na2O, MgO…<br />
2. Oxit axit: CO2, SO2,...<br />
3. Oxit lưỡng tính: Al2O3 , ZnO ,<br />
4. Oxit trung tính: CO, NO<br />
4. Kiểm tra – đ<strong>án</strong>h giá:<br />
Bài tập 1. Cho : K2O, Fe2O3, P2O5. Hãy gọi tên, phân loại và cho biết oxit nào td với:<br />
nước; dd H2SO4 (l); dd NaOH . Viết PTHH?<br />
5. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1, 2, 3, 4, 5, 6 trang 6 / SGK và xem trước bài “Một số oxit quan trọng”<br />
- Bài tập 2 (về nhà): Để hòa tan hoàn toàn 2,4 g một oxit kim loại hóa trị II cần dùng 10 g<br />
dd HCl 21,9%.Hỏi đó là oxit của kim loại nào?<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
4<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Tiết 3<br />
Ngày <strong>soạn</strong>: 8 /9 /<strong>2017</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Những tính chất hóa <strong>học</strong> của canxioxit , các ứng dụng của canxioxit.<br />
- Phương pháp điều chế CaO trong phòng thí nghiệm và trong công nghiệp.<br />
* Về kĩ <strong>năng</strong>: Viết phương trình HH của CaO và khả <strong>năng</strong> làm các bài tập hóa <strong>học</strong>.<br />
* Về thái độ : Giúp <strong>học</strong> <strong>sinh</strong> hứng thú với môn <strong>học</strong><br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, trực quan, hoạt động nhóm.<br />
III. CHUẨN BỊ:<br />
- <strong>GV</strong>: + <strong>Hóa</strong> chất: CaO, dung dịch HCl, dung dịch H2SO4 loãng, CaCO3, dd Ca(OH)2.<br />
+ Dụng cụ: Ống nghiệm, cốc thủy tinh, đũa thủy tinh.<br />
+ Tranh ảnh lò nung vôi trong công nghiệp và thủ công.<br />
- HS: Sưu tầm tư liệu về nghề sản xuất vôi ở địa phương.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ và chữa bài tập:<br />
Trình bày tính chất hóa <strong>học</strong> của oxit bazơ? Viết phương trình hóa <strong>học</strong>?<br />
Bài tập 1 phần củng cố tiết 2?<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tìm hiểu tính chất lý, hóa của CaO.<br />
- Từ bài 1, khẳng <strong>định</strong> CaO<br />
là oxit bazơ.<br />
- Yêu cầu HSQS một mẫu<br />
CaO và đọc thông tin SGK,<br />
nêu tính chất vật lý cơ bản<br />
của CaO?<br />
- Giới thiệu cách tiến hành<br />
nghiên cứu một số thí nghiệm<br />
minh họa tính chất hóa <strong>học</strong><br />
của CaO.<br />
• TN 1: Nhỏ từ từ nước vào<br />
- Nghe.<br />
- Quan sát và trả lời:<br />
1.<br />
- Nghiên cứu <strong>theo</strong><br />
nhóm.<br />
- Hiện tượng: tỏa nhiệt,<br />
<strong>sinh</strong> ra chất rắn màu<br />
trắng, tan ít trong nước.<br />
- K/luận: 2.a.<br />
A- CANXI OXIT (vôi sống)<br />
CaO :<br />
I. Tính chất :<br />
1. Tính chất vật lý.<br />
– Là chất rắn, màu trắng, nóng<br />
chảy ở nhiệt độ rất cao<br />
(2585 0 C).<br />
2. Tính chất hóa <strong>học</strong>.<br />
a. Canxi oxit + nước dung<br />
dịch canxi hidroxit<br />
mẩu CaO.<br />
* Cung cấp thêm: Chú ý khi<br />
thực hiện phản ứng tôi vôi.<br />
Ca(OH)2 tan ít , phần tan tạo<br />
thành dd bazơ. CaO hút ẩm<br />
mạnh nên được dùng để làm<br />
khô nhiều chất.<br />
• TN 2: Nhỏ từ từ dd HCl vào<br />
- Nghe và ghi bổ sung.<br />
- Hiện tượng: CaO tan<br />
trong dd HCl, tỏa nhiệt.<br />
- K/luận: 2.b.<br />
- Tính chất này, để khử<br />
chua đất trồng (NN), xử<br />
lý nước thải (CN), ...<br />
CaO + H O → Ca( OH )<br />
( r ) 2 ( l) 2( dd )<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Ca(OH)2 tan ít trong nước, phần<br />
tan tạo thành dung dịch bazơ.<br />
b. Phản ứng của canxioxit với<br />
axit:<br />
Canxi oxit + dd axit muối<br />
canxi + nước.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
5<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
mẩu CaO.<br />
CaO + 2HCl → CaCl2 + H<br />
2O<br />
- Chú ý, viết phương<br />
trình hh và kết luận 2.c.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
?Tính chất này có ứng dụng<br />
gì trong nông nghiệp? Công<br />
nghiệp?<br />
- Thông báo: Để CaO trong<br />
không khí CaO hấp thụ CO2<br />
Canxicacbonat.<br />
? Viết phương trình hh?<br />
Lồng ghép giáo dục sử<br />
dụng chất CaO tiết kiệm,<br />
đúng mục đích, an toàn và<br />
môi trường<br />
c. Phản ứng của canxioxit với<br />
oxit axit.<br />
Canxi oxit + oxit axit muối<br />
canxi.<br />
CaO + CO → CaCO<br />
( r ) 2( k ) 3( r )<br />
Hoạt động 2: Ứng dụng của CaO.<br />
- Theo em CaO có những<br />
ứng dụng gì?<br />
*<strong>GV</strong> giải thích rõ và giáo<br />
dục môi trường em<br />
– Trả lời:<br />
II. Ứng dụng :<br />
– Dùng trong luyện kim và làm nguyên<br />
liệu cho công nghiệp hóa <strong>học</strong>.<br />
– Khử chua, xử lý nước thải, sát trùng …<br />
Hoạt động 3: Sản xuất CaO.<br />
? Nguyên liệu để sản xuất<br />
canxioxit?<br />
Tự đọc<br />
thông tin và<br />
III. Sản xuất :<br />
* Nguyên liệu là đá vôi, chất đốt là than<br />
củi, dầu, khí, …<br />
Yêu cầu hs viết các PTHH trả lời.<br />
?<br />
* Các phản ứng:<br />
Viết PTHH<br />
<strong>GV</strong> chốt lại kiến thức.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
Yêu cầu HS đọc phần ghi nhớ, giải bài tập 1 trang 9/ SGK<br />
- Phát phiếu bài tập cho <strong>học</strong> <strong>sinh</strong>:<br />
Ca(<br />
OH)<br />
2<br />
<br />
0<br />
t<br />
CaCl<br />
2<br />
CaCO3<br />
⎯⎯→ CaO → <br />
Ca(<br />
NO3<br />
)<br />
2<br />
<br />
CaCO3<br />
o<br />
<br />
t<br />
C + O2 ⎯⎯→ CO2<br />
<br />
CaCO ⎯⎯→ CaO + CO<br />
o<br />
t<br />
3( r) ( r) 2( k )<br />
- Bài tập1: 8g oxit kim loại R hóa trị II tác dụng vừa đủ với 200 ml dd H2SO4 1M. Xác<br />
<strong>định</strong> công thức oxit.<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 2, 3, 4 trang 9 / SGK và xem phần còn lại của bài.<br />
- Bài tập 2(về nhà): Hòa tan 8 gam MgO cần vừa đủ 200ml dung dịch HCl có nồng độ CM.<br />
.Viết phương trình hh. Và tính CM của dung dịch HCl đã dùng.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
6<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 11/ 9/ <strong>2017</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Tiết 4<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Các tính chất của SO2. Các ứng dụng của SO2 và phương pháp điều chế<br />
SO2 trong phòng thí nghiệm và trong công nghiệp<br />
* Về kĩ <strong>năng</strong>: Viết phương trình HH và làm các bài tập tính to<strong>án</strong> <strong>theo</strong> phương trình hóa<br />
<strong>học</strong><br />
* Về thái độ : Giúp <strong>học</strong> <strong>sinh</strong> hứng thú với môn <strong>học</strong><br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, hoạt động nhóm<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong> : bảng phụ<br />
HS : ôn kiến thức, bảng phụ, bút lông<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Hoàn thành chuỗi phản ứng bằng phương trình hóa <strong>học</strong><br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất của SO2.<br />
- Giới thiệu: tính<br />
chất vật lý SO2<br />
- Từ bài 1, biết<br />
SO2 có tính chất<br />
hóa <strong>học</strong> của oxit<br />
axit.<br />
? Nêu tính chất hh<br />
của SO2 và viết<br />
PTHH.<br />
– Nghe và ghi.<br />
– Nhắc lại và viết<br />
PTHH :<br />
• Tác dụng với<br />
nước.<br />
2.a.<br />
I. Tính chất :<br />
1. Tính chất vật lý: là chất khí không màu,<br />
mùi hắc, độc, nặng hơn không khí.<br />
2. Tính chất hóa <strong>học</strong>:<br />
a. Lưu huỳnh đioxit + nước dung dịch axit<br />
sunfurơ.<br />
- SO2 là chất khí<br />
b.<br />
độc gây hại đến • Tác dụng với dung * Lưu huỳnh đioxit + dung dịch bazơ <br />
sức khỏe con dịch bazơ. muối sunfit + nước.<br />
người.<br />
2.b.<br />
SO + Ca( OH ) → CaSO + H O<br />
– Gọi <strong>học</strong> <strong>sinh</strong><br />
đọc sản phẩm tạo<br />
thành.<br />
- SO2 là chất gây<br />
ô nhiễm không<br />
• Tác dụng với oxit<br />
bazơ.<br />
2.c.<br />
– Gọi tên sản phẩm:<br />
H2SO3: Axit<br />
SO + H O → H SO<br />
2( k ) ( l) 2 3( dd )<br />
2<br />
2( k ) ( dd ) 3( r) 2 ( l)<br />
2<br />
* Lưu huỳnh đioxit + dung dịch bazơ <br />
muối hiđro sunfit<br />
SO + Ca( OH ) → Ca( HSO )<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
2( k ) ( dd ) 3 2(dd)<br />
2<br />
c. Lưu huỳnh đioxit + oxit bazơ muối sunfit<br />
SO2 + BaO BaSO3<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
7<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
khí là một trong Sunfurơ<br />
những nguyên CaSO3:Canxi<br />
nhân gây mưa Sunfuric<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
axit.<br />
BaSO4: Bari Sunfit.<br />
Hoạt động 2: Ứng dụng và điều chế SO2.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> tự đọc thông tin và<br />
cho biết ứng dụng của SO2.<br />
- Chốt lại kiến thức.<br />
III.<br />
* Giới thiệu 1. Cách điều chế SO2 trong<br />
phòng thí nghiệm: muối Sunfit + axit<br />
(dd HCl, H2SO4).<br />
? SO2 thu bằng cách nào? Cách đẩy<br />
nước hay đẩy không khí (úp hay ngửa<br />
bình thu), giải thích?<br />
* Giới thiệu 2. Cách điều chế SO2 trong<br />
công nghiệp.<br />
• Đốt S trong không khí.<br />
• Đốt quặng Pirit sắt.<br />
? Viết PTHH?<br />
Lồng ghép giáo dục sử dụng chất SO2<br />
tiết kiệm, đúng mục đích, an toàn<br />
Trong sản xuất công nghiệp, SO2 là mối<br />
hiểm họa về ô nhiễm khí quyển.<br />
– Tự thu thập<br />
thông tin về<br />
ứng dụng SO2<br />
→ II.<br />
–Trả lời:<br />
SO2 thu<br />
bằng cách đẩy<br />
không khí<br />
(ngửa bình<br />
thu). Vì SO2<br />
nặng hơn<br />
không khí.<br />
Không thu<br />
bằng cách đẩy<br />
nước vì SO2<br />
tác dụng với<br />
nước.<br />
→ III.<br />
– Viết PTHH<br />
II. Ứng dụng:<br />
– Sản xuất H2SO4.<br />
– Tẩy trắng bột gỗ trong công<br />
nghiệp giấy.<br />
– Chất diệt nấm, mốc...<br />
III. Điều chế:<br />
1. Trong phòng thí nghiệm:<br />
muối sunfit + dd axit (HCl,<br />
H2SO4 loãng)<br />
Na SO<br />
+ H SO<br />
2 3( r) 2 4( dd )<br />
→ Na SO + SO + H O<br />
2 4( dd ) 2( k ) 2<br />
2. Trong công nghiệp:<br />
– Đốt S trong không khí:<br />
S + O ⎯⎯→ SO<br />
t<br />
( r) 2( k) 2( k)<br />
Đốt quặng pirit sắt.<br />
o<br />
o<br />
t<br />
2( r) +<br />
2( k) ⎯⎯→<br />
2 3( r) +<br />
2( k)<br />
4FeS 11O 2Fe O 8SO<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
- Phát phiếu <strong>học</strong> tập cho <strong>học</strong> <strong>sinh</strong>: Hoàn thành sơ đồ chuyển hóa sau:<br />
CaCO<br />
3<br />
→ CaO → CaSO<br />
3<br />
→ SO<br />
2<br />
H<br />
2SO<br />
<br />
→ K<br />
2SO<br />
BaSO<br />
- Bài tập 1:Cho 8g SO2 tác dụng được với nước thu được 250ml dung dịch axit.<br />
a. Tính nồng độ mol của dung dịch axit thu được.<br />
b. Dẫn toàn bộ lượng khí trên đi qua 800 ml dung dịch Ca(OH)2 0,1 M .Tính m kết tủa ?<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 3, 4, 5, 6 trang 11/SGK và xem trước bài “Tính chất hóa <strong>học</strong> của axit”<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
3<br />
3<br />
3<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
8<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 15 /9 /<strong>2017</strong><br />
Tiết 5<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Các tính chất hóa <strong>học</strong> chung của axit.<br />
* Về kĩ <strong>năng</strong> :<br />
- Viết được PTHH của axit, phân biệt dd axit với dd bazơ, dd muối.<br />
- Làm bài tập tính <strong>theo</strong> phương trình hóa <strong>học</strong>.<br />
* Về thái độ: Giúp <strong>học</strong> <strong>sinh</strong> ý thức giữ gìn và cẩn thận với hóa chất đồng thời say mê bộ<br />
môn hóa <strong>học</strong>.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, thực hành.<br />
III. CHUẨN BỊ:<br />
- <strong>GV</strong>: Dụng cụ thí nghiệm: ống nghiệm, kẹp gỗ, ống hút, giá ống nghiệm.<br />
<strong>Hóa</strong> chất: dd HCl, H2SO4 loãng, Zn hoặc Al, dd CuSO4, dd NaOH, Fe2O3, quỳ tím.<br />
- HS: Ôn lại <strong>định</strong> nghĩa axit<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Hoàn thành chuỗi phản ứng bằng phương trình hóa <strong>học</strong><br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất hóa <strong>học</strong> của axit:<br />
- HDHSTN và quan sát, nêu<br />
nhận xét, viết các PTHH kết<br />
luận:<br />
TN1- Nhỏ một giọt dd HCl vào<br />
mẫu giấy quỳ tím.<br />
* Lưu ý: Tính chất này giúp<br />
chúng ta nhận biết dung dịch<br />
axit.<br />
- Bài tập 1: Trình bày PP hóa<br />
<strong>học</strong> để phân biệt các dd NaCl,<br />
NaOH, H2SO4.<br />
TN2: Cho vào ống (1) một<br />
– Các nhóm làm thí<br />
nghiệm, quan sát và nêu<br />
nhận xét:<br />
1- Quỳ tím → đỏ.<br />
- K/luận: 1.<br />
– Làm bài tập 1: Lần<br />
lượt nhỏ các dd vào<br />
mẫu giấy quỳ tím.<br />
Quỳ tím đỏ: dd<br />
H2SO4.<br />
Quỳ tím xanh: dd<br />
NaOH.<br />
Quỳ tím không đổi màu<br />
I. Tính chất hóa <strong>học</strong> :<br />
1. Dung dịch axit làm đổi<br />
màu chất chỉ thị màu.<br />
• Dung dịch axit làm chuyển<br />
màu quỳ tím thành đỏ.<br />
2. Dung dịch axit + nhiều<br />
kim loại muối + khí H2.<br />
viên Zn; ống (2): mẫu dây là dd NaCl.<br />
Zn + 2HCl<br />
→ ZnCl<br />
2<br />
+ H<br />
2<br />
<br />
đồng. Nhỏ 1 – 2ml dd HCl vào<br />
hai ống.<br />
- TN2: (1) Có bọt khí, 3. Dung dịch axit + bazơ <br />
* Lưu ý: kim loại trước H trang viên Zn tan dần. muối + nước.<br />
53/sgk<br />
(2) không hiện tượng H<br />
2<br />
SO4(dd) + Cu( OH )<br />
2( r )<br />
- Lưu ý tiếp: axit HNO3(đ), - K/luận: 2.<br />
H2SO4(đ) + nhiều kim loại<br />
→ CuSO4(dd) + 2H2O<br />
nhưng không giải phóng H2. - TN3: (1) Cu(OH)2 bị<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
9<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- TN3: Cho vào (1): Cu(OH)2; hòa tan tạo dd xanh lam. 2NaOH<br />
+ H2SO4<br />
(2): NaOH (có phenolphtalein) (2) dd NaOH có phenol<br />
→ Na2SO4 + 2H2O<br />
màu hồng.<br />
từ màu hồng trở về<br />
Cho thêm vào 2 ống dd không màu.<br />
4. Dung dịch axit + oxit bazơ<br />
H2SO4.<br />
– Kết luận: 3.<br />
muối và nước.<br />
- Giới thiệu: Phản ứng giữa axit – Nhắc lại và viết<br />
6HCl<br />
+ Fe2O3( r)<br />
→<br />
với bazơ gọi là phản ứng trung phương trình HH<br />
hòa.<br />
– Kết luận: 4.<br />
FeCl3(dd) + 3H2O<br />
? Nhắc lại tính chất oxit bazơ + → 5.<br />
axit và viết PTHH?<br />
H2SO4 + BaCl2<br />
→ 5. Dung dịch axit + dung<br />
- Giới thiệu 5. Ngoài ra, axit BaSO4 + 2HCl<br />
dịch muối-> axit mới + muối<br />
còn tác dụng được với muối (sẽ<br />
mới<br />
<strong>học</strong> ở bài 9).<br />
( sản phẩm phải có chất khí<br />
? Các em đã biết phản ứng dd<br />
hoặc chất rắn)<br />
axit + dd muối ở lớp 8?<br />
Lồng ghép giáo dục yêu thích<br />
môn <strong>học</strong> . Vai trò và ứng dụng<br />
axit trong cuộc sống .<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 2: II. Axit mạnh và axit yếu:(SGK)<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
- Trình bày tính chất hóa <strong>học</strong> của axit. Minh họa bằng phương trình hh?<br />
- Viết PTHH khidd HCl lần lượt +: magiê , sắt (II) hydroxit ,. kẽm oxit , nhôm oxit.<br />
- Bài tập: Lấy 100 ml dd hỗn hợp HCl và HNO3 cho tác dụng với Zn lấy vừa đủ. Sau<br />
phản ứng thu được 5,6 lít khí (đktc) .<br />
a) Xác <strong>định</strong> m của các axit trong hỗn hợp đầu.<br />
b) Tính nồng độ mol các axit trong hỗn hợp đầu<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 1, 2, 3, 4 trang 14 (SGK) và xem trước bài “ Một<br />
số axit quan trọng”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
10<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 18 /9 /<strong>2017</strong><br />
Tiết 06<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Các tính chất hóa <strong>học</strong> của axit HCl, axit H2SO4(l). Cách viết đúng các<br />
phương trình HH thể hiện tính chất hóa <strong>học</strong> chung của axit.<br />
* Về kĩ <strong>năng</strong>: Viết PTHH . Vận dụng những tính chất của axit HCl, H2SO4(l) trong việc<br />
giải các bài tập <strong>định</strong> tính và <strong>định</strong> lượng..<br />
* Về thái độ: Giúp <strong>học</strong> <strong>sinh</strong> ý thức giữ gìn và cẩn thận với hóa chất đồng thời say mê bộ<br />
môn hóa <strong>học</strong><br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, hoạt động nhóm, thực hành.<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong>: Dụng cụ: giá ống nghiệm, kẹp gỗ, cốc thủy tinh, đũa thủy tinh.<br />
<strong>Hóa</strong> chất: dung dịch.<br />
HS: bảng phụ, bút lông<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
- Nêu tính chất hóa <strong>học</strong> chung của axit? Viết phương trình minh họa.<br />
- Gọi HS2 chữa bài tập 3 trang 14 (SGK).<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Axit Clohyđric. (giảm tải)<br />
A. Axit clohyđric :<br />
+ Cho HS đọc SGK<br />
A.<br />
Đọc sgk<br />
1.<br />
1. Tính chất : (sgk)<br />
a- Tính chất vật lí:<br />
Dd khí hiđro trong nước gọi là axit clohiđric . Dd<br />
? Nhắc lại tính chất hóa<br />
<strong>học</strong> của axit?<br />
Trình<br />
bày tính<br />
axit clohiđric đậm đặc là dd bão hòa có nồng độ tối<br />
đa là khoảng 37%<br />
b- Tính chất hóa <strong>học</strong>: Axit clohyđric có đầy đủ<br />
? Trình bày tính chất<br />
hóa <strong>học</strong> của axit<br />
clohyđric ?<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> viết<br />
lại các tính chất và<br />
minh họa bằng PTHH<br />
chất hóa<br />
<strong>học</strong><br />
tính chất hóa <strong>học</strong> của axit :<br />
+ Đổi màu chất chỉ thị.<br />
+ Tác dụng với kim lọai: Al, Zn, …<br />
+ Tác dụng với bazơ:<br />
+ Tác dụng với oxit bazơ:<br />
+ Tác dụng với muối ( sản phẩm phải có chất khí<br />
hoặc chất rắn)<br />
+ Bổ sung: điều chế ,<br />
nhận biết.<br />
2. Đọc<br />
sgk<br />
2. Ứng dụng:(sgk)<br />
3. Điều chế :<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
- Bài tập : Để tung hòa<br />
200 ml dd HCl 0,2M<br />
+Ghi nội<br />
dung bổ<br />
H2 + Cl2 -> 2HCl(k)<br />
NaCl + H2SO4 -> Na2SO4 + HCl (k)<br />
HCl (k) + H2O -> HCl (dd)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
11<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
cần bao nhiêu ml dd sung 4. Nhận biết : thuốc thử:<br />
NaOH 0,1M. Tính nồng 3. & 4. - Quì tím<br />
độ mol của dd muối - Làm - Dd muối AgNO3<br />
<strong>sinh</strong> ra ?<br />
bài tập:<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 2: Axit Sunfuric loãng.<br />
- Quan sát,<br />
đọc SGK và<br />
nêu tính chất<br />
vật lý<br />
- Nhận xét:<br />
H2SO4(đ) dễ<br />
tan trong<br />
nước và tỏa<br />
rất nhiều<br />
nhiệt.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> quan sát lọ<br />
đựng H2SO4(đ) và đọc nội dung<br />
SGK, nêu tính chất vật lý?<br />
- HD và làm thí nghiệm pha loãng<br />
H2SO4(đ), yêu cầu <strong>học</strong> <strong>sinh</strong> nhận<br />
xét.<br />
- Chú ý khi pha loãng axit<br />
H2SO4(đ)<br />
- Nêu: H2SO4(l) có đầy đủ tính<br />
chất hóa <strong>học</strong> của axit mạnh.<br />
? Trình bày tính chất hóa <strong>học</strong> của<br />
axit sunfuric ?<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> viết lại các tính<br />
chất và minh họa bằng PTHH<br />
Lồng ghép giáo dục sử dụng chất<br />
HCl, H2SO4 tiết kiệm , đúng mục<br />
đích , an toàn<br />
Trình bày:<br />
B. Axit Sunfuric :<br />
I. Tính chất vật lý:<br />
– Là chất lỏng s<strong>án</strong>h, không màu, nặng<br />
gần gấp hai lần nước (d = 1,83),<br />
không bay hơi, tan dễ dàng trong<br />
nước và tỏa rất nhiều nhiệt.<br />
Muốn pha loãng H2SO4 (đ) phải rót<br />
từ từ axit đặc vào nước rồi khuấy đều.<br />
II. Tính chất hóa <strong>học</strong>:<br />
1- Axit Sunfuric loãng:<br />
Axit Sunfuric loãng có đầy đủ tính<br />
chất hóa <strong>học</strong> của axit :<br />
+ Đổi màu chất chỉ thị.<br />
+ Tác dụng với kim lọai: Al, Zn, …<br />
+ Tác dụng với bazơ:<br />
+ Tác dụng với oxit bazơ:<br />
+ Tác dụng với muối ( sản phẩm phải<br />
có chất khí hoặc chất rắn)<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
- Chứng minh rằng: HCl, H2SO4(l) có đầy đủ tính chất hóa <strong>học</strong> của một axit<br />
- Hoàn thành chuỗi phản ứng:<br />
HCl → SO<br />
2<br />
→ SO<br />
3<br />
→ H<br />
2<br />
Na2SO4<br />
<br />
SO4<br />
→ ZnSO4<br />
BaSO<br />
- Bài tập 1: Tính thể tích dd HCl 29,2% có D = 1,25 g/ml cần dùng để trung hòa vừa đủ<br />
200 ml dd NaOH 2 M . Tính CM của chất tan trong dd thu được (không thay đổi thể tích).<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1 trang 19 SGK và xem tiếp bài “ Một số axit quan trọng”.<br />
- Bài tập 2(về nhà): Cho 17,76g hổn hợp CaO và Fe2O3 hòa tan hoàn toàn trong 200ml<br />
dung dịch HCl 3,3M. Tính thành phần % các oxit trong hổn hợp.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
4<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
12<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 22/9 /<strong>2017</strong><br />
Tiết 07<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: H2SO4 đặc có những tính chất hóa <strong>học</strong> riêng. Cách nhận biết H2SO4 và<br />
các muối Sunfat. Các nguyên liệu và công đoạn sản xuất H2SO4 trong công nghiệp.<br />
* Về kĩ <strong>năng</strong>: Viết PTHH, phân biệt các lọ hóa chất mất nhãn, làm bài tập <strong>định</strong> lượng<br />
của bộ môn.<br />
* Về thái độ: Giúp <strong>học</strong> <strong>sinh</strong> ý thức giữ gìn và cẩn thận với hóa chất đồng thời say mê bộ<br />
môn hóa <strong>học</strong>.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát, hoạt động nhóm<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong>: Dụng cụ thí nghiệm: Giá ống nghiệm; ống nghiệm, kẹp gỗ, đèn cồn, ống hút.<br />
<strong>Hóa</strong> chất: dd H2SO4 (đ) và loãng, Cu, dd BaCl2, Na2SO4, HCl, NaCl, NaOH.<br />
HS: Xem bài trứơc.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Hoàn thành chuỗi phản ứng phần củng cố tiết 6<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất hóa <strong>học</strong> của H2SO4(đ).<br />
- TN1:<br />
• Cho vào 2 ống một ít lá<br />
đồng.<br />
• Cho vào(1) 1ml dd<br />
H2SO4(l).<br />
• Cho vào (2) 1ml H2SO4 đặc.<br />
• Đun nhẹ cả hai ống<br />
? Nêu hiện tượng và nhận xét<br />
, viết PTHH?<br />
- Bổ sung: H2SO4 đặc còn +<br />
nhiều kim loại khác muối<br />
sunfat, không giải phóng H2.<br />
– Quan sát và nhận xét:<br />
- Hiện tượng: Ở (1) không<br />
hiện tượng. Ở (2) có khí<br />
mùi hắc, dd có màu xanh<br />
lam<br />
H2SO4 đặc nóng + Cu<br />
tạo ra SO2 và dung dịch<br />
CuSO4.<br />
- Kết luận 2.a.<br />
- Hiện tượng: đường<br />
trắng dần sang vàng, nâu,<br />
2. Axit Sunfuric đặc có<br />
những tính chất hóa <strong>học</strong><br />
riêng .<br />
a. Tác dụng với kim loại:<br />
Axit Sunfuric đặc + nhiều<br />
kim loại muối sunfat, +<br />
nước + sản phẩm khử (SO2,<br />
S, H2S, …)<br />
Cu(r)+H2SO4(đnóng)<br />
CuSO4(dd) + SO2(k) + H2O(l)<br />
- TN2: Cho vào cốc thủy tinh<br />
một ít đường. Rồi cho H2SO4<br />
tạo lớp xốp đen, bị đẩy<br />
lên khỏi miệng cốc, tỏa b. Tính háo nước .<br />
(đ) vào. ? Quan sát và nhận<br />
xét hiện tượng? Giải thích<br />
hiện tượng<br />
- Lưu ý: hết sức thận trọng<br />
khi sử dụng H2SO4 đặc<br />
- Có thể viết thư bí mật bằng<br />
dd H2SO4 loãng. Khi đọc thì<br />
hơ nóng hoặc dùng bàn là.<br />
nhiều nhiệt.<br />
- Giải thích: Chất rắn màu<br />
đen là C. Sau đó C phản<br />
ứng với H2SO4 đặc <strong>sinh</strong> ra<br />
SO2, CO2 gây sủi bọt<br />
trong cốc làm C dâng lên<br />
khỏi miệng cốc.<br />
- Kết luận 2.b.<br />
H 2SO4đ<br />
C12H<br />
22O11<br />
⎯⎯⎯→<br />
11H<br />
2<br />
O + 12C<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
13<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- Quan sát và nêu ứng dụng: II. Ứng dụng: ( sơ đồ SGK)<br />
• Dùng trong công nghiệp luyện kim…<br />
- Chú ý.<br />
• Dùng trong sản xuất tơ sợi…<br />
• Nguyên liệu:<br />
III. Sản xuất<br />
• Các công đoạn chính: • Nguyên liệu: S hoặc FeS2 , không khí , oxi, nước.<br />
• Các công đoạn chính:<br />
0<br />
t<br />
+ Sản xuất SO2 S + O2<br />
⎯⎯→ SO2<br />
Hoặc 4FeS 2<br />
+ 11O2<br />
→ 2Fe2O3<br />
+ 8SO2<br />
0<br />
t , V2O5<br />
+ Sản xuất SO3. 2SO2 + O2<br />
⎯⎯⎯<br />
→2SO3<br />
+ Sản xuất H2SO4. SO3 + H<br />
2O<br />
→ H<br />
2SO4<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 3: Nhận biết H2SO4 và muối Sunfat.<br />
- HDHSTN:<br />
• Ống 1: dd H2SO4.<br />
•Ống 2: dd<br />
Na2SO4.<br />
• Cho vào 2 ống 1<br />
giọt dd BaCl2.<br />
Quan sát, nhận<br />
xét và viết PTHH<br />
? Thuốc thử là gì?<br />
- Cho bài tập:<br />
Trình bày PPHH<br />
phân biệt các dd:<br />
K2SO4, KCl, KOH,<br />
H2SO4.<br />
- Làm thí nghiệm <strong>theo</strong> nhóm:<br />
• Hiện tượng: đều xuất hiện kết tủa<br />
trắng.<br />
• Kết luận: (= SO4) kết hợp Ba kết<br />
tủa trắng BaSO4.<br />
- Biết: BaCl2 (Ba(OH)2…) được dùng<br />
làm thuốc thử nhận ra (= SO4)<br />
- Làm bài tập:<br />
• Lần lượt nhỏ các dd trên vào giấy quỳ<br />
tím.<br />
Nhận dd KOH.và dd H2SO4.<br />
•Nhỏ1–2 giọt BaCl2 vào 2 ddK2SO4;<br />
IV. Nhận biết H2SO4 và<br />
muối sunfat<br />
- Dùng quỳ tím nhận ra<br />
axit.<br />
- Dùng thuốc thử thử là dd<br />
BaCl2 hay Ba(NO3)2 hoặc<br />
Ba(OH)2 phản ứng tạo kết<br />
tủa trắng BaSO4<br />
- Có thể dùng kim loại Ba,<br />
…<br />
KCl.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
H SO + BaCl<br />
2<br />
Na SO + BaCl<br />
- Hoàn thành các pư hh sau:<br />
2<br />
4<br />
4<br />
2<br />
→ BaSO + 2HCl<br />
2<br />
4<br />
→ BaSO + 2NaCl<br />
K SO + BaCl → BaSO 2KCl<br />
2 4<br />
2<br />
4<br />
+<br />
4<br />
a) Fe + ? → ? + H b) Al + ? → Al ( SO ) + ?<br />
2 2 4 3<br />
c) Fe( OH ) + ? → FeCl + ? d) H SO + ? → HCl + ?<br />
3 3 2 4<br />
e) Cu + ? → CuSO + ? + ? g) FeS + ? → ? + SO<br />
4 2 2<br />
- Để hòa tan vừa đủ 16g CuO cần 200 g dd H2SO4 thu dd A. Tính C% dd H2SO4<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 2, 3, 5, 6, 7 trang 19/SGK và xem bài “Luyện tập” ( Ôn lại tập).<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
14<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 25 /9 /<strong>2017</strong><br />
Tiết 08<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức : Ôn tập lại các tính chất hóa <strong>học</strong> của oxit bazơ, oxit axit, axit.<br />
* Về kĩ <strong>năng</strong>: Làm các bài tập <strong>định</strong> tính và <strong>định</strong> lượng.<br />
* Về thái độ: Giúp <strong>học</strong> <strong>sinh</strong> ý thức cẩn thận với hóa chất đồng thời say mê bộ môn hóa<br />
<strong>học</strong>.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, hoạt động nhóm<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong>: Phiếu <strong>học</strong> tập; Bảng phụ.<br />
HS: Ôn tập lại các tính chất hóa <strong>học</strong> của oxit, axit.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
a)Hoạt động 1: Ôn lại các kiến thức cần nhớ.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> họat động<br />
I- Kiến thức cần nhớ:<br />
nhóm hoàn thành phiếu <strong>học</strong><br />
tập số 1&2.<br />
- Hoạt động nhóm và<br />
? Viết phương trình minh họa. hoàn thành phiếu<br />
<strong>học</strong> tập.<br />
- Viết PTHH<br />
1.<br />
Oxit bazơ<br />
+H 2 O (4)<br />
? Nhắc lại tính chất hóa <strong>học</strong><br />
của oxit, axit.<br />
A+B<br />
Bazơ (dd)<br />
+? Axit<br />
+? Bazơ<br />
(1) M + H 2 O<br />
(2)<br />
Muối<br />
(3) (3)<br />
+D Kim loại +Quỳ tím<br />
Oxit axit<br />
+H 2 O (5)<br />
Axit (dd)<br />
(1). CaO + 2HCl<br />
→ CaCl<br />
(2). CO<br />
(3). CaO + CO<br />
(5). SO<br />
2<br />
2<br />
+ Ca(<br />
OH)<br />
(4). CaO + H O → Ca(<br />
OH)<br />
2.<br />
2<br />
2<br />
2<br />
+ H O → H SO<br />
2<br />
2<br />
2<br />
→ CaCO + H O<br />
→ CaCO<br />
3<br />
3<br />
+ H O<br />
(1).2HCl<br />
+ Zn → ZnCl + H <br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Muối+ H 2 <br />
(1)<br />
Axit<br />
(4)<br />
Màu đỏ<br />
(2). Fe O + HCl → FeCl + H O<br />
2<br />
3<br />
(3). HCl + NaOH → NaCl + H O<br />
2<br />
3<br />
2<br />
2<br />
2<br />
3<br />
2<br />
2<br />
2<br />
Oxit Bazơ<br />
A<br />
Bazơ<br />
+Axit<br />
+H 2O<br />
Muối<br />
H 2O<br />
Muối<br />
Quỳ tím<br />
+ K.loại<br />
+O.bazơ<br />
+Bazơ<br />
+Bazơ<br />
+H 2O<br />
Oxit Axit<br />
+Axit<br />
Màu đỏ<br />
M+H 2 <br />
M+H 2<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
A+C<br />
Muối+ H 2 O<br />
+E Oxit bazơ +G Bazơ<br />
(2) (3)<br />
A+C<br />
Muối+ H 2 O<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
15<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
– Treo bài tập lên bảng:<br />
1. Cho các chất sau: SO2,<br />
CuO, Na2O, CaO, CO2,. Hãy<br />
cho biết những chất nào tác<br />
dụng được với:<br />
a. Nước.<br />
b. Axitclohydric.<br />
c. Natrihydroxit.<br />
2. Hòa tan 1,2g Mg bằng 50ml<br />
dung dịch HCl 3M.<br />
a. Viết PTHH phản ứng xảy<br />
ra.<br />
b. Tính V khí thoát ra (đkc).<br />
c. Tính CM của dd thu được (<br />
Coi V dd sau phản ứng bằng V<br />
dd HCl).<br />
– Trước khi <strong>học</strong> <strong>sinh</strong> làm bài<br />
tập, yêu cầu <strong>học</strong> <strong>sinh</strong> nhắc lại:<br />
• Các bước của bài tập tính<br />
<strong>theo</strong> phương trình hóa <strong>học</strong>.<br />
• Các công thức liên quan.<br />
II- Bài tập :<br />
1- Bài tập 1:<br />
a) Chất + nước là: SO2, Na2O, CaO, CO2.<br />
b) Chất + axitclohydric là: CuO, Na2O, CaO.<br />
c) Chất + NaOH là: SO2, CO2.<br />
2- Bài tập 2.<br />
a. Mg + 2 HCl → MgCl + H (1)<br />
n<br />
n<br />
Mg<br />
HCl<br />
1,2<br />
= = 0,05mol<br />
24<br />
= 0,05*3 = 0,15mol<br />
Theo(1) n du = 0,05mol<br />
H2 MgCl2<br />
Mg<br />
H2<br />
2 2<br />
n = n = n = 0,05mol<br />
b. m = 0,05*22,4 = 1,12( l)<br />
0,05 0,05<br />
c. C = = 1 M , C = = 1M<br />
MHCldu<br />
HCl<br />
MMgCl<br />
2<br />
0.05 0,05<br />
3- Bài tập 3.<br />
CaO + 2 HCl → CaCl2 + H2O (1)<br />
Fe2O3 + 6 HCl → 2 FeCl3 + 3 H2O (2)<br />
nHCl = 3,3 . 0,2 = 0,66 (mol)<br />
Gọi x,y lần lược là số mol của CaO ; Fe2O3 , ta có :<br />
56x + 160y = 17,76 x<br />
= 0,06 <br />
nCaO<br />
= 0,06( mol)<br />
<br />
2x + 6y = 0,66 y<br />
= 0,09 <br />
nFe 0,09( )<br />
2O<br />
= mol<br />
3<br />
3,36<br />
% CaO = *100 = 18,92%<br />
mCaO<br />
= 0,06*56 = 3,36( g) <br />
17,76<br />
<br />
<br />
<br />
mFe 0,09*160 14,4( ) 14,4<br />
2O<br />
= = g<br />
3<br />
% Fe2O3<br />
= *100 = 81,08%<br />
17,76<br />
3. Cho 17,76g hổn hợp CaO<br />
và Fe2O3 hòa tan hoàn toàn<br />
trong 200ml dung dịch HCl<br />
3,3M.<br />
Tính thành phần % các oxit<br />
trong hổn hợp.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 2, 3, 4, 5 trang 21 SGK và xem trước bài thực<br />
hành.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
16<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 02 /10 / <strong>2017</strong><br />
Tiết 9<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức : Thông qua các thí nghiệm thực hành để khắc sâu kiến thức về tính chất<br />
hóa <strong>học</strong> của oxit, axit.<br />
* Về kĩ <strong>năng</strong>: Tiếp tục rèn luyện kỹ <strong>năng</strong> về thực hành hóa <strong>học</strong>, giải các bài tập thực hành<br />
hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Giáo</strong> dục ý thức cẩn thận, tiết kiệm trong <strong>học</strong> tập và trong thực hành hóa<br />
<strong>học</strong>.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng ngôn ngữ hóa <strong>học</strong>, tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP:<br />
III. CHUẨN BỊ:<br />
- Dụng cụ: giá ống nghiệm, ống nghiệm, kẹp gỗ, lọ thủy tinh miệng rộng, muôi sắt.<br />
- <strong>Hóa</strong> chất: CaO, H2O, P đỏ, dung dịch HCl, dung dịch Na2SO4, dung dịch NaCl, quỳ tím,<br />
dung dịch BaCl2.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong><br />
Hoạt động 1: Tiến hành thí nghiệm.<br />
– HDHSTN 1: Cho một mẫu – Làm thí nghiệm <strong>theo</strong> nhóm, quan sát và nhận xét hiện<br />
CaO và ống nghiệm. Sau đó, tượng:<br />
thêm dần dần 1 – 2ml H2O + Mẫu CaO nhão ra.<br />
Quan sát hiện tượng.<br />
+ Phản ứng tỏa nhiều nhiệt.<br />
? Thử dung dịch sau phản ứng<br />
bằng giấy quỳ tím hoặc dung + Thử dung dịch sau phản ứng bằng giấy quỳ tím: quỳ<br />
dịch phenolphtalein màu của tím chuyển thành màu xanh (dung dịch thu được có tính<br />
thuốc thử thay đổi như thế nào? bazơ).<br />
Vì sao?<br />
? Kết luận về tính chất hóa + Kết luận: Caxioxit có tính chất hóa <strong>học</strong> của oxit bazơ<br />
<strong>học</strong> của CaO và viết PTHH?<br />
– HDHSTN 2: Đốt một ít P đỏ – Làm thí nghiệm, quan sát và nhận xét:<br />
trong bình thủy tinh miệng + P đỏ cháy trong bình tạo hạt nhỏ màu trắng, tan được<br />
rộng. Sau khi P đỏ cháy hết, trong nước tạo thành dd trong suốt.<br />
cho 3ml H2O vào bình, đậy nút, + Nhúng mẫu quỳ tím vào dd đó quỳ tím chuyển thành<br />
lắc nhẹ. Quan sát.<br />
?Thử dd thu được bằng quỳ<br />
tím, nhận xét ?<br />
? Kết luận về tính chất hóa<br />
<strong>học</strong> của P2O5. Viết các PTHH?<br />
– HDHSTN 3: Phân biệt các<br />
dung dịch H2SO4, HCl,<br />
CaO( r)<br />
+ H O(<br />
l)<br />
→ Ca(<br />
OH<br />
2<br />
) 2<br />
màu đỏ ( dd thu được có tính chất axit).<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
+ Kết luận: P2O5 có tính chất hóa <strong>học</strong> của axit.<br />
0<br />
t<br />
4P<br />
+ 5O<br />
⎯⎯→ 2P O<br />
2<br />
2<br />
5<br />
P2<br />
O5<br />
+ 3H<br />
2O<br />
→ 2H<br />
3PO4<br />
• Tính chất giúp ta phân biệt 3 dung dịch là:<br />
+ Dung dịch axit là quỳ tím chuyển thành màu đỏ.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
17<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Na2SO4.<br />
+ Nếu nhỏ BaCl2 vào HCl, H2SO4 thì chỉ có dung dịch<br />
H2SO4 xuất hiện kết tủa trắng.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
– Gợi ý cách làm:<br />
• Để phân biệt được các dung<br />
dịch trên ta phải dựa vào sự<br />
khác nhau về tính chất hóa <strong>học</strong><br />
của các dung dịch đó.<br />
? Em hãy gọi tên và phân loại<br />
chúng?<br />
?Tính chất khác nhau là gì?<br />
• Gọi <strong>học</strong> <strong>sinh</strong> nêu cách làm.<br />
• Cách làm:<br />
+ Ghi số thứ tự 1, 2, 3 cho mỗi lọ đựng dung dịch ban<br />
đầu.<br />
+ Lấy ở mỗi lọ 1 giọt nhỏ vào quỳ tím. Quỳ tím không<br />
đổi màu thì lọ số … dựng dd Na2SO4. Quỳ tím đổi sang<br />
đỏ thì lọ số … và … đựng dd axit.<br />
+ Lấy ở mỗi lọ chứa dd axit 1ml dd cho vào ống<br />
nghiệm, nhỏ 1 giọt dd BaCl2 vào mỗi ống nghiệm.<br />
Trong ống nghiệm xuất hiện kết tủa trắng thì lọ dd<br />
ban đầu có số … là dd H2SO4. Không có kết tủa thì lọ<br />
ban đầu có số … là dd HCl.<br />
– Yêu cầu các nhóm làm thí<br />
nghiệm, viết PTHH và báo cáo Kết quả:<br />
kết quả.<br />
– Lọ 1 đựng dung dịch ………………..<br />
– Lọ 2 đựng dung dịch ………………..<br />
– Lọ 3 đựng dung dịch ………………..<br />
Hoạt động 2: Tường trình: 10 phút.<br />
BaCl<br />
2<br />
+ H<br />
2SO4<br />
→ 2HCl<br />
+ BaSO4<br />
1 Phản ứng – Mẫu CaO nhão ra.<br />
– Dd thu được có tính bazơ.<br />
của CaO – Phản ứng tỏa nhiều nhiệt.<br />
với nước. – Quỳ tím chuyển sang màu<br />
xanh.<br />
2 Phản ứng – P đỏ cháy tạo thành những hạt – Dd tạo thành có tính chất axit.<br />
của P2O5 nhỏ màu trắng ta được trong<br />
với nước. nước.<br />
– Quỳ tím chuyển thành màu đỏ.<br />
3 Nhận biết – Quỳ tím chuyển thành màu đỏ:<br />
các dung dung dịch HCl và H2SO4.<br />
dịch. – Không chuyển màu: dd<br />
Na2SO4.<br />
– Cho BaCl2 vào: có kết tủa<br />
trắng là H2SO4; không là HCl.<br />
Hướng dẫn <strong>học</strong> ở nhà: 1 phút.<br />
– Chuẩn bị kiểm tra 1 tiết: Ôn lại phần Oxit và Axit.<br />
Lồng ghép giáo dục sử dụng oxit, axit đúng mục đích, an toàn, tiết kiệm và môi<br />
trường.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Ôn tập lại kiến thức từ tiết 2 – tiết 8 để tiết sau kiểm tra 1 tiết<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
<br />
CaO( r)<br />
+ H O(<br />
l)<br />
→ Ca(<br />
OH<br />
4P<br />
+ 5O<br />
P O<br />
2<br />
5<br />
2<br />
+ 3H<br />
2<br />
) 2<br />
t<br />
⎯⎯→ 2P O<br />
2<br />
0<br />
2<br />
O → 2H<br />
3<br />
5<br />
PO<br />
BaCl<br />
2<br />
+ H<br />
2SO4<br />
→ 2HCl<br />
+ BaSO4<br />
<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
4<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
18<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 02 /10 / <strong>2017</strong><br />
Tiết 10<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức : Kiểm tra việc nắm kiến thức về oxit và axit cùng với mối liên hệ giữa<br />
chúng<br />
* Về thái độ: Nghiêm túc, trung thực, cẩn thận trong kiểm tra<br />
* Về kĩ <strong>năng</strong>: Khái quát hóa kiến thức, viết phương trình hh, kỹ <strong>năng</strong> phân biệt các hóa<br />
chất, làm bài tập <strong>định</strong> lượng.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: tính to<strong>án</strong> bài tập <strong>định</strong> lượng<br />
II. PHƯƠNG PHÁP: Kiểm tra viết tự luận<br />
III- MA TRẬN VÀ ĐỀ - ĐÁP ÁN:<br />
3. Hướng dẫn <strong>học</strong> ở nhà: Đọc trước tiết 11<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
19<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 7 /10 /<strong>2017</strong><br />
Tiết 11<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
Những tính chất hóa <strong>học</strong> chung của bazơ và viết được phương trình hóa <strong>học</strong> tương ứng<br />
cho mỗi tính chất.<br />
* Về kĩ <strong>năng</strong>:<br />
Vận dụng được những tính chất của bazơ để làm các bài tập <strong>định</strong> tính, <strong>định</strong> lượng, giải<br />
thích những hiện tượng thường gặp trong đời sống sản xuất.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm, đàm thoại<br />
<strong>GV</strong>: Dụng cụ: giá ống nghiệm, ống nghiệm, đũa thủy tinh.<br />
<strong>Hóa</strong> chất: dung dịch Ca(OH)2, dung dịch NaOH, dung dịch HCl, dung dịch<br />
H2SO4(l), dung dịch CuSO4, CaCO3 (hoặc Na2CO3), phenolphtalein, quỳ tím.<br />
HS: Xem bài trước.<br />
III. CHUẨN BỊ:<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tác dụng của dung dịch bazơ với chất chỉ thị màu.<br />
– HDHSTN:<br />
– Gọi đại diện các<br />
nhóm nêu nhận xét.<br />
+ Chuẩn xác kiến<br />
thức:<br />
– Bài tập: 3 lọ mất<br />
nhãn đựng dd<br />
H2SO4, HCl,<br />
Ba(OH)2. Bằng<br />
phương pháp hóa<br />
<strong>học</strong> hãy phân biệt<br />
– Làm thí nghiệm <strong>theo</strong> nhóm:<br />
• Nhỏ 1 giọt dd NaOH lên mẫu giấy quỳ tím<br />
quan sát.<br />
• Nhỏ 1 giọt dd phenolphtalein (không màu)<br />
vào 1 – 2ml dd NaOH. Quan sát sự thay đổi<br />
màu sắc.<br />
– NX: Dd bazơ (kiềm) đổi màu chất chỉ thị.<br />
• Quỳ tím thành xanh.<br />
• Phenolphtalein không màu chuyển thành đỏ.<br />
+ Kết luận 1.<br />
– Làm bài tập:<br />
+ Lấy ở mỗi lọ 1 giọt dd nhỏ vào giấy quỳ tím.<br />
• Quì tím -> xanh : dd Ba(OH)2.<br />
1. Tác dụng của<br />
dd bazơ (kiềm)<br />
với chất chỉ thị<br />
màu:<br />
– Dd bazơ<br />
(kiềm) + quỳ tím<br />
xanh.<br />
– Dd bazơ<br />
(kiềm) + dd<br />
phenolphtalein<br />
không màu <br />
màu đỏ (hồng)<br />
các dd nói trên. • Quỳ tím -> đỏ :dd H2SO4, HCl.<br />
+ Lấy dd Ba(OH)2 nhỏ vào 2 dd chưa phân<br />
biệt<br />
• Có kết tủa trắng: dd H2SO4.<br />
• Không có kết tủa: dd HCl.<br />
Hoạt động 2: Tác dụng của dung dịch bazơ với oxit axit và axit.<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
20<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
? Liên hệ tính chất hóa - Nêu tính chất dd bazơ (kiềm) 2.Tác dụng của dd<br />
<strong>học</strong> của oxit axit, nhắc lại tác dụng với oxit axit và viết bazơ với oxit axit :<br />
tính chất tác dụng của các PTHH các phản ứng sau (cả Dd bazơ + oxit axit <br />
dung dịch bazơ với oxit 2 trường hợp)<br />
muối trung hòa + nước<br />
1) NaOH + CO2<br />
→<br />
axit?<br />
2 NaOH + CO2<br />
→ Na2CO3<br />
+ H<br />
2O<br />
2) Ca( OH )<br />
2<br />
+ SO2<br />
→<br />
Lồng ghép giáo dục yêu<br />
3) KOH + P2O<br />
5<br />
→<br />
thích môn <strong>học</strong> . Vai trò<br />
+ Kết luận 2.<br />
Dd bazơ + oxit axit <br />
và ứng dụng ba zơ<br />
– Nêu tính chất axit tác dụng muối axit<br />
trong cuộc sống .<br />
NaOH + CO<br />
với ba zơ (PƯ trung hòa) và viết<br />
2<br />
→NaHCO3<br />
? Liên hệ tính chất hóa<br />
PTHH (2 trường hợp bazơ tan<br />
<strong>học</strong> của axit, nhắc lại tính<br />
và không tan)<br />
3. Tác dụng của bazơ<br />
chất tác dụng của bazơ 1) NaOH + HCl →<br />
với axit :<br />
với dd axit?<br />
Cu( OH )<br />
2<br />
+ HCl →<br />
Bazơ tan và không tan<br />
? Phản ứng giữa axit và 2) Ba( OH )<br />
2<br />
+ HNO3<br />
→<br />
đều + dd axit muối<br />
Fe( OH )<br />
3<br />
+ HCl →<br />
bazơ gọi là phản ứng gì?<br />
+ nước.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> viết + Kết luận 3.<br />
PTHH minh họa?<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
NaOH + HCl → NaCl + H O<br />
Cu( OH ) + 2HCl → CuCl + H O<br />
2 2 2<br />
Hoạt động 3: Bazơ không tan bị nhiệt phân hủy.<br />
* HDHS thí – TN <strong>theo</strong> nhóm: (tạo ra Cu(OH)2 bằng 4. Bazơ không tan<br />
nghiệm<br />
cách dd CuSO4 + dd NaOH)<br />
bị nhiệt phân hủy<br />
Yêu cầu đại diện • Dùng kẹp gỗ, kẹp vào ống nghiệm rồi oxit + nước.<br />
nhóm nêu hiện đun ống nghiệm chứa Cu(OH)2 trên lửa<br />
tượng, nhận xét và đèn cồn.<br />
viết PTHH – Hiện tượng:<br />
5. Dd bazơ + dd<br />
• Trước đun, chất rắn có màu xanh lơ.<br />
muối -> bazơ mới<br />
• Sau đun, chất rắn có màu đen và có hơi<br />
+ muối mới<br />
– Giới thiệu 5. nước.<br />
(sản phẩm phải có<br />
Dd bazơ + dd – Nhận xét: Bazơ không tan bị nhiệt phân<br />
chất rắn)<br />
muối -> bazơ mới tạo ra oxit và nước.<br />
+ muối mới (<strong>học</strong> + Kết luận 4.<br />
sau)<br />
** Bazơ lưỡng tính vừa + dd axit ; vừa + dd bazơ (Al2O3 + HCl ; Al2O3 + NaOH)<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
- Phân biệt tính chất hóa <strong>học</strong> của bazơ tan và bazơ không tan.<br />
- BT 1: Cho: Cu(OH)2, MgO, Fe(OH)3, CaCO3; NaOH, HCl; Ba(OH)2.<br />
a. Gọi tên và phân loại các chất trên.<br />
b. Trong các chất trên, chất nào tác dụng được với dd H2SO4(l), với khí CO2. Chất<br />
nào bị nhiệt phân hủy. Viết các phương trình hóa <strong>học</strong> phản ứng xảy ra.<br />
- BT 2: 200g dd ROH 8,4 % (R là kim loại kiềm) + đủ với 200 ml dd HCl 1,5 M. Xác <strong>định</strong><br />
R<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 3, 4, 5 trang 25 SGK và xem trước bài “ Một số bazơ quan trọng”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
Cu( OH )<br />
2<br />
CuO + H O<br />
2<br />
0<br />
t<br />
2<br />
⎯⎯→<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
21<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 12 /10 /<strong>2017</strong><br />
Tiết 12<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Các tính chất vật lý, tính chất hóa <strong>học</strong> của NaOH. Viết được các phương<br />
trình hóa <strong>học</strong> minh họa. Phương pháp sản xuất NaOH trong công nghiệp.<br />
* Về kĩ <strong>năng</strong>: Làm các bài tập <strong>định</strong> tính và <strong>định</strong> lượng<br />
* Về thái độ: <strong>Giáo</strong> dục lòng yêu thích bộ môn hóa <strong>học</strong>, vai trò và ứng dụng ba zơ trong<br />
cuộc sống<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, quan sát.<br />
III. CHUẨN BỊ:<br />
<strong>GV</strong>:<br />
- Dụng cụ thí nghiệm: giá ống nghiệm, ống nghiệm, kẹp gỗ, đế sứ.<br />
- <strong>Hóa</strong> chất: Dung dịch NaOH, quỳ tím, dung dịch phenolphtalein, dung dịch<br />
HS: Soạn bài trước ở nhà.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
<strong>Học</strong> <strong>sinh</strong> 1: • Tính chất hóa <strong>học</strong> của bazơ tan.<br />
• Viết phương trình hh giữa NaOH với HCl, CO2.<br />
• Phân biệt NaOH và HCl.<br />
<strong>Học</strong> <strong>sinh</strong> 2:<br />
• Tính chất của bazơ không tan.<br />
• Viết các phương trình hh sau:<br />
Al(<br />
OH)<br />
2. Bài mới:<br />
0<br />
t<br />
⎯⎯→<br />
; Fe(<br />
OH)<br />
0<br />
t<br />
⎯⎯→ ; Fe(<br />
OH<br />
3 2<br />
)<br />
3<br />
+ HCl →<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Họat động 1: Tính chất vật lý của NaOH<br />
- HDHS cho 1 viên NaOH<br />
vào để sứ và quan sát (trạng<br />
thái, màu sắc).<br />
- Tiếp <strong>theo</strong> HDHSTN, quan<br />
sát và nhận xét.<br />
- Gọi <strong>học</strong> <strong>sinh</strong> đọc SGK để<br />
biết thêm tính chất NaOH.<br />
– Các nhóm thí nghiệm:<br />
Cho NaOH vào ống đựng<br />
nước, sờ tay vào.<br />
– Quan sát và nhận xét:<br />
+ Hiện tượng: NaOH tan,<br />
nước nóng, dd tạo thành có<br />
tính nhờn.<br />
– Đọc SGK.<br />
I. Tính chất vật lý :<br />
NaOH là chất rắn, không<br />
màu, hút ẩm mạnh , tan<br />
nhiều trong nước và tỏa<br />
nhiệt.<br />
Dd NaOH có tính nhờn,<br />
làm bục vải, giấy và ăn<br />
mòn da.<br />
* Chuẩn xác kiến thức: + Kết luận I.<br />
Hoạt động 2: Tính chất hóa <strong>học</strong> của NaOH<br />
? Các em đã biết NaOH<br />
thuộc loại bazơ nào? Dự<br />
đo<strong>án</strong> tính chất hóa <strong>học</strong><br />
– Trả lời: NaOH là<br />
bazơ tan nên có<br />
các tính chất của<br />
II. Tính chất hóa <strong>học</strong>:<br />
1. Dd NaOH làm quỳ tím xanh;<br />
làm phenolphtalein không màu đỏ.<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
22<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
của nó?<br />
bazơ tan.<br />
2. Tác dụng với axit:<br />
? Nhắc lại tính chất của<br />
NaOH + HCl NaCl + H2O<br />
bazơ tan.<br />
- Viết PTHH 3. Tác dụng với oxit axit:<br />
* Chuẩn xác kiến thức:<br />
2NaOH+ CO2 Na2CO3+H2O<br />
+ Kết luận II. NaOH+ CO2 NaHCO3<br />
4. Tác dụng với dung dịch muối<br />
Hoạt đọng 3: Ứng dụng và sản xuất NaOH<br />
- Yêu cầu HS đọc III. SGK và - Đọc III. Ứng dụng :<br />
cho biết ứng dụng NaOH. SGK Sản xuất xà phòng, chất tẩy rửa, bột giặt.<br />
và trả Sản xuất tơ nhân tạo.<br />
- Giới thiệu IV. Sản xuất NaOH lời: Sản xuất giấy.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
bằng PP điện phân dd NaCl bão<br />
hòa (có màng ngăn).<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> viết<br />
PTHH.<br />
III.<br />
- Viết<br />
Sản xuất nhôm (làm sạch quặng nhôm trước<br />
khi sản xuất).<br />
Chế biến dầu mỏ…<br />
IV. Sản xuất NaOH:<br />
Lồng ghép giáo dục vai trò và<br />
ứng dụng NaOH trong cuộc<br />
sống .<br />
PTHH.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
Bài tập 1: Hoàn thành sơ đồ phản ứng sau:<br />
Na Na2O NaOH NaCl NaOH Na2SO4.<br />
1)2 NaOH + CO → Na CO + H O<br />
2 2 3 2<br />
NaOH + CO → NaHCO<br />
2 3<br />
2) Ca( OH ) + SO → CaSO + H O<br />
2 2 3 2<br />
Ca( OH ) + 2 SO →Ca( HSO )<br />
2 2 3 2<br />
3)6KOH + P O → 2K PO + 3H O<br />
2 5 3 4 2<br />
2KOH + P O + H O → 2KH PO<br />
2 5 2 2 4<br />
{ K PO + 3H O + P O → 3 KH PO }<br />
3 4 2 2 5 2 4<br />
2NaCl + 2H O ⎯⎯⎯→ 2NaOH + Cl + H <br />
dpcmn<br />
2 2 2<br />
Bài tập 2: Cho 3,04 g hỗn hợp NaOH và KOH tác dụng với dd HCL dư thu được 4,15g<br />
các muối clorua. Tính số gam mỗi hidroxit trong hỗn hợp<br />
Hãy chọn các chất: Zn, Zn(OH)2, NaOH, Fe(OH)3, NaCl, HCl để hoàn thành PTHH sau:<br />
⎯ 0<br />
t<br />
⎯→<br />
a. ......................... Fe2O3 + H2O<br />
b. H2SO4 + ............ Na2SO4 + H2O<br />
c. H2SO4 + ............. ZnSO4 + H2O<br />
d. NaOH + ............ NaCl + H2O<br />
e. ......... + CO2 Na2CO3 + H2O<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1, 2, 3 trang 27 SGK.<br />
- Xem và <strong>soạn</strong> phần “Canxihidroxit – Thang pH”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
23<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 16 / 10 /<strong>2017</strong><br />
Tiết 13<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Các tính chất vật lý, tính chất hóa <strong>học</strong> quan trọng của Ca(OH)2<br />
- Biết ý nghĩa độ pH của dung dịch.<br />
* Về kĩ <strong>năng</strong>:<br />
- Viết các phương trình hóa <strong>học</strong> và khả <strong>năng</strong> làm các bài tập <strong>định</strong> lượng.<br />
- Biết cách pha chế dung dịch Ca(OH)2.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng trong đời sống của Ca(OH)2.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Họat động nhóm, đàm thoại.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
- Dụng cụ: cốc thủy tinh, đũa thủy tinh, phễu, giấy lọc, giá sắt, ống nghiệm, giấy pH.<br />
- <strong>Hóa</strong> chất: CaO, dd HCl, dd NaCl, dd NH3, nước cốt chanh.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>:<br />
Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
- Hoàn thành sơ đồ phản ứng sau: Na Na2O NaOH NaCl NaOH Na2SO4<br />
- Làm bài tập 2 trang 27/ SGK.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Pha chế dung dịch Canxi hydroxit.<br />
– Giới thiệu: dd Ca(OH)2<br />
có tên thường gọi nước<br />
vôi trong<br />
– Hướng dẫn <strong>học</strong> <strong>sinh</strong><br />
– Các nhóm tiến<br />
hành pha chế<br />
dung dịch<br />
I. Tính chất :<br />
1. Pha chế dung dịch Canxi hydroxit:<br />
Hòa tan Ca(OH)2 vào nước vôi sữa <br />
lọc dd Ca(OH)2<br />
cách pha chế dung dịch<br />
Ca(OH)2.<br />
Ca(OH)2.<br />
Kết luận 1.<br />
Hoạt động 2: Tính chất hóa <strong>học</strong>.<br />
? Dự đo<strong>án</strong> tính chất<br />
hóa <strong>học</strong> của dd<br />
Ca(OH)2 ?<br />
? Viết phương trình<br />
hh?<br />
- Trả lời:<br />
Dd Ca(OH)2 là bazơ tan vì<br />
vậy có những tính chất hóa<br />
<strong>học</strong> của bazơ tan.<br />
2: Tính chất hóa <strong>học</strong>:<br />
– Đổi màu chất chỉ thị. Quỳ tím<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
- HDHSTN chứng<br />
minh cho các tính chất<br />
của Ca(OH)2.<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
Kết luận 2.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
xanh; dd phenol đỏ<br />
– Tác dụng với axit.<br />
Ca(OH)2 + 2HCl <br />
CaCl2 + 2H2O<br />
– Tác dụng với oxit axit.<br />
Ca(OH)2 + CO2<br />
CaCO3 + H2O<br />
24<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
• Nhỏ một giọt dd<br />
Ca(OH)2 + 2CO2 Ca(HCO3)2<br />
Ca(OH)2 lên giấy quỳ - Làm thí nghiệm.<br />
– Tác dụng với dd muối.<br />
tím; 1 giọt pp vào • Quỳ tím xanh; phenol <br />
Ca(OH)2.<br />
đỏ.<br />
• Thổi hơi thở vào • Xuất hiện kết tủa ( hóa đục).<br />
nước vôi trong. • Mất màu đỏ<br />
• Ca(OH)2 + phenol<br />
sau đó thêm từ từ HCl<br />
Hoạt động 3: Ứng dụng và thang pH.<br />
? Ca(OH)2 có ứng dụng gì trong đời – Trả lời: 3. Ứng dụng: Làm vật liệu<br />
sống ?<br />
Kết luận 3. xây dựng, khử chua đất trồng<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- Giới thiệu: Người ta dùng thang pH<br />
trọt, khử độc,…<br />
để biểu thị độ axit hoặc bazơ của<br />
dung dịch II.<br />
- Giới thiệu về giấy pH, cách so màu<br />
với thang màu để xác <strong>định</strong> độ pH.<br />
? Kết luận?<br />
- HDHS dùng giấy pH để xác <strong>định</strong> độ<br />
pH của dung dịch:<br />
• Nước chanh, dd NH3,nước máy.<br />
Lồng ghép giáo dục vai trò và ứng<br />
dụng Ca(OH)2 trong cuộc sống .<br />
- Chú ý.<br />
- Kết luận II.<br />
- Các nhóm tiến<br />
hành thí nghiệm<br />
để xác <strong>định</strong> pH<br />
của các dung<br />
dịch.<br />
II. Thang pH.<br />
• pH = 7: trung tính.<br />
• pH 7 : bazơ.<br />
pH càng lớn tính bazơ càng<br />
lớn, pH càng nhỏ tính axit<br />
càng mạnh.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
- Bài tập 1: Trung hòa 200 ml dd H2SO4 1M bằng dd NaOH 20%<br />
a- Tính khối lượng dd NaOH phải dùng<br />
b- Thay dd NaOH bằng dd KOH 5,6%(D=1,045g/ml). Tính V dd KOH cần để trung hòa<br />
dd H2SO4 đã cho<br />
- Hoàn thành các phản ứng sau:<br />
a. ? + ? Ca(OH)2<br />
b. Ca(OH)2 + ? Ca(NO3)2 + ?<br />
c. CaCO3 ? + ?<br />
d. Ca(OH)2 + ? ? + H2O<br />
e. Ca(OH)2 + P2O5 ? + ?<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Chuẩn bị bài “ Tính chất hóa <strong>học</strong> của muối”<br />
- Làm bài tập 1, 3, 4, trang 30 SGK.<br />
V. RÚT KINH NGHIỆM:<br />
⎯ 0<br />
t<br />
⎯→<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
25<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 19 / 10 /<strong>2017</strong><br />
Tiết 14<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>:<br />
* Về kiến thức : Các tính chất hóa <strong>học</strong> của muối.Khái niệm phản ứng trao đổi, điều kiện<br />
* Về kĩ <strong>năng</strong>: Thí nghiệm, viết phương trình HH, giải bài tập hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; quan sát, đàm thoại<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ thí nghiệm: giá ống nghiệm; kẹp gỗ.<br />
<strong>Hóa</strong> chất: dây đồng và các dd AgNO3, H2SO4 , NaOH, NaCl, H2SO4 , BaCl2<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
HS 1: Trình bày tính chất hóa <strong>học</strong> của Ca(OH)2. Viết phương trình HH minh họa?<br />
HS 2: Chữa bài tập 1 trang 30 SGK.<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động1: Tính chất hóa <strong>học</strong> của muối<br />
- HDHSN: Ngâm một đoạn dây<br />
đồng vào dd AgNO3. Quan sát<br />
- HDHS viết PTHH<br />
Đồng đẩy bạc ra khỏi dd AgNO3<br />
và một phần Cu bị hòa tan.<br />
? Nêu kết luận.<br />
- Nêu vấn đề: Làm thế nào phân<br />
biệt 2 dd không màu: HCl, H2SO4?<br />
+ Từ cách giải quyết vấn đề, hãy<br />
kết luận tính chất dd muối + axit<br />
- TN nhóm, qsát<br />
+ Hiện tượng: kim<br />
loại trắng bạc bám<br />
vào dây đồng.<br />
Dd không màu<br />
chuyển dần sang<br />
màu xanh .<br />
- Viết phương trình<br />
hh:<br />
- Kết luận 1.<br />
I. Tính chất hóa <strong>học</strong> của<br />
muối:<br />
1.Dd muối + kim loại <br />
muối mới và kim loại mới.<br />
Cu+AgNO3 Cu(NO3)2 +<br />
Ag↓<br />
2. Dd muối + axit Axit<br />
mới và muối mới.<br />
– Đưa ra ½ phản ứng, AgNO3 + - Giải quyết: cho + H<br />
2SO4 + BaCl2 → BaSO4 + 2HCl<br />
.<br />
NaCl <br />
dd BaCl2. xuất hiện<br />
3. Dd muối + dd muối <br />
? Từ phản ứng, hãy kết luận? kết tủa trắng, không<br />
hai muối mới.<br />
- HDHSTN:<br />
kết tủa trắng<br />
AgNO3+ NaCl → AgCl + NaNO3<br />
Nhỏ 1 giọt ddCuSO4 vào ống + Kết luận 2.<br />
4. Dd muối + bazơ <br />
nghiệm đựng dd NaOH. Quan sát - Kết luận 3. Hai dd<br />
muối mới + bazơ mới.<br />
hiện tượng, viết PTHH<br />
muối có thể + tạo<br />
- Rút ra kết luận gì?<br />
thành 2 muối mới.<br />
CuSO4<br />
+ 2NaOH<br />
→<br />
- Giới thiệu: Chúng ta đã biết - TN <strong>theo</strong> nhóm, Cu(<br />
OH)<br />
2<br />
+ Na2SO4<br />
nhiều muối bị nhiệt phân hủy:<br />
KClO3, CaCO3, MgCO3. Hãy viết<br />
quan sát:<br />
+ Hiện tượng: xuất 5. Phản ứng phân hủy<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
26<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
PTHH?<br />
hiện chất không tan muối:<br />
0<br />
t<br />
Lồng ghép giáo dục yêu thích xanh lơ<br />
2KClO3 ⎯⎯→ 2KCl + 3O2<br />
<br />
0<br />
môn <strong>học</strong> . Vai trò và ứng dụng - Kết luận: 4.<br />
t<br />
CaCO3 ⎯⎯→ CaO + CO2<br />
<br />
muối trong cuộc sống sản xuất - Thảo luận , hoàn<br />
o<br />
t<br />
2NaHCO 3<br />
⎯⎯→ Na2CO 3<br />
+ CO2 + H2O<br />
<br />
thành:<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
- Giới thiệu: phản ứng<br />
của muối với axit,<br />
muối, bazơ, gọi phản<br />
ứng trao đổi.<br />
? Phản ứng trao đổi?<br />
? Điều kiện để PƯTĐ<br />
xáy ra là gì?<br />
** Chú ý: Phản ứng<br />
trung hòa cũng thuộc<br />
loại PƯTĐ và luôn xảy<br />
ra.<br />
+ Đưa ra bài tập: phiếu<br />
<strong>học</strong> tập 1<br />
Hoạt động 2: Phản ứng trao đổi<br />
- Trả lời: 1.<br />
- Trả lời: 2.<br />
+ Hoàn thành phiếu <strong>học</strong> tập 1:<br />
1) BaCl + Na SO → BaSO + NaCl<br />
2 2 4 4<br />
2) Al + AgNO → Al( NO ) + Ag<br />
3 3 3<br />
3) CuSO + NaOH → Cu( OH ) + Na SO<br />
4 2 2 4<br />
4) Na CO + H SO → Na SO + CO + H O<br />
2 3 2 4 2 4 2 2<br />
Phản ứng 1,3,4 là PƯTĐ. Vì<br />
có sự trao đổi các thành phần<br />
cấu tạo nên hợp chất.<br />
II. Phản ứng trao đổi.<br />
1.Định nghĩa: Là phản ứng<br />
hóa <strong>học</strong>, trong đó 2 hợp<br />
chất tham gia phản ứng trao<br />
đổi với nhau những thành<br />
phần cấu tạo của chúng để<br />
tạo ra hợp chất mới.<br />
2.Điều kiện xảy ra phản<br />
ứng trao đổi:<br />
Sản phẩm tạo thành phải<br />
có chất kết tủa hoăc bay<br />
hơi.<br />
3. Kiểm tra – đ<strong>án</strong>h giá:<br />
Bài tập 1: Cho 0,02 mol một loại muối clorua của kim loại R hóa trị III tác dụng với<br />
NaOH dư thu được 2,14 g kết tủa. Xác <strong>định</strong> công thức muối ban đầu<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 3, 4, 5 trang 33 SGK và xem trước bài một số muối quan trọng.<br />
PHIẾU HỌC TẬP 1: Hoàn thành PTHH và cho biết phản ứng trao đổi? Vì sao?<br />
1) BaCl2 + Na2SO4 ----> BaSO4 + NaCl . . . . . .<br />
2) Al + AgNO3 ----> Al (NO3)3 + Ag . . . . . .<br />
3) CuSO4 + NaOH ----> Cu(OH)2 + Na2 SO4 . . . . . . .<br />
4) Na2CO3 + H2SO4 ----> Na2SO4 + CO2 + H2O . . . . . .<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
27<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 23 / 10/ <strong>2017</strong><br />
Tiết 15<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Tính chất vật lý, tính chất hóa <strong>học</strong> của một số muối quan trọng như: NaCl, KNO3.<br />
- Những ứng dụng quan trọng của NaCl và KNO3.<br />
* Về kĩ <strong>năng</strong>: Viết phương trình hh và làm bài tập <strong>định</strong> tính.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát, đàm thoại.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Phiếu <strong>học</strong> tập.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
HS 1: Tính chất hóa <strong>học</strong> của muối. Viết các phương trình phản ứng minh họa.<br />
HS 2: Định nghĩa phản ứng trao đổi, điều kiện xảy ra?Vân dụng: Viết các PTHH:<br />
a. Pb(NO3)2 + Na2CO3 <br />
b. Pb(NO3)2 + 2KCl <br />
c. BaCl2 + Na2CO3 <br />
d. BaCl2 + H2SO4 <br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Muối Natriclorua (NaCl).<br />
? Trong tự nhiên<br />
I. Muối Natriclorua (NaCl):<br />
em thấy muối ăn<br />
có đâu?<br />
- Yêu cầu <strong>học</strong><br />
<strong>sinh</strong> đọc mục 1.<br />
& 2. SGK và<br />
quan sát tranh vẽ<br />
ruộng muối<br />
- Trả lời thực tế(nếu có)<br />
+ Đọc thông tin 1. & 2.<br />
- Cho nước biển bay hơi<br />
thu được hỗn hợp muối,<br />
thành phần chính<br />
natriclorua. Trong lòng<br />
đất cũng chứa 1 khối<br />
lượng lớn natriclorua kết<br />
1. Trạng thái tự nhiên :<br />
Natri clorua có trong nước biển.<br />
Trong lòng đất cũng chứa 1 khối lượng<br />
lớn natri clorua kết tinh , gọi là muối mỏ<br />
2. Khai thác:<br />
tinh , gọi là muối mỏ Cho nước mặn bay hơi từ từ.<br />
- Yêu cầu <strong>học</strong><br />
<strong>sinh</strong> quan sát sơ<br />
đồ và cho biết<br />
những ứng dụng<br />
quan trọng của<br />
NaCl.<br />
- Cách khai thác:<br />
Cho nước mặn bay hơi<br />
từ từ thu được muối kết<br />
tinh.<br />
<strong>Đà</strong>o hầm (giếng) sâu để<br />
lấy muối trong mỏ muối.<br />
<strong>Đà</strong>o hầm hoặc giếng sâu để lấy muối.<br />
3. Ứng dụng:<br />
+ Làm gia vị và bảo quản thực phẩm<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
- Gọi <strong>học</strong> <strong>sinh</strong><br />
nêu ứng dụng của<br />
- Quan sát và trả lời: 3.<br />
+ NaOH: chế tạo xà<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
+ Sản xuất: Na, Cl2, H2, NaOH, Na2CO3,<br />
NaHCO3…<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
28<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
sản phẩm sản<br />
xuất từ NaCl.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Lồng ghép giáo<br />
dục vai trò và<br />
ứng dụng muối<br />
NaCl trong cuộc<br />
sống .<br />
- Bổ sung mục 4.<br />
& 5.<br />
phòng; công nghiệp<br />
giấy.<br />
+ Cl2: sản xuất chất dẻo<br />
PVC, chất diệt trùng, trừ<br />
sâu, diệt cỏ, sản xuất axit<br />
clohidric.<br />
- Chú ý ghi chép<br />
4. Tính chất vật lý: thể kết tinh , vị mặn ,<br />
tan nhiều trong nước,…<br />
5. Tính chất hóa <strong>học</strong>:<br />
Điện phân dd đậm đặc muối ăn :<br />
đpcmn<br />
2NaCl<br />
+ 2H O ⎯⎯⎯→<br />
( ddbh) 2<br />
2NaOH + Cl + H<br />
( dd ) 2( k ) 2( k )<br />
Điện phân nóng chảy NaCl<br />
2NaCl ⎯⎯⎯→ 2Na + Cl<br />
đpnc<br />
( r) ( r) 2( kvl )<br />
Hoạt động 2: Muối Kalinitrat (KNO3) (sgk)<br />
3. Kiểm tra, đ<strong>án</strong>h giá:<br />
a/ Nêu lại tính chất hóa <strong>học</strong> của muối và viết phương trình hh minh họa.<br />
b/ Hợp chất A chỉ có N và H , tỉ khối hơi với H2 là 16. Cho A tác dụng CuO dư đun nóng<br />
được Cu, 5,6 g N2 và 7,2 g H2O. Xác <strong>định</strong> công thức hợp chất A<br />
c/ Hoàn thành các phản ứng hóa <strong>học</strong> sau: Phân loại phản ứng<br />
1) Mg(NO3)2 + . . . . . ----> Mg (OH)2 + . . . . --------------------<br />
2) CuCl2 + AgNO3 ----> . . . . + . . . . -------------------<br />
3) MgCO3 ----> . . . . + . . . . --------------------<br />
4) Fe + . . . . ----> FeSO4 + . . . . --------------------<br />
5) Na2CO3 + H2SO4 ----> . . . . + . . . . + H2O --------------------<br />
d/ Bài tập 1: Để hòa tan vừa đủ 21,2 g hỗn hợp CaCO3 và CaO cần vừa đủ 200 g dd HCl<br />
thu được dd X và 2,24 lít khí đktc. Tính % khối lượng của mỗi chất, C% dd HCl và C%<br />
chất tan trong dd X<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Xem bài “ Một số muối quan trọng”.<br />
- Làm bài tập 1, 2, 3, 4, 5, trang 36 SGK.<br />
2)<br />
V. RÚT KINH NGHIỆM:<br />
(1)<br />
Zn ⎯⎯→ ZnSO<br />
4<br />
(2)<br />
⎯⎯→ ZnCl<br />
2<br />
(3)<br />
⎯⎯→ Zn(<br />
NO )<br />
3<br />
2<br />
(4)<br />
⎯⎯→ Zn(<br />
OH )<br />
2<br />
(5)<br />
⎯⎯→<br />
ZnO<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
29<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 26 / 10/ <strong>2017</strong><br />
Tiết 16<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Biết công thức của một số loại phân bón hóa <strong>học</strong> thường dùng và hiểu<br />
biết một số tính chất của các loại phân bón đó.<br />
* Về kĩ <strong>năng</strong>: Khả <strong>năng</strong> phân biệt các loại phân đạm, phân kali, phân lân dựa vào tính<br />
chất hóa <strong>học</strong>. Củng cố khả <strong>năng</strong> làm bài tập <strong>theo</strong> công thức hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> biết vai trò và các ứng dụng các loại muối làm phân bón trong đời<br />
sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Các mẫu phân bón hóa <strong>học</strong>. Phiếu <strong>học</strong> tập.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Trạng thái tự nhiên, cách khai thác và ứng dụng của NaCl ?<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Những nhu cầu của cây trồng.(SGK)<br />
+ Sau vụ thu hoạch đất trồng bạc màu do thực<br />
vật lấy các ng/tố dinh dưỡng: N, K, P ... và 1<br />
số ng/tố vi lượng: B, Cu, Fe, Zn…<br />
Làm thế nào để tăng <strong>năng</strong> suất vụ sau?<br />
+ Hướng dẫn <strong>học</strong> <strong>sinh</strong> tự nghiên cứu SGK<br />
+ Giới thiệu thành phần của thực vật: → 1.<br />
Gọi HS đọc Sgk.<br />
? Ng/tố hoá <strong>học</strong> nào cây lấy từ nước, từ<br />
không khí và từ đất ? Vai trò các ng/tố đó?<br />
+ Nghe và<br />
ghi bài.<br />
+ Bổ sung<br />
các ng/tố cần<br />
thiết cho đất<br />
trồng bằng<br />
cách bón<br />
phân (chuồng<br />
; xanh ; hóa<br />
I. Những nhu cầu của<br />
cây trồng<br />
1. Thành phần của thực<br />
vật<br />
Nước: 90%<br />
Chất khô: 10%<br />
- 99%: C, H, O, N, K,<br />
Ca, P, Mg, S<br />
- 1%: Ng/tố vi lượng: B,<br />
Gọi HS trả lời → 2.<br />
<strong>học</strong> ) Cu, Zn, Fe, Mn.<br />
- Dùng dư lượng phân bón hóa <strong>học</strong> chẳng<br />
những có hại đến cây trồng mà còn có hại<br />
đến sức khỏe con người và gây ô nhiễm môi<br />
trường nghiêm trọng.<br />
+ Đọc Sgk<br />
+ Thảo lụân<br />
nhóm<br />
+ trả lời<br />
2. Vai trò của các<br />
nguyên tố HH đối với<br />
thực vật:(Sgk)<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
30<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- Phân bón hóa<br />
<strong>học</strong> có thể dùng<br />
ở dạng đơn và<br />
dạng kép II. - Biết<br />
Hướng dẫn <strong>học</strong> và ghi<br />
<strong>sinh</strong> tự nghiên bài:<br />
cứu SGK<br />
- Gọi <strong>học</strong> <strong>sinh</strong><br />
đọc mục<br />
“ECB”. - Đọc<br />
Lồng ghép giáo SGK.<br />
dục vai trò và<br />
sử dụng phân<br />
hóa <strong>học</strong> trong<br />
sản xuất.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
II. Những phân bón hóa <strong>học</strong> thường dùng:<br />
1. Phân bón đơn: Chỉ chứa một trong 3 nguyên tố dinh<br />
dưỡng chính là đạm (N), lân (p) , kali (K).<br />
a) phân đạm:<br />
- Ure : CO(NH2)2 chứa 46% nitơ, tan trong nước.<br />
- Amoni nitrat: NH4NO3 chứa 35% nitơ, tan trong nước.<br />
- Amoni Sunfat: (NH4)2SO4 Chứa 21% nitơ, tan trong nước.<br />
- Amoni Clorua NH4Cl chứa 25% nitơ, tan trong nước.<br />
b) Phân lân :<br />
- Photphat tự nhiên Ca3(PO4)2<br />
- Supephotphat Ca(H2PO4)2: có 2 loại là :<br />
+Supephotphat đơn là hỗn hợp Ca(H2PO4)2 và CaSO4<br />
+ Supephotphat kép là Ca(H2PO4)2<br />
c) Phân Kali: KCl ( kaliclorua) ; K2SO4 ( kali sunfat)<br />
2. Phân bón kép: chứa 2 hoặc 3 nguyên tố dinh dưỡng<br />
a) Phân NPK : là hỗn hợp các muối NH4NO3; (NH4)2HPO4;<br />
KCl<br />
b) Phân kali và đạm : KNO3<br />
c) Phân đạm và Lân : (NH4)2HPO4<br />
3. Phân vi lượng:chứa một lượng nhỏ các nguyên tố vi lượng<br />
: Bo, Zn, Mn, …<br />
3. Luyện tập, củng cố:<br />
Bài tập: a. Một loại phân đạm có tỷ lệ về khối lượng của các nguyên tố như sau:<br />
%N=35%, %O=60%. Còn lại là %H. Xác <strong>định</strong> công thức hóa <strong>học</strong>.<br />
Giải: %H =100% – (35% + 60%) = 5%<br />
Giả sử công thức hóa <strong>học</strong> của lọai phân đạm là: NxOyHt<br />
Ta có:<br />
35 60 5<br />
x : y : z = : : = 2 : 3: 4<br />
14 16 1<br />
Vậy công thức hóa <strong>học</strong> của phân đạm trên là: N2O3H4 hay NH4NO3.<br />
b. Tính thành phần % về khối lượng các nguyên tố có trong đạm urê CO(NH2)2.<br />
M<br />
CO ( NH 2 ) 2<br />
= 12+<br />
16+<br />
142<br />
+ 22<br />
= 60<br />
12<br />
16<br />
28<br />
% C = 100%<br />
= 20%;% O = 100%<br />
= 26,67%;% N = 100%<br />
= 46,67%;% H = 6,66%<br />
60<br />
60<br />
60<br />
4. Kiểm tra, đ<strong>án</strong>h giá: Cho các phân bón sau: KCl, NH4NO3, NH4Cl, (NH4)2SO4,<br />
Ca3(PO4)2, Ca(H2PO4)2, (NH4)2HPO4, KNO3.<br />
a. Hãy sắp xếp những phân bón này thành hai nhóm: đơn và kép.<br />
b. Trộn những phân bón nào với nhau được phân bón kép NPK.<br />
5. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1, 2, 3 trang 39 SGK<br />
- Chuẩn bị bài “ Mối quan hệ giữa các loại chất vô cơ”.<br />
V. RÚT KINH NGHIỆM:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
31<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 01/11/ <strong>2017</strong><br />
Tiết 17<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Mối quan hệ giữa các loại hợp chất vô cơ, viết được các phương trình hóa<br />
<strong>học</strong> thể hiện sự chuyển hóa giữa các loại hợp chất vô cơ đó.<br />
* Về kĩ <strong>năng</strong>: Viết phương trình hóa <strong>học</strong> và làm bài tập <strong>định</strong> tính.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>:<br />
Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao tiếp, hợp tác, sử dụng công nghệ<br />
thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>, tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Bộ bìa màu có ghi các loại hợp chất vô cơ: oxit bazơ, bazơ, oxit<br />
axit,… Phiếu <strong>học</strong> tập.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Ôn lại các tính chất của các loại hợp chất vô cơ.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
Kể tên các loại phân bón thường dùng. Viết công thức hóa <strong>học</strong> các loại phân bón đó.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Mối quan hệ giữa các loại hợp chất vô cơ.<br />
– Treo sơ đồ.<br />
– Họat động nhóm và trình bày kết quả. – Vẽ sơ đồ<br />
vào vở<br />
(3)<br />
(4)<br />
(6)<br />
(1) (2)<br />
(7)<br />
Muối<br />
(9)<br />
(8)<br />
(5)<br />
O.Bazơ<br />
(3)<br />
Bazơ<br />
(4)<br />
(6)<br />
(1) (2)<br />
Phát cho <strong>học</strong> <strong>sinh</strong> các bộ bìa<br />
màu, phiếu <strong>học</strong> tập và yêu cầu<br />
<strong>học</strong> <strong>sinh</strong> thảo luận <strong>theo</strong> các<br />
nội dung sau:<br />
+ Điền vào các ô trống loại<br />
hợp chất vô cơ cho phù hợp.<br />
+ Chọn các loại chất tác dụng<br />
để thực hiện sơ đồ chuyển hóa<br />
trên.<br />
Thực hiện các chuyển hóa như sau:<br />
(1): Oxit bazơ + axit<br />
(2): oxit axit + bazơ (oxit bazơ)<br />
(3): oxit bazơ + nước<br />
(4): bazơ không tan: nhiệt phân.<br />
(5): oxit axit + nước<br />
(6): dung dịch bazơ + dung dịch muối<br />
(7): dung dịch muối + dung dịch bazơ<br />
(8): muối + axit<br />
(9): axit + muối<br />
Hoạt động 2: Những phản ứng hóa <strong>học</strong> minh họa.<br />
– Cho các nhóm thi – Các nhóm thi viết phương trình phản ứng. – Ghi PTHH vào<br />
đua viết phương<br />
vở.<br />
(7)<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
Muối<br />
(8)<br />
(9)<br />
O.Axit<br />
(5)<br />
Axit<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
32<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
trình HH minh họa (1) : MgO + H<br />
2SO4<br />
→ MgSO4<br />
+ H<br />
2O<br />
cho dãy chuyển hóa. (2) : SO + 3NaOH<br />
→ Na SO + H O<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
(3) :<br />
(4) :<br />
(5) :<br />
(6) :<br />
Na O + H O → 2NaOH<br />
2Fe(<br />
OH)<br />
P O<br />
2<br />
3<br />
2<br />
5<br />
KOH + HNO<br />
(7) : CuCl<br />
(8) : AgNO + HCl → AgCl + HNO<br />
(9) : 6HCl<br />
+ Al O<br />
t<br />
⎯⎯→ Fe O<br />
+ 3H<br />
O → 2H<br />
PO<br />
2<br />
→ KNO<br />
+ 2KOH<br />
→ Cu(<br />
OH)<br />
3<br />
3<br />
2<br />
2<br />
2<br />
3<br />
3<br />
0<br />
2<br />
3<br />
2<br />
3<br />
3<br />
→ 2AlCl<br />
+ 3H<br />
3<br />
4<br />
4<br />
+ H<br />
2<br />
2<br />
2<br />
O<br />
+ 3H<br />
O<br />
+ 2KCl<br />
3. Luyện tập, củng cố: 9 phút<br />
– Bài tập 1: Nung 20,6 g hỗn hợp CaO, CaCO3 ở nhiệt độ cao thu được 3,36 lít khí điểu<br />
kiện chuẩn. Tính phần trăm các chất trong hỗn hợp<br />
– Bài tập 2:Trộn 30 g dd BaCl2 20,8 % với 20 g dd H2SO4 19,6 % thu được a g kết tủa A,<br />
dd B. Tính a và C% các chất trong dd B. Tính khối lượng dd NaOH 5 M(D=1,2g/ml)cần<br />
dùng để trung hòa vừa đủ dd B<br />
– Bài tập 3: Hoàn thành chuỗi phản ứng sau:<br />
a) b)<br />
a).<br />
Na O<br />
2<br />
b).<br />
Fe(<br />
OH)<br />
4. Kiểm tra, đ<strong>án</strong>h giá: Viết phương trình phản ứng cho dãy chuyển hóa sau:<br />
(1)<br />
⎯⎯→<br />
(1)<br />
3<br />
⎯⎯→<br />
(1)<br />
Fe 2 (SO 4 ) 3<br />
(6)<br />
NaOH<br />
Fe O<br />
2<br />
FeCl 3<br />
(2)<br />
⎯⎯→<br />
(3)<br />
(4)<br />
Fe 2 O 3<br />
Na<br />
(2)<br />
3<br />
⎯⎯→<br />
2<br />
SO<br />
FeCl<br />
(2)<br />
(3)<br />
4<br />
⎯⎯→<br />
Fe(OH) 3<br />
(3)<br />
3<br />
⎯⎯→<br />
NaCl<br />
Fe(<br />
NO<br />
(4)<br />
⎯⎯→<br />
3<br />
2<br />
2<br />
O<br />
NaNO<br />
(4)<br />
3)<br />
3<br />
⎯⎯→<br />
3<br />
Fe(<br />
OH)<br />
(5)<br />
3<br />
⎯⎯→<br />
5. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 1, 2, 4, trang 41 SGK.<br />
V. RÚT KINH NGHIỆM:<br />
(5)<br />
Fe ( SO )<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Cu<br />
(1)<br />
(2)<br />
CuO<br />
(6)<br />
Cu(OH) 2<br />
(5)<br />
2<br />
(3)<br />
(4)<br />
CuCl 2<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
4<br />
3<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
33<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 3 / 11/ <strong>2017</strong><br />
Tiết 18<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Ôn tập về tính chất của các loại hợp chất vô cơ – mối quan hệ giữa chúng.<br />
* Về kĩ <strong>năng</strong>: Viết phương trình phản ứng, kỹ <strong>năng</strong> phân biệt các hóa chất , làm bài tập<br />
<strong>định</strong> lượng.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; đàm thoại<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Phiếu <strong>học</strong> tập<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Ôn tập các kiến thức trong chương 1.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Kiến thức cần nhớ<br />
Phát phiếu <strong>học</strong> tập cho các nhóm và yêu cầu<br />
các nhóm hoàn thành.<br />
Các hợp chất vô cơ<br />
Oxit Axit Bazơ Muối<br />
O.Bazơ O.Axit Có oxi Không oxi Tan Không tan Axit Trung hòa<br />
– Yêu cầu cho hai ví dụ cho mỗi loại trên.<br />
? Đựa vào sơ đồ nhắc lại tính chất hóa <strong>học</strong> của<br />
oxit, axit, bazơ, muối.<br />
Hoạt động 2: Luyện tập.<br />
– Đưa bài tập 1:<br />
Trình bày phương<br />
pháp hóa <strong>học</strong> phân<br />
biệt 5 lọ hóa chất bị<br />
mất nhãn mà chỉ<br />
dùng quỳ tím: KOH,<br />
1. Phân loại các hợp chất vô cơ :<br />
Cho ví dụ:<br />
• Oixt bazơ: Na2O, K2O.<br />
• Oxit axit: CO2, SO2.<br />
• Axit có oxi: H3PO4, H2SO4.<br />
• Axit không có oxi: HCl, H2S.<br />
• Bazơ tan: NaOH, KOH.<br />
• Bazơ k tan: Cu(OH)2, Fe(OH)3.<br />
• Muối axit: NaHSO4, NaHCO3.<br />
• Muối trung hòa: KCl, Na2SO4.<br />
2. Tính chất hóa <strong>học</strong> của các loại<br />
hợp chất vô cơ :<br />
( sơ đồ SGK)<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
– Làm bài tập 1:<br />
• Lần lượt lấy ở mỗi lọ 1 giọt dd nhỏ vào mẫu giấy quỳ tím.<br />
+ Quỳ tím => xanh là dd KOH, Ba(OH)2 (nhóm I), màu quỳ tím<br />
=> đỏ là dd HCl, H2SO4 (nhóm II).<br />
+ Quỳ tím không chuyển màu là dd KCl.<br />
• Lần lượt lấy các dd ở I nhỏ vào các dd ở II.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
34<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
HCl, H2SO4, + Thấy kết tủa trắng thì ở nhóm I là Ba(OH)2, ở nhóm II là<br />
Ba(OH)2, KCl. H2SO4. Chất còn lại ở I là KOH. ở II là HCl.<br />
Ba( OH ) 2<br />
+ H<br />
2SO4<br />
→ BaSO4<br />
+ 2H<br />
2O<br />
- Đưa bài tập 2: – Làm bài tập 2:<br />
Cho các chất<br />
TT Công Tên Phân Tác dụng<br />
Mg(OH)2, CaCO3,<br />
thức gọi loại HCl Ba(OH) BaCl2<br />
K2SO4, HNO3, CuO,<br />
2<br />
NaOH, P2O5.<br />
1 Mg(OH) Bktan x<br />
a. Gọi tên và phân<br />
2<br />
loại các chất trên.<br />
2 CaCO3 Mktan x<br />
b. Trong các chất<br />
3 K2SO4 Mtan x x<br />
trên, chất nào tác<br />
4 HNO3 Axit x<br />
dụng được với:<br />
5 CuO O.baz x<br />
+ Dung dịch HCl.<br />
ơ<br />
+ Dd Ba(OH)2.<br />
+ Dd BaCl2.<br />
6 NaOH .tan x<br />
Viết các phương<br />
7 P2O5 O.axit x<br />
trình HH xảy ra.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Mg(<br />
OH)<br />
CaCO<br />
CuO + 2HCl<br />
→ CuCl<br />
NaOH + HCl → NaCl + H<br />
K<br />
2HNO<br />
P O<br />
2<br />
K<br />
2<br />
2<br />
SO<br />
5<br />
SO<br />
3<br />
4<br />
+ 2HCl<br />
→ MgCl<br />
+ 2HCl<br />
→ CaCl<br />
+ Ba(<br />
OH)<br />
+ Ba(<br />
OH)<br />
+ 3Ba(<br />
OH)<br />
4<br />
3<br />
2<br />
+ BaCl<br />
2<br />
2<br />
2<br />
2<br />
2<br />
2<br />
+ H<br />
→ BaSO<br />
→ Ba ( PO )<br />
→ BaSO<br />
+ 2H<br />
+ H O + CO<br />
+ Đưa bài tập 3:<br />
Cho 2,464 lít khí<br />
CO2 đktc đi vào dd<br />
NaOH <strong>sinh</strong> ra 11,44<br />
g hỗn hợp 2 muối<br />
NaHCO3 và<br />
Na2CO3.<br />
a . Viết các phương – Làm bài tập 3:<br />
trình hóa <strong>học</strong> xảy ra n CO2 = 2,464/22,4=0,11 mol<br />
?<br />
CO2 + 2NaOH → 2NaHCO3 (1)<br />
b . Xác <strong>định</strong> khối<br />
CO2 + 2NaOH → 2Na2CO3 + H2O (2)<br />
lượng mỗi muối ? Gọi x,y lần lược là số mol NaHCO3 , Na2CO3<br />
Ta có x + y = 0,11<br />
84 x + 106 y = 11,44<br />
Giải hệ 2 pt trên ta được : x = 0,01 ; y = 0,1<br />
=> mNaHCO3 = 0,01 x 84 = 0,84 (g)<br />
m Na2CO3 = 0,1 x 106 = 10,6 (g)<br />
Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 3 trang 43 SGK<br />
Xem nội dung bài thực hành.<br />
V. RÚT KINH NGHIỆM:<br />
O<br />
O<br />
→ Ba(<br />
NO )<br />
3<br />
4<br />
2<br />
2<br />
2<br />
4<br />
2<br />
+ 2KOH<br />
4<br />
3<br />
2<br />
2<br />
+ 2KCl<br />
2<br />
O<br />
2<br />
+ 2H<br />
+ 3H<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
2<br />
2<br />
O<br />
O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
35<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 5 / 11/ <strong>2017</strong><br />
Tiết 19<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Củng cố các kiến thức đã <strong>học</strong> bằng thực nghiệm.<br />
* Về kĩ <strong>năng</strong>: Làm thí nghiệm, khả <strong>năng</strong> quan sát, suy đo<strong>án</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Thực hành<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
<strong>Hóa</strong> chất: dung dịch NaOH, dung dịch FeCl3, dung dịch CuSO4, dung dịch HCl, dung dịch<br />
BaCl2, dung dịch Na2SO4, dung dịch H2SO4, đinh sắt.<br />
Dụng cụ: giá ống nghiệm, ống nghiệm, ống hút, kẹp gỗ.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>:<br />
Xem trước nội dung bài thực hành.<br />
Ôn lại tính chất hóa <strong>học</strong> của bazơ và muối.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Nêu tính chất hóa <strong>học</strong> của bazơ và muối<br />
2. Bài mới:<br />
Hoạt động của giáo viên<br />
Hoạt động của <strong>học</strong> <strong>sinh</strong><br />
Hoạt động 1: Tiến hành thí nghiệm.<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> làm thí<br />
nghiệm:<br />
- Các nhóm làm thí nghiệm:<br />
• TN 1: Xuất hiện kết tủa màu nâu đỏ.<br />
• TN 1: Nhỏ vài giọt dd NaOH vào<br />
ống nghiệm có chứa 1ml dd FeCl3,<br />
Kết luận: dung dịch bazơ tác dụng với dung dịch<br />
lắc nhẹ ống nghiệm, quan sát hiện<br />
muối <strong>sinh</strong> ra muối mới và bazơ mới.<br />
tượng.<br />
• TN 2: kết tủa tan dần tạo dung dịch có màu xanh<br />
• TN 2: Đồng (II) hydroxit + axit.<br />
lam.<br />
Cho một ít Cu(OH)2, vào đáy ống<br />
Cu( OH )<br />
2<br />
+ 2HCl<br />
→ CuCl2<br />
+ 2H<br />
2O<br />
nghiệm, nhỏ vài giọt dd HCl, lắc<br />
đều. Quan sát hiện tượng.<br />
Kết luận: Bazơ tác dụng với axit <strong>sinh</strong> ra muối và<br />
• TN 3: Đồng Sunfat + kim loại:<br />
nước.<br />
Ngâm một đinh sắt nhỏ trong ống<br />
• TN 3: Kim loại màu đỏ bám vào đinh sắt, dung<br />
nghiệm chứa 1ml dd CuSO4. Quan<br />
dịch màu xanh nhạt dần.<br />
sát hiện tượng.<br />
Phương trình:<br />
• TN 4: Bariclorua + axit.<br />
CuSO<br />
4<br />
+ Fe → FeSO4<br />
+ Cu<br />
Nhỏ vài giọt BaCl2 + dd H2SO4 • TN 4: Xuất hiện kết tủa trắng.<br />
loãng. Quan sát.<br />
BaCl + H SO l)<br />
→ BaSO 2HCl<br />
NaOH FeCl → Fe(<br />
OH + NaCl<br />
+<br />
3<br />
)<br />
3<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2 2 4<br />
(<br />
4<br />
+<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
36<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Hoạt động 2: Tường trình.<br />
TT Tên thí nghiệm Hiện tượng quan sát Giải thích và viết PTHH<br />
1 NaOH + muối – Xuất hiện kết tủa 6NaOH + FeCl3 → 2Fe(<br />
OH )<br />
3<br />
+ 6NaCl<br />
nâu đỏ<br />
(nâu đỏ)<br />
2 Cu(OH)2 + –Kết tủa tan dần tạo Cu( OH )<br />
2<br />
+ 2HCl<br />
→ CuCl2<br />
+ 2H<br />
2O<br />
axit<br />
dd xanh lam<br />
3 CuSO4 + kim – Có lớp kim loại đỏ<br />
loại<br />
bám vào đinh sắt, dd<br />
CuSO4 + Fe → FeSO4<br />
+ Cu (đỏ)<br />
nhạt dần.<br />
4 BaCl2 + muối – Xuất hiện kết tủa BaCl<br />
2<br />
+ Na2SO4<br />
→ BaSO4<br />
+ 2NaCl<br />
trắng<br />
(trắng)<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
5 BaCl2 + axit – Xuất hiện kết tủa BaCl<br />
2<br />
+ H<br />
2SO4 ( l)<br />
→ BaSO4<br />
+ 2HCl<br />
(trắng)<br />
trắng<br />
Lồng ghép giáo dục sử dụng chất ba zơ , muối đúng mục đích , an toàn ,tiết kiệm và<br />
môi trường .<br />
3. Hướng dẫn <strong>học</strong> ở nhà: Ôn tập chuẩn bị kiểm tra 1 tiết.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
37<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 7/11/ <strong>2017</strong><br />
Tiết 20<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức : Kiểm tra việc nắm kiến thức về bazơ và muối cùng với mối liên hệ giữa<br />
chúng<br />
* Về thái độ: Nghiêm túc, trung thực, cẩn thận<br />
* Về kĩ <strong>năng</strong>: Khái quát hóa kiến thức, viết phương trình hh, kỹ <strong>năng</strong> phân biệt các hóa<br />
chất, làm bài tập <strong>định</strong> lượng.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: tính to<strong>án</strong> bài tập <strong>định</strong> lượng<br />
II. PHƯƠNG PHÁP: Kiểm tra viết tự luận<br />
III- MA TRẬN VÀ ĐỀ - ĐÁP ÁN:<br />
3. Hướng dẫn <strong>học</strong> ở nhà: Đọc trước tiết 21<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
38<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 9 / 11/ <strong>2017</strong><br />
Tiết 21<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Một số tính chất vật lý của kim loại như: tính dẻo, dẫn điện, dẫn nhiệt và<br />
<strong>án</strong>h kim.<br />
* Về kĩ <strong>năng</strong>:<br />
- Biết thực hiện thí nghiệm đơn giản, quan sát, mô tả hiện tượng, nhận xét và rút ra<br />
kết luận về từng tính chất vật lý .<br />
- Biết liên hệ tính chất vật lý, tính chất hóa <strong>học</strong> với một số ứng dụng của kim loại.<br />
- Làm thí nghiệm, khả <strong>năng</strong> quan sát, suy đo<strong>án</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; đàm thoại.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Đoạn dây nhôm, mẫu than, giấy gói b<strong>án</strong>h kẹo bằng nhôm …<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính dẻo.<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> thí<br />
nghiệm:<br />
• Dùng búa đập vào đoạn<br />
dây nhôm và đập vào<br />
than.<br />
Quan sát nhận xét, giải<br />
thích?<br />
– Quan sát các mẫu: giấy<br />
gói b<strong>án</strong>h kẹo, vỏ đồ hộp<br />
- Làm thí nghiệm <strong>theo</strong> nhóm; quan<br />
sát và nhận xét:<br />
• Than chì vỡ vụn.<br />
• Dây nhôm chỉ bị dát mỏng.<br />
Giải thích:<br />
Dây nhôm bị dát mỏng là do nhôm<br />
có tính dẻo.<br />
Than vỡ vụn là do than không có<br />
tính dẻo.<br />
1: Tính dẻo.<br />
Kim lọai có tính dẻo.<br />
Kim lọai khác nhau<br />
có tính dẻo khác<br />
nhau.<br />
…<br />
– Quan sát và kết luận → 1.<br />
Hoạt động 2: Tính dẫn điện.<br />
? Trong thực tế dây dẫn làm bằng kim<br />
loại nào?<br />
• Các kim loại khác có dẫn điện không?<br />
Bổ sung thông tin:<br />
• Kim loại khác nhau có khả <strong>năng</strong> dẫn<br />
điện khác nhau. Kim loại dẫn điện tốt<br />
nhất (sgk) là Ag, sau đó đến Cu, Al, Fe,…<br />
• Được làm bằng<br />
kim loại: đồng,<br />
nhôm,…<br />
• Các kim loại khác<br />
2: Tính dẫn điện:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
Kim loại có khả <strong>năng</strong><br />
dẫn điện.<br />
Kim loại khác nhau có<br />
khả <strong>năng</strong> dẫn điện khác<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
39<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Kim loại dẫn điện tốt nhất (thực tế) là Au. có dẫn điện nhưng nhau<br />
• Do có tính dẫn điện, một số kim loại khả <strong>năng</strong> dẫn điện<br />
được dùng làm dây điện: Cu, Al. khác nhau.<br />
Chú ý: Không nên sử dụng dây điện – Kết luận → 2.<br />
trần hoặc vỏ bị hỏng để tr<strong>án</strong>h bị điện giật.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 3: Ánh kim.<br />
- Tiến trình: Quan sát đồ trang sức<br />
bằng vàng, bạc… ta thấy trên bề mặt<br />
có vẽ s<strong>án</strong>g lấp l<strong>án</strong>h rất đẹp.<br />
- Gọi <strong>học</strong> <strong>sinh</strong> nhận xét<br />
- Chú ý.<br />
- Kết luận<br />
3: Ánh kim.<br />
– Kim loại có <strong>án</strong>h kim.<br />
– Kim loại khác nhau có <strong>án</strong>h kim<br />
khác nhau.<br />
→ 3.<br />
Họat động 4: Tính dẫn nhiệt.<br />
• Kim loại dẫn nhiệt, kim loại dẫn điện<br />
4: Tính dẫn nhiệt.<br />
tốt<br />
- Chú ý.<br />
• Kim loại khác nhau dẫn nhiệt khác<br />
Kim loại có tính dẫn nhiệt.<br />
nhau, kim loại dẫn điện tốt dẫn nhiệt - Kết luận :<br />
tốt.<br />
• Do có tính dẫn nhiệt… làm dụng cụ nấu<br />
Kim loại khác nhau có tính dẫn<br />
nhiệt khác nhau<br />
ăn.<br />
Lồng ghép giáo dục vai trò và ứng<br />
dụng tài nguyên kim loại trong cuộc<br />
sống .<br />
3. Kiểm tra,đ<strong>án</strong>h giá:<br />
Chọn những từ (cụm từ) thích hợp điền vào chổ trống trong các câu sau:<br />
a. Kim loại vonfam đựợc dùng làm dây tóc bóng đèn điện là do có __(4)__ cao.<br />
b. Bạc, vàng được dùng làm __(6)__ vì có <strong>án</strong>h kim đẹp.<br />
c. Nhôm được dùng làm vật liệu chế tạo vỏ máy bay là do __(3)__ và__(2)__.<br />
d. Đồng và nhôm được dùng làm __(5) là do dẫn điện tốt.<br />
e. __(1)__ được dùng làm dụng cụ nấu bếp là do bên trong kk và dẫn nhiệt tốt.<br />
4. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 3, 4, 5,trang 48 SGK<br />
Xem bài “ Tính chất hóa <strong>học</strong> của kim loại”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
40<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 11 / 11/ <strong>2017</strong><br />
Tiết 22<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Tính chất hóa <strong>học</strong> của kim loại nói chung: Tác dụng với phi kim, dd axit,<br />
với dd muối.<br />
* Về kĩ <strong>năng</strong>: Thí nghiệm, quan sát hiện tượng, giải thích, nhận xét. Khái quát hóa. Viết<br />
PTHH.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát; hoạt động nhóm; đàm thoại<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ: lọ tt miệng rộng ( nút nhám); giá ống nghiệm; ống nghiệm; đèn cồn; muôi sắt.<br />
<strong>Hóa</strong> chất: lọ oxi, Cl2, Na, Fe, Zn, Cu, dây thép, dd AlCl3 , H2SO4(l); CuSO4, AgNO3.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
III. CHUẨN BỊ:<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Nêu tính chất vật lý của kim loại? Ứng dụng của các tính chất đó ?<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Phản ứng của kim loại với phi kim.<br />
– Thí nghiệm, yêu cầu HS<br />
quan sát và nêu hiện tượng<br />
viết PTHH .<br />
1: Đốt sắt trong oxi.<br />
2: Đưa một muôi sắt đựng<br />
– Quan sát và<br />
nêu hiện tượng;<br />
1: ngọn lửa<br />
s<strong>án</strong>g chói tạo ra<br />
nhiều hạt nhỏ<br />
I. Phản ứng của kim loại với phi<br />
kim:<br />
1. Ở nhiệt độ cao, nhiều kim loại + oxi<br />
→ oxit.<br />
Na nóng chảy vào bình khí màu nâu đen<br />
Clo.<br />
(Fe3O4).<br />
3Fe + 2O2 Fe3O4 (nâu đen)<br />
– Giới thiệu:<br />
+ Nhiều kim loại khác (trừ<br />
2: Tạo thành<br />
khói trắng.<br />
2. Ở nhiệt độ cao, kim loại + phi kim<br />
khác → muối.<br />
Ag, Au, Pt) + oxi tạo thành<br />
2Na + Cl2<br />
oxit.<br />
– Chú ý và ghi<br />
(trắng)<br />
+ Ở t 0 cao, kim loại phản bài<br />
ứng với nhiều phi kim <br />
muối → I.<br />
Hoạt động 2: Phản ứng của kim loại với dung dịch axit.<br />
? Nhắc lại tính chất này và<br />
viết PTHH minh họa.<br />
Bài tập 1: Hoàn thành<br />
PTHH <strong>theo</strong> các sơ đồ phản<br />
ứng sau:<br />
a. Zn + S <br />
b. ? + Cl2 AlCl3<br />
c. ? + ? MgO<br />
– Nhắc lại II.<br />
– Làm bài tập 1 .<br />
o<br />
t<br />
a. Zn + S ⎯⎯→ ZnS<br />
2Al + 3Cl → 2AlCl<br />
b. 2 3<br />
o<br />
t<br />
c. 2Mg + O2 ⎯⎯→ 2MgO<br />
o<br />
t<br />
d. Cu + Cl2 ⎯⎯→ CuCl2<br />
e. Fe + 2HCl FeCl2 + H2<br />
o<br />
t<br />
⎯⎯→<br />
o<br />
t<br />
⎯⎯→ 2NaCl<br />
II. Phản ứng của kim<br />
loại với dung dịch axit:<br />
Một số kim loại + dd<br />
axit → muối + giải<br />
phóng khí hidro<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
Zn + H SO →<br />
ZnSO<br />
2 4<br />
+ H <br />
4 2<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
41<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
d. ? + ? CuCl2<br />
f. R+ 2HCl RCl2 + H2<br />
e. ? + HCl FeCl2 + ? g.2R+3H2SO4R2(SO4)3+3H2<br />
f. R + ? RCl2 + ?<br />
g. R + ? R2(SO4)3 + ?<br />
Hoạt động 3: Phản ứng của kim loại với dung dịch muối.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
– TN đối chứng:<br />
1: Cho dây đồng vào dd<br />
AgNO3.<br />
2: Cho dây Zn vào dd CuSO4<br />
3: Cho dây Cu vào dd AlCl3.<br />
? Kết luận.<br />
– Lưu ý: trừ kim loại Na, Ba,<br />
Ca, K.<br />
– Đưa bài tập 2: Hoàn thành<br />
PTHH sau:<br />
a.Al+AgNO3 ? + ?<br />
b.?+CuSO4FeSO4+ ?<br />
c. Mg + ? ? + Ag<br />
d.Al + CuSO4 ? + ?<br />
Lồng ghép giáo dục vai trò và<br />
ứng dụng tài nguyên kim loại<br />
1: kim loại trắng xám bám vào dây đồng.<br />
Đồng tan dần. Dd không màu dần thành<br />
xanh.<br />
Cu + AgNO → Cu(<br />
NO ) + 2Ag<br />
<br />
2<br />
3<br />
3 2<br />
2: kim loại bám ngoài dây kẽm. Màu<br />
xanh của dd nhạt dần. Zn tan dần.<br />
Zn + CuSO4<br />
→ ZnSO4<br />
+ Cu<br />
Nhận xét: Cu mạnh hơn Ag; Zn mạnh<br />
hơn Cu<br />
3: Không có hiện tượng gì xảy ra.<br />
Nhận xét: Cu yếu hơn Al.<br />
- Kết luận: Chỉ có kim loại hoạt động hóa<br />
<strong>học</strong> mạnh hơn mới đẩy được kim loại yếu<br />
hơn ra khỏi dd muối. → III.<br />
- Làm bài tập:<br />
a).<br />
Al + 3AgNO<br />
b).<br />
Fe+<br />
CuSO<br />
c).<br />
Mg + 2AgNO<br />
d).2<br />
Al + 3CuSO<br />
→ Al(<br />
NO )<br />
→ FeSO<br />
+ Cu<br />
→ Mg(<br />
NO )<br />
→ Al ( SO )<br />
+ 3Ag<br />
<br />
+ 2Ag<br />
<br />
+ 3Cu<br />
3. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1, 2, 3, 4, 5, 6 trang 51 SGK và xem bài “ Dãy hoạt động hh của kim loại”.<br />
- BT 1: Ngâm một lá kẽm trong 200 g dd CuSO4 4 % cho đén khi không tan được nữa,<br />
tính khối lượng kẽm đã tham gia phản ứng và C% dd sau phản ứng<br />
- BT 2: Cho 1,38g kim loại X (I) tác dụng hết với nước tạo ra 2,24 lít H2 đktc. Tìm X<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
4<br />
3<br />
3<br />
4<br />
2<br />
4<br />
3<br />
3<br />
3<br />
4<br />
2<br />
3<br />
III. Phản<br />
ứng của<br />
kim loại<br />
với dung<br />
dịch muối:<br />
Kim loại<br />
hoạt động<br />
mạnh hơn<br />
(trừ K,<br />
Na,Ca,Ba)<br />
có thể đẩy<br />
kim loại<br />
hoạt động<br />
hóa <strong>học</strong><br />
yếu hơn ra<br />
khỏi dung<br />
dịch muối<br />
muối<br />
mới và kim<br />
loại mới .<br />
Zn + CuSO →<br />
ZnSO<br />
4<br />
4<br />
+ Cu <br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
42<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 14 / 11/ <strong>2017</strong><br />
Tiết 23<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Dãy hoạt động hóa <strong>học</strong> của kim loại và hiểu ý nghĩa của nó.<br />
* Về kĩ <strong>năng</strong>: Tiến hành thí nghiệm nghiên cứu, đối chứng để rút ra kim loại hoạt động<br />
mạnh yếu và cách sắp xếp <strong>theo</strong> từng cặp. Từ đó rút ra cách sắp xếp của dãy, ý nghĩa của<br />
dãy, viết phương trình hh chứng minh<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm, đàm thoại.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ: giá ống nghiệm, ống nghiệm, cốc thủy tinh, kẹp gỗ.<br />
<strong>Hóa</strong> chất: Na, đinh Fe, dây Cu, dây Ag, dd CuSO4, FeSO4, AgNO3, HCl, H2O, phenol<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Tính chất hóa <strong>học</strong> chung của kim loại.Viết PTHH minh họa.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Họat động 1: Dãy hoạt động hóa <strong>học</strong> của kim loại được xây dựng như thế nào.<br />
– HDHSTN 1 :<br />
+ Cho mẫu Na vào cốc<br />
nước có thêm vài giọt dd<br />
phenolphtalein.<br />
+ Cho đinh sắt vào cốc<br />
nước có phenolphtalein.<br />
?Nêu hiện tượng, nhận xét<br />
và viết PTHH? Kết luận.<br />
– Các nhóm làm thí nghiệm và trình bày:<br />
• Ở 1: Na chạy nhanh trên mặt nước, có khí thoát<br />
ra , dd có màu đỏ.<br />
• Ở 2: Không có hiện tượng<br />
Na + nước → dd bazơ làm phenolphtalein đổi<br />
sang màu đỏ.<br />
– Na mạnh hơn Fe, xếp Na trước Fe.<br />
I.Dãy<br />
hoạt<br />
động<br />
hóa<br />
<strong>học</strong><br />
của<br />
kim<br />
loại :<br />
– HDHSTN 2:<br />
• Ở 1: Có chất rắn trắng bám ngoài đinh sắt, màu<br />
+ Cho 1 đinh Fe vào ống 1: xanh của CuSO4 nhạt dần.<br />
dd CuSO4.<br />
• Ở 2: Không có hiện tượng gì.<br />
+ Cho dây đồng vào ống Sắt đẩy đồng .Đồng không đẩy được sắt .<br />
nghiệm chứa dd FeSO4. Fe + CuSO4<br />
→ FeSO4<br />
+ Cu <br />
? Hiện tượng, nhận xét và – Sắt mạnh hơn đồng. Ta sắp trước đồng.<br />
viết PTHH.? Kết luận:<br />
– HDHSTN 3:<br />
+ Cho Cu vào (1) dd<br />
AgNO3.<br />
+Cho dây Ag vào (2) dd<br />
CuSO4.<br />
? Quan sát hiện tượng, nhận<br />
xét và viết PTHH? Nêu kết<br />
2Na<br />
+ 2H<br />
2O<br />
→ 2NaOH<br />
+ H<br />
2<br />
( 1) chất rắn xám bám vào dây đồng, dd chuyển<br />
thành xanh.<br />
( 2) Không có hiện tượng gì.<br />
Cu đẩy Ag; Ag không đẩy được Cu<br />
Cu + Ag NO ) → Cu(<br />
NO ) 2Ag<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
(<br />
3 3<br />
3 2<br />
+<br />
Cu mạnh hơn Ag. Ta xếp Cu trước Ag.<br />
<br />
K;<br />
Na;<br />
Mg;<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
43<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
luận.<br />
Al;<br />
(1): Có nhiều bọt khí thoát ra.<br />
Zn;<br />
(2): Không có hiện tượng gì.<br />
Fe;<br />
Fe đẩy được H ra khỏi axit. Cu không đẩy được Pb;<br />
H ra khỏi axit.<br />
(H);<br />
Fe + 2HCl<br />
→ FeCl + <br />
Cu;<br />
2<br />
H<br />
2<br />
Ag;<br />
Au.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
– HDHSTN 4:<br />
+ Cho đinh Fe vào (1) dd<br />
HCl.<br />
+ Cho lá Cu vào (2) dd<br />
HCl.<br />
Quan sát , nhận xét và viết<br />
PTHH .? Kết luận.<br />
? Căn cứ kết luận sắp xếp<br />
các kim loại thành dãy <strong>theo</strong><br />
chiều hoạt động hóa <strong>học</strong><br />
giảm dần.<br />
Ta sếp Fe đứng trước H, Cu đứng sau H.<br />
– Sắp xếp như sau:<br />
Na, Fe, H, Cu, Ag.<br />
Bằng nhiều thí nghiệm khác nhau , người ta sắp xếp các kim loại thành dãy <strong>theo</strong><br />
chiều giảm mức độ hóa <strong>học</strong>. → I.<br />
Hoạt động 2: Ý nghĩa của dãy hoạt động hóa <strong>học</strong>.<br />
– Yêu cầu <strong>học</strong><br />
<strong>sinh</strong> đọc SGK và<br />
hỏi ý nghĩa của<br />
dãy hoạt động<br />
hóa <strong>học</strong>.<br />
* Hướng dẫn HS<br />
minh họa bằng<br />
pưhh.<br />
II.<br />
Trả lời<br />
Minh<br />
họa<br />
bằng<br />
phản<br />
ứng hóa<br />
<strong>học</strong>.<br />
II – Ý nghĩa:<br />
+ Độ hoạt động giảm dần từ trái sang phải.<br />
+ Kim loại trước Mg phản ứng với nước ở nhiệt độ<br />
thường.<br />
+ Kim loại trước H phản ứng với dung dịch axit loãng ↑<br />
hidro.<br />
+ Kim loại đứng trước (trừ K,Na,Ca,Ba) đẩy kim loại đứng<br />
sau ra khỏi dd muối.<br />
3. Kiểm tra, đ<strong>án</strong>h giá:<br />
a/ Cho các kim loại: Mg, Fe, Cu, Zn, Ag, Au. Kim loại nào tác dụng được với:<br />
a. Dung dịch H2SO4(l). b. Dung dịch FeCl2. c. Dung dịch AgNO3.<br />
Hoàn thành chuỗi phản ứng sau:<br />
b/ Bài tập: Cho 4,8g kim loại M (có hóa trị II trong hợp chất) tác dụng vừa đủ với 4,48 lít<br />
khí Clo (đkc). Sau phản ứng thu được m gam muối. Xác <strong>định</strong> kim loại M và tính m.<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 1, 2, 3, 4, 5 trang 54 SGK, xem bài “Nhôm”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Mg<br />
MgO<br />
MgCl 2<br />
MgSO 4<br />
MgCO 3<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
44<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 17 / 11/ <strong>2017</strong><br />
Tiết 24<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Tính chất vật lý của kim loại nhôm: Tính chất hóa <strong>học</strong> của nhôm:<br />
- Biết dự đo<strong>án</strong> tính chất hóa <strong>học</strong> của nhôm từ tính chất kim loại nói chung, vị trí của nhôm<br />
trong dãy hoạt động hóa <strong>học</strong><br />
* Về kĩ <strong>năng</strong>: Viết được các phương trình hóa <strong>học</strong> biểu diễn tính chất hóa <strong>học</strong> của nhôm.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát, thảo luận nhóm, đàm thoại<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ: đèn cồn, giá ống nghiệm, ống nghiệm, kẹp gỗ.<br />
<strong>Hóa</strong> chất: Dd AgNO3, HCl, CuCl2, NaOH, bột Al; dây nhôm, sắt.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Cho : Mg, Cu, Ag, Pb, Na, Zn. Hãy sắp xếp <strong>theo</strong> thứ tự tăng dần mức độ hoạt động hh?<br />
Chứng minh rằng Mg mạnh hơn Zn ?<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất vật lý.<br />
? Quan sát bột Al, dây nhôm, nêu – Quan sát, I. Tính chất vật lý:<br />
tính chất vật lý của nhôm.<br />
liên hệ thực tế - Là kim loại màu trắng bạc, có<br />
– Bổ sung : Al có tính dẻo nên có thể và trả lời: Các <strong>án</strong>h kim, nhẹ.<br />
c<strong>án</strong> mỏng hoặc kéo sợi (giấy gói tính chất vật lý - Dẫn điện, dẫn nhiệt.<br />
b<strong>án</strong>h kẹo).<br />
của nhôm - Dẻo.<br />
Hoạt động 2: Tính chất hóa <strong>học</strong>.<br />
? Dự đo<strong>án</strong> tính chất hóa <strong>học</strong> - Nhôm + phi kim, với II. Tính chất hóa <strong>học</strong>:<br />
của nhôm ? Giải thích? axit, dd muối. Vì 1. Nhôm có tính chất hóa <strong>học</strong><br />
- HDHSTN: kiểm tra dự nhôm là kim loại trước chung của kim loại :<br />
đo<strong>án</strong> ? Hiện tượng, viết H. → 1.<br />
a. Nhôm + phi kim.<br />
PTHH ?<br />
- TN nhóm, nhận xét * Nhôm + oxi ở t o cao<br />
o<br />
t<br />
a. Rắc bột Al trên ngọn lửa và viết PTHH: 4Al + 3O2 ⎯⎯→ 2Al2O3<br />
đèn cồn<br />
a. Nhôm cháy s<strong>án</strong>g tạo * Nhôm + phi kim khác ở t o cao<br />
+ Giới thiệu: Ở điều kiện<br />
thường, nhôm + oxi (trong<br />
kk) tạo thành lớp Al2O3<br />
mỏng bền vững. Lớp này<br />
bảo vệ đồ vật bằng nhôm,<br />
- Nhôm + nhiều phi kim<br />
khác: Cl2, S,…<br />
chất rắn màu trắng.<br />
o<br />
t<br />
4Al + 3O2 ⎯⎯→<br />
2Al2O3<br />
Kết luận a.<br />
b.(1) Có hiện tượng sủi<br />
bọt, Al tan dần.<br />
o<br />
t<br />
2Al + 3Cl2 ⎯⎯→ 2AlCl3<br />
b. Nhôm + ddaxit:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
2Al + 6HCl → 2AlCl + 3H<br />
<br />
3 2<br />
* Chú ý: Al không + HNO3,<br />
H2SO4 đặc nguội.<br />
c. Nhôm + dung dịch muối.<br />
2Al + 3CuCl → 2AlCl + 3Cu<br />
<br />
2 3<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
45<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
b.<br />
2. Nhôm còn có tính chất hóa<br />
+ Cho dây Al vào (1)dd HCl<br />
<strong>học</strong> riêng:<br />
+Cho dây Al vào (2)dd<br />
Nhôm + dung dịch kiềm.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
(2) Có chất rắn đỏ bám<br />
ngoài dây Al. Màu<br />
xanh của dd nhạt dần.<br />
CuCl2<br />
(3) Có chất rắn trắng 2Al + 2NaOH + 2H2O<br />
→<br />
+ Dây Al vào (3) dd AgNO3 bám vào dây Al. Dây 2NaAlO2 + 3H2<br />
<br />
c. Nhắc lại tính chất nhôm +<br />
dung dịch muối.<br />
Al tan dần.<br />
- Kết luận b.<br />
- Nhắc lại tính chất c.<br />
2. Đặt vấn đề: Ngoài tính<br />
chất chung của kim loại Al<br />
còn có tính chất đặc biệt nào<br />
không?<br />
+ Cho Fe vào dd NaOH.<br />
2.<br />
+ Sắt không + dd<br />
NaOH<br />
+ Nhôm + dd NaOH có<br />
sủi bọt, nhôm tan dần.<br />
+ Al vào dd NaOH.<br />
- Liên hệ : không nên dùng - Kết luận 2.<br />
đồ nhôm để đựng nước vôi,<br />
dd kiềm.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> kể các ứng dụng Trả III. Ứng dụng: (SGk)<br />
của nhôm trong thực tế.<br />
lời Sản xuất đồ dùng gia đình, chế tạo dây<br />
Lồng ghép giáo dục ứng dụng nhôm III. dẫn điện, vật liệu xây dựng, … chế tạo máy<br />
trong cuộc sống<br />
ôtô, tàu vũ trụ…<br />
IV. Điện phân nóng chảy quặng<br />
IV. Sản xuất:<br />
boxit<br />
Chú + Nguyên liệu: Boxit.<br />
- Nguy cơ bùn đỏ(bả thải) gây ô ý + Phương pháp: điện phân nóng chảy.<br />
nhiễm lớn cho môi trường, nhất là →<br />
đối với nguồn nước ngầm.<br />
IV.<br />
- Giới thiệu PP đ/c dùng Mg đẩy Al<br />
ra khỏi muối Al.<br />
3. Kiểm tra, đ<strong>án</strong>h giá:<br />
a/ Bài 2/58 SGK : Cho biết hiện tượng xảy ra, giải thích và viết PTHH khi thả một mảnh<br />
Al vào các dung dịch: a. MgSO4 b. CuCl2 c. AgNO3 d. HCl<br />
b/ Bài tập: Tính khối lượng nhôm sản xuất được từ một tấn quặng bô-xít có chứa 90%<br />
Al2O3 biết quá trình sản xuất có hao hụt khoảng 5 %<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Xem bài “Sắt” và làm bài tập 1, 3, 4, 5, 6 trang 57, 58 SGK.<br />
V. RÚT KINH NGHIỆM:<br />
đpnc<br />
2Al O 4Al 3O<br />
cryolit → +<br />
2 3 2<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
46<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 21 /11/ <strong>2017</strong><br />
Tiết 25<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Biết dự đo<strong>án</strong> tính chất vật lý và tính chất hóa <strong>học</strong> của sắt. Biết liên hệ tính<br />
chất của sắt và vị trí của sắt trong dãy hoạt động hóa <strong>học</strong> của sắt.<br />
* Về kĩ <strong>năng</strong>:<br />
- Biết dùng thí nghiệm và sử dụng kiến thức cũ để kiểm tra dự đo<strong>án</strong> và kết luận về tính<br />
chất hóa <strong>học</strong> của sắt.<br />
- Viết được các phương trình phản ứng minh họa cho tính chất hóa <strong>học</strong> của sắt.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ: bình thủy tinh miệng rộng; đèn cồn; kẹp gỗ.<br />
<strong>Hóa</strong> chất: Dây sắt hình lò xo, bình clo.<br />
Phiếu <strong>học</strong> tập.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
Tính chất hóa <strong>học</strong> của nhôm. Viết các phương trình phản ứng minh họa.<br />
Gọi 2 <strong>học</strong> <strong>sinh</strong> chữa bài tập 2 trang 58 SGK.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất của sắt.<br />
? Liên hệ thực tế nêu các - Nêu các tính chất vật I. Tính chất vật lý:<br />
tính chất vật lý của sắt. lý → I.<br />
- Có <strong>án</strong>h kim, dẫn điện, dẫn<br />
nhiệt, dẻo.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> đọc SGK - Đọc SGK và biết - Là kim loại nặng (có d =<br />
để bổ sung thêm thông tin. thông tin:<br />
7,86g/cm 3 ).<br />
? Sắt có tính chất hóa <strong>học</strong> - Trả lời: Sắt có những - Nóng chảy ở nhiệt độ 1539 0 C.<br />
của kim lọai không? tính chất hóa <strong>học</strong> của II. Tính chất hóa <strong>học</strong>:<br />
kim loại.<br />
a. Tác dụng với phi kim:<br />
- Thí nghiệm: Cho dây sắt → II.<br />
* Sắt + oxi ở t o cao<br />
quấn hình lò xo đã nung<br />
nóng đỏ vào bình đựng Clo.<br />
- Thông báo: Ở nhiệt độ cao<br />
sắt + nhiều phi kim khác<br />
như: S, Br2…tạo muối FeS,<br />
FeBr3…<br />
- Lưu ý <strong>học</strong> <strong>sinh</strong>: <strong>Hóa</strong> trị của<br />
sắt khi Fe tác dụng với dd<br />
- Quan sát thí nghiệm<br />
và nêu hiện tượng: Sắt<br />
cháy s<strong>án</strong>g chói tạo<br />
thành khói nâu đỏ.<br />
o<br />
t<br />
2Fe + 3Cl2 ⎯⎯→<br />
2FeCl3<br />
Chú ý và biết:<br />
o<br />
t<br />
3Fe + 2O2 ⎯⎯→ Fe3O4<br />
* Sắt + phi kim khác ở t o cao<br />
o<br />
t<br />
2Fe + 3Cl2 ⎯⎯→ 2FeCl3<br />
b. Sắt + dd axit → muối sắt (II)<br />
+ hidro:<br />
Fe+2HClFeCl2+H2<br />
* Chú ý: Sắt không + HNO3,<br />
H2SO4 đặc nguội.<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
47<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
axit và muối.<br />
+ Sắt có hóa trị II, III, c. Sắt + dd muối → muối sắt<br />
Lồng ghép giáo dục vai trò tùy điều kiện phản ứng (II) + kim loại :<br />
và ứng dụng kim loại sắt .<br />
Fe+CuSO4FeSO4+Cu↓<br />
trong cuộc sống .<br />
Hoạt động 2: Luyện tập – củng cố.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> làm - Làm bài tập 1:<br />
bài tập 1:<br />
Fe + 2HCl → FeCl + H <br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
FeCl2 →Fe( NO3 )<br />
3<br />
→Fe<br />
<br />
Fe → FeCl3 →Fe( OH )<br />
3<br />
→<br />
<br />
Fe2O3<br />
→ Fe<br />
- Bài tập 2: Cho m gam<br />
bột sắt dư vào 20ml<br />
dung dịch CuSO4 1M.<br />
Phản ứng kết thúc, lọc<br />
được dung dịch A và<br />
4,08g chất rắn B.<br />
a. Tính m?<br />
b. Tính nồng độ mol<br />
của chất có trong dung<br />
dịch A (giả thiết rằng<br />
).<br />
V =<br />
A<br />
V CuSO4<br />
0<br />
2 2<br />
2Fe + 3Cl ⎯⎯→ 2FeCl<br />
o<br />
t<br />
2 3<br />
FeCl + 2 AgNO → Fe( NO ) + 2AgCl<br />
2 3 3 2<br />
FeCl + 3 NaOH → Fe( OH ) + 3NaCl<br />
3 3<br />
2 Fe( OH ) ⎯⎯→ Fe O + 3H O<br />
t<br />
3 2 3 2<br />
Fe O + 3H ⎯⎯→ 2Fe + 3H O<br />
o<br />
t<br />
2 3 2 2<br />
- Làm bài tập 2:<br />
Chất rắn B: gồm Cu và Fe dư. Vì Fe dư nên CuSO4 phản ứng<br />
hết => dung dịch A có FeSO4.<br />
a. Tính m.<br />
Fe + CuSO4 FeSO4 + Cu↓<br />
n<br />
CuSO<br />
4<br />
= 0,02 1 = 0,02( mol). Theo(1)<br />
n = n = n = n = 0,02( mol) = m = 0,02 64 = 1,28( g)<br />
Cu Fe( pu)<br />
FeSO CuSO Cu<br />
4 4<br />
m = 4,08 − 1,28 = 2,8( g) = m = 0,02 56 = 1,12(g)<br />
Fe( du) Fe( pu)<br />
lượng ban đầu của Fe: m = 1,12 + 2,8 = 3,92g<br />
b.<br />
C<br />
M FeSO 4<br />
0,02<br />
= = 1( M )<br />
0,02<br />
Vậy khối<br />
3. Kiểm tra, đ<strong>án</strong>h giá: Bài4/60: Sắt tác dụng với những chất nào sau? Viết các PTHH và<br />
ghi điều kiện nếu có.<br />
a. Dd muối Cu(NO3)2 b. H2SO4 đặc nguội c. Khí Cl2 d. Dd ZnSO4<br />
4. Hướng dẫn <strong>học</strong> bài ở nhà:<br />
Cho 3 lọ mất nhãn, mỗi lọ đựng các kim loại Al, Fe, Ag. Trình bày phương pháp hóa <strong>học</strong><br />
phân biệt các kim loại trên.<br />
Làm bài tập 1, 2, 3, 5 trang 60 SGK và xem trước bài “ Hợp kim sắt”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
48<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 24 / 11/ <strong>2017</strong><br />
Tiết 26<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Gang là gì? Thép là gì? Tính chất và một số ứng dụng của gang, thép.<br />
- Nguyên tắc, nguyên liệu và quá trình sản xuất gang trong lò cao, sản xuất thép trong lò<br />
luyện thép.<br />
* Về kĩ <strong>năng</strong>: Viết phương trình hóa <strong>học</strong> phản ứng, khai thác thông tin từ tranh vẽ …<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại muối trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, quan sát.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Trang vẽ sơ đồ lò cao, lò luyện thép.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Tính chất hóa <strong>học</strong> của sắt? Viết các phương trình hh minh họa.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Hợp kim của sắt.<br />
Yêu cầu HS đọc<br />
SGK và thảo<br />
luận các câu hỏi:<br />
+ Hợp kim là gì?<br />
→ 1. & 2.<br />
? So s<strong>án</strong>h thành<br />
phần của gang<br />
và thép? Ứng<br />
dụng của chúng?<br />
Lồng ghép giáo<br />
dục sử dụng<br />
gang - thép<br />
đúng mục đích.<br />
– Đọc SGK thảo luận và trả lời câu hỏi:<br />
+ Hợp kim là chất rắn thu được sau khi<br />
làm nguội hổn hợp nóng chảy nhiều<br />
kim loại khác nhau hoặc của kim loại<br />
và phi kim.<br />
+ Thành phần của gang – thép:<br />
• Giống: thành phần nguyên tố<br />
• Khác: hàm lượng C<br />
+ Ứng dụng: gang trắng dùng luyện<br />
thép; gang xám dùng để đúc bệ máy,<br />
ống dẫn nước…Thép dùng chế tạo<br />
nhiều chi tiết máy, vật dụng, dụng cụ<br />
lao động. Đặc biệt thép dùng để làm<br />
vật liệu xây dựng, phương tiện giao<br />
thông, vận tải.<br />
I. Hợp kim của sắt<br />
1. Gang : là hợp kim của sắt<br />
với cacbon và một số<br />
nguyên tố khác , hàm lượng<br />
cacbon chiếm từ 2 – 5%,<br />
2. Thép : là hợp kim của sắt<br />
với cacbon và một số<br />
nguyên tố khác, hàm lượng<br />
C dưới 2%.<br />
Hoạt động 2: Sản xuất gang thép.<br />
–<br />
Đọc,<br />
quan<br />
sát,<br />
thảo<br />
luận<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Yêu cầu <strong>học</strong><br />
<strong>sinh</strong> đọc SGK<br />
và cho biết:<br />
? Nguyên<br />
liệu? Nguyên<br />
tắc? Quá trình<br />
II. Sản xuất gang, thép:<br />
1. Sản xuất gang :<br />
a. Nguyên liệu: quặng sắt: quặng manhetit (Fe3O4) và hematit<br />
(Fe2O3). Than cốc, không khí giàu oxi và một số chất phụ gia khác<br />
như đá vôi.<br />
b. Nguyên tắc: dùng CO khử oxit sắt ở t o cao.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
49<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
sản xuất gang và c. Quá trình sản xuất gang:<br />
o<br />
o<br />
t<br />
t<br />
trong lò cao. trình C + O2 ⎯⎯→ CO2 C + CO2 ⎯⎯→ 2CO<br />
o<br />
→ 1. bày:<br />
t<br />
hay<br />
2C + O2 ⎯⎯→ 2CO<br />
? Nguyên<br />
Khí CO khử oxit sắt trong quặng.<br />
0<br />
liệu, nguyên<br />
t<br />
3CO<br />
+ Fe2O3<br />
⎯⎯→ 2Fe+<br />
3CO2<br />
tắc, quá trình<br />
* Sắt nóng chảy hòa tan một lượng nhỏ C và một số các nguyên tố<br />
sản xuất thép?<br />
khác tạo gang lỏng chảy xuống nồi lò và được đưa ra ngoài qua cửa<br />
→ 2.<br />
tháo gang. Đá vôi bị phân hủy thành CaO, CaO kết hợp với các oxit<br />
- Quá trình<br />
SiO2, … tạo xỉ nổi lên và được đưa ra ở cửa tháo xỉ.<br />
sản xuất hàng<br />
o<br />
t<br />
ngày thải ra<br />
CaO + SiO2 ⎯⎯→ CaSiO3 ↓ (xỉ)<br />
lượng lớn<br />
2. Sản xuất thép:<br />
chất thải<br />
a. Nguyên liệu: gang, sắt phế liệu và oxi.<br />
dạng rắn, bụi, b. Nguyên tắc: oxi hóa một số kim loại, phi kim để loại ra khỏi<br />
khí và nước gang phần lớn các nguyên tố C, Si, Mn, …<br />
thải ảnh<br />
c. Quá trình sản xuất thép:<br />
hưởng đến<br />
Khí oxi, oxi hóa sắt tạo thành FeO, sau đó FeO sẽ oxi hóa một số<br />
môi trường nguyên tố trong gang như C, Si, S, P, …<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
C + O2 CO2↑ ;<br />
3. Kiểm tra, đ<strong>án</strong>h giá:<br />
- Thế nào là hợp kim? Gang? Thép?<br />
- Nguyên liệu, nguyên tắc, quá trình sản xuất gang, thép.<br />
- Lập PTHH <strong>theo</strong> sơ đồ sau đây và cho biết phản ứng này xảy ra trong lò luyện gang,<br />
luyện thép.<br />
o<br />
t<br />
⎯⎯→<br />
0<br />
t<br />
FeO + Mn ⎯⎯→ Fe + MnO<br />
0 0<br />
t<br />
t<br />
2 3 2<br />
a). FeO + Mn ⎯⎯→ Fe + MnOb).<br />
Fe O + CO ⎯⎯→ Fe + CO<br />
0 0<br />
t<br />
t<br />
2<br />
c). FeO + Si ⎯⎯→ Fe + SiO d).<br />
FeO + C ⎯⎯→ Fe + CO<br />
- Bài tập 1: Tính khối lượng quặng hêmatic chứa 60% Fe2O3 cần dùng để sản xuất 1 tấn<br />
gang chứa 4 % cacbon. Nếu hiệu suất quá trình là 90%<br />
5. Hướng dẫn <strong>học</strong> bài ở nhà:<br />
Làm bài tập4, 5, 6 trang 63 SGK.<br />
Tiến hành trước các thí nghiệm: Các yếu tố ảnh hưởng đến sự ăn mòn.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
50<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 29 /11/ <strong>2017</strong><br />
Tiết 27<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Khái niệm về sự ăn mòn kim loại.<br />
- Nguyên nhân làm kim lọai bị ăn mòn và các yếu tố ảnh hưởng đến sự ăn mòn, từ đó<br />
biết cách bảo vệ các đồ vật bằng kim loại.<br />
* Về kỹ <strong>năng</strong>:<br />
- Biết liên hệ với các hiện tượng trong thực tế về sự ăn mòn kim loại, những yếu tố ảnh<br />
hưởng và bảo vệ kim loại khỏi sự ăn mòn.<br />
- Biết thực hiện các thí nghiệm nghiên cứu các nguyên tố ảnh hưởng đến sự ăn mòn<br />
kim loại.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các loại hợp kim trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Một số đồ dùng đã bị rỉ.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Làm thí nghiệm “Ảnh hưởng của các chất trong môi trường đến<br />
sự ăn mòn kim loại”.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
• Thế nào là hợp kim? So s<strong>án</strong>h thành phần, tính chất và ứng dụng của gang và thép.<br />
• Nguyên tắc, nguyên liệu sản xuất gang. Viết các phương trình hóa <strong>học</strong> xảy ra.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Họat đông 1: Thế nào là sự ăn mòn kim loại.<br />
- Cho <strong>học</strong> <strong>sinh</strong> quan sát một số đồ<br />
I. Sự ăn mòn kim loại: là sự<br />
dùng bị rỉ nêu khái niệm. - Quan sát và nêu phá hủy kim loại, hợp kim<br />
- Nguyên nhân của sự ăn mòn.<br />
→ I. do kim loại tiếp xúc với<br />
- Sau đó, cho <strong>học</strong> <strong>sinh</strong> đọc SGK.<br />
những chất trong môi trường.<br />
- Kim loại, hợp kim bị biến chất do - Đọc SGK.<br />
tác dụng hóa <strong>học</strong> trong môi trường.<br />
Hoạt động 2: Những yếu tố ảnh hưởng đến sự ăn mòn kim loại.<br />
- Gọi <strong>học</strong> <strong>sinh</strong> nhận xét hiện<br />
tượng đã chuẩn bị.<br />
- Từ các hiện tượng trên yêu<br />
cầu <strong>học</strong> <strong>sinh</strong> rút ra kết luận.<br />
- Liên hệ: thanh sắt trong bếp<br />
than bị ăn mòn nhanh hơn để ở<br />
nơi khô ráo, tho<strong>án</strong>g mát.<br />
– Nhận xét:<br />
+ Ở ống 1: (đinh sắt trong<br />
không khí khô): không bị<br />
ăn mòn.<br />
+ Ở ống 2: đinh sắt trong<br />
nước có hòa tan oxi bị ăn<br />
mòn chậm.<br />
+ Ở ống 3: đinh sắt trong<br />
II. Những yếu tố ảnh<br />
hưởng đến sự ăn mòn<br />
kim loại:<br />
+ Thành phần của môi<br />
trường mà kim loại tiếp<br />
xúc.<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
+ Ở nhiệt độ cao sự ăn<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
51<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- Trong môi trường, đồ dùng dung dịch muối ăn: bị ăn mòn kim lọai diễn ra<br />
hay công trình bằng kim loại, mòn nhanh.<br />
nhanh hơn.<br />
hợp kim bị ăn mòn nghiêm + Ở ống 4: đinh sắt trong<br />
trọng không chỉ thiệt hại về tài nước cất không bị ăn mòn.<br />
sản mà còn là vấn đề môi<br />
trường toàn cầu.<br />
– Kết luận → II.<br />
Hoạt động 3: Bảo vệ kim loại không bị ăn mòn.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> thảo - Thảo luận nhóm III. Bảo vệ kim loại không bị ăn<br />
luận nhóm trả lời câu hỏi: và trình bày: mòn: bằng các biện pháp :<br />
? Vì sao phải bảo vệ kim + Phải bảo vệ kim • Ngăn không cho kim loại tiếp xúc<br />
loại?<br />
loại để các đồ dùng với môi trường như sơn, mạ, bôi dầu<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
? Các biện pháp bảo vệ<br />
kim loại?<br />
- Cuối cùng yêu cầu <strong>học</strong><br />
<strong>sinh</strong> đọc mục “ECB”.<br />
Lồng ghép giáo dục sử<br />
dụng đi đôi với bảo quản<br />
kim loại, hợp kim trong kĩ<br />
thuật và cuộc sống.<br />
bằng kim loại<br />
không bị ăn mòn.<br />
→ Các biện<br />
pháp:<br />
- Đọc và biết quy<br />
trình bảo vệ một số<br />
máy móc.<br />
mỡ ,… Để đồ vật kim loại nơi khô<br />
ráo, thường xuyên lau chùi; rửa sạch<br />
sẽ đồ dùng, dụng cụ lao động và tra<br />
dầu mỡ .<br />
• Chế tạo hợp kim ít bị ăn mòn: cho<br />
thêm vào thép một số kim loại crom,<br />
niken (kền) làm tăng độ bền của thép<br />
với môi trường.<br />
4. Kiểm tra, đ<strong>án</strong>h giá.<br />
- Ăn mòn kim loại là gì? Nguyên nhân của sự ăn mòn kim loại?<br />
- Các biện pháp bảo vệ kim lọai khỏi bị ăn mòn?<br />
- Sự ăn mòn kim loại là hiện tượng vật lý hay hóa <strong>học</strong>? Lấy ví dụ chứng minh.<br />
- Chọn câu đúng: Con dao làm bằng thép không bị rỉ nếu:<br />
a. Sau khi dùng, rửa sạch, lau khô.<br />
b. Cắt chanh rồi không rửa.<br />
c. Ngâm trong nước tự nhiên hoặc nước máy lâu ngày.<br />
d. Ngâm trong nước muối một thời gian.<br />
5. Hướng dẫn <strong>học</strong> bài ở nhà: Chuẩn bị bài thực hành Tính chất hóa <strong>học</strong> của nhôm và sắt<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
52<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 29 /11/ <strong>2017</strong><br />
Tiết 28<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Khắc sâu kiến thức hóa <strong>học</strong> của nhôm và sắt.<br />
* Về kỹ <strong>năng</strong>:<br />
- Tiếp tục rèn luyện kỹ <strong>năng</strong> thực hành hóa <strong>học</strong>, khả <strong>năng</strong> làm thực hành hóa <strong>học</strong>.<br />
- Rèn luyện ý thức cẩn thận, kiện trì trong <strong>học</strong> tập và trong thực hành hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các kim loại nhôm và sắt trong<br />
đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Thực hành <strong>theo</strong> nhóm.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
- Dụng cụ: đèn cồn, giá sắt, kẹp sắt, ống nghiệm, giá ống nghiệm, nam châm.<br />
- <strong>Hóa</strong> chất: bột nhôm, bột sắt, bột lưu huỳnh, dung dịch NaOH.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem trước nội dung thực hành và kẻ tường trình thí nghiệm.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Họat động 1: Thí nghiệm1 – Tác dụng của nhôm với oxi<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> nêu cách<br />
tiến hành thí nghiệm 1.<br />
– Hướng dẫn các nhóm làm<br />
thí nghiệm, quan sát hiện<br />
tượng và viết phương trình<br />
phản ứng.<br />
– Nêu: Rắc nhẹ bột nhôm trên ngọn lửa đèn cồn.<br />
– Các nhóm làm thí nghiệm và nhận xét:<br />
Nhôm cháy s<strong>án</strong>g tạo thành chất rắn màu trắng.<br />
4Al + 3O2 2Al2O3<br />
Giải thích: Nhôm cháy trong oxi tạo ra nhôm oxit.<br />
Trong phản ứng Al đóng vai trò là các chất oxi hóa.<br />
Hoạt động 2: Thí nghiệm2 – Tác dụng của sắt với lưu huỳnh.<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> thí nghiệm:<br />
+ Cho hổn hợp bột Fe: S = 7:4 (về<br />
khối lượng) vào ống nghiệm.<br />
+ Đun nóng trên ngọn lửa đèn<br />
cồn.<br />
Yêu cầu <strong>học</strong> <strong>sinh</strong> quan sát hiện<br />
tượng, màu sắc, trạng thái của Fe,<br />
S và chất sau khi đun.<br />
- Làm thí nghiệm <strong>theo</strong> nhóm và nhận xét:<br />
+ Hiện tượng:<br />
• Trước thí nghiệm: Bột Fe màu trắng xám, bị nam<br />
châm hút, bột S màu vàng nhạt.<br />
• Khi đun hổn hợp trên ngọn lửa đèn cồn hổn hợp<br />
cháy nóng đỏ, tỏa nhiều nhiệt.<br />
• Sản phẩm tạo thành khi để nguội có chất rắn màu<br />
đen, không bị nam châm hút.<br />
0<br />
Dùng nam châm hút hổn hợp<br />
t<br />
Fe + S ⎯⎯→ FeS<br />
trước và sau khi đun. Nhận xét?<br />
Hoạt động 3: Nhận biết kim loại nhôm, sắt<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
53<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- Nêu vấn đề: Có hai lọ<br />
không d<strong>án</strong> nhãn đựng - Các nhóm làm thí nghiệm và nhận xét:<br />
2 kim loại riêng biệt: Lấy một ít bột trong 2 lọ cho vào 2 ống nghiệm 1 và 2.<br />
Al, Fe. Làm tế nào để Nhỏ một vài giọt NaOH vào từng ống nghiệm.<br />
nhận biết?<br />
• Ống nghiệm có hiện tượng sủi bọt khí chứa kim loại Al còn lại<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> tiến là Fe.<br />
hành thí nghiệm. 2Al<br />
+ 2NaOH<br />
+ 2H<br />
2O<br />
→ 2NaAlO2<br />
+ 3H<br />
2<br />
<br />
Hoạt động 4: Tường trình thí nghiệm: 13 phút<br />
Tên thí Cách tiến hành Hiện tượng quan sát Giải thích và viết phương trình HH<br />
nghiệm<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Al tác<br />
dụng<br />
Rắc một ít bột Al<br />
trên ngọn lửa đèn<br />
Nhôm cháy s<strong>án</strong>g tạo<br />
thành chất rắn có<br />
Chất rắn màu trắng là nhôm oxit.<br />
4Al + 3O2 2Al2O3<br />
với O2 cồn.<br />
màu trắng.<br />
Fe tác<br />
dụng<br />
với S<br />
- Cho hổn hợp bột<br />
Fe: S = 7:4 (về<br />
khối lượng) vào<br />
ống nghiệm.<br />
- Đun nóng trên<br />
Hổn hợp nóng đỏ,<br />
sau khi phản ứng<br />
xong để nguội có<br />
màu đen không bị<br />
nam châm hút.<br />
Sản phẩm không bị nam châm hút<br />
do tạo thành chất mới có tính chất<br />
khác so với tính chất ban đầu.<br />
ngọn lửa đèn cồn:<br />
- Đưa nam châm<br />
lại gần sản phẩm.<br />
(r) (r) (màu đen)<br />
Nhận - Lấy một ít bột - Một ống nghiệm - Ống nghiệm có hiện tượng sủi bọt<br />
biết Al trong 2 lọ cho vào có hiện tượng sủi khí đựng Al.<br />
và Fe. 2 ống nghiệm. bọt khí.<br />
- Cho vài giọt - Một ống nghiệm<br />
dung dịch NaOH không có hiện tượng<br />
vào.<br />
gì.<br />
- Ống nghiệm không có hiện tượng<br />
gì đựng Fe<br />
<strong>Giáo</strong> dục sử dụng tài nguyên nhôm; sắt đúng mục đích, tiết kiệm và môi trường<br />
Hoạt động 5: Hướng dẫn <strong>học</strong> ở nhà:<br />
Xem trước bài “ Luyện tập chương II” và làm thêm 1 số bài tập:<br />
- BT1: Hòa tan 11 g hỗn hợp nhôm, sắt trong dd NaOH dư thấy còn lại a g chất rắn X<br />
không tan. Hòa tan hết a g X vào dd HCl dư thu được 2,24 lít khí H2 ở đktc. Tính % khối<br />
lượng mỗi kim loại trong hỗn hợp ban đầu<br />
- BT 2: Tính khối lượng sắt tác dụng vừa đủ với 200 ml dd H2SO4 1 M, thể tích khí H2<br />
<strong>sinh</strong> ra ờ đktc và khối lượng FeSO4.7H2O kết tinh khi cô cạn dd muối thu được<br />
- BT 3: Hòa tan hết 8g hỗn hợp Fe, Mg trong 200 g dd HCl vừa đủ, thu được dd chứa 22,2<br />
g hỗn hợp 2 muối . Tính % m mỗi kim loại trong hỗn hợp đầu và C% dd HCl đã dùng.<br />
V. RÚT KINH NGHIỆM:<br />
Fe+<br />
S ⎯<br />
0<br />
t<br />
⎯→<br />
Al + NaOH + H<br />
3 NaAlO<br />
2<br />
+ H<br />
2<br />
2<br />
FeS<br />
O →<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
2<br />
<br />
( r)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
54<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 2 /12/ <strong>2017</strong><br />
Tiết 29<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Hệ thống hóa các kiến thức cơ bản. So s<strong>án</strong>h được tính chất của nhôm với<br />
sắt và so s<strong>án</strong>h tính chất chung của kim loại.<br />
* Về kỹ <strong>năng</strong>: Biết vận dụng ý nghĩa của dãy hoạt động hóa <strong>học</strong> để xét và viết các<br />
phương trình phản ứng hóa <strong>học</strong>. Vận dụng để làm các bài tập <strong>định</strong> tính và <strong>định</strong> lượng.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các kim loại trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: <strong>Đà</strong>m thoại, hoạt động nhóm<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Bảng phụ, phiếu <strong>học</strong> tập.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Ôn tập lại các kiến thức có trong chương.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Kiến thức cần nhớ.<br />
? Nhắc lại tính chất hóa<br />
<strong>học</strong> của kim loại.<br />
? Viết dãy họat động hóa<br />
<strong>học</strong> của kim loại? Ý<br />
nghĩa?<br />
? Viết PTHH minh họa:<br />
+ Kim loại + phi kim.<br />
Clo , Oxi , Lưu huỳnh.<br />
+ Kim loại + nước.<br />
+ Kim loại + dd axit.<br />
+Kim loại + dd muối.<br />
I- Kiến thức cần nhớ.<br />
– Tính chất hóa <strong>học</strong> kim loại: tác dụng với phi kim.; với dd<br />
axit. ; với dd muối.<br />
– Dãy hoạt động hóa <strong>học</strong> của kim loại.<br />
K, Na, Mg, Al, Zn, Fe, Pb, H, Cu, Ag, Au.<br />
Ý nghĩa: (SGK)<br />
– Thảo luận nhóm và trả lời:<br />
+ So s<strong>án</strong>h tính chất hóa <strong>học</strong> của nhôm và sắt.<br />
• Giống: Có những tính chất hóa <strong>học</strong> chung của kim loại. Al<br />
và Fe không + HNO3, H2SO4 đặc nguội.<br />
• Khác: Al + dd kiềm, còn Fe thì không. Trong các hợp chất<br />
Al chỉ có hóa trị III, còn Fe có cả 2 hóa trị II và III.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> thảo 2Al + 3Cl2 → 2AlCl3 + H<br />
2<br />
<br />
luận:<br />
2Fe + 3Cl2 →2FeCl3<br />
? So s<strong>án</strong>h được tính chất 2NaOH + 2Al + 2H 2O → 2NaAlO2 + 3H<br />
2<br />
<br />
hóa <strong>học</strong> của nhôm và sắt. – Làm bài tập 1:<br />
? Viết các PTHH minh + Chuỗi a).<br />
họa.<br />
+ Chuỗi b)<br />
Bài tập 1:Hoàn thành – Các nhóm thảo luận hoàn thành phiếu <strong>học</strong> tập.<br />
chuỗi a)<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Al ⎯⎯→ Al ( SO ) ⎯⎯→ AlCl<br />
(1) (2)<br />
2 4 3 3<br />
⎯⎯→ Al( OH ) ⎯⎯→ Al O ⎯⎯→<br />
(3) (4) (5)<br />
3 2 3<br />
Al ⎯⎯→ Al O ⎯⎯→ Al( NO )<br />
(6) (7)<br />
2 3 3 3<br />
Thành<br />
phần<br />
Gang<br />
– Fe ,C và một số<br />
nguyên tố khác, hàm<br />
lượng C từ 2 – 5%.<br />
Thép<br />
– Fe ,C và một số nguyên tố<br />
khác hàm lượng C < 2%.<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
55<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
b)<br />
Tính Giòn, không rèn, – <strong>Đà</strong>n hồi, dẻo , cứng.<br />
(1) (2) (3)<br />
Fe ⎯⎯→ FeCl2 ⎯⎯→ Fe( OH )<br />
2<br />
⎯⎯→ FeSO4<br />
chất không dát mỏng<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Fe ⎯⎯→ FeCl ⎯⎯→ Fe( OH ) ⎯⎯→<br />
(4) (5) (6)<br />
3 3<br />
được<br />
(7) (8)<br />
Fe2O3 ⎯⎯→ Fe ⎯⎯→ Fe3O4<br />
Sản – Dùng CO khử oxit<br />
xuât sắt ở nhiệt độ cao.<br />
Gang Thép<br />
0<br />
t<br />
Fe2O3<br />
+ 3CO<br />
⎯⎯→ 2Fe+<br />
3CO<br />
T.chất<br />
T.phần<br />
S. xuất<br />
– Phát phiếu <strong>học</strong> tập :<br />
II- Luyện tập:<br />
Bài tập 2<br />
a. Những kim loại tác dụng được với HCl là Fe và Al.<br />
b. Những kim loại tác dụng được với KOH là Al.<br />
c. Kim loại tác dụng được với CuSO4 là: Fe, Al.<br />
d. Kim loại tác dụng với dd AgNO3 là Al, Fe, Cu<br />
Bài tập 3<br />
0,672<br />
2R + 6HCl → 2RCl3+ 3 H2<br />
(1), nH<br />
= = 0,03mol<br />
2<br />
22,4<br />
2 20,03<br />
Theo (1): n = n = = 0,02mol<br />
R<br />
H2<br />
3 3<br />
m 0,54<br />
aM )<br />
R<br />
= = = 27.Vây R là Al<br />
n 0,02<br />
b) n = 0,05 2 = 0,1( mol)<br />
HCl<br />
n = 2n = 2 0,03 = 0,06( mol)<br />
HCl<br />
(p/u) 2<br />
→ n = 0,1− 0,06 = 0,04( mol)<br />
HCl<br />
(du)<br />
H<br />
Dung dịch sau phản ứng gồm AlCl3 và HCl dư.<br />
0,02 0,04<br />
CM<br />
= = 0,4 M , C 0,8<br />
AlCl<br />
M<br />
= = M<br />
3<br />
HCl<br />
0,05 0,05<br />
2<br />
– Oxi hóa C, Mn, Si,<br />
P,…trong gang.<br />
0<br />
t<br />
FeO + C ⎯⎯→ Fe + CO<br />
3. Hướng dẫn <strong>học</strong> ở nhà:<br />
- Làm bài tập 1, 2, 3, 4, 5, 7 trang 69 SGK.<br />
- BT 1: Ngâm một thanh sắt trong 200 g dd CuSO4 đến khi sắt không tan được nữa, lấy<br />
thanh sắt ra cân lại thấy khối lượng thanh sắt tăng thêm 1,6 g. Tính khối lượng sắt hoàn<br />
tan, CM của dd CuSO4 đã dùng. Giả thuyết toàn bộ lượng Cu <strong>sinh</strong> ra bám hết vào thanh sắt<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
56<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 4 /12/ <strong>2017</strong><br />
Tiết 30<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Tính chất vật lý, hóa <strong>học</strong> của phi kim.<br />
- Các phi kim có mức độ hoạt động khác nhau.<br />
* Về kỹ <strong>năng</strong>:<br />
- Sử dụng các kiến thức đã biết để rút ra tính chất vật lý và tính chất hóa <strong>học</strong> của phi<br />
kim.<br />
- Viết được các phương trình phản ứng thể hiện tính chất hóa <strong>học</strong> của phi kim.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và các ứng dụng các kim loại nhôm và sắt trong<br />
đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
- Dụng cụ: ống nghiệm có nút, ống dẫn khí, ống vuốt nhọn.<br />
- <strong>Hóa</strong> chất: Zn, HCl, bình đựng khí Clo, qyù tím.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Tính chất vật lý của phi kim.<br />
Yêu cầu <strong>học</strong> <strong>sinh</strong> Nghiên cứu và trả lời:<br />
I. Tính chất vật lý:<br />
nghiên cứu SGK và → I.<br />
+ Phần lớn các nguyên tố<br />
cho biết tính chất vật Ở điều kiện thường, phi kim tồn tại ở phi kim không dẫn điện,<br />
lý của phi kim. cả 3 trạng thái:<br />
dẫn nhiệt và có nhệt độ<br />
• Rắn: C, S, P,…<br />
nóng chảy thấp.<br />
• Lỏng: Br2,…<br />
+ Một số phi kim độc: Cl2,<br />
• Khí: O2, N2, Cl2,…<br />
Br2, I2,…<br />
Hoạt động 1: Tính chất hóa <strong>học</strong> của phi kim.<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> thảo luận - Thảo luận và II. Tính chất hóa <strong>học</strong> :<br />
nhóm, viết tất cả phương<br />
trình hh đã biết trong đó có<br />
phi kim tham gia.<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> sắp xếp<br />
và phân loại các phản ứng đó<br />
thành 3 nhóm phản ứng thuộc<br />
3 tính chất hh phi kim.<br />
1. – Biễu diễn TN: Na cháy<br />
viết vào bảng<br />
nhóm.<br />
- Sắp xếp:<br />
- Quan sát và<br />
nhận xét hiện<br />
tượng và viết<br />
PTHH:<br />
1. Tác dụng với kim loại:<br />
o<br />
t<br />
a) oxi + kim loại ⎯⎯→ thường là oxit<br />
bazơ<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
t<br />
O2 + 2Cu ⎯⎯→ 2CuO<br />
b) Nhiều phi kim + kim loại<br />
o<br />
o<br />
t<br />
⎯⎯→ muối<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
57<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
o<br />
trong Clo.<br />
→ 1.<br />
t<br />
Cl2<br />
+ 2Na ⎯⎯→ 2NaCl<br />
2. – Biễu diễn thí nghiệm H2<br />
o<br />
t<br />
cháy trong Clo.<br />
→ 2. 3S + 2Al ⎯⎯→ Al2S3<br />
3. – Biễu diễn thí nghiệm S, P<br />
cháy trong oxi.<br />
→ 3. 2. Tác dụng với H2 tạo hợp chất khí<br />
o<br />
Yêu cầu <strong>học</strong> <strong>sinh</strong> nhận xét<br />
t<br />
a. oxi + hidro ⎯⎯→ nước<br />
o<br />
hiện tượng.<br />
t<br />
O2 + 2H2 ⎯⎯→ 2H2O<br />
Ngoài Cl2 còn nhiều phi kim:<br />
o<br />
t<br />
C, S, Br2,… tác dụng với b. Phi kim khác + hidro ⎯⎯→ hợp chất<br />
H2<br />
khí.<br />
khí<br />
o<br />
t<br />
4. Đưa ra một số phản ứng :<br />
Cl2+ H2 ⎯⎯→ 2HCl<br />
phi kim + hidro và phi kim + → 4.<br />
kim loại .<br />
3. Tác dụng với oxi<br />
o<br />
? Khả <strong>năng</strong> phản ứng của các<br />
t<br />
Nhiều phi kim + oxi ⎯⎯→ oxit axit<br />
phi kim trong các phản ứng?<br />
– Thông báo: Mức độ hoạt<br />
động của các phi kim là khác<br />
nhau.<br />
Lồng ghép giáo dục vai trò ;<br />
ứng dụng tài nguyên phi<br />
kim trong cuộc sống và môi<br />
4. Mức độ hoạt động của phi kim được<br />
xét căn cứ vào khả <strong>năng</strong> phản ứng của:<br />
trường .<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
S + O ⎯⎯→ SO<br />
o<br />
t<br />
2 2<br />
4P + 5O ⎯⎯→ 2P O<br />
t<br />
2 2 5<br />
C + O ⎯⎯→ CO<br />
o<br />
t<br />
2 2<br />
phi kim + hidro và phi kim + kim loại .<br />
3. Kiểm tra,đ<strong>án</strong>h giá: Viết sơ đồ biểu diễn chuyển đổi sau:<br />
Phi kim Oxit axit Oxit axit Axit Muối Sunfat tan Muối Sunfat không tan.<br />
Hoàn thành dãy chuyển hóa sau:<br />
→ HS<br />
2<br />
<br />
S → SO → SO → H SO → K SO → BaSO<br />
<br />
<br />
→ FeS<br />
2 3 2 4 2 4 4<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 1, 2, 3, 4, 6 trang 76 SGK, xem trước bài “Clo”.<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
o<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
58<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 6 /12/ <strong>2017</strong><br />
Tiết 31<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Tính chất vật lý và tính chất hóa <strong>học</strong> của Clo. Clo có một số tính chất hóa<br />
<strong>học</strong> của phi kim và Clo tác dụng với nước , có tính tẩy màu, tác dụng với dung dịch kiềm .<br />
* Về kĩ <strong>năng</strong>:<br />
+ Dự đo<strong>án</strong> tính chất hóa <strong>học</strong> Clo, kiểm tra dự đo<strong>án</strong> bằng kiến thức và thí nghiệm hóa<br />
<strong>học</strong>.<br />
+ Biết các thao tác tiến hành thí nghiệm: tính chất hóa <strong>học</strong> Clo, điều chế Clo trong<br />
phòng thí nghiệm . Biết quan sát hiện tượng, giải thích và rút ra kết luận.<br />
+ Viết phương trình hóa <strong>học</strong> minh họa cho tính chất hóa <strong>học</strong> của Clo.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và tác hại của khí clo trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
Dụng cụ; Bình thủy tinh có nút, đèn cồn, giá sắt, ống dẫn khí, đũa , cốc thủy tinh.<br />
<strong>Hóa</strong> chất: MnO2, dung dịch HCl đặc, bình khí Clo, dung dịch NaOH, H2O.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
<strong>Học</strong> <strong>sinh</strong> 1: Viết các phương trình hóa <strong>học</strong> của: S, C, Cu, Zn, với O2.<br />
<strong>Học</strong> <strong>sinh</strong> 2: Viết các phương trình hóa <strong>học</strong>:<br />
a. Khí flo và hydro. c. Bột sắt và lưu huỳnh.<br />
b. Lưu huỳnh và oxi. d. Khí hydro và lưu huỳnh.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Họat động 1: Tìm hiểu tính chất vật lý của clo.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> quan sát<br />
bình đựng khí Clo và cho biết:<br />
màu sắc, trạng thái, mùi?<br />
– So s<strong>án</strong>h khí clo với không<br />
– Quan sát và nhận xét:<br />
Clo là chất khí, màu<br />
vàng lục, mùi hắc.<br />
– Clo nặng hơn không<br />
I. Tính chất vật lý :<br />
– Clo là chất khí, màu vàng<br />
lục, mùi hắc.<br />
– Nặng hơn không khí 2,5<br />
khí?<br />
71<br />
khí d<br />
Cl /<br />
= = 2, 5<br />
lần.<br />
2 kk<br />
– Cung cấp thêm:<br />
29 – Tan được trong H2O.<br />
+ Clo tan được trong H2O, độc. → I.<br />
– Là khí độc.<br />
+ Chốt lại tính chất vật lý Clo.<br />
Hoạt động 2: Tính chất hóa <strong>học</strong> của Clo.<br />
? Dự đo<strong>án</strong> xem Clo có những tính<br />
chất hóa <strong>học</strong> nào?<br />
? Viết phương trình hh.<br />
1. – Biễu diễn thí nghiệm: đồng<br />
tác dụng với Clo.<br />
- Dự đo<strong>án</strong>: Clo có những<br />
tính chất của phi kim:<br />
→ 1.<br />
a. Tác dụng với kim loại.<br />
- Viết phương trình hh:<br />
II. Tính chất hóa <strong>học</strong> :<br />
1. Clo có những tính<br />
chất của phi kim:<br />
a. Tác dụng với kim<br />
loại.<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
59<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
- Ô nhiễm clo không chỉ ảnh<br />
Cl2 + Cu<br />
( vl)<br />
( đ )<br />
hưởng đến môi trường mà còn - Quan sát và nhận xét<br />
t<br />
⎯→CuCl2 ( khóitrang )<br />
ảnh hưởng trực tiếp đến sức hiện tượng: khói trắng<br />
khỏe con người.<br />
dạng bột.<br />
3 Cl2( k) + 2 Fe( r)<br />
o<br />
t<br />
- Đặt vấn đề: Ngoài tính chất hóa<br />
⎯⎯→ 2 FeCl3<br />
( r)<br />
<strong>học</strong> của phi kim Clo còn có tính<br />
b. Tác dụng với hiđro.<br />
chất hóa <strong>học</strong> nào khác?<br />
b. Tác dụng với Hydro. Cl2( k) + H2( k)<br />
- Làm thí nghiệm Clo + nước: Viết phương trình hh:<br />
+ Đổ nước vào bình đựng khí Clo,<br />
→ 2 HCl( k)<br />
đậy nút, lắc nhẹ. Dùng đũa thủy<br />
tinh chấm vào nước Clo rồi cho → 2.<br />
vào giấy quỳ tím Nhận xét. a. Quan sát thí nghiệm, 2. Clo còn có tính chất<br />
- Giải thích: phản ứng của Clo với nhận xét:<br />
hóa <strong>học</strong> khác:<br />
nước xảy ra <strong>theo</strong> hai chiều: + Dung dịch nước Clo a. Clo + nước:<br />
HCl làm quỳ tím hóa đỏ, sau đó có màu vàng lục, mùi<br />
mất màu do tính oxi hóa mạnh hắc.<br />
(tẩy màu của HClO).<br />
+ Nhúng giấy quỳ tím<br />
- Cho <strong>học</strong> <strong>sinh</strong> thảo luận nhóm: vào chuyển sang màu đỏ<br />
? Khi dẫn khí Clo vào nước xảy ra sau đó mất màu ngay.<br />
b. Clo + dd kiềm:<br />
hiện tượng vật lý hay hóa <strong>học</strong>? - Chú ý.<br />
- Làm thí nghiệm clo + dd - Thảo luận và trình bày:<br />
NaOH:<br />
Dẫn khí Clo vào nước<br />
+ Dẫn khí Clo vào cốc đựng dung xảy ra cả hiện tượng vật<br />
dịch NaOH.<br />
lý và hóa <strong>học</strong>.<br />
+ Nhỏ 1 – 2 giọt tạo thành vào<br />
giấy quỳ tím Quan sát hiện - Quan sát và nhận xét:<br />
tượng.<br />
Dung dịch tạo thành<br />
- Hướng dẫn <strong>học</strong> <strong>sinh</strong> viết phương không màu.<br />
trình HH.<br />
Giấy quỳ tím mất màu.<br />
- Nước Gia – ven có tính tẩy màu<br />
vì NaClO là chất oxi hóa mạnh<br />
tương tự HClO.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Cl<br />
+ H O<br />
2( k) 2 ( l)<br />
HCl<br />
+ HClO<br />
( dd ) ( dd )<br />
3. Hướng dẫn <strong>học</strong> ở nhà: 1 phút<br />
- Làm bài tập 3, 4, 5, 6, 11 trang 81 SGK.:<br />
- Xem tiếp bài “Clo”.<br />
- Bài tập : Cho clo + bột sắt thu được muối A. Cho 16,25 g muối A + AgNO3 dư thấy tạo<br />
ra 43,05 g kết tủa . Xác <strong>định</strong> công thức A.<br />
V. RÚT KINH NGHIỆM:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
60<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 09 /12/ <strong>2017</strong><br />
Tiết 32<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
- Củng cố , hệ thống hóa lại kiến thức về tính chất của các loại hợ chất vô vơ, kim loại. Để<br />
<strong>học</strong> <strong>sinh</strong> thấy được mối liên hệ giữa đơn chất và hợp chất vô cơ, kim lọai<br />
- Thiết lập sự chuyển đổi hóa <strong>học</strong> của các kim loại thành hợp chất vô cơ và ngược lại<br />
- Biết chọn chất cụ thể để làm ví dụ<br />
- Rút ra được mối quan hệ giữa các chất<br />
* Về kĩ <strong>năng</strong>: Viết phương trình hóa <strong>học</strong> minh họa cho tính chất hóa <strong>học</strong> của, hệ thống<br />
hóa kiến thức đã <strong>học</strong><br />
* Về thái độ: <strong>Học</strong> tập nghiêm túc<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>: Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao<br />
tiếp, hợp tác, sử dụng công nghệ thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>,<br />
tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
2. Bài mới:<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên: Bảng phụ, bảng nhóm, bút dạ.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Ôn lại kiến thức cơ bản từ tiết 37 đến hết tiết 58<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
TG Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1 ( / ) I. Kiến thức cần nhớ<br />
<strong>GV</strong>: Nêu mục tiêu của tiết ôn tập<br />
HS thảo luận nhóm: 6’<br />
1. Sự chuyển đổi kim loại thành các hợp chất<br />
vô cơ:<br />
1. Từ kim loại có thể chuyển hóa<br />
thành những loại hợp chất vô cơ<br />
nào?<br />
Muối<br />
Bazơ muối 1 muối 2<br />
2. Viết sơ đồ chuyển hóa?<br />
KL Oxit bazơ bazơ M1 M2<br />
3. Viết PTHH thực hiện sự chuyển<br />
Axit Muối 1 bazơ<br />
hóa đó?<br />
Muối 3 muối 2<br />
HS Thảo luận <strong>theo</strong> nhóm:<br />
Các nhóm báo cáo<br />
<strong>GV</strong>: Nhận xét bài của các nhóm.<br />
Kết luận thành sơ đồ.<br />
2. Sự chuyển đổi các loại hợp chất vô cơ<br />
thành kim loại:<br />
<strong>GV</strong>: Phát phiếu <strong>học</strong> tập số 2:<br />
Hãy điền vào ô trống sau:<br />
Lấy VD minh họa, Viết PTHH<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
KL<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
61<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 2 II. Bài tập<br />
<strong>GV</strong>: Hãy nêu CTPT, PTK của<br />
Cacbonđioxit?<br />
? Hãy nêu những tính chất vật<br />
lý của CO2<br />
1. Bài tập 3: Phân biệt Al, Ag, Fe<br />
- Lấy mỗi kim loại một ít làm mẩu thử<br />
- Cho các mẩu thử tác dụng với dd NaOH. Mẩu thử nào<br />
có bọt khí bay ra là Al<br />
Al+ NaOH + H2O –> NaAlO2 + H2 (k)<br />
<strong>GV</strong>: Làm thí nghiệm<br />
- Cho CO2 tác dụng với nước<br />
- Hai mẩu thử còn lại cho tác dụng với HCl . Chất thử<br />
nào tan ra và có khí thoát ra là Fe<br />
? Nêu hiện tượng quan sát Fe(r) + 2HCl (dd) –> FeCl2 (dd) + H2 (k)<br />
được?<br />
- Chất còn lại là Ag<br />
? Kết luận và viết PTHH?<br />
2. Bài tập 5:<br />
<strong>GV</strong>: Đây là phản ứng thuận<br />
- Dùng AgNO3 dư cho vào hỗn hợp. Đồng và nhôm<br />
nghịch<br />
hoạt động hóa <strong>học</strong> mạnh hơn nên đẩy bạc ra khỏi dd<br />
AgNO3 . Thu được bạc . Lọc dd thu được bạc nguyên<br />
? Hãy lấy VD viết PTHH?<br />
chất.<br />
3. Bài tập 3:<br />
a.<br />
Zn(r) + 2HCl(dd) –> ZnCl2 (dd) + H2 (k)(1)<br />
? Hãy nêu những ứng dụng<br />
của CO2 mà em biết?<br />
ZnO(r) + 2HCl(dd)<br />
nH2 = 0,448 : 22,4 = 0,02mol<br />
Theo ( 1) :<br />
nZn = nH2 = 0,02mol<br />
mZn = 0,02 . 65 = 1,3g<br />
m ZnO = 4,54 – 1,3 = 3,24 g<br />
–> ZnCl2 (dd) + H2O(l)(2)<br />
1,3<br />
% Zn = – . 100% = 28,6%<br />
4,54<br />
3,24<br />
% ZnO = – . 100% = 71,4%<br />
4,54<br />
3. Hướng dẫn <strong>học</strong> ở nhà : Ôn tập , <strong>học</strong> kỹ để chuẩn bị kiểm tra cuối <strong>học</strong> <strong>kì</strong><br />
Bài tập về nhà: Bài : 1, 2, 3, 4, 5 SGK<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
62<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>:12 /12/ <strong>2017</strong><br />
Tiết 33<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
– Một số ứng dụng của Clo.<br />
– Phương pháp: điều chế khí Clo trong phòng thí nghiệm: dụng cụ, hóa chất, thao tác<br />
thí nghiệm, cách thu khí, … Điều chế khí Clo trong công nghiệp: điện phân dung dịch<br />
NaCl bão hòa có màng ngăn.<br />
* Về kĩ <strong>năng</strong>:<br />
– Quan sát sơ đồ rút ra kiến thức về tính chất, ứng dụng và điều chế Clo.<br />
* Về thái độ<br />
- <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và tác hại của khí clo trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong><br />
Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao tiếp, hợp tác, sử dụng công nghệ<br />
thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>, tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Hoạt động nhóm; quan sát<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
– Tranh vẽ H 3.4: Sơ đồ về một số ứng dụng của Clo.<br />
– Bình điện phân.<br />
+ Dụng cụ: giá sắt, đèn cồn, bình cầu có nh<strong>án</strong>h, ống dẫn khí, bình thủy tinh có nút,<br />
cốc thủy tinh đựng dung dịch NaOH đặc.<br />
+ <strong>Hóa</strong> chất: MnO2 hoặc KMnO4, dd HCl đặc, dd H2SO4, dd NaOH đặc.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>:<br />
Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
<strong>Học</strong> <strong>sinh</strong> 1: Tính chất hóa <strong>học</strong> của Clo. Viết phương trình phản ứng minh họa.<br />
<strong>Học</strong> <strong>sinh</strong> 2: Có 3 khí đựng riêng biệt trong 3 lọ: H2, HCl, Cl2. Hãy nêu phương pháp phân<br />
biệt các khí trong lọ.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Ứng dụng của Clo.<br />
– Yêu cầu <strong>học</strong> – Quan sát III. Ứng dụng của Clo<br />
<strong>sinh</strong> quan sát H và trả lời: + Dùng để khử trùng nước <strong>sinh</strong> họat.<br />
3.4 và nêu ứng → III + Tẩy trắng vải sợi, bột giấy.<br />
dụng của Clo.<br />
+ Điều chế nước Gia – ven Clorua vôi.<br />
Hoạt động 2: Điều chế Clo.<br />
HDHS:<br />
Cách điều chế clo trong PTN: (<br />
H.3.5)<br />
- Yêu cầu <strong>học</strong> <strong>sinh</strong> viết pthh:<br />
+ Điều chế nhựa PVC, chất dẻo, chất màu, cao su,…<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
- Viết<br />
PTHH:<br />
IV. Điều chế Clo.<br />
1. Điều chế clo trong PTN:<br />
Đun nóng nhẹ dd HCl với chất oxi hóa<br />
mạnh như MnO2 (KMnO4)<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
63<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
dunnhe<br />
+ Yêu <strong>học</strong> <strong>sinh</strong> đọc sgk<br />
4HCl( d )<br />
+ MnO2( r)<br />
den<br />
⎯⎯⎯→<br />
? Điều chế clo trong công nghiệp Không. Vì<br />
MnCl2 + Cl2( k ) vangluc<br />
+ 2H2O<br />
bằng phương pháp nào?<br />
clo + nước<br />
? Có thể thu khí clo bằng đẩy<br />
nước được không? giải thích?<br />
2. Điều chế clo trong công nghiệp :<br />
? Có thể thu khí clo bằng đẩy Được. Điện phân dd NaCl bão hòa có màng<br />
không khí được không? giải thích? Giải thích: ngăn xốp<br />
dpcmn<br />
Lồng ghép giáo dục tầm quan<br />
2NaCl( dd )<br />
+ 2H2O<br />
⎯⎯⎯→<br />
trọng và tính độc hại của clo.<br />
2NaOH + Cl2( k ) vangluc<br />
+ H2<br />
Sử dụng lượng dư clo trong thức<br />
ăn nước uống làm tăng nguy cơ<br />
bị ngộ độc.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Hoạt động 3: Luyện tập, củng cố.<br />
– Bài tập 1: Viết các phương trình<br />
hh phản ứng khi cho Clo tác dụng<br />
với:<br />
a. Nhôm. b. Đồng. c. Hydro.<br />
d. Nước. e. Dung dịch NaOH.<br />
– Gọi <strong>học</strong> <strong>sinh</strong> lên bảng , lớp nhận<br />
xét.<br />
– Đ<strong>án</strong>h giá, cho điểm.<br />
a).2<br />
Al + 3Cl<br />
b).<br />
Cu + Cl<br />
c).<br />
H<br />
2<br />
d).<br />
Cl<br />
e).<br />
Cl<br />
2<br />
2<br />
2<br />
+ Cl<br />
2<br />
t<br />
⎯⎯→ 2AlCl<br />
t<br />
⎯⎯→ CuCl<br />
t<br />
⎯⎯→ 2HCl<br />
+ H O → HCl + HClO<br />
2<br />
2<br />
0<br />
0<br />
0<br />
+ 2NaOH<br />
→ NaCl + NaClO + H<br />
3. Hướng dẫn <strong>học</strong> ở nhà:<br />
Làm bài tập 1, 2, 7, 8, 9, 10 trang 81 SGK<br />
Bài tập : a/ Cho MnO2 dư tác dụng với 400 ml dd HCl 3M thu được V lít khí clo (đktc).<br />
Tính V nếu PƯ xảy ra hoàn toàn, không có hao hụt.<br />
b/ Cho toàn bộ lượng clo <strong>sinh</strong> ra hấp thụ vào 400 ml dung dịch NaOH 2M thu<br />
được 400ml dd X. Tính nồng độ các chất trong X.<br />
Chú ý ôn tập lại những kiến thức cơ bản đã được <strong>học</strong> để kiểm tra <strong>học</strong> <strong>kì</strong> 1<br />
V. RÚT KINH NGHIỆM:<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
2<br />
3<br />
2<br />
O<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
64<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 15 /12/ <strong>2017</strong><br />
Tiết 34<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
1/ Kiến thức<br />
- Tính chất hóa <strong>học</strong> của các loại hợp chất vô cơ.<br />
- Tính chất hóa <strong>học</strong> của kim loại.<br />
2/ Kĩ <strong>năng</strong> :<br />
- Dựa vào các kiến thức đã <strong>học</strong> ở chương I,II,III để viết phương trình hóa <strong>học</strong>.<br />
- Kĩ <strong>năng</strong> làm các bài tập nhận biết, phân biệt, tách riêng các chất.<br />
- Tính to<strong>án</strong> <strong>theo</strong> phương trình hóa <strong>học</strong>.<br />
- Giải thích một số hiện tượng có liên quan đến nội dung đã <strong>học</strong>.<br />
3/ Thái độ : Nghiêm túc, trung thực, cẩn thận, chính xác, tư duy.<br />
II. PHƯƠNG PHÁP: Kiểm tra viết tự luận<br />
III. ĐỀ KIỂM TRA – ĐÁP ÁN: Đề Sở<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
65<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 18/12/ <strong>2017</strong><br />
Tiết 35<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức:<br />
+ Cacbon có 3 dạng thù hình chính, dạng hoạt động hóa <strong>học</strong> nhất là Cacbon vô <strong>định</strong><br />
hình.<br />
+ Sơ lược tính chất vật lý của 3 dạng thù hình.<br />
+ Tính chất hóa <strong>học</strong> của Cacbon: Có một số tính chất hóa <strong>học</strong> của phi kim , đặc biệt là<br />
tính khử ở nhiệt độ cao. Một số ứng dụng.<br />
* Về kỹ <strong>năng</strong>:<br />
+ Dự đo<strong>án</strong> tính chất hóa <strong>học</strong> của C từ tính chất của phi kim.<br />
+ Biết nghiên cứu thí nghiệm để rút ra tính hấp thụ của than gỗ.<br />
+ Biết nghiên cứu thí nghiệm để rút ra tính chất đặc biệt của C.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và ứng dụng của cacbon trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong><br />
Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao tiếp, hợp tác, sử dụng công nghệ<br />
thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>, tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát, đàm thoại.<br />
III. CHUẨN BỊ:<br />
1. Chuẩn bị của giáo viên:<br />
– Mẫu vật: than chì (ruột bút chì), Cacbon vô <strong>định</strong> hình (than gỗ).<br />
– Dụng cụ: giá sắt, ống nghiệm, bộ ống dẫn khí, lọ khí CO2, đèn cồn, cốc thủy tinh,<br />
phễu thủy tinh, muối sắt, giấy lọc, bông.<br />
– <strong>Hóa</strong> chất: than gỗ, bình O2, H2O, CuO, dung dịch Ca(OH)2.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ: Cách điều chế clo trong phòng thí nghiệm. Viết phương trình phản<br />
ứng hóa <strong>học</strong>.<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Các dạng thù hình của Cacbon.<br />
– Giới thiệu về dạng thù – Chú ý và biết: Cacbon có 3 I. Các dạng thù hình của<br />
hình.<br />
dạng thù hình.<br />
Cacbon:<br />
– Giới thiệu dạng thù hình + Kim cương: cứng, trong Cacbon có 3 dạng thù<br />
của Cacbon.<br />
suốt, không dẫn điện. hình.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> cho biết + Than chì: mềm dẫn điện. + Kim cương:<br />
tính chất vật lý của từng + Cacbon vô <strong>định</strong> hình: xốp + Than chì<br />
dạng thù hình.<br />
không dẫn điện.<br />
+ Cacbon vô <strong>định</strong> hình:<br />
Hoạt động 2: Tính chất của Cacbon.<br />
– HDHSTN: Cho mực chảy qua lớp<br />
bột gỗ. Phía dưới có đặt chiếc cốc thủy<br />
tinh.<br />
– Qua thí nghiệm trên em có nhận xét<br />
về tính chất của bột than gỗ.<br />
– Giới thiệu: Bằng nhiều thí nghiệm<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
– Quan sát và nêu<br />
hiện tượng:<br />
Ban đầu mực có<br />
màu tím.<br />
Dung dịch thu được<br />
trong cốc không màu.<br />
II Tính chất của<br />
Cacbon<br />
a. Tính hấp phụ:<br />
khả <strong>năng</strong> giữ trên bề<br />
mặt của nó các chất khí,<br />
chất tan trong dung<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
66<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
khác nhau, người ta nhận thấy than gỗ a. Nhận xét: Than gỗ dịch.<br />
có khả <strong>năng</strong> giữ trên bề mặt của nó các có tính hấp thụ màu<br />
chất khí, chất tan trong dd.<br />
trong dung dịch. b. Tính chất hóa <strong>học</strong><br />
– Giới thiệu than hoạt tính và ứng dụng<br />
+Tác dụng với oxi<br />
0<br />
của nó.<br />
b. Hiện tượng:<br />
t<br />
C + O2<br />
⎯⎯→ CO2<br />
– Thông báo: C có tính chất hóa <strong>học</strong> Tàn đóm bùng cháy. +Tác dụng với oxit<br />
của phi kim: tác dụng với kim loại, + Hiện tượng: kim loại<br />
0<br />
hidro, … Tuy nhiên điều kiện xảy ra Hổn hợp chuyển từ<br />
t<br />
2 CuO( r) + C( r)<br />
⎯⎯→<br />
phản ứng rất khó khăn.<br />
màu đen sang màu<br />
(đen) (đen)<br />
? Các em quan sát thí nghiệm nêu hiện đỏ. Nước vôi trong<br />
tượng? Viết phương trình hóa <strong>học</strong>. vẫn đục.<br />
Cu( r) + CO2<br />
( k)<br />
– HDHSTN: than cháy trong oxi – Trả lời:<br />
(đo) (không màu)<br />
+ Đưa mẫu than còn tàn đỏ vào bình + Vì sản phẩm có<br />
O2.<br />
CO2<br />
+Tác dụng với kim<br />
– HDHSTN: than + đồng(II)oxit + Chất rắn tạo thành loại, hiđro,…<br />
+ Trộn một ít bột CuO + C cho vào màu đỏ là Cu.<br />
ống nghiệm có ống dẫn khí sang cốc<br />
III. Ứng dụng:<br />
chứa dd Ca(OH)2. Đốt nóng ống – Viết pthh: - Than chì: làm điện<br />
nghiệm.<br />
cực, chất bôi trơn, ruột<br />
? Vì sao nước vôi trong vẫn đục.<br />
bút chì,…<br />
+ Chất rắn <strong>sinh</strong> ra có màu đỏ là chất<br />
- Kim cương : đồ trang<br />
nào?<br />
sức, mũi khoan, …<br />
– Giới thiệu: Ở t o – Đọc SGK.<br />
cao C còn khử được<br />
- C vô <strong>định</strong> hình:<br />
một số oxit kim loại: PbO, ZnO, Fe2O3,<br />
* Than hoạt tính: mặt nạ<br />
… (trừ oxit kim loại mạnh từ đầu đến<br />
phòng độc, …<br />
Al).<br />
* Than đá, gỗ: nhiên<br />
– Bài tập: Viết PTHH khi cho C + (t o<br />
liệu, chất khử.<br />
cao) với: oxit sắt từ, chì(II)oxit,<br />
sắt(III)oxit.<br />
III– Yêu cầu <strong>học</strong> <strong>sinh</strong> đọc SGK<br />
Lồng ghép giáo dục vai trò ; ứng<br />
dụng tài nguyên cacbon trong cuộc<br />
sống<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
4C<br />
+ Fe O<br />
3<br />
3C<br />
+ Fe O<br />
2<br />
4<br />
3<br />
→ 3Fe+<br />
4CO<br />
→ Fe+<br />
3CO<br />
C + 2PbO<br />
→ 2Pb+<br />
CO<br />
3. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 2, 3, 4, 5 trang 84 SGK.<br />
Bài 1: Tính lượng than cốc cần dùng để điều chế 1 m 3 khí than CO trong CN ở đktc. Biết<br />
o<br />
o<br />
t<br />
t<br />
than cốc đã tham gia phản ứng sau: C + O2 ⎯⎯→ CO2 C + CO2 ⎯⎯→ 2 CO<br />
Cho hiệu suất quá trình điều chế đt 89%<br />
Bài 2: Tính nhiệt lượng tỏa ra khi đốt 10 kg than chứa 96% C( tạp chất trơ), biết 1 mol C<br />
cháy giải phóng 394 kJ.<br />
Xem trước bài “ Các oxit của Cacbon”.<br />
V. RÚT KINH NGHIỆM:<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
2<br />
2<br />
2<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
67<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
Ngày <strong>soạn</strong>: 21 /12/ <strong>2017</strong><br />
Tiết 36<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
I. MỤC TIÊU BÀI HỌC:<br />
* Về kiến thức: Tính chất vật lý, tính chất hóa <strong>học</strong> và ứng dụng của CO …<br />
* Về kỹ <strong>năng</strong>: Viết phương trình hóa <strong>học</strong>.<br />
* Về thái độ: <strong>Học</strong> <strong>sinh</strong> thấy được vai trò và tác hại của khí clo trong đời sống.<br />
* Định <strong>hướng</strong> <strong>phát</strong> <strong>triển</strong> <strong>năng</strong> <strong>lực</strong>:<br />
Tự <strong>học</strong>, giải quyết vấn đề, s<strong>án</strong>g tạo, tự quản lí, giao tiếp, hợp tác, sử dụng công nghệ<br />
thông tin và truyền thông, sử dụng ngôn ngữ hóa <strong>học</strong>, tính to<strong>án</strong> bài tập <strong>định</strong> lượng.<br />
II. PHƯƠNG PHÁP: Quan sát, đàm thoại.<br />
III. CHUẨN BỊ:<br />
. Chuẩn bị của giáo viên:<br />
– Dụng cụ: Giá sắt, ống nghiệm có ống dẫn khí, đèn cồn.<br />
– <strong>Hóa</strong> chất: CaCO3, quỳ tím, CuO, dung dịch Ca(OH)2.<br />
2. Chuẩn bị của <strong>học</strong> <strong>sinh</strong>: Xem bài trước.<br />
IV. TIẾN TRÌNH DẠY – HỌC:<br />
1. Kiểm tra bài cũ:<br />
Viết pthh C với: CuO, PbO, Fe3O4.<br />
Hãy cho biết vai trò của C trong phản ứng ?<br />
2. Bài mới:<br />
Hoạt động của giáo viên Hoạt động của <strong>học</strong> <strong>sinh</strong> Nội dung<br />
Hoạt động 1: Cacbon oxit.<br />
? CTPT, PTK của Cacbon<br />
oxit.<br />
– Yêu cầu <strong>học</strong> <strong>sinh</strong> nghiên<br />
cứu SGK tính chất vật lý của<br />
CO.<br />
– CO là một khí rất độc. Hít<br />
phải CO thì CO kết hợp với<br />
Hb trong máu ngăn không<br />
cho máu nhận và cung cấp<br />
O2 cho tế bào gây tử<br />
vong.<br />
– Thông báo CO là chất khí.<br />
– Trả lời:<br />
+ CTPT:<br />
CO.<br />
+ PTK: 28<br />
– Nghiên<br />
cứu và cho<br />
biết tính<br />
chất vật lý<br />
của CO.<br />
I. Cacbon oxit:<br />
1. Tính chất vật lý<br />
CO là một khí không màu, không mùi, rất<br />
độc , nhẹ hơn không khí.<br />
2. Tính chất hóa <strong>học</strong> :<br />
a. CO là oxit trung tính: không tác dụng<br />
với nước, với axit, với kiềm.<br />
b. CO là chất khử<br />
o<br />
Tính chất hóa <strong>học</strong>: là oxit<br />
t<br />
4CO + Fe3O4 ⎯⎯→ 3Fe + 4CO2<br />
trung tính không tác dụng với<br />
o<br />
t<br />
3CO + Fe2O3 ⎯⎯→ 2Fe + 3CO2<br />
nước, với axit, với kiềm.<br />
o<br />
t<br />
CO là chất có tính khử mạnh,<br />
CO + CuO ⎯⎯→ Cu + CO2<br />
khử được 1 số oxit kim loại<br />
** CO là chất đốt trong công nghiệp<br />
o<br />
trung bình và là chất cháy<br />
t<br />
CO + O2 ⎯⎯→ CO2+<br />
Q<br />
được tỏa nhiều nhiệt.<br />
- Trong cuộc sống, ta có thể<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
68<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM
https://twitter.com/daykemquynhon<br />
https://www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
https://daykemquynhon.blogspot.com/<br />
<strong>Giáo</strong> <strong>án</strong> <strong>Hóa</strong> 9 <strong>năm</strong> <strong>học</strong> <strong>2017</strong> - <strong>2018</strong> <strong>GV</strong>: <strong>Nguyễn</strong> <strong>Thị</strong> <strong>Hoa</strong> – <strong>Đà</strong> <strong>Nẵng</strong><br />
hạn chế việc CO được <strong>sinh</strong><br />
ra do sự cháy không hoàn<br />
3. Ứng dụng:<br />
toàn của C (than, củi)<br />
- Nhiên liệu, chất khử, …<br />
o<br />
t<br />
2C<br />
+ O2<br />
⎯⎯→ 2CO<br />
+ Q<br />
- Nguyên liệu trong công nghiệp hóa <strong>học</strong>.<br />
Lồng ghép giáo dục vai trò ;<br />
ứng dụng, tác hại của CO<br />
trong cuộc sống sản xuất.<br />
Hoạt động 2: Bài tập<br />
1. Cho 10 lít hỗn hợp CO, CO2 (đktc) qua dd nước vôi dư thấy xuất hiện 20 gam kết tủa.<br />
Tính % về thể tích mỗi khí trong hỗn hợp ban đầu.<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - <strong>Hóa</strong> cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn <strong>Đà</strong>n To<strong>án</strong> - Lý - <strong>Hóa</strong> 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
3. Củng cố: Nhắc lại nội dung chính của bài.<br />
4. Hướng dẫn <strong>học</strong> ở nhà: Làm bài tập 1, 2, 3, 4, 5 trang 87 SGK.<br />
V. RÚT KINH NGHIỆM:<br />
..............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
...............................................................................................................................................................................................................................................................<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi <strong>GV</strong>. <strong>Nguyễn</strong> Thanh Tú<br />
69<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial