GA Hóa học lớp 10 theo chuẩn kiến thức kĩ năng mới cả năm đầy đủ 3 cột GV soạn Phan Dư Tú Trường THPT Phong Điền
https://app.box.com/s/s1ze87es2zyf9rpr9amo7xdnkunju8bv
https://app.box.com/s/s1ze87es2zyf9rpr9amo7xdnkunju8bv
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
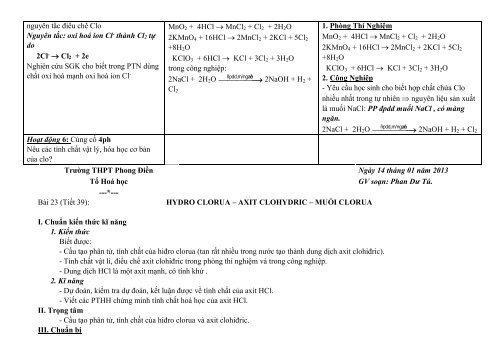
nguyên tắc điều chế Clo<br />
Nguyên tắc: oxi hoá ion Cl - thành Cl2 tự<br />
do<br />
2Cl - → Cl2 + 2e<br />
Nghiên cứu SGK cho biết trong PTN dùng<br />
chất oxi hoá mạnh oxi hoá ion Cl -<br />
Hoạt động 6: Củng cố 4ph<br />
Nêu các tính chất vật lý, hóa <strong>học</strong> cơ bản<br />
của clo?<br />
<strong>Trường</strong> <strong>THPT</strong> <strong>Phong</strong> <strong>Điền</strong><br />
Tổ Hoá <strong>học</strong><br />
---*---<br />
Bài 23 (Tiết 39):<br />
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O<br />
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2<br />
+8H 2 O<br />
KClO 3 + 6HCl → KCl + 3Cl 2 + 3H 2 O<br />
trong công nghiệp:<br />
ñpdd,m/ngaên<br />
2NaCl + 2H 2 O<br />
Cl 2<br />
⎯⎯⎯⎯⎯→ 2NaOH + H 2 +<br />
1. Phòng Thí Nghiệm<br />
MnO 2 + 4HCl → MnCl 2 + Cl 2 + 2H 2 O<br />
2KMnO 4 + 16HCl → 2MnCl 2 + 2KCl + 5Cl 2<br />
+8H 2 O<br />
KClO 3 + 6HCl → KCl + 3Cl 2 + 3H 2 O<br />
2. Công Nghiệp<br />
- Yêu cầu <strong>học</strong> sinh cho biết hợp chất chứa Clo<br />
nhiều nhất trong tự nhiên nguyên liệu sản xuất<br />
là muối NaCl: PP đpdd muối NaCl , có màng<br />
ngăn.<br />
2NaCl + 2H 2 O<br />
HYDRO CLORUA – AXIT CLOHYDRIC – MUỐI CLORUA<br />
ñpdd,m/ngaên<br />
⎯⎯⎯⎯⎯→ 2NaOH + H 2 + Cl 2<br />
Ngày 14 tháng 01 <strong>năm</strong> 2013<br />
<strong>GV</strong> <strong>soạn</strong>: <strong>Phan</strong> <strong>Dư</strong> <strong>Tú</strong>.<br />
I. Chuẩn <strong>kiến</strong> <strong>thức</strong> <strong>kĩ</strong> <strong>năng</strong><br />
1. Kiến <strong>thức</strong><br />
Biết được:<br />
- Cấu tạo phân tử, tính chất của hiđro clorua (tan rất nhiều trong nước tạo thành dung dịch axit clohiđric).<br />
- Tính chất vật lí, điều chế axit clohiđric trong phòng thí nghiệm và trong công nghiệp.<br />
- Dung dịch HCl là một axit mạnh, có tính khử .<br />
2. Kĩ <strong>năng</strong><br />
- Dự đoán, kiểm tra dự đoán, kết luận được về tính chất của axit HCl.<br />
- Viết các PTHH chứng minh tính chất hoá <strong>học</strong> của axit HCl.<br />
II. Trọng tâm<br />
- Cấu tạo phân tử, tính chất của hiđro clorua và axit clohiđric.<br />
III. Chuẩn bị