énoncé - Chimie - PCSI
énoncé - Chimie - PCSI
énoncé - Chimie - PCSI
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
« Cadmos luttant contre le dragon » (amphore visible au musée du Louvre ; 560-550 avant notre ère).<br />
Cadmos, frère d’Europe enlevée par Zeus, chercha en vain sa sœur. Il fonda la Cadmée, ancienne citadelle de<br />
l’actuelle ville de Thèbes. Mais il dut pour cela tuer un dragon qui gardait la source d’eau voisine. Le minerai<br />
« cadmia » était extrait dans cette région.<br />
Problème<br />
Quelques aspects de la chimie du cadmium<br />
Les différentes parties sont presque totalement indépendantes. L’utilisation de la<br />
calculatrice est autorisée<br />
Le cadmium est un métal blanc argenté, découvert en 1817 par Friedrich Stromeyer. Il constata que<br />
certains échantillons de carbonate de zinc , dissous dans un acide, donnaient un précipité<br />
jaune avec de l’hydrogène sulfuré ; il isola le métal de ce sulfure et lui donna le nom de cadmium (du<br />
latin « cadmia », la calamine, minerai de carbonate de zinc).<br />
Le cadmium et ses ions<br />
DEVOIR<br />
SURVEILLE<br />
9<br />
1) Rappeler quatre propriétés (physiques ou chimiques) communes à l’ensemble des<br />
métaux.<br />
2) Déterminer la structure électronique de l’atome de cadmium dans son état fondamental<br />
(numéro atomique Z = 48). Souligner les électrons de valence du cadmium.<br />
3) Déduire de la configuration électronique du cadmium sa position dans la classification<br />
périodique.<br />
JM Urbain – Janson de Sailly
En solution aqueuse, il existe deux ions du cadmium, et .<br />
On souhaite tracer le diagramme de prédominance (existence) des différentes espèces du<br />
cadmium dans l’eau à l’aide des données suivantes :<br />
E°( / ) = ; E°( / ) =<br />
Les conventions choisies pour le tracé et les frontières sont les suivantes :<br />
Concentration totale en atomes de cadmium en solution :<br />
Frontière entre deux espèces en solution : égalité du nombre d’atomes de cadmium (même<br />
nombre d’atomes de cadmium sous chaque forme).<br />
Frontière entre une espèce en solution et un solide : à la frontière la concentration limite en<br />
atomes dissous en solution est égale à .<br />
4) Tracer le diagramme de prédominance/existence du couple et calculer la<br />
valeur de la frontière entre les deux domaines (on néglige la concentration de ).<br />
Présenter les calculs soigneusement.<br />
5) Tracer le diagramme de prédominance du couple , en absence de , et<br />
calculer la valeur de la frontière entre les deux domaines. Présenter les calculs<br />
soigneusement.<br />
6) Réunir les deux précédents diagrammes sur un unique diagramme et conclure.<br />
7) A l’aide des données, calculer E°( / ) (expression littérale puis application<br />
numérique). On pourra par exemple considérer une solution à l’équilibre contenant les trois<br />
formes du cadmium.<br />
Accumulateur nickel-cadmium<br />
On trouve du cadmium dans les accumulateurs (piles rechargeables) NiCd inventés en 1899<br />
par le suédois Waldmar Jungner. Dans ces accumulateurs, le milieu est fortement alcalin<br />
(l’accumulateur contient de la potasse ). Or, en présence d’ions hydroxydes, les ions<br />
cadmium précipitent en hydroxyde de cadmium .<br />
On donne ( .<br />
8) Tracer le diagramme d’existence de ce précipité dans une solution d’ions cadmium<br />
de concentration égale à .<br />
L’accumulateur nickel-cadmium peut être modélisée ainsi (la polarité est indiquée) :<br />
/ / / / /<br />
9) Quels sont les nombre d’oxydation du nickel dans les deux<br />
composés présents dans l’accumulateur ?<br />
10) Lors de la décharge, écrire les équations des réactions aux électrodes (on rappelle que le<br />
milieu est très basique) ? Préciser l’anode et la cathode.<br />
11) Montrer que la fem notée e est indépendante de la concentration en ions hydroxyde.<br />
JM Urbain – Janson de Sailly
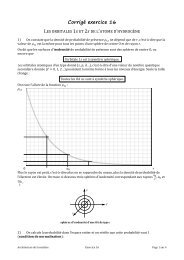
Titrage d’un mélange suivi par pH-métrie<br />
L’hydroxyde de cadmium utilisé dans les accumulateurs NiCd (partie précédente) peut être préparé<br />
très simplement en traitant du nitrate de cadmium par de l’hydroxyde de sodium.<br />
Dans cette partie, on titre 10,0 mL d’une solution aqueuse (S), mélange d’acide sulfurique<br />
(concentration ) et d’ions cadmium (concentration ), par une solution de<br />
soude de concentration C = 0,10 .<br />
Au cours du titrage il se forme un solide blanc dans le bécher.<br />
On obtient la courbe expérimentale suivante :<br />
L’acide sulfurique est un diacide : dans ce problème on considère que les deux acidités de<br />
l’acide sulfurique sont fortes.<br />
12) On rappelle que le soufre est dans la famille de l’oxygène. Proposer un schéma de Lewis<br />
pour la molécule d’acide sulfurique.<br />
13) Rappeler les électrodes utilisées pour effectuer un titrage pH-métrique.<br />
14) On rappelle que l’électrode de référence utilisée contient le couple rédox .<br />
Proposer un schéma soigné et légendé de cette électrode. Quelle est l’expression de son<br />
potentiel ? Comment s’assurer que son potentiel soit fixe ?<br />
15) A partir de la courbe expérimentale, déterminer les concentrations et dans la<br />
solution (S). Votre réponse doit être clairement justifiée (équations des réactions de<br />
titrage, ordre…).<br />
JM Urbain – Janson de Sailly
Complexe cyanuré du cadmium<br />
L’ion cyanure donne avec les ions cadmium un complexe stable de formule<br />
. On cherche à déterminer expérimentalement la constante de formation K de ce<br />
complexe et l’indice de coordination n.<br />
On réalise pour cela une pile formée de deux compartiments reliés par un pont salin (le<br />
voltmètre qui relie les deux électrodes n’est pas représenté ci-dessous) :<br />
L’expérience est effectuée à 298 K. Dans le compartiment (2), on verse des volumes<br />
d’une solution de cyanure de potassium de concentration .<br />
On mesure la force électromotrice e = ( est le potentiel dans le compartiment i) de la<br />
pile formée pour différents volumes versés de la solution de cyanure.<br />
V(CN – ) (mL) 2,0 4,0 6,0 8,0 12,0 16,0 20,0<br />
e(mV) 327 363 384 399 420 435 447<br />
On pourra négliger l’effet de dilution dû à l’addition de la solution de cyanure et, la<br />
concentration des ions dans cette solution étant très élevée, on pourra considérer que<br />
pour toutes les valeurs de indiquées, est en large excès, après formation du<br />
complexe, dans le compartiment (2).<br />
16) Donner le schéma de Lewis de l’ion cyanure . Quelle est la particularité de ce<br />
ligand ?<br />
17) Déterminer l’expression de x en fonction de n dans .<br />
18) Habituellement le nombre maximal de ligands autour d’un ion central est de 6.<br />
Comment justifier qu’il est difficile d’en avoir plus ?<br />
19) Quelle serait la valeur de e avant ajout de la solution de cyanure de sodium ?<br />
20) Montrer effectivement que dès le 1 er ajout (2,0 mL), les ions cyanure sont en très large<br />
excès dans le compartiment 2.<br />
21) Justifier qualitativement le signe de la fem e mesurée (quel que soit le volume versé).<br />
22) Ecrire la relation existant entre e, K, n et , concentration à l’équilibre en ions<br />
dans le compartiment (2).<br />
23) Montrer qu’il est possible, à l’aide des résultats expérimentaux, de déterminer<br />
graphiquement K et n.<br />
24) En déduire la valeur de n ainsi qu’une valeur approchée de K.<br />
JM Urbain – Janson de Sailly
Cadmium en chimie organique<br />
Les organocadmiens R-Cd-X et R-Cd-R sont comparables aux organomagnésiens. Les<br />
premiers organocadmiens ont été préparés en 1917 par Erich Krause. Ils peuvent être<br />
préparés par réaction d’un organomagnésien avec du chlorure de cadmium (II)<br />
(réaction de « transmétallation »).<br />
Ils sont actuellement très peu employés en raison de la forte toxicité du cadmium mais en<br />
1952, un organocadmien a été utilisé dans une synthèse totale du cholestérol (proposée par<br />
Woodward et coll.).<br />
25) Les organocadmiens sont réputés bien moins nucléophiles que les organomagnésiens.<br />
Quel argument peut-on proposer pour justifier cette moindre réactivité ?<br />
Dans la synthèse de Woodward, la réaction ci-dessous avec un équivalent d’organocadmien<br />
créé in situ conduit « très proprement » (très bon rendement de 92 % et pas de réaction<br />
parasite) au produit désiré, alors qu’avec un équivalent d’un simple organomagnésien, il<br />
aurait été difficile de s’arrêter au produit voulu et on aurait eu un mélange.<br />
26) Représenter le produit obtenu ici et représenter le produit parasite que l’on obtient en<br />
quantité non négligeable si l’on utilise un organomagnésien. Expliquer un minimum. Il<br />
n’est pas obligatoire de préciser les mécanismes.<br />
Fin de l’<strong>énoncé</strong><br />
JM Urbain – Janson de Sailly