Résumé des réactions du livre
Résumé des réactions du livre
Résumé des réactions du livre
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
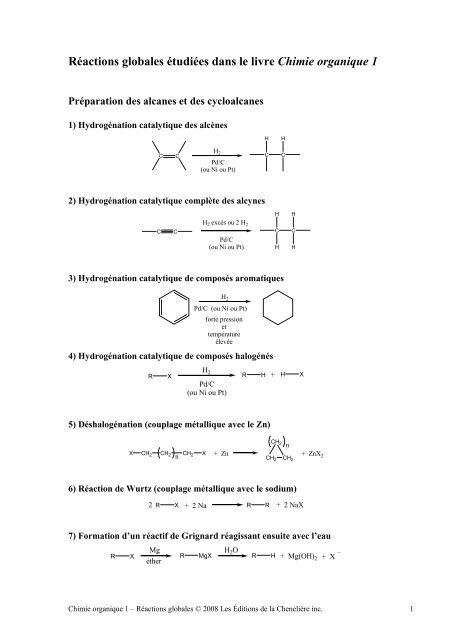
Réactions globales étudiées dans le <strong>livre</strong> Chimie organique 1<br />
Préparation <strong>des</strong> alcanes et <strong>des</strong> cycloalcanes<br />
1) Hydrogénation catalytique <strong>des</strong> alcènes<br />
H<br />
H<br />
C<br />
C<br />
H 2<br />
Pd/C<br />
(ou Ni ou Pt)<br />
C<br />
C<br />
2) Hydrogénation catalytique complète <strong>des</strong> alcynes<br />
H<br />
H<br />
C<br />
C<br />
H 2 excès ou 2 H 2<br />
Pd/C<br />
(ou Ni ou Pt)<br />
C<br />
H<br />
C<br />
H<br />
3) Hydrogénation catalytique de composés aromatiques<br />
H 2<br />
Pd/C (ou Ni ou Pt)<br />
forte pression<br />
et<br />
température<br />
élevée<br />
4) Hydrogénation catalytique de composés halogénés<br />
H 2<br />
R X R H + H X<br />
Pd/C<br />
(ou Ni ou Pt)<br />
5) Déshalogénation (couplage métallique avec le Zn)<br />
X CH CH CH X + Zn<br />
CH 2<br />
n<br />
+ ZnX<br />
2 2 2<br />
n CH 2 CH<br />
2<br />
2<br />
6) Réaction de Wurtz (couplage métallique avec le sodium)<br />
2 R X + 2 Na R R<br />
+ 2NaX<br />
7) Formation d’un réactif de Grignard réagissant ensuite avec l’eau<br />
R<br />
X<br />
Mg<br />
éther<br />
R<br />
MgX<br />
H 2 O<br />
R H + Mg(OH) + X 2<br />
_<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 1
Réactivité <strong>des</strong> alcanes et <strong>des</strong> cycloalcanes<br />
1) Combustion<br />
A) Combustion complète<br />
C n H<br />
3n+1<br />
2n+2 + O 2 n CO 2 + (n+1) H 2 O<br />
2<br />
B) Combustions incomplètes<br />
2 CH 4 + 3 O 2 → 2 CO + 4 H 2 O<br />
CH 4 + O 2 → C + 2 H 2 O<br />
CH 4 + O 2 → CH 2 O + H 2 O<br />
2 C 2 H 6 + 3 O 2 → 2 CH 3 CO 2 H + 2 H 2 O<br />
2) Halogénation radicalaire<br />
R-H + X 2<br />
ou hν<br />
R-X + H-X (X = Cl ou Br)<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 2
Préparation <strong>des</strong> alcènes<br />
1) Hydrogénation catalytique partielle <strong>des</strong> alcynes (ré<strong>du</strong>ction contrôlée <strong>des</strong><br />
alcynes et formation d’alcènes cis)<br />
R<br />
R<br />
H 2<br />
R C C R C C<br />
catalyseur de Lindlar<br />
H<br />
H<br />
2) Ré<strong>du</strong>ction contrôlée <strong>des</strong> alcynes avec le sodium métallique (formation<br />
d’alcènes trans)<br />
R<br />
H<br />
H 2<br />
R C C R C C<br />
Na (s) , NH 3( )<br />
H<br />
R<br />
3) Réactions d’élimination d’ordre 2 ou d’ordre 1<br />
Y<br />
C<br />
C<br />
E1 ou E2<br />
C<br />
C<br />
H<br />
La règle de Saytzev doit être respectée.<br />
Si Y est un halogène (Cl, Br et I) : déshalogénation (base forte, KOH ou<br />
NaNH 2 ).<br />
Si Y est un alcool (OH) : déshydratation (H 2 SO 4 conc. )<br />
* Si Y est une amine (NH 2 ) : désamination (élimination de Hofmann) (1)<br />
CH 3 I (excès), et 2) Ag 2 O, H 2 O / ).<br />
4) Déshalogénation (couplage métallique avec le Zn)<br />
X<br />
C<br />
C<br />
Zn<br />
C C + ZnX 2<br />
X<br />
* Une réaction précédée d’un astérisque signifie que cette réaction n’a pas été illustrée dans le manuel<br />
et qu’elle est une autre voie possible.<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 3
Réactivité <strong>des</strong> alcènes<br />
1) Addition d’halogénures d’hydrogène (H-X)<br />
R<br />
H<br />
X<br />
H<br />
C<br />
C<br />
CCl 4<br />
+ H-X R C C<br />
H<br />
H<br />
H<br />
H<br />
H<br />
X = Cl, Br, I<br />
Respect de la règle de Markovnikov<br />
2) Hydratation en milieu acide (ou addition d’eau en milieu acide)<br />
R<br />
H<br />
OH<br />
H<br />
C<br />
C<br />
+<br />
H 2 O<br />
H 2 SO 4<br />
R<br />
C<br />
C<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Respect de la règle de Markovnikov<br />
3) Hydroboration<br />
R<br />
H<br />
H<br />
OH<br />
H<br />
C<br />
C<br />
H<br />
1) BH 3<br />
2) H 2 O 2 , OH -<br />
R<br />
C<br />
H<br />
C<br />
H<br />
H<br />
Addition globale de type anti-Markovnikov<br />
4) Addition de HBr de type anti-Markovnikov<br />
R<br />
H<br />
H<br />
Br<br />
C<br />
C<br />
+ H-Br<br />
ROOR<br />
hν<br />
R<br />
C<br />
C<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Addition globale de type anti-Markovnikov<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 4
5) Addition de X-OH (équivalent à l’addition de X 2 dans l’eau)<br />
H<br />
H<br />
OH<br />
X<br />
C<br />
C<br />
CCl 4<br />
+ X-OH H C C<br />
H<br />
H<br />
H<br />
où X = Cl, Br<br />
H<br />
H<br />
6) Hydrogénation catalytique (ou addition d’hydrogène, H 2 )<br />
H<br />
H<br />
C<br />
C<br />
H 2<br />
Pd/C<br />
(ou Ni ou Pt)<br />
C<br />
C<br />
H 2<br />
Pd/C<br />
(ou Ni ou Pt)<br />
H<br />
H<br />
Addition syn<br />
7) Halogénation (ou addition d’halogènes, X 2 )<br />
R<br />
H<br />
X<br />
X<br />
C<br />
C<br />
+ X 2<br />
CCl 4<br />
R<br />
C<br />
C<br />
H<br />
H<br />
H<br />
X = Cl ou Br<br />
H<br />
H<br />
X<br />
X 2<br />
CCl 4<br />
X<br />
Addition anti<br />
8) Addition radicalaire et polymères ; polymérisation radicalaire de l’éthylène<br />
n<br />
H<br />
H<br />
C<br />
C<br />
H<br />
H<br />
ROOR<br />
pression élevée,<br />
température élevée<br />
CH 2 CH 2<br />
n<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 5
9) Oxydation douce avec le permanganate de potassium dilué<br />
OH<br />
OH<br />
KMnO<br />
C C 4<br />
C C<br />
H 2 O<br />
KMnO 4<br />
H 2 O<br />
OH<br />
OH<br />
Addition syn<br />
10) Oxydation forte avec le KMnO 4 ou le K 2 Cr 2 O 7 concentré<br />
R<br />
R'<br />
C<br />
C<br />
R''<br />
H<br />
KMnO 4 conc.<br />
H 3 O +<br />
R<br />
O<br />
C<br />
R'<br />
+<br />
R''<br />
O<br />
C<br />
OH<br />
Cétone<br />
Acide<br />
Les aldéhy<strong>des</strong> ne sont pas conservés.<br />
Ils sont oxydés en aci<strong>des</strong>.<br />
11) Ozonolyses oxydante et ré<strong>du</strong>ctrice<br />
Oxydante<br />
R<br />
R''<br />
O<br />
O<br />
R'<br />
C<br />
C<br />
H<br />
1) O 3<br />
R<br />
C<br />
R'<br />
Cétone<br />
+<br />
R''<br />
C<br />
OH<br />
2) H 2 O 2 , H 3 O + Les aldéhy<strong>des</strong> ne sont pas conservés.<br />
Acide<br />
Ils sont oxydés en aci<strong>des</strong>.<br />
Ré<strong>du</strong>ctrice<br />
R<br />
R''<br />
O<br />
O<br />
R'<br />
C<br />
C<br />
H<br />
1) O 3<br />
2) Zn , H 3 O + ou<br />
CH 3 SCH 3<br />
C<br />
R<br />
Cétone<br />
R'<br />
+ C<br />
R'' H<br />
Aldéhyde<br />
Les aldéhy<strong>des</strong> sont conservés.<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 6
12) Formation d’époxy<strong>des</strong> (époxydation)<br />
C C<br />
RCOOOH<br />
C<br />
(ex. MCPBA)<br />
O<br />
C<br />
13) Combustion complète<br />
C n H 2n<br />
3n<br />
+ O 2 n CO 2 + n H 2 O<br />
2<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 7
Préparation <strong>des</strong> alcynes<br />
1) Déshydrohalogénation double (élimination double)<br />
X<br />
C<br />
X<br />
C<br />
Base forte<br />
(KOH, NaNH 2 , etc.)<br />
C<br />
C<br />
H<br />
H<br />
Dihalogénure vicinal<br />
X<br />
C<br />
H<br />
C<br />
Base forte<br />
(KOH, NaNH 2 , etc.)<br />
C<br />
C<br />
X<br />
H<br />
Dihalogénure géminal<br />
*2) Synthèse inorganique ; procédé in<strong>du</strong>striel à partir <strong>du</strong> coke et de la chaux<br />
3 C + CaO<br />
forte pression _<br />
_<br />
C C<br />
température<br />
Ca 2+ + CO<br />
très élevée<br />
_<br />
C<br />
C<br />
_<br />
Ca 2+ + 2 H 2 O<br />
H C C H + Ca(OH) 2<br />
Réactivité <strong>des</strong> alcynes<br />
1) Addition double<br />
A) d’halogénures d’hydrogène (H-X)<br />
X<br />
H<br />
R<br />
C C H<br />
HX (excès ou 2 équivalents)<br />
R<br />
C<br />
C<br />
H<br />
CCl 4<br />
X<br />
H<br />
Addition selon la règle<br />
de Markovnikov)<br />
B) de HBr de type anti-Markovnikov<br />
H<br />
Br<br />
R<br />
C C H<br />
HBr (excès ou 2 équivalents)<br />
ROOR<br />
hυ<br />
R<br />
C<br />
H<br />
C<br />
Br<br />
H<br />
Addition de type<br />
anti-Markovnikov<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 8
C) d’halogénures (X 2 ) ; halogénation<br />
R<br />
C C H<br />
X 2 (excès ou 2 équivalents)<br />
CCl 4<br />
L’addition partielle (limitée à un seul équivalent) de HX, de HBr de type<br />
anti-Markovnikov et de X 2 est possible, mais plus difficile.<br />
D) d’hydrogènes (H 2 ) ; hydrogénation catalytique<br />
R<br />
X<br />
C<br />
X<br />
X<br />
C<br />
X<br />
H<br />
H<br />
H<br />
R<br />
C C H<br />
H 2 (excès ou 2 équivalents)<br />
Pd/C<br />
(Ni ou Pt)<br />
R<br />
C<br />
H<br />
C<br />
H<br />
H<br />
2) Hydratation en milieu acide en présence d’un catalyseur de mercure<br />
R<br />
C C H<br />
OH H<br />
H 2 O<br />
R C C H<br />
H 2 SO 4<br />
HgSO 4<br />
Énol<br />
Addition selon la règle de Markovnikov<br />
R<br />
O<br />
C<br />
CH 3<br />
3) Hydroboration<br />
O<br />
R C C H<br />
1) BH R C<br />
3<br />
CH<br />
2) H 2<br />
2 O 2 , OH _ C C H<br />
H OH<br />
H<br />
Énol<br />
Addition de type anti-Markovnikov<br />
4) Hydrogénation catalytique partielle <strong>des</strong> alcynes (ré<strong>du</strong>ction contrôlée <strong>des</strong><br />
alcynes et formation d’alcènes cis)<br />
R<br />
R<br />
H 2<br />
R C C R C C<br />
catalyseur de Lindlar<br />
H<br />
H<br />
5) Ré<strong>du</strong>ction contrôlée <strong>des</strong> alcynes avec le sodium métallique (formation<br />
d’alcènes trans)<br />
R<br />
H<br />
H 2<br />
R C C R C C<br />
Na (s) , NH 3( )<br />
H<br />
R<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 9
6) Oxydation et ozonolyse<br />
O<br />
O<br />
R C C R'<br />
+<br />
C<br />
C<br />
R OH R' OH<br />
Réactifs possibles :<br />
A) Ozonolyse : 1) O 3 et 2) H 2 O<br />
B) Oxydation au permanganate de potassium : 1) KMnO 4 conc. et 2) H 3 O +<br />
7) Élongation de la chaîne de carbones<br />
A) Formation de l’acétylure (ou sel d’alcyne)<br />
NaNH 2<br />
R C C H<br />
R C C Na + + NH 3<br />
B) Réaction <strong>du</strong> sel d’alcyne avec :<br />
a) un composé halogéné<br />
R C C + R'-X R C C<br />
R'<br />
b) un époxyde<br />
1) H 2 C CH 2<br />
O<br />
R C C<br />
R C C CH 2<br />
2) H 2 O, H 3 O +<br />
CH 2<br />
OH<br />
c) un aldéhyde ou une cétone<br />
O<br />
1) C<br />
R' R''<br />
R C C<br />
R C C<br />
2) H 2 O, H 3 O +<br />
R'<br />
C<br />
R''<br />
OH<br />
8) Combustion complète<br />
C n H 2n + 1<br />
n O 2 n CO<br />
n<br />
+ 2 + H 2 O<br />
2<br />
2<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 10
Préparation <strong>des</strong> composés aromatiques<br />
*1) Déshydrogénation <strong>des</strong> cyclohexanes<br />
catalyseur<br />
de platine<br />
(Pt)<br />
support d'alumine<br />
(ex. Al 2 O 3 )<br />
H 2 sous pression<br />
température élevée<br />
+<br />
3 H 2<br />
*2) Déshydrocyclisation de l’hexane<br />
catalyseur<br />
de platine<br />
(Pt)<br />
support d'alumine<br />
(ex. Al 2 O 3 )<br />
H 2 sous pression<br />
température élevée<br />
+<br />
4 H 2<br />
*3) Déshydroisomérisation <strong>des</strong> cyclopentanes<br />
catalyseur<br />
de platine<br />
(Pt)<br />
support d'alumine<br />
(ex. Al 2 O 3 )<br />
H 2 sous pression<br />
température élevée<br />
+<br />
3 H 2<br />
Réactivité <strong>des</strong> composés aromatiques<br />
1) Hydrogénation catalytique<br />
+<br />
3 H 2<br />
Pd/C ou Ni ou Pt<br />
forte pression<br />
et température<br />
élevée<br />
ou<br />
+ 3 H2<br />
Ni de Raney<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 11
2) Substitution électrophile aromatique<br />
A) Halogénation<br />
X<br />
X 2<br />
FeX 3 ou AlX 3<br />
B) Nitration<br />
NO 2<br />
HNO 3<br />
H 2 SO 4<br />
C) Sulfonation<br />
SO 3 H<br />
H 2 SO 4<br />
SO 3<br />
D) Alkylation de Friedel-Crafts<br />
R<br />
R<br />
X<br />
FeX 3 ou AlX 3<br />
CH 2 CH 3<br />
H 2 C CH 2<br />
H 2 SO 4<br />
E) Acylation de Friedel-Crafts<br />
O<br />
R<br />
O<br />
C<br />
X<br />
C<br />
R<br />
FeX 3 ou AlX 3<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 12
3) Oxydation <strong>des</strong> chaînes alkyles<br />
R<br />
COOH<br />
KMnO 4<br />
H 3 O +<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 13
Préparation <strong>des</strong> composés halogénés<br />
1) Halogénation radicalaire <strong>des</strong> alcanes<br />
R-H + X 2<br />
ou hν<br />
R-X + H-X (X = Cl ou Br)<br />
2) Additions électrophiles sur un alcène<br />
R<br />
H<br />
Y<br />
H<br />
C<br />
C<br />
R<br />
C<br />
C<br />
H<br />
H<br />
H<br />
H<br />
Z<br />
A) d’halogénures d’hydrogène (H-X) : ; Y = halogène et Z = hydrogène<br />
Réactifs : H-X (où X = Cl, Br et I), CCl 4 (respect de la règle de<br />
Markovnikov)<br />
B) de HBr de type anti-Markovnikov : ; Y = hydrogène et Z = halogène<br />
Réactifs : H-Br, ROOR, h<br />
C) halogénation : ; Y et Z = halogènes<br />
Réactifs : X 2 (où X = Cl, Br), CCl 4 (addition anti)<br />
3) Additions électrophiles doubles sur un alcyne<br />
R<br />
Z<br />
(1 éq.) (1 éq.)<br />
R C C H<br />
C C<br />
R<br />
Y<br />
C<br />
Z<br />
C<br />
H<br />
Y<br />
H<br />
Y<br />
Z<br />
(excès ou 2 éq.)<br />
A) d’halogénures d’hydrogène (H-X) ; Y = halogène et Z = hydrogène<br />
Réactifs : H-X (où X = Cl, Br et I), CCl 4 (respect de la règle de<br />
Markovnikov)<br />
B) de HBr de type anti-Markovnikov ; Y = hydrogène et Z = halogène<br />
Réactifs : H-Br, ROOR, h<br />
C) halogénation ; Y et Z = halogènes<br />
Réactifs : X 2 (où X = Cl, Br), CCl 4 (addition anti)<br />
L’addition partielle (limitée à un seul équivalent) de HX, de HBr de type anti-<br />
Markovnikov et de X 2 est possible, mais plus difficile.<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 14
4) Réactions de substitution nucléophile à partir <strong>des</strong> alcools<br />
R OH R X<br />
Réactifs possibles :<br />
I) HX (où X = Cl, Br ou I) ; ajout de ZnCl 2 si alcool primaire (test de Lucas)<br />
II) SOCl 2<br />
III) PX 3 (où X = Cl ou Br)<br />
5) Substitution électrophile aromatique ; halogénation<br />
X<br />
X 2<br />
FeX 3 ou AlX 3<br />
Réactivité <strong>des</strong> composés halogénés<br />
1) Substitution nucléophile (S N 1 et S N 2)<br />
R X R Y<br />
A) Formation d’alcools ; Y = OH<br />
Réactifs : OH - ou H 2 O<br />
B) Formation d’éthers ; Y = OR<br />
Réactifs : RO - ou ROH<br />
C) Formation d’esters ; Y = OCOR<br />
-<br />
Réactifs : RCO 2<br />
D) Formation d’amines primaires ; Y = NH 2<br />
Réactifs : NH 3<br />
E) Formation d’amines secondaires ; Y = NHR’<br />
Réactifs : R’NH 2<br />
F) Formation d’amines tertiaires ; Y = NR’R’’<br />
Réactifs : R’NH R’’<br />
G) Formation de thiols ; Y = SH<br />
Réactifs : SH -<br />
H) Formation de thioéthers ; Y = SR’<br />
Réactifs : R’SH<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 15
I) Formation de nitriles ; Y = CN<br />
Réactifs : CN -<br />
J) Formation d’alcynes; Y = C≡CR’<br />
Réactifs : R’C≡C -<br />
2) Élimination (E1 et E2)<br />
A) Formation d’alcènes<br />
X<br />
X<br />
C<br />
C<br />
Zn<br />
C<br />
C<br />
X<br />
C<br />
C<br />
Base forte - E2<br />
(ex. NaOH, KOH,<br />
NaNH 2 , etc.)<br />
ou<br />
Base modérée à faible -<br />
E1 (ex. H 2 O, NH 3 )<br />
C<br />
C<br />
H<br />
B) Formation d’alcynes (déshydrohalogénation double)<br />
X<br />
C<br />
X<br />
C<br />
Base forte<br />
(KOH, NaNH 2 , etc.)<br />
C<br />
C<br />
H<br />
H<br />
Dihalogénure vicinal<br />
X<br />
C<br />
H<br />
C<br />
Base forte<br />
(KOH, NaNH 2 , etc.)<br />
C<br />
C<br />
X<br />
H<br />
Dihalogénure géminal<br />
3) Hydrogénation catalytique (substitution radicalaire)<br />
H 2<br />
R X R H + H X<br />
Pd/C ou Ni ou Pt<br />
4) Réaction de Wurtz (substitution radicalaire)<br />
2 R X +2Na R R<br />
+2NaX<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 16
5) Formation de cycloalcanes à partir de composés dihalogénés et de zinc<br />
métallique<br />
X CH 2 CH 2 CH 2 X<br />
n<br />
+ Zn<br />
CH 2<br />
n<br />
CH 2 CH 2<br />
+ ZnX 2<br />
6) Formation d’organomagnésiens (réactifs de Grignard)<br />
R X + Mg éther<br />
anhydre<br />
7) Formation d’organolithiens<br />
hexane<br />
R X + 2Li<br />
R Li<br />
R<br />
MgX<br />
+ LiX<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 17
Préparation <strong>des</strong> composés organométalliques<br />
1) Formation d’organomagnésiens (réactifs de Grignard)<br />
R X + Mg éther<br />
R MgX<br />
anhydre<br />
2) Formation d’organolithiens<br />
hexane<br />
R X + 2 Li<br />
R Li<br />
+ LiX<br />
Réactivité <strong>des</strong> composés organométalliques (réactifs de Grignard)<br />
1) Réactions acido-basiques sur <strong>des</strong> composés ayant un proton acide ou<br />
légèrement acide H-B (soit H-OH ; H-OR ; H-NH 2 ; H-NHR ; H-NR 2 ;<br />
H-C≡C-R ; H-C≡N ; H-X et H-OCOR)<br />
R MgX + H OR R H (+ ROMgX)<br />
2) Substitution nucléophile sur <strong>des</strong> composés halogénés R-X<br />
R' MgX + R X R' R (+ MgX 2 )<br />
3) Additions nucléophiles<br />
A) sur <strong>des</strong> époxy<strong>des</strong><br />
1)<br />
O<br />
R<br />
MgBr<br />
H 2 C CH 2<br />
2) H 2 O, H 3 O +<br />
R CH 2 CH 2 OH<br />
B) sur <strong>des</strong> groupements carbonyles<br />
a) CO 2<br />
OH<br />
R<br />
MgX<br />
1) CO 2<br />
2) H 2 O, H 3 O +<br />
R<br />
C<br />
O<br />
b) aldéhy<strong>des</strong> et cétones<br />
1)<br />
O<br />
R MgX + R''<br />
R<br />
MgX<br />
R'<br />
C<br />
R''<br />
2) H 2 O, H 3 O +<br />
R'<br />
c) dérivés d’aci<strong>des</strong> carboxyliques (halogénures d’acide, esters et<br />
anhydri<strong>des</strong>) :<br />
O<br />
C<br />
OR'<br />
R<br />
O<br />
C<br />
R<br />
OH<br />
C<br />
(+ R'OMgX)<br />
R''<br />
+<br />
R<br />
R''<br />
MgX<br />
H 2 O, H 3 O +<br />
R<br />
OH<br />
C<br />
R<br />
R''<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 18
C) sur <strong>des</strong> nitriles<br />
H<br />
N<br />
O<br />
R<br />
MgX<br />
1) R'<br />
C<br />
N<br />
2) H 2 O, H 3 O +<br />
R<br />
C<br />
R'<br />
NH 3<br />
+<br />
R<br />
C<br />
R'<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 19
Préparation <strong>des</strong> alcools<br />
1) Réactions d’addition et d’oxydation sur les alcènes<br />
R<br />
H<br />
H<br />
H<br />
C<br />
C<br />
R<br />
C<br />
C<br />
H<br />
H<br />
H<br />
Y<br />
Z<br />
A) Hydratation ; Y = OH et Z = H (respect de la règle de Markovnikov)<br />
Réactifs : H 2 O, H 2 SO 4<br />
B) Hydroboration ; Y = H et Z = OH (addition globale de type anti-<br />
Markovnikov)<br />
Réactifs : 1) BH 3 et 2) H 2 O 2 , OH -<br />
C) Oxydation douce ; Y et Z = OH (formation d’un diol)<br />
Réactifs : KMnO 4 dilué à froid (addition syn)<br />
2) Substitution nucléophile sur un composé halogéné<br />
_<br />
OH ou H 2 O<br />
R X R OH<br />
3) Additions nucléophiles <strong>des</strong> composés organométalliques sur les époxy<strong>des</strong>, les<br />
aldéhy<strong>des</strong>, les cétones et les dérivés d’aci<strong>des</strong> carboxyliques<br />
1)<br />
O<br />
1)<br />
O<br />
R<br />
MgBr<br />
H 2 C CH 2<br />
R CH 2 CH 2 OH<br />
2) H 2 O, H 3 O +<br />
R<br />
MgX<br />
C<br />
R' R''<br />
2) H 2 O, H 3 O +<br />
R<br />
OH<br />
C<br />
R''<br />
R'<br />
R MgX + R''<br />
O<br />
C<br />
OR'<br />
R<br />
O<br />
C<br />
(+ R'OMgX)<br />
R''<br />
+ R<br />
MgX<br />
H 2 O, H 3 O +<br />
R<br />
OH<br />
C<br />
R<br />
R''<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 20
4) Ré<strong>du</strong>ction <strong>des</strong> aldéhy<strong>des</strong> et <strong>des</strong> cétones<br />
O<br />
1) NaBH 4 ou LiAlH 4<br />
2) H 2 O, H 3 O +<br />
OH<br />
R<br />
C<br />
R'<br />
ou<br />
H 2 (forte pression)<br />
Pd/C ou Pt ou Ni<br />
R<br />
C<br />
H<br />
R'<br />
5) Hydrolyse (en milieu acide) et saponification (en milieu basique) <strong>des</strong> esters<br />
Hydrolyse:<br />
O<br />
O<br />
H 2 O, H 3 O +<br />
C<br />
C + R'OH<br />
R OR'<br />
R OH<br />
Saponification:<br />
R<br />
O<br />
C<br />
OR'<br />
H 2 O, NaOH<br />
R<br />
O<br />
C<br />
_<br />
O Na +<br />
+ R'OH<br />
6) Ré<strong>du</strong>ction d’esters<br />
O<br />
R<br />
C<br />
OR'<br />
1) LiAlH 4<br />
2) H 2 O, H 3 O +<br />
RCH 2 OH<br />
+ R'OH<br />
7) Clivage d’éthers<br />
H 2 O<br />
R O R' R OH + R' OH<br />
H 2 SO 4<br />
Réactivité <strong>des</strong> alcools<br />
1) Réaction rédox avec un métal, formation <strong>des</strong> ions alcoolate<br />
2 R-OH + 2 K (ou 2 Na) → 2 RO - K + + H 2<br />
ou<br />
R-OH + NaH → RO - Na + + H 2<br />
2) Réactions acido-basiques avec un réactif de Grignard<br />
R-MgBr + R’-OH → R-H + R’O - + MgBr<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 21
3) Déshydratation (réaction d’élimination)<br />
OH<br />
C<br />
C<br />
H 2 SO 4<br />
C<br />
C<br />
H<br />
Si l’alcool est primaire, l’acide sulfurique est concentré et la réaction s’effectue<br />
selon un mécanisme E2.<br />
Si les alcools sont secondaires ou tertiaires, l’acide sulfurique est dilué et la<br />
réaction s’effectue selon un mécanisme E1.<br />
4) Réactions de substitution nucléophile ; formation de composés halogénés<br />
R OH R X<br />
Réactifs possibles :<br />
I) HX (où X = Cl, Br ou I) ; ajout de ZnCl 2 si alcool primaire (test de Lucas)<br />
II) SOCl 2<br />
III) PX 3 (où X = Cl ou Br)<br />
5) Oxydation<br />
A) <strong>des</strong> alcools primaires en aci<strong>des</strong> et <strong>des</strong> alcools secondaires en cétones<br />
OH<br />
O<br />
R<br />
C<br />
H<br />
H<br />
R<br />
C<br />
OH<br />
OH<br />
O<br />
R C H<br />
C<br />
R<br />
R'<br />
Réactifs possibles :<br />
I) KMnO 4 conc. en présence de chaleur<br />
II) K 2 Cr 2 O 7 (ou Na 2 Cr 2 O 7 ) / H 2 SO 4 , H 2 O<br />
III) CrO 3 / H 2 SO 4 , acétone (réactif de Jones)<br />
R'<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 22
B) <strong>des</strong> alcools primaires en aldéhy<strong>des</strong><br />
OH<br />
O<br />
R<br />
C<br />
H<br />
PCC<br />
R<br />
C<br />
H<br />
H<br />
ou<br />
R<br />
OH<br />
C<br />
H<br />
Réactif de Swern<br />
O<br />
C<br />
H<br />
R<br />
H<br />
Réactifs de Swern :<br />
H 3 C<br />
O<br />
S<br />
CH 3<br />
,<br />
Cl<br />
O<br />
C<br />
O<br />
C<br />
Cl<br />
Et 3 N, CH 2 Cl 2 , -60 o C<br />
6) Synthèse de Williamson ; formation d’éthers asymétriques<br />
R OH<br />
1) NaH ou Na ou K<br />
2) R'-X<br />
R O R'<br />
7) Estérification de Fischer ; formation d’esters<br />
O<br />
O<br />
R<br />
C<br />
OH +<br />
R'<br />
OH<br />
H 2 SO 4<br />
R C<br />
OR' + H 2 O<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 23
Préparation <strong>des</strong> phénols<br />
*1) Procédé in<strong>du</strong>striel (hydroperoxyde de cumène)<br />
OH<br />
CH CH 2<br />
CH 3<br />
H 2 SO 4 (HA)<br />
1) O 2 , Na 2 CO 3 , Δ<br />
2) H 2 SO 4 , H 2 O, Δ<br />
+<br />
O<br />
*2) Diazotation et décomposition <strong>des</strong> sels de benzènediazonium<br />
N<br />
NH 2<br />
NaNO 2 , H 3 O + , 0 o C H 2 O<br />
N+<br />
OH<br />
Sel de benzènediazonium<br />
*3) Substitution nucléophile<br />
A) sur un halogénobenzène<br />
Cl<br />
OH<br />
1) NaOH,<br />
pression et<br />
température élevées<br />
2) H 2 O, H 3 O +<br />
B) sur un acide benzènesulfonique<br />
SO 3 H<br />
1) NaOH,<br />
pression et<br />
température élevées<br />
2) H 2 O, H 3 O +<br />
OH<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 24
Réactivité <strong>des</strong> phénols<br />
1) Réactions acido-basiques, formation d’ions phénolate<br />
OH<br />
NaOH<br />
_<br />
O Na +<br />
+ H 2 O<br />
N.B. : Avec cet ion phénolate, il est possible de synthétiser <strong>des</strong> éthers en les faisant<br />
réagir avec un composé halogéné (R-X).<br />
2) Substitutions électrophiles aromatiques<br />
A) Nitration<br />
OH<br />
OH NO 2<br />
HNO 3 dilué<br />
NO 2<br />
+<br />
OH<br />
+ H 2 O<br />
Pro<strong>du</strong>it majoritaire<br />
B) Bromation<br />
OH<br />
OH<br />
Br<br />
Br<br />
Br 2 (excès)<br />
H 2 O<br />
+ 3 HBr<br />
Br<br />
3) Oxydation menant à la formation de quinones<br />
OH<br />
O<br />
Na 2 Cr 2 O 7<br />
H 2 SO 4<br />
30 o C<br />
OH<br />
O<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 25
OH<br />
ON<br />
_<br />
SO 3<br />
K +<br />
_<br />
SO 3 K +<br />
O<br />
Sel de Fremy<br />
O<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 26
Préparation <strong>des</strong> thiols<br />
1) Substitution nucléophile sur un composé halogéné<br />
R<br />
X<br />
HS _ R SH<br />
*2) Clivage de thioéthers<br />
R S R<br />
HX (1 éq)<br />
R X + R SH<br />
Réactivité <strong>des</strong> thiols<br />
1) Formation de mercapti<strong>des</strong> (sels de mercure)<br />
HgCl 2<br />
2 R SH<br />
(RS) 2 Hg + 2 HCl<br />
2) Formation d’ions thiolate<br />
NaOH<br />
_<br />
R SH R S Na +<br />
+ H 2 O<br />
3) Oxydation en disulfures<br />
2 R SH<br />
Oxydation<br />
I 2 ou H 2 O 2<br />
R S S R<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 27
Préparation <strong>des</strong> éthers et <strong>des</strong> époxy<strong>des</strong><br />
1) Formation d’éthers symétriques<br />
H 2 SO 4 conc.<br />
2 R OH R O R<br />
2) Synthèse de Williamson ; formation d’éthers asymétriques<br />
R OH<br />
1) NaH ou Na ou K<br />
2) R'-X<br />
R O R'<br />
N.B. Optimale pour les alcools et composés halogénés primaires ; non<br />
recommandée pour les alcools et les composés halogénés secondaires et tertiaires.<br />
3) Époxydation en présence d’un catalyseur d’argent<br />
Ag H 2 C<br />
H 2 C CH 2 + O 2<br />
pression<br />
O<br />
CH 2<br />
4) Époxydation avec un peracide (MCPBA)<br />
C<br />
C<br />
RCOOOH<br />
C<br />
C<br />
O<br />
O<br />
RCOOOH = MCPBA<br />
O<br />
O<br />
H<br />
Cl<br />
Réactivité <strong>des</strong> éthers et <strong>des</strong> époxy<strong>des</strong><br />
1) Clivage <strong>des</strong> éthers (formation d’alcools)<br />
H 2 O<br />
R O R' R OH + R' OH<br />
H 2 SO 4<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 28
2) Clivage <strong>des</strong> éthers (formation de composés halogénés)<br />
R O R'<br />
HX (1éq)<br />
HX (1éq)<br />
R X + R' OH<br />
R' X +<br />
H 2 O<br />
où X = Br ou I<br />
X - attaque le côté le moins encombré<br />
(on suppose ici le groupement R)<br />
O<br />
R<br />
HX (excès)<br />
OH<br />
+<br />
R<br />
X<br />
R O R'<br />
1) BBr 3 (1éq)<br />
R Br +<br />
2) H 2 O<br />
R'<br />
OH<br />
1) BBr 3 (1éq)<br />
2) H 2 O<br />
R' Br + H 2 O<br />
3) Ouverture <strong>des</strong> époxy<strong>des</strong> en milieu acide<br />
R<br />
Y<br />
O<br />
R<br />
OH<br />
Si Y = OH<br />
Réactifs : H 2 O, H 2 SO 4 conc.<br />
Si Y= OR<br />
Réactifs : ROH, H 2 SO 4 conc.<br />
4) Ouverture <strong>des</strong> époxy<strong>des</strong> en milieu basique<br />
R<br />
R<br />
OH<br />
O<br />
Y<br />
Si Y = OH<br />
Réactifs : H 2 O, OH -<br />
Si Y = OR<br />
Réactifs : ROH, RO -<br />
Si Y = R<br />
Réactifs : 1) RMgX ou RLi et 2) H 2 O, H 3 O +<br />
Chimie organique 1 – Réactions globales © 2008 Les Éditions de la Chenelière inc. 29