ITC - Szerves Kémiai Tanszék
ITC - Szerves Kémiai Tanszék
ITC - Szerves Kémiai Tanszék
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
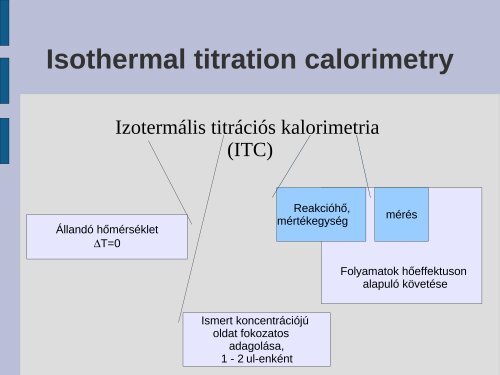
Isothermal titration calorimetry<br />
Izotermális titrációs kalorimetria<br />
(<strong>ITC</strong>)<br />
Állandó hőmérséklet<br />
∆T=0<br />
Reakcióhő,<br />
mértékegység<br />
mérés<br />
Folyamatok hőeffektuson<br />
alapuló követése<br />
Ismert koncentrációjú<br />
oldat fokozatos<br />
adagolása,<br />
1 - 2 ul-enként
Termodinamika és molekuláris alapjai<br />
Biofizika (Damjanovich) : 52-61, 249-275<br />
Fizika II. (Litz) 48-245 (ajánlott)<br />
Biofizika silabusz: http://szerves.science.unideb.hu/<br />
letöltések
(Gibbs-potenciál)<br />
definíció<br />
10
Kalorimetria<br />
Fizikai és kémiai folyamatokat kísérő energiaváltozás hő<br />
formájában nyilvánul meg: hő szabadul fel (exoterm), hő nyelődik<br />
el (endoterm)<br />
Hőmennyiség SI mértékegysége a Joule (J) [Nm],<br />
alternatív mértékegység a kalória (cal) 1 cal = 4.18 J<br />
A molekuláris interakció során keletkezik / elnyelődik hő →<br />
hidrogén kötések, hidrofób kölcsönhatások, Van der Waals kh,<br />
oldószer átrendeződés, konformáció változás
Endoterm és exoterm folyamatok<br />
●<br />
●<br />
Endoterm: ∆H pozitív érték (báriumhidroxid és<br />
ammónium tiocianát: 30 °C → 20 °C)<br />
Exoterm: ∆H negatív érték (tömény savat vízhez<br />
adunk)
Kaloriméter<br />
●<br />
Olyan eszköz, mely méri a reakció során<br />
keletkezett / elnyelt hőt
Hőkapacitás (C p<br />
)<br />
●<br />
●<br />
●<br />
●<br />
●<br />
Egy rendszer hőkapacitása megadja, hogy mennyi hőt kell<br />
közölni a rendszerrel, hogy hőmérséklete 1Kel emelkedjék<br />
(állandó nyomáson vett hőkapacitást (Cp) használjuk)<br />
Mértékegység: J/K<br />
C = ∆Q / ∆T<br />
Fajlagos hőkapacitás: 1g anyag 1Kel való felmelegítéséhez<br />
szükséges energia (J K 1 g 1 )<br />
Moláris hőkapacitás: 1 mol anyag 1Kel való<br />
felmelegítéséhez szükséges energia (J K 1 mol 1 )
Belső energia (∆U)<br />
●<br />
●<br />
●<br />
●<br />
●<br />
Egy termodinamikai rendszer összes energiája, extenzív<br />
mennyiség<br />
SI mértékegysége: Joule (J)<br />
2 fő komponense: kinetikus energia és a helyzeti energia<br />
(potentital energy)<br />
Kinetikus energia: a rendszer részecskéinek mozgásából adódik<br />
: rotáció, vibráció<br />
Helyzeti energia pedig az anyag statikus alkotóival van<br />
kapcsolatban: a molekulák, kristályok atomjainak energiája és<br />
kémiai kötések energiája
Termodinamika I. főtétele<br />
●<br />
●<br />
●<br />
●<br />
A belső energia megváltoztatható, ha a melegítjük a<br />
rendszert (∆Q), vagy munkát végzünk rajta (∆W) →<br />
→ ∆U = ∆Q ∆W (Zárt rendszer)<br />
∆Q – rendszerrel közölt hő<br />
∆W – a rendszer által a környezeten végzett munka<br />
A környezeten végzett munka vagy nyomás vagy térfogat<br />
változás eredménye: ∆W = p∆V<br />
p nyomás, V térfogat
Entalpiaváltozás: ∆H<br />
● Közel egyensúlyi folyamatokban állandó nyomáson a ∆H<br />
egyenlő a rendszer belső energia változásával (∆U) és a<br />
munkával amit a rendszer a környezetén végez (∆W).<br />
● Ez azt jelenti, hogy az entalpia változás ilyen körülmények<br />
között egy kémiai reakció által kibocsátott (vagy elnyelt)<br />
”hővel” egyenlő. Azzal az energiával ami hő formájában ki tud<br />
bocsátódni vagy el tud nyelődni.<br />
● ∆H = kJ/mol (előjel!!)<br />
● kJ → Q = m c ∆T (J)<br />
● Mol
Entalpiaváltozás: ∆H<br />
∆H = kJ/mol<br />
kJ → Q = mc∆T (J)<br />
Példa:<br />
Mol<br />
● 0,67g Mgot beleteszek 100ml (100,0 g) HClba és<br />
mérem a hőmérséklet változást<br />
● 19,1 °C → 48,7 °C ∆T = 29,6 °C<br />
● Q = (100g)(4,18 J/g°C)(29,6 °C) = 12373J = 12,4kJ<br />
● 1 mol Mg → 24,3 g; nekünk 0,67g van, ez 0,0276 mol<br />
● ∆H= 12,4kJ/0,0276 mol = 449kJ/mol<br />
exoterm reakció tehát: 449kJ/mol
Entrópiaváltozás (∆S)<br />
●<br />
●<br />
●<br />
●<br />
Az anyagi rendszerek molekuláris rendezettségét<br />
jellemzi<br />
Következtethetünk belőle a maguktól végbemenő<br />
folyamatok irányára<br />
Extenzív mennyiség<br />
Két molekula kapcsolódása során az entrópia<br />
csökken (a rendezetlenség csökken)
<strong>ITC</strong>: szerkezet –<br />
<br />
<br />
<br />
mechanizmus - funkció<br />
Sok szerkezeti adat<br />
Biokémiai interakciók felderítéséhez nem elegendő<br />
csak a szerkezet ismerete (pl. enzimek)<br />
Reakciók termodinamikai jellemzése, interakciós<br />
partnerek felderítése<br />
Komplexek<br />
szerkezeti<br />
sajátságai<br />
(interakciós<br />
felszínek,<br />
funkciós<br />
csoportok<br />
orientációja)<br />
+<br />
Reakció<br />
termodinamikai<br />
paraméterei<br />
MECHANIZMUS,<br />
FUNKCIÓ
MicroCal <strong>ITC</strong> 200<br />
<br />
<br />
<br />
<br />
<br />
<br />
<br />
Legérzékenyebb a típusok között<br />
Minimális kísérlet tervezés<br />
Könnyű kivitelezés<br />
Egy kísérlet: ~2 óra<br />
Univerzális detektor (nem optikai)<br />
Nem szükséges a minta jelölése,<br />
immobilizációja<br />
Mérés oldatban<br />
<br />
Hőmérséklettartomány: +2 °C ... +80 °C<br />
<br />
<br />
Széles moltömeg tartomány<br />
Sok publikáció és referencia<br />
TÁMOP és OTKA pályázat
MicroCal <strong>ITC</strong> 200<br />
<br />
<br />
Összes kötődési paraméter egyidejű<br />
meghatározása egyetlen kísérletben<br />
Közvetlenül mérhetőek mMnM<br />
nagyságrendű disszociációs állandók<br />
(K d<br />
) (K eq<br />
: 10 2 to 10 9 M 1 )<br />
<br />
Kompetitív technika használatával nM <br />
pM kötődési állandók (10 9 to 10 12 M 1 )<br />
<br />
Kis mintatérfogat: 200 µl + 40 µl (akár<br />
10 µg fehérje is elegendő)<br />
- VP-<strong>ITC</strong> cella: 1,4 ml<br />
- <strong>ITC</strong>200 cella: 200µl<br />
- <strong>Kémiai</strong>lag ellenálló<br />
Hastelloy® cellák
<strong>ITC</strong> kísérlet elve<br />
<br />
<br />
<br />
<br />
Egy molekula oldatát titráljuk a reakciópartner oldatával<br />
A kibocsátott / elnyelt hőmennyiség folyamatos mérése: nyers adat<br />
(exoterm, endoterm reakciók)<br />
A csúcs alatti területek integrálásával meghatározható a molekuláris<br />
kölcsönhatás teljes termodinamikai profilja<br />
Hőeffektus az alábbiakból tevődik össze: kevertetés, a ligand hígulása,<br />
a makromolekula hígulása, az interakcióból származó hő
<strong>ITC</strong> kísérlet elve<br />
<br />
Minden kötődési (interakció) paraméter meghatározása egy kísérletben:<br />
N (reakció sztöchiometriája),<br />
K B<br />
(kötődési konstans) = 1/K d<br />
,<br />
∆H (entalpia): moláris entalpia változás (kcal/mól)<br />
endoterm reakció: ∆H>0 exoterm reakció: ∆H
The energetics<br />
∆G = -RT ln K A<br />
∆G = ∆H –T∆S
Az affinitás csak egy része a teljes képnek<br />
Entalpia termodinamikai és funkciós / szerkezeti<br />
<br />
összefüggések<br />
<br />
Kötések energetikája: pl. hidrogén hidak<br />
kialakulása/felbomlása, Van der Waals kölcsönhatások<br />
<br />
<br />
Hidrofób interakciók, konformációs változások<br />
Elektrosztatikai interakciók<br />
Ezeknek jellegezetes termodinamikai profilja van:
<strong>ITC</strong> technikai működése<br />
DP: mért energia különbség,<br />
amely szükséges a<br />
referencia cella és a minta<br />
cella közötti ∆T~0<br />
hőmérséklet különbség<br />
biztosításához<br />
<br />
<br />
<br />
<br />
<br />
Referencia cella<br />
Minta cella<br />
Fecskendő (keverő<br />
berendezés is egyben)<br />
Adiabatikus köpeny<br />
Gyors hőmérséklet<br />
kiegyenlítés: félvezető<br />
Peltier szenzor a két<br />
cella között
Interakció erőssége<br />
<br />
Gyenge, közepes és erős interakció<br />
1 < c= n x K a<br />
x [M] T<br />
< 1000<br />
<br />
Paraméterek optimalizálása (több kísérlet)
<strong>ITC</strong> experiment design - C value<br />
What is the C value?<br />
– N x [protein in cell]/K D or N x [protein in cell] x K A<br />
Why does it matter?<br />
– Data quality-successful experiments
Kontroll kísérlet:<br />
EDTA - CaCl 2<br />
5 mM CaCl 2<br />
<br />
0,4 mM EDTA (Etiléndiamintetraecetsav)<br />
<br />
Puffer: 10mM MES (2(Nmorpholino)ethanesulfo<br />
nic acid), pH 5,6<br />
<br />
25 °C
PAF - Ca 2+<br />
<br />
NMR adat:<br />
K eq<br />
= 463 ± 23 M 1<br />
<br />
<strong>ITC</strong> adat:<br />
K eq<br />
= 400 ± 8,6 M 1
Jellegzetes alkalmazási<br />
területek<br />
<br />
<br />
<br />
<br />
Széleskörű alkalmazás<br />
Molekuláris interakciók jellemzése – natív molekulák<br />
oldatban való vizsgálata:<br />
<br />
kis molekulák, fehérjék, antitestek, DNS,<br />
szénhidrátok, lipidek, célmolekulagyógyszer<br />
molekula, fém ionok között<br />
Enzimaktivitás vizsgálata, enzim – szubsztrát, enziminhibítor,<br />
enzimszubsztrátinhibítor, enzimkinetika<br />
Molekulán található több különböző interakciós hely<br />
affinitásának meghatározása
Többszörös kötőhely<br />
<br />
<br />
Endonukleáz, két értékű fém ion<br />
kofaktor szükséges a<br />
reakcióhoz<br />
MnCl 2<br />
oldat (8.8 mM) enzim<br />
(382 μM)<br />
<br />
<strong>ITC</strong> mérés: az I.es kötőhely 30<br />
szor erősebb mint a II.es<br />
Feng, et al, Nat. Struct. Mol. Biol. 11, 450-456 (2004)
DNS-fehérje interakció<br />
<br />
<br />
<br />
<br />
Megismerésük a biokémia és molekuláris biológia egyik fő<br />
célja ( a génszabályozás hibája pl. rákos megbetegedéshez<br />
vezethet)<br />
DNSben kódolt információ kifejezése enzimreakciók<br />
segítségével történik, a génszabályozásban a DNS szállal<br />
való kölcsönhatás kulcsfontosságú<br />
Ez a kölcsönhatás közvetlenül mérhető <strong>ITC</strong> módszerrel<br />
pl. restrikciós endonukleázok: az enzimek ezen csoportjának<br />
nagyfokú specifitása van egyes DNS szekvenciákra
DNS-fehérje interakció<br />
<br />
MunI restrikciós endonukleáz –<br />
duplaszálú DNS<br />
d(GCCAATTGGC) 2<br />
<br />
19,5 °C, 200 mM NaCl, pH 6,5<br />
K b<br />
: 1x10 6 M 1<br />
<br />
∆H: 80 kJ mol 1<br />
<br />
DNSpuffer titrálás és DNSfehérje<br />
titrálás<br />
Ladbury, J. E. and Doyle, M. L. (eds) (2005) Front Matter, in Biocalorimetry 2:<br />
Applications of Calorimetry in the Biological Sciences, John Wiley & Sons, Ltd,<br />
Chichester, UK.
Enzim-szubsztrát-inhibítor<br />
Assay<br />
<br />
<br />
<br />
<br />
<br />
<br />
Enzim katalizált reakciók termodinamikájának és kinetikájának<br />
vizsgálata<br />
Rekombináns technikával előállított enzimek (orvosi, biotechnológiai<br />
alkalmazás)<br />
<strong>Kémiai</strong> szintézissel előállított szubsztrátok, szubsztrát analógok,<br />
inhibítorok<br />
Enzim katalizált reakció tanulmányozása: spektrofotometriásan vagy<br />
radioaktív jelöléssel; a szubsztráton lévő csoportok gyakran nem<br />
kívánt hatással vannak az enzim aktivitására<br />
Ilyen csoportok <strong>ITC</strong> vizsgálathoz nem szükségesek<br />
Enzim kinetikai paraméterek meghatározása:<br />
<br />
Egyszeres injektálás: ∆H<br />
<br />
Többszörös injektálás: K m<br />
, K cat
B-D-Glükozidáz – cellobióz<br />
1 mg/ml enzim<br />
10 mM cellobióz<br />
<br />
20 mM MOPS puffer, pH 7,2<br />
hidrolízise<br />
<br />
25 °C, 290 rpm<br />
Egyszeres injektálás: ∆H= -627,8 ± 5,25 cal/mol
B-D-Glükozidáz - cellobióz<br />
Többszörös injektálás:<br />
- 1.0 µg/ml enzim<br />
- 200 nmol cellobióz/titrálás<br />
K m<br />
= 0,22 ± 0,02 mM<br />
k cat<br />
= 16,3 ± 0,16 s -1<br />
Jeoh, T., Baker, J.O., Ali, M.K., Himmel, M.E. & Adney, W.S. β-d-Glucosidase reaction kinetics from<br />
isothermal titration microcalorimetry. Analytical Biochemistry 347, 244-253 (2005).