Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
1<strong>Szerves</strong> kémia előadás környezettan-analitikus szakirányú hallgatók számáraOktató: Dr. Gulácsi Katalin, elérhetőség: E-423/A, tel.:22476Előadás helye, ideje: E-320, szerda 8-10Ajánlott irodalom:Antus Sándor, Mátyus Péter: <strong>Szerves</strong> kémia, I, II, III, Nemzeti Tankönyvkiadó,Budapest, 2005Litkei György: <strong>Szerves</strong> kémia, I, II, egyetemi jegyzet, Tankönyvkiadó Budapest, 1986-1987
2A kémia történeteNyugodtan mondhatjuk, hogy a kémia története már az őskorban elkezdődött. Azősembernek is voltak <strong>kémiai</strong> ismeretei, még akkor is, ha ezt esetleg nem is tudta. A többtízezer éves barlangrajzokon látható, hogy az ősember is ismert számos a természetbentalálható színes anyagot és ezeket tudatosan fel is használta. Voltak egyéb olyananyagismereteik is, amit ma a kémia tárgykörébe sorolunk: tudtak tüzet gyújtani, ismertekbizonyos fémeket, járatosak voltak a fémolvasztás, üvegkészítés, erjesztés, festékkészítés,fazekasság, tartósítás körében. Az írásbeliség megjelenését követően ismereteikről márfeljegyzéseket is készítettek. Leírták az eljárásokat és az azokhoz alkalmazott készülékeket is.Zimbabwei barlangrajz A franciaországi Lascaux barlangból: sztyeppei bölény. Altamirai bölény i.e. 17000Az ókorban a görögök és rómaiak is készítettek <strong>kémiai</strong> tárgyú feljegyzéseket. A legnagyobbösszefoglaló Plinius 37 kötetes műve, a Historia naturalis volt. A kor legtöbb tudományosgyűjteménye az alexandriai könyvtárban volt.A Naturalis Historia egy 1669-es kiadásaElképzelt portré Idősebb PliniusrólA következő évszázadokban az alkimisták foglalkoztak kémiával és az "aranycsinálási"kísérletek "melléktermékeként" felfedeztek számos új anyagot, eszközt és eljárást. (HennigBrand német alkimista felfedezte a foszfort., Böttger a porcelánt) Ezzel párhuzamosanKínában és Indiában is jelentős felfedezéseket tettek. Az 1. században Kínában feltalálták apapírt, amely nagyon megkönnyítette az írásos feljegyzések elterjesztését. Ez a 8. századbanarab közvetítéssel került el Európába is.
4A szerves vegyületek számának rohamos növekedése indokolttá tette a szerves kémia önállótudománnyá válását. A 19. század végén jelentős felfedezések születtek a szénhidrátok,aminosavak, nukleinsavak és az enzimek területén is. A kőolaj alapú benzin előállítása isjelentős változást hozott. 1886-ban elkészült az első automobil, megalapozva a maiközlekedést és a hozzá kapcsolódó vegyipar meghatározó jelentőségét.Akik hozzájárultak a kémia fejlődéséhezLomonoszov, Mihail Vasziljevics (1711 - 1765) orosz fizikus, kémikus kísérletileg igazolja azanyagmegmaradás törvényét.Cavendish, Henry (1731 - 1810) Angol fizikus és kémikus felfedezi a hidrogént ésmegállapítja, hogy a víz két gáz egyesüléséből keletkezik.Lavoisier, Antoine Laurent (1743 - 1794) Francia kémikus. A modern kémia megteremtője. Ővezeti be a mérleget, mint elengedhetetlen segédeszközt a kémiában. Kimondja atömegmegmaradás tételét a <strong>kémiai</strong> reakciók esetében. Megállapítja a levegő és a vízösszetételét. Tisztázza a savak fogalmát. Megmagyarázza a légzést, miszerint az aszervezetben végbemenő égés. Módszeres, hosszú kísérleti vizsgálatok alapján megdöntötte aflogisztonelméletet és helyesen értelmezte az égési folyamatokat. Ő javasolta, hogy avegyületek neve feltétlenül fejezze ki azok összetételét.Proust, Joseph Louis (1754 - 1862) Francia gyógyszerész és kémikus. Felfedezi az állandótömegarányokat. Fontos szerepet játszott az analitikai <strong>kémiai</strong> területén.
6ONH 4 OCNH 2 N NH 2ammónium-cianát karbamidH 2 OHg(CN) 2 N C C N HOOC COOHoxálsavHess, Henry (1802 - 1850) Svájci születésű szentpétervári vegyész. 1840-ben, atermodinamika első főtételének kimondása előtt, felállította a róla elnevezett törvényt. Ezért atermokémia úttörőjének tekintik.Bunsen, Robert Wilhelm (1811 - 1899) Német kémikus. A színképelemzés egyikmegteremtője.Loschmidt, Joseph (1821 - 1895) Osztrák fizikus és kémikus. <strong>Szerves</strong> vegyületekábrázolásával, a vegyérték, és a gyök fogalom kidolgozásával megelőzte korát.
7Kekulé von Stradonitz, Friedrich (1829 - 1896) Német kémikus. Bevezette a <strong>kémiai</strong> <strong>kötés</strong>elméletét, a négy vegyértékű szénatomot, a szerkezeti képleteket. Ő javasolta a benzolszerkezetére a szénatomokból álló gyűrűt.Canizzaro, Stanislao (1826 - 1910) Olasz kémikus. Bevezette az atomtömeg és amolekulatömeg fogalmát.Mengyelejev, Dimitrij Ivanovics (1834 - 1907) Orosz vegyész, természettudós. 1869-benmegalkotta a periódusos rendszert.Le Bel, Joseph Achille (1847 - 1930) Francia kémikus. 1874-ben elméletet dolgozott aszerves molekulák eltérő optikai aktivitására. Ezt a sztereo<strong>kémiai</strong> jelenséget J. H. van't Hofffalközösen ismerték fel.Perrin, Jean Babtiste (1870 - 1942) Francia fizikus, kémikus. Vizsgálataival bizonyította azatomok és molekulák létét.
8Lewis, Gilbert Newton (1875 - 1946) Amerikai fizikai-kémikus. Kidolgozza a kovalens <strong>kötés</strong>elméletét.Hevesy György (1885 - 1966) Magyar fizikus és kémikus. Kidolgozza a radioaktívnyomjelzés technikáját.<strong>Kémiai</strong> anyagokÉv szervetlen szerves1865 3-40001880 150001910 1500001935 30000 3500001955 6500001970 < 50000 30000001980 ~ 50000 > 40000001993 12000000
9C 4 H 10 O összegképletnek megfelelő izomerekKekulé képlet szerkezeti képlet vonalas képletModern értelmezésA <strong>kémiai</strong> <strong>kötés</strong>elméletekLewis-Kossel oktett-elv: a kapcsolódó atomok nemesgáz konfiguráció elérésére törekednek
10metánA többszörös <strong>kötés</strong>eket megfelelő számú kötőelektron pár alkotja.A módszer hiányosságai:Nem értelmezhető a többszörös <strong>kötés</strong>ek eltérő <strong>kötés</strong>ereje, a sztereoizoméria, a<strong>kötés</strong>szög
11Csak a vegyértékhéj elektronjait ábrázoljaKötéstípusok, elektronegativitás• <strong>Kémiai</strong> <strong>kötés</strong>ek: atomok ill. atomcsoportok között kialakuló kapcsolatok, amelyeklétrejöttével a rendszer stabilabb (alacsonyabb energiaszintű) állapotba jut.• Elsőrendű <strong>kémiai</strong> <strong>kötés</strong>ek: azok a <strong>kötés</strong>ek, amelyek kialakulása során a kapcsolódóatomok vegyértékhéj-szerkezete megváltozik (ún. intramolekuláris kapcsolatok).• Másodrendű <strong>kötés</strong>ek: azok a <strong>kötés</strong>ek, amelyek gyenge elektrosztatikus kölcsönhatásrévén az anyagi halmazok részecskéi (molekulák ill. ionok) között alakulnak ki (ún.intermolekuláris kapcsolatok).• Kötési energia: az adott típusú <strong>kémiai</strong> <strong>kötés</strong> felbontásához szükséges (vagy a <strong>kötés</strong>létrejöttekor felszabaduló) energia átlagos értéke, 1 mól anyagra viszonyítva.Elektronegativitás (elektronvonzó képesség), EN: annak az erőnek a mértéke, amellyelegy atom a <strong>kémiai</strong> <strong>kötés</strong>ben lévő elektronokat magához vonzani képes. A Pauling-féle ENskála alappontjai:‣ a lítium EN-értéke 1,0‣ a fluor EN-értéke 4,0A többi atom EN-értékét ezekhez viszonyítva állapították meg.Kötés típusok:Ionos vagy heteropoláros <strong>kötés</strong>: az egyik atom lead, a másik felvesz annyi elektront,hogy a nemesgáz konfiguráció kialakuljon. A <strong>kötés</strong>t elektrosztatikus kölcsönhatáshozza létre. Szén esetében C 4+ , illetve C 4- kellene résztvegyen a <strong>kötés</strong>ben, amienergetikailag kedvezőtlen, így nem is alakul ki ionos <strong>kötés</strong>.Na + Cl Na + ClKovalens vagy atom<strong>kötés</strong>: a két atom megosztja az elektronokat, illetve közösenhasználva alakítja ki a nemesgáz konfigurációt (kolligáció, ellentéte a homolízis)metán etán etén etin (acetilén)Kovalens <strong>kötés</strong> polaritása: a <strong>kötés</strong> apoláris, ha a kötő elektronpár a kapcsolódó két atomhozegyenlő mértékben tartozik (a töltéseloszlás szimmetrikus); ellenkező esetben a <strong>kötés</strong> poláris.A <strong>kötés</strong> polaritását a kapcsolódó atomok elektronegativitásának különbsége (∆EN) alapjánítéljük meg.
12Datív vagy koordinációs <strong>kötés</strong>: a <strong>kötés</strong>t csak az egyik atom elekronjai adják (ellentétea heterolízis):HHHN+ HHN HHHKvantummechanikai értelmezésDe Broglie-féle anyag-hullám elmélet (1924) szolgál alapul, vagyis minden anyagi részecske(pl. elektron) hullámtermészetü is. Erre megadható egy hullámegyenlet (Schrödinger),amelynek csak meghatározott feltételek között van reális megoldása. Az így nyerthullámfüggvények (ψ) valószínűségi függvények és az elektron tartozkódási valószínűségéreilletve energiájára adnak felvilágosítást, kvantummechanikai értelemben megadják azatompályákat (olyan burkolófelületek ahol az elektron 90%-os valószínűséggelmegtalálható). Kiszámítható, hogy a legalacsonyabb energiájuak az 1s és 2s elektronok, ezeka mag körül gömbszimmetrikus töltéseloszlásuak. A 2p elektronok súlyzó szimmetriájuak éstérorientáltak:A molekula létrejöttével a valószínűségi függvény csak közelítő módszerekkel oldható meg,de elfogadhatóan leírja a molekulapályákat (MO).
13A VB (valence bond) módszerA VB (vegyérték elektron) módszer két atom között létrejövő <strong>kötés</strong>t két AO (azonoselőjelű részük közt létrejövő) "átlapolásával" értelmezi (lokalizált <strong>kötés</strong>, vagyis azelektronok lokalizáltak a <strong>kötés</strong> mentén):sspspppp és <strong>kötés</strong>ek kialakulásaA <strong>kötés</strong>tengelyre nézve forgásszimmetrikus <strong>kötés</strong>eket -<strong>kötés</strong>eknek nevezzük. A -<strong>kötés</strong> két s, egy s és egy p, illetve két p AO között is létrejöhet. Ilyenkor a kombinálódó AO-ka létesülő <strong>kötés</strong> tengelyének irányában helyezkednek el.Két p AO a <strong>kötés</strong>tengelyre merőlegesen és egymással párhuzamosan orientálódva islétesíthet <strong>kötés</strong>t. Az így létrejövő <strong>kötés</strong>t -<strong>kötés</strong>nek nevezzük. A -<strong>kötés</strong> gyengébb, mint a -<strong>kötés</strong>.Ellentétes előjelű pályarészek közötti átlapolás nem eredményezi <strong>kötés</strong> kialakulását,ezért a <strong>kötés</strong>tengelyre merőleges p AO és a másik atom s AO-ja, illetve két egymásramerőlegesen orientált p AO között nem létesülhet <strong>kötés</strong>.A és -<strong>kötés</strong> sajátságai:1) Rotáció A -<strong>kötés</strong> körül a kapcsolódó atomok elfordulhatnak, mivel az átlapolásmértéke ettől nem változik (szabad rotáció): pl. alkánok (konformációs izoméria) A -<strong>kötés</strong> esetében az elfordulás az átlapolás csökkenésével, majdmegszűnésével jár. A -<strong>kötés</strong> megszüntetése viszont jelentős energiabefektetéstigényel, ezért a rotáció gátolt: pl. alkének (geometriai izoméria)2) Polarizálhatóság
14 A -<strong>kötés</strong> esetében az elektronsűrűség a <strong>kötés</strong>tengely körül a két mag közöttmaximális. Ezért ez a <strong>kötés</strong> nehezen polarizálható. Fokozottan igaz ez az azonosatomok között létrejött -<strong>kötés</strong> esetében (pl.: C-C). A -<strong>kötés</strong> esetében az elektronsűrűség a <strong>kötés</strong> tengelyét magában foglaló és a<strong>kötés</strong>t létesítő p AO-k tengelyére merőleges sík alatt és felett maximális. Ezért azatommagok erőterétől viszonylag távol eső -<strong>kötés</strong> könnyen polarizálható.Az atomkapcsolódás feltételei:1. A két atommmag kölcsönös vonzást gyakorol a vegyérték elektronok töltésfelhőjére,így közelebb kerülnek egymáshoz mindaddig, míg a magok között fellépő taszításnem érvényesül (a két mag közötti távolságot <strong>kötés</strong>hossznak nevezzük).2. Stabilabb, kisebb energiájú töltésfelhő alakuljon ki. Az energia különbséget <strong>kötés</strong>ienergiának nevezik.3. A vegyérték elektronok ellentétes spinüek legyenek (Pauli elv): ↑↓4. Az atomok közel azonos töltéssűrűségüek legyenek5. A töltésfelhők kellően hatoljanak egymásba.A molekulapálya elméletA molekulapálya-elmélet értelmében egy <strong>kémiai</strong> <strong>kötés</strong> létesítésében a molekulát felépítővalamennyi atom atompályája (AO) részt vesz. Így delokalizált <strong>kötés</strong>ek jönnek létre és akölcsönhatásban részt vevő atompályák számával megegyező számú, diszkrét energiájúmolekulapályák képződnek. E molekulapályák matematikailag az atompályák lineáriskombinációjával (linear combination of atomic orbital rövidítéséből LCAO módszerrel), azaza pályákat leíró függvények összegzésével és kivonásával írhatók le.Matematikailag kimutatható, hogy az AO-ok lineáris kombinációjával (LCAO) levezetett -kötő pálya (bonding orbital) alacsonyabb energiaszintet képvisel, mint az atomorbitálokkülön-külön. Létrejön egy úgynevezett nemkötő pálya is, amely magasabb energiájú és csakgerjesztés esetén tölthető be. Az AO-ok között számos kombinációs lehetőség van a MO-klétrehozására:
15Hibridizáció elméletC: 1s 2 2s 2 2p x 1 2p y 1 . két betöltött pálya, tehát elvileg csak két elektron vehetne részt <strong>kötés</strong>kialakításában. De ismeretes, hogy a szén 4 vegyértékű a vegyületeiben.Metán, CH 4
16A szénatom vegyértékelektron-konfigurációja 2s 2 2p 2 . A hibridizáció-elméletértelmében a 2s pálya egyik elektronja energiabefektetéssel, promócióval az eredetileg benem töltött 2p z pályára kerül és a 2s 1 2p 1 2p 1 2p 1 x y zelektronkonfiguráció alakul ki, majd a négypárosítatlan elektront tartalmazó pálya hibridizációjával négy egyenértékű, a matematikaikeverésből adódóan egymással 109 o 28’ bezáró hibridpálya jön létre. Az így képzett sp 3hibridpályáknak egy résznyi s- és három résznyi p-jellegük van. A négy sp 3 pályán lévőelektron négy hidrogénatommal létesít <strong>kötés</strong>t. Ez a modell, túl azon, hogy a tetraéderes<strong>kötés</strong>irányt a kísérleti tapasztalattal összhangban írja le, tájékoztatást nyújt a szén és ahidrogén között képződő <strong>kötés</strong> erősségéről is. Az sp 3 pálya – nagy p-hányadának (75%)megfelelően – a tér jelentős részébe “kinyúlik” és így a hidrogén 1s pályájával jelentős azátlapolása, ezáltal erős, a <strong>kötés</strong>tengelyre hengerszimmetrikus egyszeres kovalens <strong>kötés</strong>,vagyis -<strong>kötés</strong> létesül.Etán CH 3 CH 3Etén, C 2 H 4sp 2
17A promóciós folyamat ugyanaz mint a metán esetében: 2s 2 p 2 2s 1 2p 1 2p 1 2p 1 x y z. Az s-pályaés két p-pálya (pl.: p x és p y ) hibridizációjával most három ekvivalens, egymással 120 o -osszöget bezáró sp 2 hibridpálya képződik (trigonális geometria), amelyek közül kettő egy-egyhidrogénatommal, egy pedig a másik szénatom egyik sp 2 pályájával létesít -<strong>kötés</strong>t. A kétszénatomon megmaradó, nem hibridizált pálya (p z ) egymással -<strong>kötés</strong>t hoz létre.Etin, C 2 H 2spEbben az esetben is, promócióval a szénatom 2s 1 2p 1 2p 1 x y2p 1 zelektronkonfigurációja jön létre.A 2s 1 és 2p 1 x pályák hibridizációjával két egyenértékű sp hibridpálya létesül, amelyek 180 o -os<strong>kötés</strong>szöget képezve egy egyenesbe esnek (lineáris rendszer). Az egyik sp pálya ahidrogénatomhoz, a másik sp pálya pedig a másik szénatom sp pályájához kapcsolódik. A kétszénatom egy-egy nem hibridizált p y és p z pályája két egymásra merőleges -<strong>kötés</strong>t létesít
18A karbonilcsoport, C=OFormaldehidC: 1s 2 2s 2 2p x 1 2p y1Oxigén: 1s 2 2s 2 2p x 2 2p y 1 2p z 1 .OxigénRezonanciaelméletVannak molekulák és ionok, amelyeknek több, csupán az elektronok helyzetébenkülönböző Lewis-képlete lehet (pl. a karbonátion). Ilyen esetben a rezonanciaelmélet szerint ahipotetikus képletek, az ún. rezonáns határszerkezetek kombinációja (és nem keveréke!) írja lea valóságos molekulát, amelynek tényleges energiaállapota bármelyik határszerkezethez
19tartozó energiaállapotnál alacsonyabb. A karbonátanion esetében három határszerkezetetírhatunk fel:OOOOCOCOCOOOA határszerkezetek rajzolásánál az alábbi szempontok szerint kell eljárni:a) valamennyi képletnek meg kell felelnie a Lewis-elméletnek,b) a párosított és párosítatlan elektronok számának valamennyi határszerkezetben azonosnakkell lenniük.A <strong>kémiai</strong> reakciók felosztása<strong>Kémiai</strong> reakció: molekuláris szinten történő változásFelosztás: a kiindulási vegyület és a keletkező termék szerkezetének összehasonlítása alapján:– Szubsztitúció vagy helyettesítési reakció: valamely molekula atomja vagy atomcsoportjamás atommal vagy atomcsoporttal cserélődik ki.– Addíció vagy egyesülési reakció: két vagy több molekula egyetlen, új molekulává egyesül.– Elimináció vagy kilépéses reakció: valamely molekulából egy vagy több atom, illetveatomcsoport kihasad.– Átrendeződés vagy izomerizáció: a molekulaszerkezet – azaz az atomok, illetveatomcsoportok molekulán belüli kapcsolódása (konnektivitása) változik meg.
20A <strong>kötés</strong> létrejöttének mechanizmusa (egy szerves <strong>kémiai</strong> átalakulás részletekbe menő,<strong>kémiai</strong> vonatkozású története ) és a reakciópartnerek jellege szerint megkülönböztethetünk:– ionos vagy ionos jellegű és– gyökös vagy gyökös jellegű reakciókat.A reakciópartnerek megkülönböztetése a reagens–szubsztrát fogalmakkal történik. A reagenskiválasztása, akár csak két reakciópartner esetében is, megállapodás szerint történik: a szerveskémiában reagensnek azt a komponenst tekintik, amelynek a reakcióban részt vevő centrumanem szénatom; szubsztrát pedig az a komponens, amelynek szénatomján a reakció végbemegy. Amennyiben a támadó reagens reakcióképes centruma is szénatom, úgy a reagens–szubsztrát fogalmak megválasztása önkényes. Attól függően, hogy a reagens a <strong>kötés</strong>létesítésében miként vesz részt, megkülönböztetünk:– nukleofil (magot kedvelő),– elektrofil (elektront kedvelő) és– gyökös reagenseket, illetve reakciókat.A reakciómechanizmusok jelölése:elektronpár mozgásának jelőléseegy elektron mozgásának jelöléseNukleofilek: negatív töltést vagy nemkötő elektronpárt tartalmaznak: HO – , Cl – , NH 3Elektrofilek: elektronhiányos vagy pozítiv töltést tartalmaznak: AlCl 3 , H + , NO 2+Gyökök: párosítatlan elektront tartalmaznak: CH 3 ∙, CH 2 =CH-CH 2 ∙
21SZERVES VEGYÜLETEK CSOPORTOSÍTÁSAAlapváz szerint:SzénvegyületekNyílt láncú (alifás)Zárt láncú (gyûrûs, azaz ciklusos)Telített Telítetlen Izociklusos HeterociklusosalkánokalkénekalkinokAliciklusos Aromás Telített AromáscikloalkánokXXFunkciós csoport szerint:Vegyülettípus Funkciós csoport KötésAlkánC H C CCHC CAlkénAlkinAromásCCCC=nHalogénezett szénhidrogének C-Hlg Alkoholok, fenolok C-OH sp Éterek C-O-C sp TiolokC-SHSzulfidok (tioéterek)C-S-CC-S ( sp 2 , sp 3 )SzulfonsavakC-SO 3 HAminok C-NH 2C-N (sp 3 , sp 2 , sp)
22NitrovegyületekDiazovegyületekDiazóniumsókAzovegyületekAldehidekC-NO 2C N NC N N XHCOO = sp 2KetonokOCKarbonsavakOCOHSavanhidridekOOCOCÉszterekOCOCSavhalogenidekOCHlgAmidokNitrilekHeteroaromásOC NH 2-C≡NNBioszerves kémiaXSzénhidrátokXX = O, S, NAminosavak, fehérjékNukleinsavakGyógyhatású anyagok
23AlkánokC n H 2n+2Az alkánok telített, el nem ágazó, aciklusos szénhidrogének.Az első négynek triviális neve van: metán (gör. mocsárgáz), etán (etil + alkán, 1873), propán(protos pion = első zsír, 19. sz.), bután (butirum = vaj, görög). A többi neve: görög számok +án végződés: pentán, hexán, heptán, oktán, nonán, dekán, undekán, dodekán, stb.Leghosszabb lánc elé írjuk az oldallánc nevét:1 2 3 4 5 66 5 4 3 2 1CH 3 CH 2 CHCH 2 CH 2 CH 3 CH 3 CH CH 2 CH CH CH 3CH 3 CH 3 CH 3 CH 33-metilhexán2,3,5-trimetilhexán109873211089 765 43212,7,8-trimetildekán4-etil-6-metildekánCsoportnév képzés„án‖ végződést „il‖-re cseréljükPl.: CH 3 - = metil, CH 3 CH 2 - = etilSzénatomok rendüsége:primertercierCH 3CH 3kvaternerCH 3 CH 2 CH CH 2 C CH 3szekunderCH 3Alkánok szerkezeteKonformációs izoméria a C-C egyszeres <strong>kötés</strong> mentén elfordulva nyert térbeli elrendeződés
24Etán szerkezeteBután szerkezete:Előfordulás és kinyerésAz alkánok nagy mennyiségben állnak rendelkezésre a természetben, a földgázban éskőolajban, de minden esetben egymáshoz fizikai és <strong>kémiai</strong> tulajdonságaikban közelállóvegyületek elegyeinek formájában. A homológ sor első tagjai (C 1 -C 5 ) megfelelőmódszerekkel tisztán elkülöníthetők a természetes előfordulásokból; a nagyobbmolekulatömegű komponensek tiszta állapotban való előállítása azonban gyakran csakszintetikus úton, laboratóriumi módszerekkel lehetséges.-- A földgázA nyers földgáz - előfordulási helyétől függően - 70-90 % (esetenként közel 100 %) metánt,1-7 % etánt, 0-3 % propánt és 0-4 % magasabb (C 4 -C 6 ) telitett szénhidrogént tartalmaz.
25A világ földgáztermelése évente jelenleg kb. 2600 milliárd m 3 (2003-as adat). Ennek nagyrészét tüzelőanyagként hasznosítják, de a vegyipar (a petrol<strong>kémiai</strong> ipar) is egyre nagyobbmennyiséget dolgoz fel. A földgáz metántartalmából többek között szintézisgázt (CO + H 2 ),hidrogént, acetilént, finom eloszlású kormot állítanak elő.-- A kőolajAz kőolaj (ásványolaj) többnyire sötét színű, sűrűn folyó anyag, amelynek összetétele azelőfordulási helytől függően változik. Megkülönböztetünk paraffin bázisú, intermedier bázisúés naftén bázisú kőolajat (utóbbi főleg telített gyűrűs szénhidrogéneket, ún. nafténekettartalmaz). Egyes kőolajokban viszonylag nagy mennyiségű (30-40 %) aromás szénhidrogénis található. A különböző kőolajok átlagos elemi összetétele a következő határok közöttmozog: 81-87 % C, 10-14 % H, 0-7 % O, 0-6 % S, 0-1 % N. Kis mennyiségben más elemeket(így különböző fémeket) is tartalmazhatnak. A világ évi kőolaj termelése 2003-ban kb. 3800milliárd tonna volt.A kőolaj légköri desztillációjakor a következő frakciókat szokták elkülöníteni:60-200 °C: nyers benzin180-280 °C: petróleum260-360 °C: gázolaj360 °C felett: kenő- és paraffinolajpárlási maradék: petróleumaszfalt (gudron)Krakkolás (hőbontás)Nagyobb molekulatömegű szénhidrogéneknek, alkánoknak nagy nyomáson és magashőmérsékleten való átalakítása kisebb móltömegű és kisebb szénatom számúszénhidrogénekké. Katalizátor jelenlétében nagy nyomáson és hőmérsékleten (2,0-4,0 Mpa,500°C) végzik. A krakkolás folyamán nagyobb részben C 5 -C 10 szénatom számú telített éstelítetlen szénhidrogének keletkeznek dehidrogénezés és láncszakadás következtében. Célja akőolaj energiahordozó vegyületként kevésbé jelentős vegyületeiből fontos energiahordozóvegyületek előállítása (krakkbenzin, krakkgáz). A megfelelő oktánszámú benzin mellett akrakkolás termékeként keletkező vegyületek közül az alkének fontos szerves <strong>kémiai</strong>alapanyagok.
26Fizikai tulajdonságokA nyílt szénláncú alkánok homológ sorozatának első négy tagja gáz-halmazállapotú. A C 5 -C 16szénatomszámú alkánok folyadékok, C 16 felett pedig szilárd halmazállapotúak.OlvadáspontPáros (transz helyezkedés, monoklin)páratlan (cisz helyezkedés, rombos)A páratlan szénatom számú alkánok olvadáspontja alacsonyabb, mint a páros számuaké. Ezutóbbiak jobban helyezkednek el a kristályrácsban, nagyobb a rendezettség, ezért több energiaszükséges a megbontásukhoz. A páratlan szénatom számú alkánok esetében kisebb fokú arendezttség, ezért könnyeben bontható meg a kristályrács.Monoklin (egyhajlású) kristályrendszer: három különböző nagyságú tengelye közül kettőmerőleges egymásra és a harmadik nem 90 fokban metszi a másik kettőt (gipsz, talk, azurit).Kristályos azurit. Aragonit monoklin rombos
27Rombos: a három koordinátatengely egymásra merőleges, de különböző egységhosszúságúak.Szimmetriaelemeinek száma több mint három (anhidrit, aragonit, antimonit, barit, enargit,kalkozin, kén, markazit, nagyágit, olivincsoport).ForráspontAlkánok reakcióiHalogénezés: gyökös láncreakcióKezdőlépés: A C–H <strong>kötés</strong> <strong>kötés</strong>i energiája (414 kJ mol –1 ) sokkal nagyobb mint a Cl–Cl<strong>kötés</strong> <strong>kötés</strong>i energiája (243 kJ mol –1 ), ezért az átalakulás kezdeti lépése a klórmolekulahomolitikus disszociációja.Láncvivő lépések:1. (Endoterm lépés) 2.A második láncvivő lépés exoterm, ezért az első lépés kedvezőtlen volta most megszűnik és ahő elegendő sok metán molekula átalakulásához.Összegzés:
28Lánczáró lépések:Szulfovegyületek előállításaSzulfoklórozás: Reed reakció, foto<strong>kémiai</strong> aktiválás, 30-50 o C, gyökös folyamatA képződő szulfonsav-kloridot elszappanosítják, a termék alkil-szulfonát, kiváló mosó-,illetve nedvesítőszerNaOHRSO 2 Cl RSO 2 ONa + NaCl + H 2 OAlifás nitrovegyületek előállításaAlkánok oxidációjaAz alkánok tökéletes oxidációja erőteljes hőfejlődéssel jár, ezért energiahordozókéntszéleskörűen alkalmazzák a földgázt és a kőolajfrakciókat.2 C n H 2n+2 + (3n + 1) O 2 2n CO 2 + (2n + 2) H 2 OAz oktánszám a benzin nyomástűrésére, illetve öngyulladására vonatkozó mérőszám.Nemzetközileg egységes érték, a benzinkutak töltőoszlopain fel van tüntetve a benzinoktánszáma. Ha nem megfelelő oktánszámú benzint használunk, az a motor kopogását [belsőégésű motoroknál hallható ütemes zaj, amit a levegő-üzemanyag keverék idő előtti
29(kompresszió során bekövetkező) robbanása okoz, azaz egyenetlen járást] idézi elő, amikárosíthatja a motort magát. Az oktánszám adalékanyagokkal (például ólom-tetraetillel, amikörnyezetszennyező hatása miatt már nem használatos) növelhető.Manapság a legtöbb benzinüzemű jármű 95-ös oktánszámú (ún. szuper-) benzint használ.A mérendő benzint izooktánból (izooktán-C 8 H 18 ) és n-heptánból (C 7 H 16 ) készült keverékkelhasonlítják össze. A mérendő benzinnel kompressziótűrés szempontjából azonostulajdonságokkal rendelkező keverék térfogatszázalékban megadott izooktán tartalmátnevezzük a benzin oktánszámának. Tehát például a 95-ös benzin nyomástűrése azonos a 95(V/V)% oktánt és 5 (V/V)% heptánt tartalmazó keverékével.Izooktán (2,2,4-trimetilpentán)Az alkánok ún. irányított oxidációjával értékes vegyipari alapanyagokat: karbonsavakat ésketonokat lehet előállítani. Az oxidációt mangánsók jelenlétében a levegő oxigénjével végzik.OR CH 2 CH 2 R ' O 2R C CH 2 R 'O 2RCOOH + R 'COOHketonkarbonsavA metán parciális oxidációjával szintézisgázt, azaz szén-monoxid és hidrogén elegyét lehetelőállítani.2 CH 4 + O 2 2 CO + 4 H 2A szintézisgázt az ammónia gyártásban és a nagyobb szénatomszámú alkánok elegyének azelőállítására (Fischer–Tropsch-szintézis) használják az iparban.Katalizátorok: Fe, Co, Ni, Ru
30CikloalkánokAz egy vagy több gyűrűt tartalmazó telített szénhidrogéneket cikloalkánoknak vagycikloparaffinoknak nevezzük.MonocikloalkánokEzek a vegyületek csak egy gyűrűt tartalmaznak. Homológ sorozatuk általános képlete C n H 2n .Nevüket a megfelelő normál szénláncú alkán nevéből a ciklo- előtaggal képezzük.ciklopropán ciklobután ciklopentánA vegyületeket gyakran a megfelelő poligonnal ábrázoljuk a szénatomok és a hidrogénatomokfeltüntetése nélkül. A szubsztituált származékok elnevezésénél a gyűrű számozását –amennyiben a szubsztituensek minden esetben azonos helyzetszámot kapnának – azábécérendben első szubsztituensnél kezdjük. A csoportnevekben a szabad vegyértékű atom alegkisebb helyzetszámot kapja.Cikloalkánok szerkezete546312CH 2 CH 31-etil-2-metilciklohexánCH 3CH 345312-metilciklopentán-1-ilA cikloalkánokban az alkánokhoz hasonlóan a szénatomok egyszeres <strong>kötés</strong>ekkelkapcsolódnak össze, mégis ha modellezni akarjuk a vegyületeket, a három és négytagúgyűrűk felépítése tetraéderes szénatomokból nehézségbe ütközik.A 109,5-os <strong>kötés</strong>szögek helyett a síkalkatú ciklopropánban 60, a ciklobutánbanpedig 90 a gyűrűt alkotó szénatomok <strong>kötés</strong>szöge. Ezt a <strong>kötés</strong>szög torzulásából eredő Baeyerfeszültségeta fedőállású hidrogénatomok kölcsönös taszításából származó torziós feszültség(más néven Pitzer-feszültség) tovább növeli.2A ciklopropán esetében olyan mérvű a <strong>kötés</strong>szögtorzulás (49,5), hogy nem valósulhat meg azsp 3 hibridpályák tökéletes átlapolása, ezért a szénatomok közötti maximális elektronsűrűség
31helye nem a két atommag közötti egyenesre, hanem egy körívre esik. Az ilyen <strong>kötés</strong>t hajlítottvagybanán<strong>kötés</strong>nek nevezzük.A ciklobután <strong>kötés</strong>szögtorzulása kisebb (19,5), mivel a vegyület a síkalkatbólkimozdulva csökkenti a torziós feszültséget.A síkalkatú ciklopentánban mindössze 1,5 a <strong>kötés</strong>szögtorzulás. A vegyület a síkból kifordulóboríték, valamint csavart konformáció egyensúlyi elegyeként létezik, ami a torziósfeszültségek csökkenését eredményezi.A tetraéderes szénatomokból feszültségmentesen lehet felépíteni a nem síkalkatú ciklohexánt(másképp ugyanis meglehetősen nagy szög- és torziós feszültség lépne fel).Egyes konformációk energia viszonyai → a szék a legstabilabb
32Fizikai tulajdonságaik hasonlóak az alkánokéhoz, de magasabb a forr-, illetve olvadáspontjuk,mert a formájuk miatt jobban illeszkednek egymáshoz a molekulák. Reaktivitásuk ugyanolyan, mint az alkánoknak, kivétel a feszült gyűrűk, amelyek könnyen reakcióba vihetők.KötésrendszerAlkénekGeometriai izoméria
33H 3 CHCCCH 3HH 3 CHCCHCH 3cisz (zusammen = Z) transz (entgegen = E)but-2-énA transz izomer a stabilabb, mert így a nagyobb csoportok távolabb kerülnek egymástól.Elnevezés az azonos szénatomszámú alkán nevéből vezetjük le, az án végződést én-re cserélve.Számozás: a kettős <strong>kötés</strong> kapja a lehető legkisebb helyzetszámot; ha több kettös <strong>kötés</strong> van,szótő + helyzetszámok + dién, trién, tetraén, stb, kötőjellel elválasztva.CH 2 C CH 2hex-2-én hexa-2,4-dién buta-1,3-dién propadién ciklohexa-1,3-dién(allén)Elágazó szénláncú alkén esetén, az alapvegyület az lesz, amelyik a legtöbb kettős <strong>kötés</strong>ttartalmazza:124 4 1163 55 622-etil-4-propilhexa-1,3,5-triénReakciókHidrogén-halogenid addíció32-metilciklohexa-1,3-dién26535-etilciklohexa-1,3-dién4
34Karbokationok stabilitása: 3º > 2º > 1ºHalogén addícióHidrogénezés
35Oxidációs reakciók: kálium-permanganáttal (Baeyer próba), ozmium tetroxiddal,peroxidokkalAlkének polimerizációjaEténpolietilénDiének
36Terpének A terpének főleg a növények illóolajában fordulnak elő, és az aromájukért felelősek(terpentinolaj a fenyőgyanta alkotója: „terebenthinum‖). A terpének építőköve az izoprén, C 5 H 8 A terpének több izoprén egységből állnak, amelyekre „fej-láb‖ illeszkedés jellemző.CH 2CHCCH 3CH2fej H 2 CCCHláb H 2 CCH 2CHCH 2fejlábCH 3 C CH 3izoprén mircén egyszerűsítettvonalábraCsoportosítás:Monoterpének (C 10 ): két izoprén egységből állnak, lehetnek nyílt láncúak (pl. mircén), vagygyűrűsekCitrusok héja borsmenta kámforfaDiterpének (C 20 ): 4 izoprén egység (fitol, a klorofill alkotórésze)
37Tetraterpének (C 40 ): 8 izoprén egységből állnak, a növényi és állati szervekben elterjedtvegyületek, jelentős szerepük van az életfunkciókban.A látásban van szerepecitromfű illatanyagaAz A-vitamin prekurzora, elővitaminA természetes kaucsuk és a gumiKaucsukfa (Heves brasiliensis) tejszerű nedve, ozonidos lebontással Harries igazolta (1909)az izoprén részek 1-4 addicíóját:
38A guttaperka (más kiejtéssel: guttapercsa) hátsó-indiai fák megszilárdult tejszerű nedve. Agalvanoplasztikában – grafittal bevonva – formaképelésre használják.A kaucsuk nagy rugalmassága a cisz geometriájú olefin <strong>kötés</strong>eknek köszönhető zegzugosszerkezettel magyarázható.H 3 CCH 2CCHCH 2 CH 2 C CH 3 CCH 2 CH 2C CHH 3 CHCH 2 CH 2H 3 CCCCH 2Hazonossági periódusA nyers kaucsuk felhasználása korlátozott, ezért kénnel, töltő- és adalékanyaggal keverve(vulkanizálás) gumivá alakítják.KötésrendszerAlkinok
39Elnevezés: az azonos szénatomszámú alkán nevéből vezetjük le, az án végződést in-re cserélve.Számozás: a hármas <strong>kötés</strong> kapja a lehető legkisebb helyzetszámot; ha több hármas <strong>kötés</strong> van,szótő + helyzetszámok + diin, triin, tetrain, stb, kötőjellel elválasztva.HC CH HC C CH 3 H 3 C C C CH 2 CH 3etin propin pent-2-in(acetilén)Kettős és hármas <strong>kötés</strong> egyidejű jelenlétében: ha választani lehet, a kettős <strong>kötés</strong> kapja a kisebbhelyzetszámot:hex-1-én-5-in hex-1,3-dién-5-in hepta-4-én-1-inReakciók: elektrofil addíciókHidratálásIpari jelentőség
40HC≡CH + HCl ——> H 2 C=CHClHC≡CH + CH 3 CO 2 H ——> H 2 C=CHOCOCH 3HC≡CH + HCN ——> H 2 C=CHCNVinil-kloridVinil-acetátAkril-nitrilA vinil-klorid mérgező tulajdonságú. Keringési zavarokat idézhet elő, a máj és a lépkárosodását okozhatja. (Májrákot hosszabb behatás esetén).Polivinil-kloridból fröccsöntéssel, extrudálással, fúvással állítanak elő különböző eszközöket:vegyipari csővezetékeket, szennyvízcsöveket, korrózióálló edényeket, tartályokat, szellőzőberendezéseket,szerelvényeket, csapokat, szelepeket, kábelbevonó anyagokat,csomagolóanyagokat, padlóburkolatokat, műbőröket.Polivinil-acetát: elsősorban lakkok és ragasztók (pl. az ismert Technokol, illetve faipariragasztó), valamint fóliák alapanyaga.Az akrilnitrilt főként a műanyagipar alkalmazza poliakrilnitril előállítására. A poliakrilnitrilhosszú, fonalszerű molekula, ami az akrilnitril polimerizációjakor keletkezik. Ezt a polimertfőként műszálak gyártására használják. Mesterséges szálasanyagok készítéséhez az akrilnitriltgyakran más vegyületekkel kopolimerizálják. Leggyakrabban poliakrilnitrilből állítják elő aszénszálakat is. A butadién és az akrilnitril kopolimerizációjával műkaucsukot állítanak elő.Ezen kívül az akrilnitrilt akrilsav és akrilamid gyártására is felhasználják.Aromás vegyületekBenzol
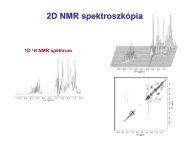
41A benzol elektronszerkezetének különféle spektroszkópiai módszerekkel (UV, IR, NMR ésröntgendiffrakció) igazolt pontos magyarázata Hückel nevéhez fűződik. Értelmezése szerint amolekulapálya elmélet (MO) alapján a benzol három elektronállapota a következő:‣ egyetlen atommag erőterében mozgó elektronok. Ilyenek a szénatom lezárt 1s pályájánlévő elektronpárok;‣ elektronpáronként két-két atommag közös erőterében mozgó elektronok, melyek aszén–szén és a szén–hidrogén közötti -<strong>kötés</strong>eket alakítják ki;‣ az sp 2 -hibridállapotú szénatomok 2p z pályáin lévő elektronok, melyek eloszlása a -váz síkjának két oldalán koncentrálódik és ezek alkotják a molekula -elektronrendszerét.Ennek megfelelően a Hückel-féle molekulapálya-módszer (rövidítve HMO-módszer) szerint abenzolmolekulában elkülönül a -váz és a -elektronrendszer. Az utóbbi a szénatomok 2p zpályáinak kölcsönhatásából (matematikailag lineáris kombinációként) alakul ki, és a hatatompálya (p z ) kombinációjával hat molekulapálya képződik.Az elmélet alapja: a szimmetriafeltételek által megengedett maximális számúatompálya azonos előjellel történő kombinációja. Az atompályák azonos előjelű ún. kötőjellegű kombinációja energetikailag kedvezőbb, mint az ellentétes előjelű pályáké, amelyeklazító jellegűek. A molekulapálya energiája a csomósíkok számának növekedésével nő. Azígy kialakuló molekulapályák szimmetriája megfelel a molekula szimmetriaviszonyainak,vagyis a benzol szimmetriaelemeire vonatkoztatva minden molekulapálya szimmetrikus vagyantiszimmetrikus. A benzolmolekula hat szénatomjához tartozó hat p z -pálya legkedvezőbb,azaz legkisebb energiaértékű kombinációja ( 1 ) úgy valósul meg, hogy a p z -pályák azonosfázisban lépnek kölcsönhatásba egymással, és így az elektronsűrűség minden szénatom felettés alatt azonos.Aromacitás feltételei: planáris (sík) gyűrűs szerkezetközel egyenlő <strong>kötés</strong>távolságokátlapoló p z pályák4n+2 elektron (Hückel szabály), n = 0,1,2, stb.
42Kondenzált aromás vegyületekAromás elektrofil szubsztitúció
43A benzol brómozásaLewis-sav, elektronhiányos
44Az aromás elektrofil szubsztitúció irányítási szabályaiSebesség meghatározó lépés:SSS+E + + + E HE Hátmeneti állapot-komplexaréniumionA szubsztituens típusa szerint: Gyorsabb reakció, ha S elektronküldőSSS+E + + + EHEHstabilizáltátmeneti állapot-komplexaréniumionLassúbb reakció, ha S elektronszívóSSS+E + + +EHEHdestabilizáltátmeneti állapot-komplexaréniumion
45Induktív és mezomer effektusokInduktív effektusEgy <strong>kötés</strong>nek valamily hatásra bekövetkező polarizációja. Lehet –I vagy +I, aszerint,hogy a szubsztituens elektronszívó, vagy elektronküldő a hidrogénhez képest.+I O > COO > CR 3 > CHR 2 > CH 3-I N + R 3 > CX 3 > NO2 > SO 3 R> CHO > COR > COOH > CN> COOR > F> Cl> Br > I,~ OR, OH, ArR S elektronegatív atom, direkt kapcsolódik a gyűrűhöz: F, Cl, Br -S +direkt kifejtett,elektronszívó hatásS atomcsoport, a direkt kapcsolódó atomhoz egy, vagy több elektronegatívabb atomkötődik: N + R 3 , CX 3 , NO2, SO 3 , CHO, COR, COOH, CN, COORMezomer effektusS nemkötő vagy -elektronokat tartalmaz, amelyek képesek megváltoztatni a -elektronrendszer elektroneloszlását.+M: ha növeli az elektronsűrűséget: O > NH 2 , NR 2 , > OH, OR, SH, > F, Cl, Br, IM: ha csökkenti az elektronsűrűséget: nagy elektronegativitású atomot tartalmazó csoportok: COR < CN< NO 2 mezomériával stabilizált szubsztituensek: COOH < COOR pozitív töltésű szubsztituensek: N + R 3 , CH=N + R 2EH+SEH+SMetahelyzetbe irányító csoportok-I, vagy –I és –M effektusok érvényesülnekSO 3 H, CN, CHO, COR, COOH, COOR, COClNO 2 , CF 3 , N + R 3
46CF 3E +CF 3CF 3CF 3EHEHEHfokozottan instabil-komplexCF 3E + CF 3ECF 3CF 3HEHEHCF 3CF 3E + E HCF 3E Hfokozottan instabil-komplexECF 3HAz elektronvonzó szubsztituens minden -komplexre destabilizáló hatást fejt ki, de a metaizomerhezvezető részecske esetében ez kevésbé érvényesül, ugyanis a pozitív töltés nemjelenik meg a szubsztituenshez kapcsolódó szénatomon. Az átmeneti állapothoz vezetőenergia szükséglet itt a legkisebb, tehát a meta-izomer keletkezik a leggyorsabban.Orto- és para irányító csoportok+I, +I és +M, +M, +M > -I effektusok érvényesülnek+I: -R (alkil)+I és +M: -O (fenoxid)+M: Ar (aril)+M > -I: NR 2 , NHR, NH 2 , NHCOR, OH, OR, SRNH 2E +NH 2EHNH 2EHNH 2EHNH 2EHNH 2E + ENH 2NH 2relatív stabil-komplexHNH 2NH 2E HNH 2NH 2E HEHEHNH 2NH 2E + E HEHrelatív stabil-komplex
47A szubsztituens elektronküldő hatása miatt, a -komplexek stabilabbak, mint a benzolbólképződők, így mindhárom izomer gyorsabban képződik. Az o- és p-izomerekhez vezető -komplexben a részleges pozitív töltés megjelenik a szubsztituenst viselő szénatomon is, amiaz elektronküldő hatás miatt fokozott stabilitású lesz. A Hammond-elv szerint az ehhez vezetőátmeneti állapot energiája kisebb, ezért nagyobb mennyiségben képződnek az o-/ p-izomerek.Halogének, nitrozo- és szulfinilcsoportok irányítása-I > +M-I: dezaktiváló hatás; az S E aktiválási szabadenergiája nagyobb, mint a benzol esetében+M: o-, p-helyzetbe való szubsztitúció szabadenergiája kisebb, mint a m-ba szükségesszabadenergia (több mezomer szerkezet)Halogének elektronegativítása: F > Cl > Br > IPolarizálhatóság: F < Cl < Br < IEbből azt várnánk, hogy a fluorbenzol a legkevésbé reakcióképes, de a tapasztalat nem eztmutatja.Reaktivitás: PhH > PhF > PhCl ≈ Br > PhIA magyarázat a fluoratom kicsi méretében keresendő (1s 2 , 2s 2 , 2p x 2 , 2p y 2 , 2p z 1 ): a magányoselektronpárjának és az aromás rendszer -elektronjainak kölcsönhatásából (+M) származóaktiválás ellensúlyozza az elektronegativításból (I) származó dezaktiváló hatást. Ajódbenzolnál az induktív elektronszívás, az atom nagy mérete miatt csökken, olyanmértékben, hogy már alig dezaktivál, ugyanakkor az o-/ p-irányítást a gyengébb mezomer(+M) kölcsönhatás még elősegíti.ClE +ClEHClEHClEHClEHClClClClrelatív stabil-komplexE +EHEHEHClClClClClE + E HEHEHrelatív stabil-komplexEHAlkilcsoportok irányításának értelmezéseo,p-irányítók, a kation hiperkonjugáció révén stabilizálódik. A C + üres p atomorbitáljaátlapolhat a CH -<strong>kötés</strong>sel a szomszédos metilcsoportból, így a pozitív töltés delokalizálódhata hidrogénre.
48delokalizációHEH HCHHsp 3 orbitálHEHCH 2-<strong>kötés</strong>HCH HCHHsp 2 síktrigonálisszénatomAromás vegyületek nevének eredeteNév Származás a MegjegyzésAnilinNH 2Sp, anil,indigóElõször az indigó desztillálásával állították elő; az anil azegyik indigótermelő növény, az Indigofera suffruticosacserje neve.AntracénG, anthrax,szénA kőszénkátrány komponense.BenzolA név arra emlékeztet, hogy a vegyületet benzoesavból iselőállították.FenolOHG, phainen,világítaniA benzol elnevezésére javasolt egyik szóból származik; abenzolt először világítógázból állították elõ a XIX. századelejénFuránOL, furfur,korpaA "furfurán" rövidítése; a furfuránt a furfuroldekarbonilezésével nyerték, ezt pedig a híg kénsavval kezeltkorpa desztillációjával állították elő.HidrokinonA kínasav oxidációjából származó kinon redukciójával
49HOOHállították elő.IndolindigóElõször az indigó bontásából származó oxindoldesztillációjával állították elő.NHKatechinOHOHkatehuA különbözó trópusi növényekbõl kinyerhető, gumiszerűvérzéscsillapító anyag, a katehu (kasu) nevéből származószó.KrezolOHvalószínűlegN, KresolA fakátrány desztillációjakor keletkezõ, égető, füstös ízűolaj, a kreozot nevéből származó szó.CH 3KumolAz Egyiptomban és Szíriában honos növény, a kuminnevéből származó szó.MezitilénCH 3CH 3CH 3A név a "mesite" szóból származik (ez pedig a görögmezosz, között szóból). Valamikor úgy gondolták, hogy a"mesite" nevű folyadék tulajdonságai az alkohol és az étertulajdonságai között vannak; később a vegyületet acetonnaknevezték el. A mezitilén onnan kapta a nevét, hogyelőállítható a "mesite" kondenzációjával.PiridinNPirrolNHRezorcinOHOHG, pira, tûzG, pirro,tûzvörösL, resina,gyantaOl, orcello,lakmuszA csontok pirolízisekor keletkezõ olaj desztillációjávalállították elő.Először vörös színe alapján figyeltek föl rá, amikor a gőzeérintkezésbe lépett a koncentrált sósavval nedvesítettfenyőfa forgácsokkal.A lakmusz különböző zuzmókból kinyerhető lila festék; habizonyos (zuzmókból származó?) gyantákat káliumhidroxiddalömlesztenek meg, rezorcin képződik.SztirolCH CH 2L, styrax,sztóraxElõször a Liquidambar styracifluából és a Liquidambarorientalisból származó balzsam, a folyékony sztóraxdesztillációjával állították elő.
50ToluolCH 3A tolubalzsam desztillációjával állítható elő; ez az illatossárgásbarna gyanta a tolufából származik, melyet akolumbiai Santiago de Tolu tengerpartról neveztek el.XilolCH 3CH 3G, xilon, fa Elõször fakátrányból állították elő.a S: spanyol, G: görög, L: latin, Ol: olasz, N: német.Naftalin8761()Többgyűrűs aromás szénhidrogének2()35 4Csökkent aromás sajátságú, jóllehet az aromacitás feltételei teljesülnek, de a p z -pályákkölcsönhatásából adódó mezoméria energia kisebb, mint a benzol mezoméria energiájának akétszerese.Névmezoméria energiaszámítottmértbenzol - 150naftalin 300 255A fenti megállapításokból adódik, hogy a naftalin reakcióképesebb, mint a benzol.Elektrofil szubsztitúciós reakciókNitrálás:HNO 3AcOH, 50 o CNO 2NO 2Szulfonálás:1-nitronaftalin 2-nitronaftalin(90%) (10%)
51H 2 SO 4 H 2 SO 480 o C 140 o CH()SO 3 HH 2 SO 4SO 3 H140 o Cnaftalin-1-szulfonsav naftalin-2-szulfonsavElőször itt is a kinetikusan kontrollált termék, a naftalin-1-szulfonsav keletkezik, amelymagas hőmérsékleten a termodinamikailag stabilabb naftalin-2-szulfonsavvá rendeződik át.Az -izomer kisebb stabilitását elsősorban a C-8 helyzetű peri-hidrogén és szulfonsavcsoportközötti van der Waals kölcsönhatás (taszítás) okozza.(Sok esetben egy kiindulási állapotból több egymás mellett lefutó reakció is elindulhat.Megfelelően megválasztott alacsony hőmérsékleten ezek közül a legkisebb aktiválásiszabadentalpiájú reakció megy végbe, hiszen a többi reakcióút bejárásához nem rendelkezikelég energiával a rendszer. Az ilyen körülmények között végbemenő reakciót kinetikusankontrolláltnak nevezzük. Ahogy növeljük a reakció hőmérsékletét, egyre több reakcióút válikbejárhatóvá, és elérhetjük azt a hőmérsékletet, amikor a kevésbé stabil termékekvisszaalakulása is elindul. Ugyanakkor, a legstabilabb termékek változatlanok maradnak,hiszen a belőlük kiinduló reakcióknak van a legnagyobb energiagátja. Az ilyen hőmérsékletentartott reakcióelegyben leggyorsabban ekkor is a legkisebb aktiválási szabadentalpiávalrendelkező reakció megy végbe, de az oda-vissza alakulások eredményeképp idővel alegstabilabb termék dúsul fel, vagy válik egyetlen termékké. Az ilyen körülmények közöttvégbemenő reakciót termodinamikusan kontrolláltnak nevezzük.)Addíciós reakciókOk: konjugált dién jelleg az egyik gyűrűben, valamint addíció után a nem érintett gyűrűbenbenzoid rendszer kialakulásaNaEtOH, Nai-C 5 H 11 OHdialintetralinBr 2BrBrBr 2BrBrBrBr1,4-dibróm-1,4-di- 1,2,3,4-tetrabróm-1,2,3,4-hidronaftalin tetrahidronaftalin
52Oxidációs reakciókMár enyhe körülmények között is lejátszódnak, ami bizonyítja a kevésbé kifejezett aromásjelleget.CrO 3AcOH, OCOOHK 2 Cr 2 O 7H 2 SO 4 , COOHO1,4-naftokinon ftálsavKötésrendszer, dipólus momentumHalogénezett vegyületekCsoportosítás1. Halogénatomok száma szerint: mono, di, tri,….poli2. A halogén viszonylagos helyzete szerint:C HlgHlgCCHlg HlgC (CH 2 ) n CHlgHlggeminális vicinális diszjunkt n ≥ 13. A halogént viselő szénatom rendűsége szerint:CH 3 CH 2 CH 2 Hlg (CH 3 ) 2 CH Hlg (CH 3 ) 3 C Hlgprimer (1 o ) szekunder (2 o ) tercier (3 o )4. A szénhidrogénváz jellege szerint:a.) alifás telítetttelítetlenb.) aliciklusosc.) aromásaril-halogenidek (Ar-Hlg)vinil-halogenidek (CH 2 =CH-Hlgallil-halogenidek (CH 2 =CH-CH 2 -Hlg)
53benzil-halogenidek (PhCH 2 -Hlg)ElnevezésSzubsztitúciós nomenklatúraAlapnév + fluor-, klór-, bróm- vagy jód előtagBrClBr Cl N2-klórciklohexán 1-bróm-4-klórbenzol 2-brómpiridinCsoportfunkciós nomenklatúra<strong>Szerves</strong> csoportnév + kötőjel + fluorid, klorid, bromid, jodid csoportnév (előttüksokszorozó előtag)CH 3 IBrBrBrmetil-jodid benzil-bromid etilén-dibromidAlifás halogénvegyületek előállításaAlkánok, cikloalkánok gyökös szubsztitúciójával (ld. előbb)Telítetlen szénhidrogének elektrofil addíciós reakciójával (ld. előbb)Alkoholokból a hidroxilcsoport cseréjévelHgyorsR OH + HX R CH 2 OHAromás halogénvegyületek előállítása Elektrofil szubsztitúcióval (ld. előbb)Xlassú- H2 ORCH 2 Xoxóniumion karbéniumiongyRCH 2 XFizkai sajátságokVízzel nem elegyednek, de sok szerves anyagot oldanak, különösen a zsírokat. Ezérttisztítószerként alkalmazzák őket. Narkotikus sajátságúak, nem gyúlékonyak.Halogénvegyületek reakcióiInduktív effektusEgy <strong>kötés</strong>nek valamily hatásra bekövetkező polarizációja. Lehet –I vagy +I, aszerint,hogy a szubsztituens elektronszívó, vagy elektronküldő a hidrogénhez képest.
54-I s F> Cl> Br > I statikus polározottság-I d I > Br > Cl > F dinamikus polározhatóság: a jód könnyebben polarizálható, mertnagy térkitöltésű, a külső elektronhéj kisebb magvonzás alatt áll. Ebben a sorrendbenlecserélhetők a halogének más csoportokra, azaz nukleofilekre. A <strong>kötés</strong> a szén és a halogénkülönböző elektronegativitása miatt polarizált:C X NukleofilekO-nukleofilek: H 2 O, OH¯, RO¯, RCOO¯S-nukleofilek: H 2 S, SH¯, RS¯, ¯SCN, R-S-RN-nukleofilek: NH 3 , NO 2¯, N 3¯ (-N=N + =N¯C-nukleofilek: CN¯, HC≡C¯Nukleofil szubsztitúciós reakciókEzek a reakciók a <strong>kötés</strong> polarizáltságának következményei. Kétféle mechanizmus szerintjátszódhatnak le: bi-, illetve monomolekuláris folyamatban.Bimolekuláris átalakulás (S N 2 mechanizmus)R 2R 3R R 3R 2 3 R 2lassúY + C XY - C + X - gyorsY C + XgyorsR lassú1R 1Például:R 1Királis szubsztrátum esetén: konfiguráció változás (Walden inverzió)(R)-2-brómbután(S)-bután-2-ol
55A nukleofil, Y¯ a kilépő csoporttal X¯ ellentétes oldalról támad. A trigonális bipiramidálisgeometriájú átmeneti állapotban a nukleofil részben már kötődik a reakciócentrumhoz,miközben leszorítja a kilépő csoportot, amely részben már disszociált. Az új <strong>kötés</strong>t a nukleofilkét elektronja alakítja ki, míg a távozó csoport elviszi a felszakadó <strong>kötés</strong> elektronjait. Ebbenaz esetben a reakció aktiválási energiája G # jelentősen függ a nukleofil és a szubsztrátumreakciókészségétől, hiszen mindkettő aktív résztvevő a folyamatban. A reakció bimolekuláris,tehát a reakciósebesség mindkét komponens koncentrációjának függvénye:v = -k[halogenid][Y¯]k = másodrendű sebességi allandóMonomolekuláris átalakulás (S N 1 mechanizmus)R 2C XR 1R 3lassúgyorsR 2 R 3C +R 1X -YXR 2R 3CR 1Y (gy)lassúR 2R 3Y C +R 1R 2R 3C YR 1R 3 R 2 2 R 3Y C +RC YR 1R 1Például:inverzió retencióracemizáció
56E reakciók két lépésben játszódnak le. Első lépésben a kilépő csoport elhagyja aszubsztrátumot, és egy karbokationos intermedier képződik. A második, gyors lépésben, anukleofil lép be, és kialakul a termék. Ebben az esetben a reakció sebessége csak a kilépőcsoport távozó képességétől függ. Mivel az aktivált komplex szerkezete „intermedierszerű‖,az aktiválási energia a karbokation stabilitásától függ. Amennyiben a karbokation stabilizált(pl. rezonancia által vagy elektronküldő csoportok részvételével), a mechanizmuskedvezményezett lesz. A karbokation síktrigonális szerkezete folytán, a nukleofil egyenlőeséllyel támadhatja bármelyik oldalról, ebből kifolyólag racém elegy lesz a termék (ha aszubsztrátum optikailag aktív volt).A reakció elsőrendű kinetikájú, tehát a sebesség csak a szubsztrátum koncentrációjátólfügg:v = -k[halogenid]Karbokationok stabilitási sorrendje: benzil ≈ 3 o >allil > 2 o > 1 oA nukleofil szubsztitúciót befolyásoló tényezőkAz R csoport szerkezete:S N 1: 3 o > 2 o > 1 oS N 2: 1 o > 2 o > 3 oA kilépő csoport tulajdonságai (X¯): Minél gyengébben kötődik, annál jobb kilépő csoport, I > Br > Cl > F Minél erősebb bázis X¯, annál kevésbé lehet kicserélni (OH¯,OR¯, SH¯, NH 2 rosszkilépők)A belépő csoport tulajdonságai (Y¯): S N 1 reakcióban nincs szerepe
57 S N 2 reakcióban fontos szerepe van: minél polarizálhatóbb a nukleofil, minél kisebb azelektronpárt szolgáltató atom elektronegativitása, annál nukleofilebb a reagens (I > Br> Cl > F)Az oldószer szerepe: S N 1: protikus oldószerek kedvezők, mert mint az aniont, mint a kationt szolvatálják (aC-Hlg <strong>kötés</strong> heterolíziséhez szükséges energiát a képződő karbéniumion éshalogenidion szolvatációs hője fedezi): víz, alkoholok, szerves savak. S N 2: aprotikus oldószerek kedvezők, mivel ezek az aniont nem szolvatálják. Ezek azun. meztelen anionok nagyon reakcióképesek lesznek. A szolvatáció a nukleofilekalapállapotát jobban stabilizálja, mint az átmeneti állapotot. Ez növeli a reakcióaktiválási energia igényét. Tehát ha a nukleofilnek át kell törnie a szolvatációs burkot,vagyis a deszolvatációs energia is növeli a reakció aktiválási energiáját. Aprotikusoldószerek pl. aceton, dimetilformamid, dimetilszulfoxid.Eliminációs reakciókAz alkil-halogenidek és helyzetű szénatomján levő hidrogének környezetében csökkentaz elektronsűrűség a halogénatom elektronvonzó tulajdonsága miatt, ezért ezek a hidrogénekprotonként aránylag könnyen lehasíthatók. -Elimináció esetén alkén keletkezik.Az eliminációt bázisokkal váltjuk ki, és látható, hogy kétféle termék keletkezik: egy láncvégialkén (kisebb mennyiségben, un. Hofmann termék), és egy szubsztituáltabb alkén (Zajcevtermék), amelyik a stabilabb átmeneti állapoton keresztül jön létre (zöld E # ). A folyamatszinkron, vagyis a proton és a halogén lehasadása, valamint a kettős <strong>kötés</strong> kialakulásaösszehangoltan történik. Ez a bimolekuláris elimináció, E2. Feltétele a lehasadó csoportokantiperiplanáris állása.
58RRHClRHHOHORRHClRH- H 2 O- ClRRRHE1 mechanizmusXCHClassú- X - C CHgyors, E 1- HCCintermedierLátható, hogy első lépésben karbéniumion alakul ki, a halogén kilépésével, ami lassúfolyamat. Ezután, gyors lépésben, a proton kilépése következik, az általa visszahagyottelektronpár alakítja ki a kettős <strong>kötés</strong>t.Az S N és E reakciók konkurens folyamatok, számos körülmény befolyásolja lefutásukat:hőmérséklet, oldószer, szubsztrátum szerkezete.
59Halogenidek átalakítási reakcióinak összefoglalásaFontosabb halogéntartalmú vegyületekMetil-bromid: növényvédőszer, erősen mérgező, mutagén, rákkeltő (metilezőszer)Kloroform: erősen párolgó (fp. 61 o C), jellegzetes szagú folyadék. Fény hatásáraoxigén jelenlétében bomlik (foszgén és sósav keletkezik). Régebben altatószerkénthasználták, de májkárosító hatása miatt ma már nem alkalmazzák.Szén-tetraklorid: jó apoláros oldószer, korábban tűzoltásra is használták. Azózonpajzsot károsítja.Freonok (fluorklóralkánok): kellemes illatú, kevéssé reakcióképes vegyületek.Hajtógázként, hűtőgépekhez, légkondiciónálókban hűtőközegként használták, ma márnem engedélyezett alkalmazásuk ózonkárosító hatásuk miatt.Halonok (brómfluoralkánok) tűzoltásra használták, de ózonkárosító hatásuk miattbetiltották.Etil-klorid: nagy párolgáshőjű folyadék, fagyasztásos fájdalomcsillapításra használják.Vinil-klorid: a PVC monomereTetrafluoretén: a teflon monomereTriklóretén: vegytisztításRovarírtószerek: DDT, lindán (hexaklórciklohaxán), adrin, dieldrin. Biológiai útonnem bomlanak le, felhalmozódnak az eélő szervezetben, ezért betiltották őket.Meddőséget, rákot okozhatnak, a magzatot is károsítják.
60Cl CH ClClClClClClCCl 31,1,1-triklór-2-bisz(4-klórfenil)etán (DDT)Clhexaklórciklohexán (-HCH)ClClClClClClOClClClClaldrindieldrinHalogénezett vegyületek kimutatásaEtanolos ezüst-nitrát tesztAcetonos nátrium-jodid tesztBeilstein próba: rézdrót, lángfestés (zöld): klór, bróm, jód esetébenHidroxivegyületekKötésrendszerAz oxigén sp 3 hibridállapotú: 1s 2 2s 2 2p x 2 2p y 1 2p z 1 → 1s 2 2h 1 2 h 2 2 h 3 1 h 41
61A két magános elektronpár a tetraéderes elrendeződést deformálja, így a vegyértékszögnem 109 o lesz, mint a szénnél, hanem kisebb. Víz esetében 104,5 o , alkoholoknál 108 o .Csoportosítás1. Hidroxilcsoportok száma szerint (értékűség): mono, di, tri,….polialkoholok2. A hidroxilcsoportok viszonylagos helyzete szerint:C OHOHCHOCOHHOC (CH 2 ) n COHgeminális vicinális diszjunkt n ≥ 13. A hidroxil csoportot viselő szénatom rendűsége szerint:CH 3 CH 2 CH 2 OH (CH 3 ) 2 CH OH (CH 3 ) 3 C OHprimer (1 o ) szekunder (2 o ) tercier (3 o )4. A szénhidrogénváz jellege szerint:a.) alifás telített CH 3 CH 2 OHtelítetlen enolok (CH 2 =CH-OH)inolok (HC≡C-OH)b.) aliciklusosciklohexanolc.) aromásfenolok (Ar-OH)Nevezéktan (alkoholok és fenolok)Szubsztitúciós név:Alapnév + ol, diol, triol, stb.CH 3 OH CH 3 CH 2 OH OHmetanol etanol fenolHa az OH-nál magasabb rangú csoport van a molekulában, „hidroxi‖ előtagként nevezzükmeg.
625OH5-hidroxioktanal1CHOCsoportfunkciós nomenklatúra:Alapvegyület, mint csoportnév + kötőjel + alkohol funkciós csoportnévCH 3 CH 2 OHOHCH 2 OHetil-alkohol szek-butil-alkohol benzil-alkoholAlkoholokElőállítása) Ipari módszerekZnO / Cr 2 O 3CO + 2H 2400 o C, 300 atm CH ox.3OH CH 4szintézis gázHCCHCH 2 CH 2szénhidrátok (C n H2 n O n )Hg 2+ / H 2 SO 4CH 2 CH OHH 2 O, H 3 PO 4, pélesztõ / -CO 2CH 3 CHO Re(Ni) / H 2CH 3 CH 2 OHb) Természetes eredetű észterek hidrolízisével Viaszok: nagy szénatom számú, nyíltláncú alkoholok + savakZsírok: glicerin + savakRCOOR'1. OH / H 2 O / RCOOH + R'OH2. H / H 2 Oc) Laboratóriumi módszerekAlkének hidratálásaAlkének merkurálása-demerkurálása
63Alkil-halogenidek hidrolíziseFémorganikus vegyületek és aldehidek és ketonok reakciójaAldehidek és ketonok redukciójaÉszterek redukciójaFizikai tulajdonságoka) VízoldhatóságOHH HOH R OHH HOOHHhidrogén <strong>kötés</strong>ekR = Me, Et, Pr, terc-Bun-Bu csak 8%-banA hidrogén<strong>kötés</strong> kialakulásának oka a <strong>kötés</strong>ek nagyfokú polaritása. A H atomelektronsűrűsége lecsökken, míg az O atomon nagyobb lesz az elektronsűrűség, így amolekulákból assszociátumok jönnek létre. Az asszociáció megszüntetése energia befektetéstigényel, így érthető, hogy az alkoholok olvadás- és forráspontja magas.
64b) Amfoter tulajdonság: savként, valamint bázisként is viselkedhetROH + HClROH 2 + Clbázis sav konjugáltsav(oxóniumion) bázisROH + HO RO + H 2 Osav bázis konjugáltbázis (alkoholát) savAz alkoholok gyenge savak, a víz erősebb sav, ezért alkáli-hidroxidokkal nem lehetalkoholátokat képezni. Ezeket alkohol és alkálifémek (vagy kalcium, magnézium,alumínium) reakciójával nyerhetjük:2 EtOH + 2 M 2 EtO M + H 2Hajtóerő: a molekuláris hidrogén távozása a rendszerbőlAlkoholok abszolutizálása (vízmentesítése):2 EtOH + Mg (EtO ) 2 Mg 2+ + H 2H 2 OEtOH + Mg(OH) 2Alkoholok reakcióiSzubsztitúcióHX-el
65SzubsztitucióSOCl 2 –alTozilátokelőállítása(továbbiszubsztitúcióhoz)Átalakítás éteréÁtalakításészteréSavkatalizáltadehidratálásOxidációkarbonilvegy.-éAlkoholok kimutatása1. Lucas próba: megkülönböztetés rendűség szerint. A reagens sósavas cink-klorid,ZnCl 2 /koncentrált HCl. A tercier alkoholhoz való hozzáadása után, azonnal két fázisjelenik meg. A szekunder alkohol lassabban reagál, ezért rövid melegítés után, kb. 10perc múlva jelenik meg két fázis. A primer alkohol nem reagál. Heterogén fázis vagyemulzió megjelenése pozitív próba. A teszt idő- és hőmérsékletfüggő.OHHClZnCl 21 o alkoholOHHClZnCl 2Cl+ H 2 O (10 perc)2 o alkohol nem oldódikOHCl+ H 2 O (azonnal)3 o alkohol nem oldódik
662. Krómsavas teszt. A primer és szekunder alkoholokat lehet megkülönböztetni atercierektől. Krómsavval (Bordwell-Wellman reagens) a primer alkohol aldehiden keresztülkarbonsavvá oxidálódik, míg a szekunder alkohol ketonná. A tercier alkohol nem reagál. Areagens narancssárga színe zöldeskékre vált.3 CH 3 CH 2 OH + 4 H 2 CrO 4 + 6 H 2 SO 4 → 3 CH 3 CO 2 H + 2 Cr 2 (SO 4 ) 3 + 13 H 2 O1 o alkohol narancs karbonsav zödeskék3 (CH 3 ) 2 CHOH + 2 H 2 CrO 4 + 3 H 2 SO 4 → 3 (CH 3 ) 2 C=O + Cr 2 (SO 4 ) 3 + 8 H 2 O2 o alkohol narancs keton zöldeskék(CH 3 ) 3 COH + H 2 CrO 4 + H 2 SO 4 → nincs reakció3 o alkohol narancs narancsszínű marad3. Jodoform teszt. Etil-alkoholra és CH 3 -CH(OH)-R szerkezetű alkoholokra jellemző. Ajód átmenetileg acetaldehiddé, ill. ketonná oxidálja az alkoholt, ami tovább oxidálódikkarbonsavvá és sárga csapadékként megjelenő jodoformá.OHR C CH 3HFenolokO+ 4 I 2 + 6 NaOHR C O - Na ++ 5 NaI + 5 H 2 O + HCI 3iodoformyellow pptCsoportosításA hidroxilcsoportok száma szerint történik:OHOHOHOHOHOHOHOHOHOHfenol benzol-1,2-diol benzol-1,3-diol benzol-1,4-diolpirokatechin rezorcin hidrokinonIpari előállítások1.OHbenzol-1,2,3-triolpirogallolHOOHbenzol-1,3,5-triolfloroglucinS N Ar, NaOH, 300-350 o C, savas feldolgozás, legrégibb módszer, addició-eliminációsmechanizmus, SO 3 2- a távozó csoport2.
67S N Ar, NaOH, 350 o C, savas feldolgozás, elimináció-addíciós lépések, arin mechanizmus3. Kumol peroxidos oxidációja, olcsó, két főtermékLaboratóriumi eljárás: anilin diazotálása, majd elfőzés<strong>Kémiai</strong> tulajdonságoka) Amfoter jellegűek, de a fenol erősebb sav, mint az alifás alkohol, mert aképződő fenolátion rezonancia stabilizált (a savasság fokozható elektronszívó csoportokbevitelével o, p-helyzetbe, pl. NO 2 )b) ReakciókAromás elektrofil szubsztitúció: könnyebben lejátszódik, mint a benzol esetében, ahidroxilcsoport aktiváló hatása miatt
68Acilezés:C-acilezés: S E Ar, stabilabb termék, termodinamikai kontroll, AlCl 3 katalizátor + acilezőszerO-acilezés: S N Ac, gyorsabb reakció, kinetikai kontroll, sav vagy bázis jelenlétébeKolbe-Schmidt reakció: szalicilsav előállításWilliamson éter szintézisOxidációMűgyanta előállítás: bakelit (térhálós), Leo Hendrik Baekeland
69(1863-1944) 1907Természetes fenolok:Timol (kakukkfű)Rezveratrol(gyümölcsök)Fenolok kimutatásaReakció brómos vízzel vagy jóddal: 2,4,6-trihalogénezett fenol keletkezik, amicsapadékként kiválik.IOHOH+ 3 I 2 + 3 HII IFenolok savassága. A fenolt karbolsavnak is nevezik, mert gyenge sav, és rögtön feloldódiklúgban.
70OH O - Na ++ NaOH + H 2 OFerriklorid teszt. Vas(III)-klorid vizes oldatával a fenolok szerkezetüktől függően színesoldatot adnak: zöld-lila.NevezéktanÉterekÁltalános képlet: ROR’, illetve RSR’a.) Szubsztitúciós név:R’O, R’S előtag + RH alapvegyületb.) Csoportfunkciós név:betűrendben, kötőjellel elválasztva az R, R’ csoport neve + kötőjel + éter/szulfidfunkciós csoportnévO(S)O(S)ClO(S)a.) 1-propoxi(propilszulfanil)pentán 1-etoxi(etilszulfanil)-2-klóretán etoxi(etilszulfanil)eténb.) propil-pentil-éter(szulfid) etil-(2-klóretil)-éter(szulfid) etil-vinil-éter(szulfid)Ciklusos étereka.) heterociklusos vegyületkéntb.) epoxi mint elváló előtag, + alapnévc.) alapnév + oxid funkciós csoportnévO32O1342516O7a.) oxirán 2-etil-2-metiloxirán 7oxabiciklo[4.1.0]heptánb.) 1,2-epoxi-2-metilbután epoxiciklohexánc.) etilén-oxid ciklohexén-oxidElőállítása) Williamson-szintézis
71b) Alkoholok savkatalizálta dehidratálásaOHH 2 SO 4 +OOSOOHS N 2EtOHODe ha az alkohol szterikusan gátolt, elimináció játszódik le.OHH 2 SO 4OH 2- H 2 OHHE1- HHCiklusos éterekOOOtetrahidrofurán 1,4-dioxán oxiránO18-korona-6 komplex fémion hidratálásaAz éterek jó komplexképző vegyületek, az oxigén nemkötő elektronpárja koordinálódhatelektronhiányos részecskékre (Grignard vegyületek így válnak oldhatóvá). A koronaéterekképesek bezárni a megfelelő méretű kationokat a gyűrűjükbe, ezáltal az anion szabaddá válik(„meztelen anion‖) és reakcióképesebb lesz, valamint oldhatóvá is teszik a ionos szervetlenvegyületeket apoláros szerves oldószerekbe. Pl. a kálium-permanganát, 18-korona-6segítségével, benzolba oldhatóvá válik („lila benzol‖).
72K MnO 4NitrovegyületekNitrovegyületek levezetése:OHO NOsalétromsavHO N OsalétromossavRNOORONOOR N O R O N Onitrovegyület(nitroalkán)salétromsav-észter(alkil-nitrát)nitrozovegyület(nitrozoalkán)salétromossav-észter(alkil-nitrit)ElnevezésCsak szubsztitúciós nomenklatúraNitro-, nitrozo előtag + alapvegyületO 2 NNO 2CH 3 NO 2NO NO 2nitrometán nitrozobenzol 1,3-dinitrobenzol (preferált) 2-nitronaftalino-dinitrobenzolElőállítás:Alifás vegyületek: lásd alkánokAromás vegyületek: elektrofil szubsztitúció
73NO 2füstölgő HNO 3NO 2HNO 3H 2 SO 460 °CH 2 SO 4100 °CNO 2NO 2 BF 4FSO 2 OHNO 2 O 2 N NO 2A trinitrotoluol (más néven trotil vagy TNT) gyakran használt robbanóanyag. A toluolnitrálásával állítható elő.CH 3cc H 2 SO 4O 2 NCH 3NO 2füst. HNO 3NO 2Eltérően a nitroglicerintől, a finomított trinitrotoluol elég stabil és nem annyira robbanékony.Nyílt lánggal meggyújtható, ekkor lassan és kormozva elég. Gyutacssal nem indítható(gyutacsérzéketlen), ezért detonátor segítségével lehet használni, ellentétben a már kis ütéshatására is robbanó nitroglocerinnel. A robbanás mértékét a képződő gázok nagy feszítő erejeokozza (H, N, CO 2 ).Fizikai tulajdonságokA nitrovegyületek forráspontja és olvadáspontja – a nitrocsoport jelentős dipólus momentumakövetkeztében kialakuló erős dipól-dipól kölcsönhatásai miatt – jóval magasabb a megfelelőszénhidrogénekéhez és azok más monoszubsztituált származékaihoz képest.A nitroparaffinok színtelen, jellegzetes illatú, általában bomlás nélkül desztillálhatóvegyületek. Vízben alig, vagy egyáltalán nem oldódnak, viszont lúgban oldódnak és többnyireszerves oldószerekkel is jól elegyednek. A mononitro-származékok általában színtelenek, atöbb nitrocsoportot tartalmazó származékok sárga színűek.Az aromás nitrovegyületek többsége szobahőmérsékleten szilárd, kristályos anyag –kivétel a nitrobenzol, mely folyadék, forráspontja 207 C. A nitrocsoportok számával azolvadáspont általában nő. Vízben alig, tömény salétromsavban és számos szerves oldószerbenviszont jól oldódnak.RedukcióAz alifás nitrovegyületek könnyen redukálhatók a megfelelő alkil-aminná. Enyhe, szelektívredukció esetén közbenső termékként N-alkil-hidroxilamin nyerhető.Zn / HClR-NO 2 R-NH 2-34 oNa / NH 3 foly.R-NH-OH
74Az aromás nitrovegyületek nitrocsoportja is könnyen redukálható. A redukció körülményeitőlfüggően a nitrobenzol reduktív átalakítása többféle, esetenként elkülöníthető terméken átvezet anilinhez. A redukció erősen savas közegben, például Béchamp-redukcióval, azaz olcsóvasforgáccsal híg sósavas közegben, továbbá gyengén savas közegben, semleges vagy lúgoskörülmények mellett, valamint katalitikus hidrogénezéssel is elvégezhető.NO 2savasközegFe/HCl; vagy SnCl 2 /HCl;vagy H 2 /NiNH 2nitrobenzolanilinlúgosközegsemlegesközegNONH OHkat./H 2Na/EtOHnitrozobenzolfenilhidroxilaminONNNNNH NHazoxibenzolazobenzolhidrazobenzol(difenilhidrazin)Természetes vegyületekAminok
75Foltos bürök kávécserje dohányConium maculatum Coffea arabica Nicotiana tabacumMák Légyölő galóca NadragulyaPapaver somniferum Amanita muscaria Atropa belladonnaElnevezésRNH 2 , RR’NH, RR’R‖N típusú vegyületekPrimer aminoka.) RH alapvegyület + amin (főcsoportot jelölő utótag), (szubsztitúciós művelet)b.) R-csoport + kötőjel + amin funkciós csoportnév (csoportfunkciós nomenklatúra)4NH 2NH2 22 2 5ONNH111a.) propánamin benzofurán-2-amin kinolin-3-amin imidazol-4-metánaminb.) propil-amin (benzofurán-2-il)-amin (kinolin-3-il)-amin (imidazol-4-ilmetil)-aminHa az NH 2 - nem főcsoport, akkor „amino‖ előtagként használjuk:3HOOC NH 2HO4-aminobenzoesav54132NH 234NH 23-aminobutanol34N NH 2
76Szekunder és tercier aminokSzimmetrikus aminok: R 2 NH, R 3 Nb.) „di‖ vagy „tri‖ + csoport neve + kötőjel + amin funkciós csoportnévNH (CH 3 CH 2 ) 3 N (ClCH 2 CH 2 ) 2 NHdifenil-amin trietil-amin bisz(2-klóretil)-aminAszimmetrikus aminok: RR’NH, R 2 NR’, RNR’R‖a.) az alap primer amin N-szubsztituált származékab.) R, R’, R‖ csoportok (megfelelő sokszorozó taggal ellátva, egymástól kötőjellelelválasztva, betűrendbe sorolva) + kötőjel +amin funkciós csoportnévClNHNNC 6 H 5a.) N-(2-klóretil)propán-1-amin N-etil-N-metilbután-1-amin N-etil-N-propilanilinb.) (2-klóretil)-propil-amin butil-etil-metil-amin etil-fenil-propil-aminKötésrendszerAz aminok szerkezetét a nitrogénatom sp 3 hibridizációjának megfelelő trigonálispiramisos geometria jellemzi, az N–C vegyértékszögek értéke pedig közelítőleg 108.Fizikai sajátságokAz aminoknak (miként az alkoholoknak) sokkal magasabb a forráspontjuk, mint ahasonló molekulatömegű szénhidrogéneknek. A kis szénatomszámú aminok polárisjellegükből adódóan egymással dipol–dipol kölcsönhatásba lépnek, illetőleg
77hidrogén<strong>kötés</strong>eket képeznek. Ezek – a szénhidrogénekre nem jellemző – intermolekuláriskölcsönhatások okozzák a szénhidrogénektől jelentősen eltérő fizikai tulajdonságokat. Azintermolekuláris hidrogénhíd kötődések az aminokban gyengébbek, mint az alkoholokban.(nitrogén kisebb méretű, a vegyérték elektronok és a nemkötő pár nagyobb magvonzás alattállnak).R 1R 2NHR 1NO H OH R 2 RRHamin alkoholAz alacsonyabb szénatomszámú aminok vízben jól oldódnak (jobban, mint azalkoholok és az éterek, mert a nitrogénatom jobb protonakceptor, mint az oxigén), a nagyobbszénatomszámúak (pl. az aromás aminok) esetében a szénhidrogén-maradékok hidrofóbjellege kerül túlsúlyba és ezért az oldhatósága romlik. Az aminok szerves oldószerekben jóloldódnak. A kvaterner ammónium vegyületek és a különböző rendű aminok ammóniumsóiionos szerkezetük révén vízben általában jól, szerves oldószerekben kevésbé vagy egyáltalánnem oldódnak.Az aminok kellemetlen szagú vegyületek (pl. a bomló hal szaga származikaminokból). A szagra való utalás sok esetben az amin nevében is tükröződik A bután-1,4-diamin triviális neve: putreszcin (putresco: megrothad), a bután-1,5-diamin triviális neve:kadaverin (cadaver: hulla).Az aminok bázicitásaGázfázisban szolvatáció hiányában a bázicitást a szubsztituensek elektronos hatása határozzameg. Elektronküldő csoportok növelik a nitrogénatom elektronsűrűségét és így a bázicitást is.Bázicitás növekvő sorrendje gázfázisban:R>R > NR>> NH>R > NH 2 > NH 3>RROldat fázisban – így vízben is – mindezen túl a dipol–dipol kölcsönhatás és hidrogén<strong>kötés</strong>hatása is érvényesül.HHH 3 CNHXH 3 CNHXdipól-dipólkölcsönhatásHHOHHHOHhidrogén<strong>kötés</strong>Vizes közegben az alkilcsoportnak kettős hatása van az ammóniumionra. Egyrésztelektronküldő sajátsága révén elősegíti a töltésdiszpergálódást, s így az iont stabilizálja,
78másrészt nehezíti az oldószermolekula hozzáférését, azaz a szolvatációt. E két hatás eredőjealakítja ki az adott amin bázicitását. Az ammóniumion egyetlen hidrogénjének metilcsoportratörténő cseréje közelítőleg egy egész egységgel növeli a bázicitást. A második hidrogénnek acseréjekor azonban a bázicitás már nem változik, mivel a stabilizáló és destabilizáló hatáskiegyenlíti egymást. A harmadik hidrogénatom cseréje után viszont – a szolvatációcsökkenése miatt – a destabilizáló hatás kerül túlsúlyba. Így a legerősebb bázisok a szekunderaminok.Bázicitás növekvő sorrendje vízben:<strong>Kémiai</strong> tulajdonságokAlkilezés: vegyes termékek, elválasztás Hinsberg módszerrelAcilezés: védőcsoport, savkloridok, savanhidridek, szulfonsav-kloridok alkalmazásávalHinsberg próba: aminok elválasztása rendűség alapján
79Aminok reakciója salétromossavvalPrimer aminokSzekunder aminokErősen mérgezőTercier aminokAromás primer aminokAromás szekunder aminokAromás tercier aminok
80Diazóniumsók átalakításai (Sandmeyer reakció rézsók jelenlétében, NaBF 4 -dal Schiemannreakció)Reakció oxovegyületekkelLeválasztásra használható: iminek képződnekMechanizmus:
81Azokapcsolási reakciókPéldául:PhNN XPhNH 2>Ph N N NH PhN N NH 2diazaaminobenzol4-aminodiazobenzolAzovegyületek felhasználásaAz aromás azovegyületeket a textiliparban színezékként, az analitikai kémiában pedig savbázisindikátorként alkalmazzák. A vegyületek színe molekuláik -elektronrendszerénekkönnyű gerjeszthetőségével függ össze, azaz már a látható fény is gerjeszteni tudja a HOMOpályán levő elektronjaikat. Az azocsoport protonálódásával azonban megváltozik a gerjesztésienergia, ezáltal a protonált és nemprotonált formák színe is különbözik. Ezen a jelenségenalapul indikátor szerepük.OOSONNsárga (lúgban)pH > 4,0 max = 454 nmNOCH 3O S N NCH 3ONCH 3CH 3+ H- HOOSHNNNCH 3OOHS N NNCH 3OCH 3metilnarancsOpiros (savban)pH < 3,1 max = 504 nmCH 3A metilnarancs indikátor színváltozása természetesen független a szulfonsav protonáltságifokától. Azt csak az azocsoport – mint kromoforcsoport – nitrogénjének protonálódása, illetvedeprotonálódása határozza meg.
82Aldehidek és ketonokTermészetes vegyületekFahéjCinnamonum verumvaniliaVanilla planifoliaCitromfű Konyhakömény KámforfaCymbopogon marginatus Carum carvi Cinnamomum camphoraSzibériai pézsmaszarvasMoschus moschiferus
83Kötésrendszer, szerkezetA karbonilcsoport, C=OFormaldehidC: 1s 2 2s 2 2p x 1 2p y1Oxigén: 1s 2 2s 2 2p x 2 2p y 1 2p z 1 .Kötési energia
84A <strong>kötés</strong>i energia értékéből az adódik, hogy a kettős <strong>kötés</strong> kialakulása egyes reakcióknálhajtóerő lehet, mivel energetikailag kedvező. A C=O kettös <strong>kötés</strong> <strong>kötés</strong>i energiája nagyobbmind a C-O egyszeres <strong>kötés</strong> energiájának kétszerese.PolaritásTekintettel a töltésszétválásra, a nukleofil addíciók jellemzők.Aldehidek nevezéktanaÁltalános képlet:CCOHa.) ha a megfelelő karbonsavnak triviális neve van, a sav latin szótöve + aldehidb.) aciklusos mono és dialdehidek: azonos szén atomszámú szénhidrogén neve + al, dialc.) más aldehidek: alapnév + karbaldehid utótagElőtag: „formil‖31CH 3 CHO CHO OHC CHO CHO2a.) acetaldehidb.) etanal pentanal pentándialc.)ciklohexánkarbaldehidOHC43 12CHOCHOb.)c.) bután-1,2,4-trikarbaldehidOHC23CHOCHO2-(formilmetil)hexándial1Ketonok nevezéktanaÁltalános képlet:
85CCCOa.) szubsztitúciós név: alapnév + „on‖, „dion‖, stb. utótagelőtag: „oxo‖b.) csoportfunkciós név (mono- és vicinális diketonok esetében): R,R’ csoportnevekbetűrendben, kötőjellel elválasztva, + kötőjel + keton/diketon utótagOOOOa.) bután-2-on heptán-2-on 1-fenilpentán-2,3-dionb.) etil-metil-keton metil-pentil-keton benzil-etil-diketonOCOOHO OOa.) heptán-2,4-dion 4-oxociklohexánkarbonsav piridin-2(H)-onAromás ketonok esetében: „ofenon‖, „onafton‖ utótag is használhatóO O OONHa.) 1-feniletanon difenilmetanon 1-fenilpropanon 1-naftiletanonb.) fenil-metil-keton difenilketon etil-fenil-keton metil-naftil-ketonacetofenon benzofenon propiofenon acetonaftonAldehidek és ketonok fizikai tulajdonságaiA legegyszerűbb oxovegyület a formaldehid gáz-halmazállapotú, de a legtöbb aldehid ésketon jellegzetes illatú folyadék. Forráspontjuk a karbonilcsoport polározottsága miattkialakuló dipol–dipol kölcsönhatásoknak köszönhetően magasabb, mint az azonos móltömegűszénhidrogéneké, de alacsonyabb, mint az alkoholoké. A kisebb szénatomszámú vegyületekvízben korlátlanul oldódnak, a szénlánc növekedésével az oldékonyság csökken. <strong>Szerves</strong>oldószerekben általában jól oldódnak.
86<strong>Kémiai</strong> tulajdonságokNukleofil addíciós reakciók: a karbonil szénenReakció az -helyzetű szénen: a proton lazított tekintettel a karbonil csoportelektronszívó tulajdonságáraA reaktivitást befolyásoló tényezők:
87Reakció oxigén-nukleofilekkelAcetálképzés aldehidekből: védőcsoportPolimerizációs reakciók
88Reakció nitrogén-nukleofilekkelimin (Schiff bázis)Néhány, leválasztásra alkalmas reakció:Reakció szén-nukleofilekkelAz oxovegyületek redukciója
89Katalitikus hidrogénezésRedukció fémhidridekkelMechanizmus:Oxovegyületek kimutatási reakcióiAz aldehidek kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagyFehling-próbával (réz-szulfát + Na,K-tartarát + NaOH oldat)Tollens teszt
90Fehling tesztKarbonsavak
92SzerkezetA karboxilát anion:Karbonsavak nevének eredeteNév a Származás b MegjegyzésAdipinsav L, adeps, zsír Telítetlen zsírok oxidációjakor keletkezik.AlmasavBenzoesavBorkõsavElõször éretlen almából állították elõ.Egy Indonéziában honos fa gyantájából, abenzoegyantából állították elõ.Borkészítéskor "borkõ" alakjában válik ki (a borkõ,
93latinul tartarus, kálium-hidrogén-tartarát).BorostyánkõsavEcetsavA borostyán desztillációs bontásakor képzõdõdesztillátumban fedezték fel.Az ecetben található.Fumársav L, fumus, füst A Fumaria nevű növényben található; a növényt régenazért égették, hogy a füstjével elűzzék a gonoszszellemeket.HangyasavGlutársavHangyák desztillációs bontásával állították elõ.Elõször a glutaminsavból állították elõ.Kapronsav L, caper, kecske Kecsketejben található, szaga a kecskére emlékeztet.Linolsav,lenolajsavG, linon, len +olajGlicerin-észter formájában megtalálható a lenolajban.Maleinsav L, malum, alma Az almasav dehidratációs terméke.Malonsav L, malum, alma Elõször az almasav oxidációjával állították elõ.OxálsavG, oxisz,savanyúSavanyú ízű vegyület, az Oxalis nemzetséghez tartozónövényekbõl vonható ki.Palmintisav L, palma, pálma Megtalálható a pálmaolaj gilcerin-észterében.PiroszõlõsavPropionsavG, piro, tûzG, proto, elsõ éspion, zsírA (szõlõbõl kiváló) borkõsav pirolízisével állíthatóelõ.A legrövidebb szénláncú sav, amely a hosszabbzsírsavak tulajdonságait mutatja.SztearinsavTejsavVajsavValeriánsav,macsakgyökérolaja G: görög, L: latinG, sztear, faggyú Növényi és állati zsírok glicerin-észtereiben fordul elõ.Aludttejben fedezték fel.Avas vajban található.A Valeriana officialis (macskagyökér) gyökerébõlnyerik ki. (A macskákra ingerlõen hat a növény fõalkaloidja.)Fizikai tulajdonságok
94Vízoldhatóság:<strong>Kémiai</strong> tulajdonságok: átalakítási lehetőségekA karbonsavak savi jellege:
95Szubsztituált karbonsavak savi erőssége:Dikarbonsavak hevítése: hosszabb lánc esetén anhidridek képződnek
Karbonsavak átalakítása savkloridokká96
97Észterképzés savkatalízis, egyensúly reakcióKarbonsavak kimutatási reakcióipH mérés: 5% ecetsav oldat, pH papírNátrium-bikarbonát tesztCO 2 fejlődés pozitív tesztZsírsavakA kémiában zsírsavaknak hívjuk azokat a (mono)karbonsavakat, melyek hosszabb (legalább8 – egyes kémikusok szerint 4 – szénatom hosszúságú), telített vagy telítetlen alifás láncottartalmaznak. A természetben előforduló zsírsavak általában páros számú szénatombólépülnek föl, ugyanis a bioszintézisük a 2 szénatomos acetát-csoportokból (ecetsav) történik.A zsírok és zsírszerű anyagok (olajok) annyira elterjedtek a növényvilágban, hogyha csekélymennyiségben is, de majdnem minden növényi alkatrészben feltalálhatók. A növények egyesrészei éspedig leggyakrabban a magvak, súlyuknak mintegy felét kitevő magaszsírtartalommal bírhatnak. Az állatvilágban a növényvilághoz hasonlóan szintén igenelterjedtek az olaj- és zsírféleségek. Sokszor vastag rétegekben, laza sejtek közé ágyazva,vagy bőr alá rétegezve, mint "szalonna", a hasüregben, mint "háj", a szárcsontokban éskoponyaüregben, mint "velő" vannak felhalmozva. Egyes rovarok, pl. a méhek testükből nagymennyiségű zsírt (viaszt) választanak ki. A tengerekben élő állatok, nevezetesen a bálnák ésrozmárfajták teste különösen zsírdús. Az előfordulásnak megfelelően a növényi zsíroknál a
98magokat és a terméseket, míg az állatoknál a zsírszöveteket, melyek a zsírt magukba foglalják(szalonna, háj, csontzsír, velő) dolgozzák fel zsírkinyerés céljaira.A zsírsavak a glicerinnel triglicerideket alkotva képezik a természetes zsírokat és olajokat.A zsírsavak redukciójával kaphatjuk a zsíraldehideket illetve a zsíralkoholokat.TelítettKéplet Triviális név OlvadáspontCH 3 (CH 2 ) 10 CO 2 H laurinsav 45 ºCCH 3 (CH 2 ) 12 CO 2 H mirisztinsab 55 ºCCH 3 (CH 2 ) 14 CO 2 H palmitinsav 63 ºCCH 3 (CH 2 ) 16 CO 2 H sztearinsav 69 ºCCH 3 (CH 2 ) 18 CO 2 H arachidinsav 76 ºCTelítetlenKéplet Triviális név OlvadáspontCH 3 (CH 2 ) 5 CH=CH(CH 2 ) 7 CO 2 H palmitoleinsav 0 ºCCH 3 (CH 2 ) 7 CH=CH(CH 2 ) 7 CO 2 H olajsav 13 ºCCH 3 (CH 2 ) 4 CH=CHCH 2 CH=CH(CH 2 ) 7 CO 2 H linolsav -5 ºCCH 3 CH 2 CH=CHCH 2 CH=CHCH 2 CH=CH(CH 2 ) 7 CO 2 H linoleinsav -11 ºCCH 3 (CH 2 ) 4 (CH=CHCH 2 ) 4 (CH 2 ) 2 CO 2 H arachidonsav -49 ºCA zsírok és olajok főalkatrészei közül a keményebb zsírokban (pl. disznózsírban és méginkább a faggyúban) inkább a sztearinsavas és palmitinsavas glicerinészter, a folyékonyzsírokban – vagyis olajokban – fôként az olajsavas glicerinészter dominál.Étkezésre szolgáló olajok és zsírok kinyerése és elôkészítése természetesen különöseljárásokat, gondos munkálatokat igényel, mert ezeknek az olajoknak a higiénia
99követelményeinek is eleget kell tenni. Itt említjük meg, hogy a legáltalánosabban használtétolaj a hideg, vagy csak a gyengén melegpréselésû olivaolaj, melynek savmentesnek ésszagtalannak kell lenni. Étolajul azonban jól felhasználható a szezámolaj, nemkülönben atökmagolaj, a napraforgóolaj és a kendermagolaj is.A mesterséges ételzsírok közül nagy szerepet játszik a művaj vagy más néven margarin.Margarin gyártására marhafaggyút szokás használni, melyből sajtolással mindenekelőttoleomargarint készítenek. Oleomargarin alatt a faggyúnak 30–32 C o között még folyékonyrészét értjük. A présből kifolyó oleomargarin megdermedés után fehér, legfeljebb gyengénsárgás tömeget alkot, mi ételek készítésére közvetlenül is felhasználható. Hogy ebből vajszerűtömeget nyerjünk, még további eljárásnak kell alávetni, melyet vajasításnak neveznek. Ezlényegileg abban áll, hogy az oleomargarint tejjel dolgozzák el, miközben a vajszerűállomány biztosítására más zsírokat (szezámolajat, kókuszolajat, gyapotmagolajat stb.) isadnak hozzá. Jó minőségű margarinvaj pl. a következő anyagokból készül:Nyári készítmény Téli készítményTeljes tej 500 l 500 lOleomargarin 500 kg 500 kgFaggyú 25 kg –Szezámolaj 50 kg 70 kgDán vajfesték 0,40 kg 0,40 kgA zsírok és olajok technikai feldolgozásának legősibb módja az, hogy belőlük szappantfőzünk. A képződő nátronszappan nem egyéb, mint a zsírokban foglalt zsírsavaknátriumsójának keveréke. Az egyidejüleg felszabaduló glicerin a házi szappanfőzésnélveszendőbe megy.Szappanok és detergensek
100A felületaktív anyagok mosóhatásaA tenzidek vízben oldható anyagok. A homogén elegy (oldat) kialakulásának előfeltétele amosásnak (mosogatásnak, mosdásnak), ami nem más, mint a szennyeződések eltávolítása atisztítandó felületről felületaktív anyag tartalmú készítmény és sok víz segítségével.A tenzideknek e folyamatban kifejtett tevékenységét nevezzük mosóhatásnak. Ez többféle,egyidejűleg lejátszódó részfolyamat eredményeképpen valósul meg.Elsőként a felületaktív anyagok közrefogják a szennyeződést (és a mosandó textíliát), azaznedvesítenek.Erősebb kapcsolatot képesek létesíteni a szennyeződéssel és a textíliával, mint a szennyeződésa textíliával, ezért e két anyag közé is beékelődnek. A szennyeződést így lefejtik és kisebbmolekulahalmazokra bontják, aprítják, idegen szóval: diszpergálják. Ez a részfolyamat annálgyorsabban zajlik le, minél nagyobb felületen terül el ugyanaz a szennyeződésmennyiség,valamint minél frissebben került az a textíliára.A felületaktív anyagok diszpergáló hatásaA rászáradt, régi, erősen kötődő, nagy mennyiségű szennyeződés fellazítása csak hosszasáztatás során valósítható meg.A fellazított, leválasztott, szétdarabolt folyékony szennyeződés kis gömböcskék alakjábahúzódik össze, amiket természetesen körülvesznek a felületaktív anyag molekulái és az ekörül lévő vízmolekulák, a hidrátburok. A szilárd szennyeződést hasonló módon darabolja,leválasztja és eltávolítja a textil szálaitól. Ez a kettős gyűrű biztosítja a szennyeződés tökéletesemulgeálását. Az emulgeáló hatás (azaz a kettős elektromos burok) gátolja meg azt, hogy aszennyeződés újra visszatapadhasson a mosólében lévő textilneműre.
101A felületaktív anyagok emulgeáló hatása a) a szennyeződés eloszlatása; b) a szennyeződés visszajutásánakmegakadályozásaViaszokspermaceti méhviasz karnauba viaszCH 3 (CH 2 ) 14 CO 2 -(CH 2 ) 15 CH 3 CH 3 (CH 2 ) 24 CO 2 -(CH 2 ) 29 CH 3 CH 3 (CH 2 ) 30 CO 2 -(CH 2 ) 33 CH 3Ámbrás cet (Physeter macrocephalus)prunifera)Házi méh (Apis mellifica L.) Carnauba pálma (CoperniciaA nagy molekulasúlyú zsírsavaknak nagy molekulasúlyú egyértékű alkoholokkal képezettészterei a viaszok, melyek szagtalan szilárd anyagok, s külsőleg a paraffinra emlékeztetnek.<strong>Kémiai</strong>lag azonban lényegesen különböznek a paraffinektől, mert elszappanosíthatók, vagyisvízfelvétellel savra és alkoholra bonthatók fel, míg a paraffinek szénhidrogének lévén, nembomlanak. A viaszok állati és növényi szervezetek anyagcseretermékeiként fordulnak elő atermészetben, kisebb-nagyobb mértékben más anyagokkal (pl. szénhidrogénekkel, szabadsavakkal) szennyezve.A legközönségesebb viasz a méhviasz, mely főtömegében a palmitinsavnak miricilalkohollalképezett észteréből, C 15 H 31 COOC 30 H 61 , áll. Természetes állapotában sárga színű, 63–65 C o -on olvadó viasz, mely gyakran fehérített állapotban kerül forgalomba (sárga és fehér viasz).Különböző ipari célokra, s az orvosi gyakorlatban kenőcsök alapanyagául használják. Abőrgyógyászatban előszeretettel használják a bálnaviaszt vagy cetaceumot (spermacet-et),mely a bálna-félék koponyaüregében található. Ez az 50 C o -on olvadó kristálylemezkékből
102álló viasz főleg a palmitinsav cetilalkohollal képezett észteréből, C 15 H 31 COOC 16 H 33 , áll. Akínai viasz rovaroknak az anyagcsereterméke és cerotinsavas cerilészterbôl áll,C 25 H 51 COOC 26 H 53 .Az állati eredetű viaszok közül említésre méltó még a gyapjúzsír (lanolin), mely a gyapjúnkeletkezik és a gyógyszerészetben, valamint a kozmetikában játszik fontos szerepet.A carnauba-viasz viszont, melyet pl. paraffingyertyák fehérítésére használnak, növényieredetű és fő alkotórésze a cerotinsavas miricilészter, C 25 H 51 COOC 30 H 61 .Levezetés, általános képletKarbonsavszármazékok<strong>Kémiai</strong> rokonságSzármazékokSavhalogenidek:a.) csoportfunkciós név: acilcsoport + kötőjel +halogenidek neve betűrendbenb.) funkciós csoport módosítását jelző név: sav neve + kötőjel + halogenid neve
103H 3 CClBr Br ClOOOOO O ClCla.) acetil-klorid hexanoil-bromid malonil-bromid-klorid tereftaloil-dikloridb.) ecetsav-klorid hexánsav-bromid malonsav-bromid-klorid tereftálsav-dikloridElőtag: „halogénkarbonil‖OClOHOClOOklórkarbonilecetsavOetil-[2-(klórkarbonil)benzoát]AnhidridekSzimmetrikus anhidridek: sav neve + kötőjel + anhidrid funkciós csoportnévOOOOOOOOOecetsav-anhidrid hexánsav-anhidrid ciklohexánkarbonsav-anhidridGyűrűs anhidridek:a.) szimmetrikus anhidridkéntb.) heterocikluskéntOOOOOOOOOa.) borostyánkõsav-anhidrid glutársavanhidrid ftálsav-anhidrid(butándisav-anhidrid) pentándisav-anhidridb.) tetrahidrofurán-2,5-dion tetrahidropirán-2,6-dion 1,3-dihidroizobenzofurán-1,3-dionAszimmetrikus (vegyes) anhidridek: a két sav betűrendben, kötőjellel elválasztva + kötőjel +anhidrid
104OOOOClOOOOObutánsav-propánsav-anhidrid ecetsav-klórecetsav-anhidrid benzoesav-propánsav-anhidridElőtag: „aciloxikarbonil‖H 3 C O CH 2 OHO O OacetiloxikarbonilecetsavÉszterekAlkil és/vagy aril csoportnév betűrendben felsorolva + kötőjel + anion neveCOOH 5 C 2 OOCCOOC 2 H 5H 5 C 2 OOC COOCH 3etil-butanoát dietil-hexándioát etil-metil-malonátOCOC 2 H 5etil-ciklohexánkarboxilátGyűrűs észterek: laktonokAmidoka.) sav nevében a „sav‖ vagy „karbonsav‖ utótagot „amid‖ utótagra cseréljükb.) triviális nevű karbonsav esetén: acilcsoport szótöve + amid
105c.) sav neve + kötőjel + amid (funkciós csoport módosítását jelző név)Előtag: „karbamoil‖ (CONH 2 csoport) a H 2 NCOOH szerkezetű karbamidsavbólCH 3OCNH 2ONH 2ONH 2a.) etánamid pentánamid ciklohexánkarboxamidb.) acetamidc.) ecetsav-amid pentánsav-amid ciklohexánkarbonsav-amidCOOHCONH 22-karbamoilbenzoesavN-szubsztituált amidok: RCONHR’, RCONR’R‖: mint nitrogénen R’, R‖ csoporttalhelyettesített származékokONHCH 3ONHCH 3OCNHb.) N-metilbenzamid N-fenilbenzamid N-fenilacetamidbenzanilidacetanilidGyűrűs amidok: laktámokAmidok szerkezete:
106NitrilekMás néven cianidok (pszeudohalogenidek)Általános képlet:R C Na.) Szubsztitúciós név: (savszármazékként) szénhidrogén neve + nitril, dinitril, karbonitrilb.) Triviális nevű karbonsavakból levetetett nitrilek: acilcsoport szótöve + „onitril‖c.) Csoportfunkciós név: R előtag neve + kötőjel + cianidCH 3 C N C N NCCNCNCNa.) etánnitril pentánnitril butándinitril ciklohexánkarbonitril benzolnitrilb.) acetonitril valeronitril szukcinonitril benzonitrilc.) metil-cianid butil-cianid ciklohexil-cianid fenil-cianidElőtag: cianoCOOHCNNCCONH 2CNNCCNCN4-cianopentánsav 3-(cianometil)hexándinitril 2,4-dicianobenzamid
107<strong>Kémiai</strong> tulajdonságokSzubsztitúció karbonil szénatomonReaktivitás, illetve egymásba való átalakíthatóság:
Reakciótípusok108
109Észterek savas hidrolíziseÉszterek lúgos hidrolíziseGliceridek hidrolizíse: ld. előbb szappanok is
110Kéntartalmú szerves vegyületekPéldák:CH 3 CH 2 SH etántiol Ph-SH benzoltiolCH 2 =CH-CH 2 -S-S-CH 2 -CH=CH 2diallil-diszulfid (fokhagyma olaj)KötésrendszerA C–S <strong>kötés</strong> apoláros, mivel a szén- és kénatom elektronegativitása azonos (2,5). Akénatom elektonegativitása kisebb, mint az oxigénatomé (3,5) és a kén központi atommagtöltésétkét lezárt elektronhéj is árnyékolja (O: 1s 2 , 2s 2 2p 4 ; S: 1s 2 , 2s 2 2p 6 , 3s 2 3p 4 ), s így azatommag pozitív töltésének a viszonylag távoli vegyértékhéjra gyakorolt hatása csekélymértékű.Az éterek és tioéterek <strong>kötés</strong>szögében is eltérés mutatkozik, azonos szubsztituensekesetén a kénvegyületekben a <strong>kötés</strong>szögek jóval kisebbek.H 3 C SH S98,5 o 92,5 oH 3 CHdimetil-szulfidhidrogén-szulfidFizikai tulajdonságokA kénatom nagyobb méretű és könnyebben polarizálható, mint az oxigén, ezért az S–H <strong>kötés</strong> gyengébb, mint az O–H <strong>kötés</strong>. Ebből következik, hogy a tiolok nemcsak azalkoholoknál, hanem a víznél is erősebb savak, így már vizes lúggal is sót képeznek.
111kén-hidrogén (pK a =7,04)HSH+ H 2 OHS +H 3 Otiolok (pK a =8)RSH+ H 2 ORS +H 3 OCH 3 CH 2 CH 2 SHpropán-1-tiol+ KOH CH 3 CH 2 CH 2 SK + H 2 Okálium-propán-1-tiolátkáliumprop-1-il-szulfidA fentiekkel függ össze, hogy az alkiltiolát-anion gyengébb bázis, ugyanakkor erősebbnukleofil, mint az alkoxidion. A gyengébb S–H <strong>kötés</strong>sel kapcsolatos a tiolok nagyfokúérzékenysége oxidálószerekkel szemben. Már a levegő oxigénjének vagy más enyheoxidálószernek (pl. I 2 vagy K 3 [Fe(CN) 6 ]) a jelenléte diszulfidokhoz vezet. A reakciómegfordítható, így redukálószerek (pl. Zn + HCl) hatására visszanyerhető a tiol.[O]2 CH 3 CH 2 SH CH 3 CH 2 S S CH 2 CH 3[H]etántiol dietil-diszulfidErélyes oxidálószerek (pl. persavak, KMnO 4 stb.) hatására a tiolok szulfonsavvá alakíthatók.OR SH[O]R S OHtiolOszulfonsavA szulfonsavak vízben oldódó erős savak, az aromás származékokat bőrcserző anyagkénthasználják.SzulfonsavszármazékokJelentősek a szulfonsav-kloridok (ld. alkánok, benzol reakciói), melyek sok iránybaalakíthatók át. A szulfonamidok fontos gyógyszerek (Ultraszeptil, Szulfaguanidin)NRH 2 NSO 2HNNR'Szulfaguanidin (R, R' = H, Me)Szuperszeptil (R,R' = Me)
112SO 2 NHRSO 2 ClSO 2 OHRNH 2H 2 OszulfonamidH 2 /kat.ROHszulfonsavSHSO 2 ORtiolszulfonsav-észterA toluol klórszulfonálásával nyerhető szulfonsavszármazékok mesterséges édesítőszerek(szacharin) ill. fertőtlenítőszerek (Diklóramin-T).NH 3ClSO 3 H2 molSO 2 ClNH 3SO 2 NH 2SO 2 NH 2SO 2 Clox.NaOClSO 2 NH 2OHSO 2 NCl 2Diklóramin-TO OSN NaNaOH- H 2 OOO OSNHOOszacharin-Na só(oldódik vízben)szacharinAminosavakAminosavak, peptidek, fehérjékAz aminosavak olyan karbonsavszármazékok, amelyekben a szénhidrogéncsoportokegy vagy több hidrogénjét aminocsoport helyettesíti. Az aminosavakat a szénhidrogénrészjellege (alifás/aromás), valamint az aminocsoportnak a karboxilcsoporthoz viszonyított
113helyzete szerint osztályozzuk, és így megkülönböztethetünk -, -, - stb. aminosavakat,illetve aromás aminosavakat.A különféle típusú aminosavak közül legjelentősebbek az -aminosavak, mert ezekbőlépülnek fel az élő sejt anyagállományának nélkülözhetetlen alkotórészei a fehérjék. Sokfélefehérjét ismerünk, így a fehérje elnevezés gyűjtőfogalom, hasonlóan a szénhidrogénekhez. Aközismert tojásfehérje is sok száz különböző fehérje vizes oldata, melyből körülményesmunkával tiszta, egységes fehérjéket lehet elkülöníteni. Ezek teljes hidrolízisénél -aminosavak, részleges hidrolízisénél pedig peptidek keletkeznek. A fehérjék és peptidek teljeshidrolízisével mintegy 20-féle aminosav nyerhető.Természetes aminosavakAlapvető fontosságú (esszenciális) aminosavaknak nevezzük azt a 9 aminosavat, amelyeket aszervezet nem, vagy csak elégtelen mennyiségben képes előállítani:metionin, treonin, lizin, izoleucin, valin, leucin, fenilalanin, triptofán. hisztidin.
114Aminosavak nevének eredeteNév a Származás b MegjegyzésArgininAszparaginAszparaginsavCiszteinCisztinL, argentum,ezüstL, asparagus,spárgaG, kisztisz,hólyagJól definiált ezüstsót képez.Elõször spárgában mutatták ki.Az aszparaginnal rokon.A cisztin redukciós terméke.Elõször húgykõbõl állították elõ.Glutaminsav glutén +aminoGlutaminA sikér (glutén) hidrolízisével állítható elõ; a sikér a gabonáknagy fehérjetartalmú komponense.A glutaminsavból származik.GlicinHisztidinIzoleucinLeucinLizinG, glikisz,édesG, hisztion,szövetG, leukosz,fehérG, lizisz,kibontásÉdes ízû.A leucin izomere.Fehér lapok formájában képzõdik.A kazein hidrolízistermékei között fedezték fel.Metionin metil + tio Kénatomot (a kén görög neve theion) és hozzá kacsolódómetilcsoportot tartalmaz.Prolin pirrolidin Pirrolidingyûrût tartalmaz.SzerinL, sericum,selyemElõször selyembõl állították elõ.Treonin treóz Térbeli konfigurációja hasonlít a D-treózéhoz (ez utóbbinégy szénatomos cukor)Triptofán tripszines +fánTirazin G, tirosz, sajt A sajtban található.Fehérjék hasnyámirigybeli emésztésével képzõdhet; atripszin a hasnyálmirigynedv fehérjebontó enzime, a fán agörög phanein, megjelenni igébõl származik.Valin valerián Szénváza megfelel az izovaleriánsavénak.a Ezeket a biológiailag fontos -aminosavakat szinte sosem említik a szisztematikus nevükön. Az -in végzõdésgyakori a nitrogéntartalmú vegyületeknél (amin-bázisoknál). b L: latin, G: görög.
115Az -aminosavak kristályos, magas olvadáspontú vegyületek. Olvadáspontjuk sokkalmagasabb, mint azoké a karbonsavaké vagy aminoké, melyekből helyettesítéssellevezethetők. Olvadáspontjuk fölött elbomlanak, gázhalmazállapotban nem létképesek.Oldékonyságuk is a sókra emlékeztet. <strong>Szerves</strong> oldószerekben, például alkoholban a prolin és ahidroxiprolin kivételével gyakorlatilag oldhatatlanok, míg vízben valamennyi jól oldódik.Oldatban, az oldat pH-jától függően kationként, anionként vagy ún. ikerionos alakban vannakjelen. Minthogy e vegyületek egyidejűleg bázikusak és savasak, a savas csoport (–COOH)átadja a protonját a bázisosnak (–NH 2 ) és így keletkezik az ikerionos forma.HHN CH COOHRHHN CH COOH Raminosav formaikerionos formaAz -aminosavak térszerkezeteOptikai izoméria fogalmaA négy különböző csoporttal helyettesített központi szénatom esetén a molekula már nemrendelkezik szimmetriaelemmel: aszimmetriacentrumot (un. aszimmetrikus szénatomot,jele: C*) tartalmazó királis vegyület, melynek a következő két, egymással fedésbe nemhozható és optikai aktivitást mutató tükörképi szerkezete (antipódja) lehetséges:Az ilyen királis szerkezeteket enantiomer vegyületpároknak nevezzük. Egy királisvegyületnek csak egy enantiomer párja lehet. Ezek a vegyületek minden fizikai-<strong>kémiai</strong>tulajdonságukban megegyeznek, csak az optikai forgatóképességük különböző.Az aszimmetriacentrumhoz kapcsolódó csoportokat az Emil Fischer által javasolt vetítésiszabálynak megfelelően úgy ábrázoljuk, hogy a szénlánc a vetítéssel kapott képletbenfüggőlegesen és az aszimmetrikus szénatomhoz képest a papír síkja felé helyezkedjék eI, s alegmagasabb oxidációs fokú funkciós csoportot felül, a leghosszabb szénláncot pedig alultartalmazza. A központi szénatomhoz csatlakozó egyéb csoportok helyzetét (vízszintesirányban) így a térszerkezet egyértelműen meghatározza. Példaképpen bemutatjuk a tejsavegyik optikai antipódjának a Fischer-féle konvenció szerinti projektív képletét:
116A D- és L- jelölés konvencionálisan csak a glicerinaldehid megfelelő térszerkezetiformájával (konfigurációjával) való genetikai összefüggést, másképpen a glicerinaldehidrevonatkoztatott relatív konfigurációt jelzi. A relatív konfiguráció és a forgatás iránya közöttnincs egyértelmű összefüggés. Például:Az -aminosavak molekulái – a glicin kivételével – királisak és ennek megfelelően kéttükörképi konfigurációba rendezhetők, melyeket a Fischer-féle jelölést használva L-, illetveHHH 3 NCCOORCOOCRNH 3COOtükörsíkCOOH 3 NCHH C NH 3RRLD-betűkkel különböztethetünk meg. A természetben előforduló aminosavak túlnyomótöbbsége az L-sorba tartozik és (S)-abszolút konfigurációjú, mint azt az R-(+)-glicerinaldehiddel történő <strong>kémiai</strong> korrelációjuk, valamint röntgenvizsgálataik is igazolták. AzL-cisztein esetén a C.I.P. szabály alapján a prioritási sorrend miatt nem az (S)-, hanem az (R)-konfiguráció adódik.DH 3 NCOOC HkétszerescsereHSCH 23COOC NH 3CH 2 SH2H14L-cisztein(R)-cisztein
117Aminosavak kimutatása: színreakció ninhidrinnel, csak rájuk jellemző (a prolinkivételével).Peptidek -Aminosavakból felépülő 2-100 egységből álló polimerek Csoportosításuk oligopeptidek 2-10 aminosavpolipeptidek 10-100 aminosavproteinek100 > aminosavA peptidek szerkezeteH 2 NQCOOHH 2 NRCOOH- H 2 OH 3 O (6M HCl)H 2 NQONHRCOOHsavamid (peptid)<strong>kötés</strong>A peptideket nyílt láncú és nagy tagszámú gyűrűs peptidekre osztjuk. A nyílt láncúpeptidekben a lánc egyik végén az aminocsoport szabad, ez az N-terminális rész (Nterminus),a másik végén a karboxilcsoport szabad, ez a C-terminális rész (C-terminus).Lúgos közegben anionként, savasban kationként vannak jelen, izoelektromos pontjukon pedigdipoláris ionkét.
118N-terminusH 3 NRONHROnNHRCOOC-terminusHOHH 3 NRONHROnNHRCOOHH 2 NRONHROnNHRCOORöntgendiffrakciós vizsgálatokkal megállapították, hogy a peptid molekulákban akapcsolódó atomok egy síkban vannak, a savamid <strong>kötés</strong> transz-térállású, és a <strong>kötés</strong>távolságiadatok szerint a C-N <strong>kötés</strong> a konjugációs kölcsönhatás következtében kettős<strong>kötés</strong> jellegű.HR 3 H O R 1114 125NoN110O R 2 H HH o 114 oo 121 oOHNA savamidokra jellemző konjugációs kölcsönhatás következtében a szabad rotálás nemkövetkezhet be a savamid <strong>kötés</strong> mentén, így a stabilis transz-téralkat energetikailag kedvezőállapotot biztosít a molekulának. Ugyanakkor a savamid <strong>kötés</strong> a legstabilabb <strong>kötés</strong>, csakerélyes körülmények között bontható fel (tömény sósav, forralás).Néhány jelentős természetes peptidGlutation: tripeptid, glu-cys-gly; oxidációs-redukciós folyamatok partnere, a szulfidcsoportdiszulfiddá oxidálódikHOOCONHSHNHCOOHA AH 22 G-SH G-S-S-GNH 2OB BH 2Oxitocin és vazopresszin agyalapi mirigy hormonjai. oktapeptidek, majdnem azonos szerkezetűek, két aminosav különbözik bennük oxitocin: méhösszehúzó hatású, a tejelválasztást segíti elő vazopresszin: vérnyomás szabályozása és a vizelet kiválasztása (antidiuretikushormon)
119vazopresszinoxitocinCikloproteid antibiotikumok: gramicidin-S (D-konfigurációjú aminosavat is tartalmaznak).-Amanitin:Gyilkos galóca (Amanita phalloides)A gyilkos galóca háromféle toxincsoportot tartalmaz: amanitineket, falloidineket ésvirotoxinokat. Ezek olyan ciklikus oligopeptidek, amelyeket a szervezet enzimei nem tudnaklebontani, tehát hatástalanítani. A legveszélyesebbek közülük az amanitinek. A lappangási időhosszú, vagyis a tünetek csak jóval a gomba elfogyasztása után (8-24 óra múlva)jelentkeznek, amikor a méreg már felszívódott a tápcsatornából, ezért a gyomormosás nemsokat használ. A toxin a májkapuvénán keresztül a májba jut és egyenesen a májsejtekhezkötôdve, azok pusztulását okozza. Jelentősen károsodik a vese is. Az amanitin hatása a sejtekDNS-től függő RNS polimerázának gátlásán alapul: a sejtben megszünik a fehérjeszintézis.Az -amanitin csak a melegvérű állatok DNS-polimerázára hat, ezért pl. a csigarágott
120termőtest még lehet mérgezô! A gyilkos galócában található egyéb toxinok, a falloidinek ésvirotoxinok kevésbé mérgezôk és rosszabbul is szívódnak fel.Mellitin (méhek fullánkmérge, Apis mellifera):Gly-Ile-Gly-Ala-Val-Leu-Lys-Val-Leu-Thr-Thr-Gly-Leu-Pro~~Ala-Leu-Ile-Ser-Trp-Ile-Lys-Arg-Lys-Arg-Gln-GlnNH 2 (or GIGAVLKVLTTGLPALISWIKRKRQQNH 2 )Inzulin (diabetes mellitis kezelése)Fehérjéknagy molekulasúlyú, többszáz aminosavból felépülő makromolekulákaz élő szervezet legfontosabb anyagai20-féle aminosavból épülnek fel, kapcsolódási lehetőségük korlátlanCsoportosítás1) Összetétel alapján Protein (egyszerű), hidrolízissel -aminosavak képződnek Proteid (összetett protein), hidrolízissel -aminosavak és egyéb anyagokképződnek foszfoproteidek: kazeinkromoproteidek: hemoglobin (színesek)mukoproteidek: szénhidrátot tartalmaznaklipoproteidek: zsírszerű anyagot tartalmaznaknukleoproteidek: nukleinsavat tartalmaznak, DNSmetalloproteidek: fémek komplexei2) Oldékonyság alapján Albuminok: vízben oldódnak (vérsavó, tojásfehérje) Globulinok: neutrális sóoldatban oldódnak (fibrin) Prolaminok: vizes alkoholban oldódnak Hisztonok: ammoniával kicsaphatók
121 Szkleroproteinek: oldhatatlanok, stabilisak (vázfehérjék)3) Koaguálás alapján (fémion, sav, fizikai hatásra, hő, rázás hatására bekövetkezőváltozás) Reverzibilis fehérjék (külső hatásra koagulálnak, a hatás megszűnése utánvisszaalakulnak): felvert tojásfehérje Irreverzibilis (denaturálás): rántotta4) A fehérjemolekula alkata alapján Fibrilláris fehérjék: fonál alakúak (haj, izomrost) Globuláris fehérjék: gömb alakúak (sejt legtöbb fehérjéje)5) Biológiai hatás alapján Inaktív fehérjék (vázanyagok): haj, köröm, bőr, kollagén (inak,kötőszövetek), miozin (izom) Fiziológiailag aktív fehérjék (bioregulátorok): anyagtranszportotszabályozzák hormonok (inzulin)enzimek (pepszin)vírusok (dohánymozaik-vírus)bakteriofágoktoxinok (kígyómérgek)antitestekProteinek sajátságaiNagy molekulasúly, kolloid sajátságú anyagokLegtöbb liofil kolloid, vagyis oldószerrel szolvatálódnak, ezért duzzadnak megoldódáskorSzínreakciók kimutatásraXantoprotein-próba: tömény salétromsav hatására a tirozin vagy triptofánaromás gyűrűjének nitrálódásával jellemző sárga szín keletkezikBiuret-próba: lúgos réz-szulfát oldattal élénk ibolyaszínű réz-komplexképződik (Magyarázat: melegítés hatására a fehérjék aminocsoportjából ammóniaés biuret keletkezik, amely lúgos közegben réz(II)-szulfáttal vörösesibolya színűkomplexet képez).BiuretallofánsavNinhidrin-próba: kékes ibolyaszín ninhidrinnel (ld. aminosavaknál)OOHOHAmfoter jellegűekO2,2-dihidroxiindán-1,3-dionA fehérjék primer szerkezete
122a kapcsolódó -aminosavak sorrendjeA fehérjék szekunder szerkezeteAz alapkonformációt -<strong>kötés</strong>ek, ugyanakkor a legstabilabb állapot kialakulását a nemkovalens <strong>kötés</strong>ek határozzák meg (hidrogénhidak, van der Waals erők).Röntgendiffrakciós vizsgálatok megállapították, hogy a polipeptidlánc térbeli elhelyezkedésea legstabilabb kétféle pozícióval: redőzött vagy -struktúrahélix strukturaRedőzött struktúraA fehérjemolekulák között kialakul a hidrogén<strong>kötés</strong>, azonban a nagy térkitöltésű oldalláncokvan der Waals taszítása következtében ezek nem lehetnek stabilisak.OH O R H H O R H HNNNNNH R H O H R H OHNOHRNHORHHNOHRNHORHHNOA peptid<strong>kötés</strong>nek olyan kedvező konformációt kell felvennie, hogy zavartalanulalakulhassanak ki a hidrogén <strong>kötés</strong>ek, és a van der Waals rádiuszok is megfelelőeklegyenek. Az amid<strong>kötés</strong>ben a nitrogénatom nemkötő elektronjai konjugációskölcsönhatásba kerülnek a karbonilcsoporttal, ez azt eredményezi, hogy az amid<strong>kötés</strong>mentén a szabad rotálás gátolt és így rögzített lesz. A szabad rotálás viszont az N-C(R)Hill. a H(R)C-C tengely körül lehetséges, úgy hogy az amid<strong>kötés</strong> síkja elfordul.ONHRHOHNONHRHOHNAz elfordulás következtében a közvetlenül kapcsolódó szomszédos atomok konformációjanem változik meg, ellenben megváltozik az egymáshoz kapcsolódó szomszédos atomokviszonylagos helyzete.Ebben az esetben lesz a közvetlenül kapcsolódó atomok van der Waals rádiusza alegmegfelelőbb. A redőzött (plisszírozott) struktúra, mint energetikailag stabilis konformáció
123kialakulása, lehetővé teszi a peptidláncok közötti hidrogén<strong>kötés</strong>ek létrejöttét úgy, hogy az R-csoportok is maximális távolságra kerüljenek egymástól.A selyemhernyó szál: fibroin, redőzött strukturájú, erős, de nem nyújtható, viszonthajlékony. Erős: stabilis H-<strong>kötés</strong>ek, ezért nem szakad el, és nem nyúlik meg Hajlítható: a gyengébb van der Waals kölcsönhatások következtében, elcsúszhatnak arétegekHélix struktúraA fehérjelánc egy képzeletbeli henger palástján tekeredik fel csavarvonalszerűen = -hélix. Az -hélixekben az N-H és C=O csoportok párhuzamosak a hélix tengelyével, míg azR-szubsztituensek a hengerpalástból kifelé állnak (extrovertált szerkezet). Minden egyescsoport olyan távolságra van egymástól, hogy intramolekuláris H-<strong>kötés</strong> alakulhat ki minden
124amidcsoport karbonilcsoportja és az előtte levő harmadik amidcsoport N-H-ja között. Az -hélixben egy menetet 3-6 aminosavrész alkot, és 5 menet után kerülnek tökéletesen azonoshelyzetbe. Az -hélix átmérője 10,5 Å, amely a legmegfelelőbb távolság a maximális van derWaals kölcsönhatásra.-Hélix szerkezetű a fibrilláris fehérjék sorában tartozó keratin, amely a haj, szőr, gyapjú,toll fehérjéje.Haj: 3-3 hélix tekeredik össze, háromszálú hélixet alkotva; ezek tovább rendeződnek, kétháromszálú hélixet kilenc másik vesz körül, így stabilis, vastag kötegek jönnek létre, melyeketdiszulfidhidak is összekapcsolnak, merevítenek.
125Tartós hullám (dauer) készítése:Kollagén: a kötőszövetek, az inak, porcok fehérjéje. Aminosav tartalmának kb. 1/3-a prolin éshidroxiprolin. Ezekből nem alakulhat ki sem -hélix, sem redőzött struktúra. A láncokcsaknem nyújtottak, meredeken csavarodó (egy menet kb. 30 aminosav) hélixet (-hélix)alkotnak úgy, hogy három lánc tekeredik össze és a molekulák közötti H-<strong>kötés</strong> tartja össze aláncokat. A kollagén rostok nem nyújthatók, meglehetősen szilárdak, így a szervezet számárakitűnő tartó, merevítő szerkezeti elemek.
126Szénhidrátok (cukrok)A cukor rövid történeteA legrégibb édesítő anyag a méz volt. A nádcukor hazája India.Az első hírt a cukorról Nagy Sándor két hadvezére hozta Európába Kr.e. 327, indiaihadjáratukról hazatérőben. Akkor még a cukornád levét használták édesítőként.A szilárd cukor felfedezése kb. Kr.e. 300-600 körül tehető, ezt az indiaiak szákkáránaknevezték, ami homokot jelent. Kínában is innen terjedt el.Cukorgyártás kezdete: Perzsia, Kr.u. V. sz. a perzsák a vörös színű nyerscukrot hívtákszákkárának, a fehér kristályos cukrot kánd névvel hozták forgalomba. (innen a kandis cukorelnevezés, egykristály-cukor, jégcukor)Európában az arabok hozták be, kik meghódítván Perzsiát, a cukorgyártás mesterségétis eltanulták, szukhárnak nevezték, innen ered a neve. Az arabok hódításait nyomon követte acukor elterjedése is.Cukor névadás:sakkara óindsukkar arabszakhar(on) görögsaccharum latinsucrefranciazucchero olaszZucker németsukker norvégcukierlengyelcukormagyar, szlovákzahârrománsugarangolcaxaporoszMagyarországon: kb. a XIV. sz. lett ismeretes; 1419-ben Zsigmond, 1476-ban Mátyás királyünnepi lakomáján szerepelt, mint drága asztaldísz. Először nagyrészt az olaszok készítették acukros süteményeket, akik gyógyszerekkel is üzérkedtek.
1271750 első finomító, Mária Terézia, Fiume, holland RT.1747: Margraff András Zsigmond (1709-1789) német kémikus bebizonyította, hogyua. az anyag van hazai növényekben is, pl. a répában.Achard Ferenc (1753-1821), fenti tanítványa, fektette le a gyártás alaptételeit répából.XVIII. sz. Debrecenben épül kísérleti répacukorgyár, Gertinger János Sámuel eperjesigyógyszerész támogatása által.Édesítőszerek:Szénhidrátok szerepeA szénhidrátok (cukrok) felépítésük szerint, a régi megközelítéssel a szén hidrátjainaktekinthetők.1. energiahordozók2. növényekben: fotoszintézis(CO 2 )n + (H 2 O)nhklorofil(CH 2 O)n + (O 2 )niparbanüzemanyagpótlóEtOHkeményítõSzervezetben: cukorlebontásglükóz H 2 O + CO 2 675 kcal / mol3. vázanyagok: a szénhidrátokból keletkező polimerek (cellulóz, kitin)
1284. biológiai információk hordozói:A szénhidrátok és konjugátumaik (glikopeptidek, glikolipidek) az élő sejt felületéngondoskodnak a sejt adhézióról (tapadás), részt vesznek a sejt osztódás gátlásában, szerepükvan a vírusok, baktériumok és hormonok valamint toxinok sejten való megkötődésében ésirányítják az immunválaszt. Szerepük van az ivarsejtek egymásra találásában. Mintnukleozidok alkotóelemei közvetői a genetikai folyamatoknak (RNS, DNS, receptorok a sejtmembrán felületén / glikolipidek, glikoproteidok)5. királis kiindulási anyagokA szénhidrátok felosztása egyszerű szénhidrátok: hidrolízissel nem bonthatók tovább diszacharidok: hidrolízissel egyszerű szénhidrátokká bonthatók oligoszaharidok (összetett cukrok): tíznél kevesebb egyszerű szénhidrátottartalmaznak poliszaharidok (cukrokhoz nem hasonló, összetett szénhidrátok): tíznél több egyszerűszénhidrátból felépülő makromolekulákEgyszerű szénhidrátokKözös jellemvonásuk:Csoportosításhidrolízissel nem bonthatók feláltalában édes ízűekvízben oldódnak1. Oxocsoport jellege szerint: aldózokKetózokCH 2 (CH) n COHOHOHCH 2 (CH) n COH OH OCH 2OHaldóz ketóz2. A kapcsolódó szénatomok száma szerint:aldóz n ketóztrióz 1 0tetróz 2 1pentóz 3 2hexóz 4 33. Az oxocsoporttól legtávolabb levő szénatom konfigurációja szerint: D-, vagy L-konfiguráció (a ketotrióz kivételével minden molekula egy, vagy több aszimmetriáscentrumot tartalmaz)
129CHOCHOCH 2 OHC OCH 2 OHC OHC OHCH 2 OHHOC HCH 2 OHHC OHCH 2 OHHOC HCH 2 OHD- L- D- L-Szénhidrátok térszerkezetének ábrázolása:Fischer-féle projekció
130oxCredHCHOOHCH 2 OHHOCHOHCH 2 OHDLHHOHH2 CHOCHOHO2 x4 H C OH 1HO C CH 2 OHCH 2 OHH3CHOCHOOHHOHOHCH 2 OHCH 2 OHCHOCH 2 OHCHOCH 2 OHRCHOCH 2 OHD-glükóz D-mannóz D-galaktózepimer cukrokegy OH konfigurációjában különböznek2 4 8 db D=168 db LA szénhidrátok egyensúlyi elegyében a nyílt láncú forma és a ciklofélacetál öt- vagyhattagú gyűrűs állapotban található →Haworth-Böeseken-képlet (piranóz, illetve furanóz, amegfelelő heterociklusok analógiájára): IR spektroszkópiával ugyanis nem mutatható ki akarbonilcsoport, tehát spontán, reverzibilis intramolekuláris nukleofil addícióvalciklofélacetálokként vannak jelen.OOOOpirán piranóz furán furanózCHOCH 2 OH2 xcsereHOH 2 CCHOOHHOH 2 OO HCOHO OCH 2 OH HHO H O OHCH 2 OH HCH 2 OH H+OHH-anomer-anomer
131OHCHOCH 2 OHCHOCH 2 OHHOOHOH OHOHOHHO+OHOH OHOHOH-D-furanóz -D-furanózAz anomerek keletkezésére (és tulajdonképpen a gyűrűs szerkezet kialakulására) amutarotáció jelensége hívta fel a figyelmet. A kristályosítás módjától függően kétféleforgatóképességű D-glükóz (vagy egyéb cukor) ismeretes.jégecet oldat alkohol[] = + 112,2°[] = + 18,7 o[] = +52,2 o-D-glükóz-D-glükózszilárdszilárdOO HCHOOD-glükózD-glükóz36% 1% 63%Mutarotáció: a forgatóképesség megváltozása oldatbanHexózok konformációja
132aeeOaOOC1 konformer(stabilabb)1C konformerOH5 O34OHOHOHOH124OH65OH3OHO2OH1OHHOHO43OH52OOH1OHAz oxocsoport reakciói4C 1-D-glükopiranóz4 C 1legstabilabb szerkezetH mind axiálisOH, CH 2 OH mind ekv.csupa transz(a felső és az alsó index a C-1 és C-4 szénatomok relatív helyzetére utal)Az aldozók kimutathatók ezüsttükör (ammoniás ezüst-oxid – Tollens)- vagy Fehlingpróbával(réz-szulfát + Na,K-tartarát + NaOH oldat), mivel kis mennyiségben nyitottformában is jelen vannak vizes oldatban.Tollens teszt
133Fehling tesztFontosabb monoszacharidok és rokon vegyületekD-GlükózCHOCH2OHCH2OHCH 2 OHHHOHOHHOHNi / H 2red.HHOHOHHOHBacterium xylinumox. (C-5 OH)HHOHOHHOHOHOHHOHHOHHOHOHOHCH 2 OHCH 2 OHCH 2 OHCH2OHD-ribóz és 2-dezoxiribóz (pentóz)A nukleinsavak építőkövei közé tartoznak.D-szorbit L-szorbózCHOCHOOHOHHOOOHHHOHHOOOHOHCH2OHOHOHOHCH2OHOHL-aszkorbinsav (C-vitamin)2-dezoxi-2-keto-L-gulonsav -laktonjának enol alakja (gyűrűs észter forma)Szent-Györgyi Albert (1933 Nobel-díj)Lebontás (könnyen oxidálódik – levegőn is – a kettős <strong>kötés</strong> miatt):
134HOHOHOOHOHO- 2H+ 2HHOOHOHOOOox.HOCOOHCOOHoxálsavCOOHOHL-aszkorbinsavdehidro-L-aszkorbinsavOHC-vitamin források /100 g :csipkebogyó: 400 mgzöldpaprika: 125-180 mgkáposzta: 87 mgcitrom: 45 mgburgonya: 24 mgtej: 1-2 (4-7) mgL-treonsavnapi igény: 75 mgRosa canina Capsicum annuum Brassica oleracea Citrus limonSolanum tuberosumtejDiszacharidoka) Nem redukáló diszacharidokKét cukor glikozidos hidroxilcsoportjának kondenzációja (glikozid képzése) révén vezethetőkle.-D-glükopiranozil--D-Szacharóz (répacukor 20%, nádcukor 15%) „a cukor‖fruktofuranozid
135HOOOHHOHO-D-glükózHOH2HO451CH 2 OHC OCHCHCH3OHOHCH 2 OH6HOOHOHO HO-D-fruktofuranózD-fruktózOH- H 2 OHOOHHOHOO HHOO HOOOHOHb.) Redukáló diszacharidokA vízkilépés az monóz glikozidos és a másik monóz valamelyik alkoholoshidroxilcsoportjából történik (4 vagy 6).Maltóz: malátacukor, a keményítő részleges hidrolízésével nyerhető.Cellobióz: a cellulóz részleges hidrolízésével nyerhető.Laktóz: tejcukor, az emlősök tejének cukorkomponense (az anyatej 5-8% laktózt tartalmaz)
136AminocukrokA természetben előfordulnak 2-amino-2-dezoxi, 3-amino-3-dezoxi, stb. monoaminohexózok.Számos bakteriális poliszacharidban poliamino-polidezoxi cukor találhatóA leggyakoribb aminocukor a glükózamin, a 2-amino-2-dezoxi-D-glükóz:HOOHOOHOHNH 2 *HXDiszacharidok közül említjük a kitobióz néven ismert 1→4-<strong>kötés</strong>ű molekulát, mely 2-glükózaminból épül fel:HOOHKitin rákok, rovarok vázanyagaOHONHROOHOHONHROHkitobióz (R = H, ilyenkor HCl-só formájában van)kitin (R = CH 3 CO-)Kénsavval észteresített származékai: emberi, állati porcogó, inak, kötőszövetek„gélszerű‖ állományának alkotórészeiHeparinvéralvadásgátló, hasonló szerkezetű poliszacharid (korlátozza a trombokinázenzim műkődését, amelynek a véralvadás előidézésében döntő szerepe van)kimutatás: májban, Mc Lean, 1916NaOSO 2 OOOHOONHSO 2 ONaCOOHOOHOOHNaOSO 2 OOHOONHSO 2 ONaCOOHOOHOOSO 2 ONa
137Heterociklusos vegyületekGyűrűs vegyületek, amelyek a szénatomok mellett heteroatomot(okat) is tartalmaznak,pl: O, N, S, valamint B, Si, P, As, Sb, Sn, Pb, utóbbiak mesterségesek.Felosztás1. gyűrűrendszer alapjána.) a gyűrűk tagszáma, heteroatom minősége és száma, helyzete szerintb.) a gyűrűk telítettsége szerint: telített, részlegesen telített, telítetlen2. gyűrűk elektronrendszere alapján:a.) aromás (heteroaromás)b.) nem aromásNevezéktana.) triviális név: barbitursav, piridin, atropin, flavon, stb.b.) szisztematikus név: IUPAC (International Union of Pure and Applied Chemistry)Heteroatom jelölése: O oxaS tia prefixek, de ha magánhangzó következik, az aelmaradN azaA Hantzsch-Widman rendszer végződései:Gyűrűméret telítetlen telített3 -irén* -irán**4 -et -etán5 -ol -olán6 -in -án7 -epin -epán8 -ocin -okán9 -onin -onán10 -ecin -ekán* A tradicionális „-irin‖ végződés használható, ha a gyűrű csak nitrogént tartalmaz.** A tradicionális „-iridin‖, „-etidin‖ és „-olidin‖ végződéseket preferáljuk a nitrogént is tartalmazótelített három-, négy- vagy öttagú gyűrűs heteromonociklusok esetén.
138OOSoxirén oxirán tiirén tiirán azirin aziridin(etilén-oxid) (etilén-szulfid) (etilén-imin)SNHNHO O S S N NHoxet oxetán tiet tietán azet azetidinOOSSNHNHoxol oxolán tiol tiolán azol azolidin(furán) (T HF) (tiofén) (THT) pirrol pirrolidinO O O S S S N N2H-pirán 4H-pirán oxán 2H-tii n 4H-tiin tián piridin azinán(-pirán) (-pirán) (THP) (-tiopirán) ( -tiopirán) (perhidrotiofén) (piperidin)A számozás mindig a heteroatomon kezdődik!HTöbb azonos heteroatomot tartalmazó gyűrűk elnevezése*az oxin név nem használható a pirán esetében, mivel ezt korábban a kinolin-4-ol triviális nevekénthasználták** az azin név nem használható a piridin esetében, mivel ez régóta használatos az =N-N= típusúvegyületcsalád elnevezésére
139Eltérő heteroatomot tartalmazó gyűrűk elnevezéseoxa tia azaO1N2O1N 3S1N 31,2-oxazol 1,3-oxazol 1,3-tiazol(izoxazol)(oxazol)Kondenzált heterociklusok elnevezéseO4b5 acO132OObenzo-(2,3)-furán furán benzo-(3,4)-furán dibenzofuránbenzo[b]furánbenzo[c]furán(kumaron)(izokumaron)Négytagú, egy heteroatomot tartalmazó heterociklusok-Laktámgyűrűs antibiotikumokAntibiotikum: mikróbák által termelt vegyületek, amelyek más mikróbák szaporodásátgátolják (elpusztítják)Alexander Fleming (1881-1955) Ernst Boris Chain (1906-1979) Howard Florey (1898-1968)Fleming 1928-ban felfedezte a penicillint, és megkapta az Orvosi Nobel-díjat 1945-ben.Chain, Florey (1945): szerkezetfelderítés, Nobel-díj 1945
140RCONHSvízRCONHSONCOOHhidrolízisHOOCHNCOOHvízCO 2RCONHCHOH 2 NHSCOOHpenilloaldehid2,2-dimetil-D-ciszteinA penicillinek hatásmechanizmusaA -laktám antibiotikumok hatásuk révén a baktériumok sejtfalának szintézisétbefolyásolják. Feltételezik, hogy a penicillin a természetes eredetű peptidoglikánszubsztrátum analógjaként működik, amelyek térhálósítással építik fel a baktériumok sejtfalát.Ennek a D-Ala-D-Ala egységnek a konformációja hasonlít a -laktám szerkezetéhez.ROC NCH 3OHHHHN CH 3CO OROCNHOHHSHNCOOCH 3CH 3D-Ala-D-Ala egység PenicillinFélszintetikus penicillinszármazékokH 2 NSRCOClRCOHNSONCOOHNaHCO 3ONCOOH6-aminopenicillánsavészteresítésRCOHNSONCOOR'R = PhCH 2 -R = PhOCH 2 -R = CH 3 CH 2 =CHCH 2 CH 2 -R = CH 3 (CH 2 ) 4 -R = CH 3 (CH 2 ) 6 -penicillin-Gpenicillin-Vpenicillin-Fdehidropenicillin-Fpenicillin-KMaripen R = HO-C 6 H 4 -CH 2 -R' = -CH 2 OAc
141R = p-CH 3 -C 6 H 4 -CH 2 -R = HOOC-CH(NH 2 )(CH 2 ) 3 -R = H 2 N-CH(COOH)(CH 2 ) 3 -penicillin-Xpenicillin-Nizopenicillin-NÖttagú heterociklusos vegyületek' ' OOOfurán benzofurán dibenzofuránStiofénSbenzotiofénNHpirrol benzpirrol dibenzpirrol(indol)(karbazol)NHNHKötésrendszerNHNHNHHNA nemkötő elektronpár részt vesz az aromás rendszer kialakításábanaromás jelleg: tiofén > pirrol > furánk S Ebenzol < pirrol(,’) > tiofén < furánreaktivitás: pirrol > furán > tiofén > benzol<strong>Kémiai</strong> tulajdonságokBázikus jellegPirrol: nem bázikus, ez a nemkötő elektronpár delokalizációjára utal.
142NHNHszek. amin, erős bázisnem bázispK b 3,2 13,6Furán: enol-éter (konjugált dién) jellegű, sav hatására gyűrűfelnyílás, majd gyantásodáskövetkezik be (mivel az aromás rendszer szűnik meg, hosszas savas főzés, nagysavkoncentráció szükséges).OHH2OOHH2O-HHOenolOHOHCCHOszukcinaldehidgyantaSavas jellegPirrol: a konjugáció következtében a heteroatomon lecsökken az elektronsűrűség, így N-Hsavként működik. Ezért reagál káliummal vagy Grignard-reagenssel, és ebből kifolyólagszámos származék állítható elő.NHKpKa ~ 15NK+ 1/2 H2Q-HlgRMgXQ-HlgNQNHQNMgXQ = alkil, acilCO2, majd vízNNCOOHOCOMgXHElektrofil szubsztitúciós reakciókA -komplex kialakulása könnyebben megy végbe, mint a benzol esetében, a -komplexpedig az szénatomon kedvező.
143HHHEXEXEXEXHEHEHammond-elv!XXStabilabb átmeneti állapoton keresztül kedvezőbb a reakció, tehát a szubsztitúció -helyzetben játszódik le.ReakciókBrómozás, nitrálás, szulfonálás:Br 2 / 0 o CX X BrBr 2 / 5 o CBrXBrHNO 3X Ac 2 O X NO 2A nitrálás nem érintheti a heteroatomot, ezért használunk enyhébb reakciókörülményeket:HNO3 H NO3OOOOOOH- AcOHH3C C ONO3H3C C OON O OHajtóerő: az acetát anion nagyfokú stabilitásaH3CCOONO2Öttagú heterociklusok benzológ származékaiXXO benzofuránNH benzopirrol (indol)
144Fontosabb vegyületek:COOHHONHNH2NHNH2triptofán (Trp)szerotonin (vérnyomás hormonja)HOCOOHNHNMe2NHbufotenin(varangyméreg- Bufo bufo)mérges gombákban is3-indolilecetsav(heteroauxin - növényi növekedési hormon)Európai közönséges varangy(Bufo bufo)A szerotonin a vérnyomást szabályozza, felhalmozódása esetén alszunk, eközben elbomlik,ekkor ébredünk. Ha gátolt a képződése, a kóros álmatlanság lép fel. Alkohol hatásáraképződik.Az indolilecetsav a növények hosszanti növekedéséért felelős; a hasonló szerkezetűklórfenoxiecetsavak ellentétes hatásúak (auxinantagonisták):OCOOHClKlórfenoxiecetsav, herbicid (gyomirtó)IndigóAz Indigofera fajok tartalmazzák az indoxil-glükozidot, az indikánt, amelyenzimatikusan hidrolizál indoxillá. Az indoxil levegőn, állás közben kék színű, a vízbenoldhatatlan indigóvá oxidálódik.
145HONHOHOOHOHOHenzim- glükózNHOHNHOO 2NHOOHNindoxil-glükozid indoxil indigó(glikozid = aglikon + cukorrész; glükozid = aglikon + glükóz)Öttagú, két heteroatomot tartalmazó heterociklusokONSoxazol tiazol imidazol1,3-diazolNNHNONSizoxazol izotiazol pirazol1,2-diazolNNHNNObenzoxazolbenztiazolNSNNHbenzimidazolKötésrendszerNNS ENHN"'NN 'H- 1/2+ 1/2'
146Az imidazol tökéletesebb aromás rendszer, mint a pirrol.Bázikus tulajdonságú vegyületek, de a pirazol és az imidazol, savas protonjuk miatt, amfoterjellegűekN N N N N N N NH H HHN N N NHHR43 N2NH14(5)-R-imidazolR 5HN1gyors protonvándorlás(virtuális tautoméria)Az R csoport jelenlétében, már nem azonos a két tautomer.24N 3pirazol : csak dimerNHNHNNTermészetes vegyületekAlapvázak: 4 pirrol gyűrű, metilénhidakkal összekötveCH2 3CHCH1HC87NHNNHNCH64CH5HC87NHNNHNCHCHNNHCHNNCHporfin klorin korrinHemoglobinA hemoglobin a gerincesek vörös vérsejtjeiben lévő összetett fehérje (kromoproteid).Oxigénszállító szerepét régen felismerték és már 1862-ben kristályosan el is tudták különíteni.A hemoglobin fehérjementes része egy szubsztituált porfinvázas vegyület a porfirin vas(II)-komplexe. A hem totálszintézisét és ezzel szerkezetének felderítését H. Fischer (1929)valósította meg. A fehérjerész hisztidin nitrogénje a porfinváz síkjára merőleges iránybólkoordinatíve kapcsolódik a központi vas(II)-atomhoz. Ezzel ellentétes oldalról a vas(II)-atomegy oxigénmolekulát képes megkötni. Az oxigéntartalmú fehérjét oxihemoglobinnaknevezzük.
147HC CH 2CHOOkordinatívekötött oxigénCH 3CH CH 2H 3 CHCH 3 CH 2 C H 2 CCOOHNNNFe II CHNCH 3CHCH 2 CH 2COOHfehérjeNNFeNNHNNa hem síkjaa fehérjehisztidin részea hemoglobin hemjeaz oxihemoglobin szerkezeteSzénmonoxid mérgezés:KarboxihemoglobinKlorofillA klorofill a Nap sugárzó energiáját abszorbeálja és közvetíti a növényi sejtek energiátigénylő szintetikus folyamatai számára. A klorofill viaszállományú, rendkívül érzékenyvegyület, ami már enyhe behatásra (levegő, fény, savak, lúgok stb.) is irreverzibilis változástmutat. A klorofillt Willstätter (1904-1913) különítette el először tisztán és megállapította,hogy két hasonló szerkezetű anyag keveréke. A két vegyület, a klorofill-a és a klorofill-b csaka 3-helyzetű szénatom szubsztituensében különböznek. A 7,8-dihidro-porfinváz komplex<strong>kötés</strong>ű magnéziumot tartalmaz. A gyűrű oldalláncában lévő egyik karboxilcsoportot egyditerpénalkohol, a fitil-alkohol észteresíti.
148H 2 CH 3 CH 3 COHCHCHH 2 CH 2 CCOHNNRCH3CH 2 CH 3NMg CHNCHC3H OCOOCH 3fitil-csoportCH 3 H3 C H H 3 C H CH 3CH 2CH 3klorofill-a (R=CH 3 )klorofill-b (R=COH)B 12 -vitaminTőkehal (Gadus morhua)(csukamájolaj!!!)A B 12 -vitamin hiánya vészes vérszegénységet okoz. A betegség kezelésére korábban májkivonatot használtak, de a tiszta hatóanyagot a sztreptomicin gyártás során visszamaradóanyalúgból izolálták (Folkers, 1948). A B 12 -vitamin sötétvörös kristályos vegyület, optikailagaktív – vizes oldata balra forgató. Szerkezetét röntgendiffrakciós módszerekkel 1957-bentisztázták, amit 1971-ben totálszintézissel igazoltak (Woodward, 1971). A B 12 -vitamintszerkezete alapján cianokobalaminnek nevezték el. A korrinvázas vegyület középpontjábankobalt(III)-atom található, ami a gyűrű nitrogénjeihez egy kovalens és három koordinatív<strong>kötés</strong>sel kapcsolódik. A korrinváz nem teljesen síkalkatú, mivel a folytonos konjugáció csak13 atomra terjed ki. A kobaltatomhoz a négy nitrogénatom síkjára merőlegesen felülről egyciáncsoport kapcsolódik kovalens <strong>kötés</strong>sel, alulról pedig a benzimidazolgyűrű nitrogénjévellétesít koordinatív <strong>kötés</strong>t.
149OOH 2 N C CH 2 CHCH 3 2 H 3 CC CH2 C NH 2O H 3 CH OH 2 N C CH CN2 N N CH 2 CH 2 CHO 3 C Co CHHN NH 2 N C CH 2CH 3O CH C HCH 3OCH 2 CH 2CH 3CH CH 2 CH 2 C NH 3 2NHCH 2 CH O ON CH 3PCH 3 O OHONCH 3NH 2HOCH 2OB 12 -vitamin (cianokobalamin)A B 12 -vitamin biológiailag aktív formájában a ciáncsoport helyett adenozintrifosztátkapcsolódik a kobaltatomhoz.Imidazol gyűrűt tartalmazó aminosav az L-hisztidin: -(4-imidazolil)-L-alaninONOH enzim NNH 2 NH 2NNHhisztaminA hisztamin a hajszálereket tágítja, serkenti a simaizom működést. Allergiás tüneteknél nagymennyiségben kerül a szövetnedvekbe.Amidazophen: fájdalom- és lázcsillapítóCO 2NHNNOGombamérgekPh
150Muszkarinszindróma: Amanita muscaria (légyölő galóca), Clytocibe (fehér tölcsérgomba),Inocybe (susulyka) (hallucinogének).Clytocibe Inocybe Amanita muscariaHattagú, oxigéntartalmú heterociklusokOOO O O OOpiriliumion benzpirilium piron benzpiron (kromon)Pirán-származékokMeOHHOMeMeMeOTokoferol (E-vitamin)OHasis (marihuana)Olajbogyó olajfa vadkenderOlea europaeaCannabis sativaAz emberben a tokoferol hatása kevéssé ismert, hiánya nem okoz jellemző tüneteket. Atokoferolok könnyen oxidálódnak, miközben antioxidáns hatást fejtenek ki, ígymegakadályozzák a többszörösen telítetlen zsírsavak oxidációját. Biológiailag a D-alfatokoferola leghatásosabb. E-vitaminban gazdagok a növényi olajok, zöldnövények,gabonamagvak, de főleg a csíráztatott magvakból nyert olajok.
151Flavonoidokhidroxilcsoportokat tartalmazó fenilkromán-származékok, melyek szabad, illetveglikozidjaik formájában fordulnak elő a növényvilágbanOHOOdiglikozidHOOOHrutin (P-vitamin)(aglikon = kvercetin)OHHajdina (Fagopyrum esculentum)flavus = sárga (latin); erek permeabilitását befolyásolja (vérzékenység)(OH) n : 640 db.(OH) n (OCH 3 ): 38627 db.Osteochin R (Chinoin) = 7-izopropiloxiizoflavon (csontritkulás előrehaladását csökkenti)OPhOOOsteochinFlavin 7: A Flavin 7 termékek tartalma: flavonoidok (kvercetin, rutin, miricetin, kempferol,izoramnetin, malvidin-3-glükozid, katechin, krizin, galangin, apigenin, fizetin,
152luteolin, morin és sok más, kisebb mennyiségben elõforduló flavonoid), rezveratrol(transz-, cisz-, valamint ezek glükozidjai), egyéb, az alapanyagul szolgálógyümölcsökben található növényi antioxidánsok, vitaminok, ásványi anyagok,nyomelemek. A Flavin 7 összetevõi: 7 féle gyümölcsbõl készül, vörösszõlõ feketeszeder,feketecseresznye, feketeribizli, pirosribizli, szilva, alma. Minimális alkoholtartalma isvan.RezveratrolAntocianinok → glikozidok, hidrolízisük antocianidineket és cukrokat eredményez. Anövények színét adják.OHOHOHOHOHHOOOHHClHOOClcianidin-klorid (vörös)OHkékOOpiros muskátli, szegfű, ha bázikus talajba kerülnek, kékek lesznekPiridinszármazékokHattagú, nitrogéntartalmú heterociklusokNox.COOHOCNH 2OCNH NH 2NMeNNN(-) nikotin nikotinsav nikotinsav-amid izonikotinsav-hidrazidOHHOOHMe Npiridoxin (B 6 vitamin)ba N21kinolinbenzo[b]piridin1-azanaftalin10cbNaizokinolinbenzo[c]piridin2-azanaftalin
153NKötésrendszerNsp 2 (h 2 1 h 1 2 h 1 3 2p 1 z ) = 2,21 DStab. energia: 146,65 kJ/molk: S E -helyzet < benzolS N -helyzet (Csicsibabin reakció)NN+0,170,140 nm+0,050,139 nm+0,050,134 nm N-0,570,9671,0040,998N1,048elektronsûrûségBázicitás:A nitrogén sp 2 hibridállapota miatt nagyobb az s orbitál hányad, az elektronoknagyobb magvonzás alatt állnak, ezért a piridin gyengébb bázis, mint a tercier amin.Savmegkötőként alkalmazzák a szerves <strong>kémiai</strong> szintézisekben.NNpK b 4,2 8,8NHox. (persav)NOPd(C) / H 2vagyFe / AcOHNMeI / NMeIpiridin-N-oxidN-metilpiridinium-jodidterc-aminra utaló kvaternizálásPapaverin: izokinolinszármazék A mák (Papaver somniferum) egyik alkaloidja spazmolitikum (simaizom görcsoldó)MeOMeOMeONCH 2MeO
154No-spa: görcsoldó készítmény (Chinoin)MeOPiridoxin (adermin, B 6 -vitamin) hiánya patkányon bőrgyulladást okoz rizskorpa, élesztő tartalmazzaMeOCHNHOEtHOMeNOHOHop. 136 o COEtPiperidin származékokFentanyl: fájdalomcsillapító, enyhe narkotikumONN[N-fenil-N-(1-feniletil-4-piperidil)]propionsav-amidPiperin: a bors tartalmazza, transz-transz izomer, cisz változata a kavicin, ami a borscsípős ízéért felelős.OOCNOOCNOpiperinOkavicinHosszabb állás után, a bors elveszti csípős ízét, mert a kavicin a stabilabb piperinnéizomerizálódik.Feketebors (Piper nigrum)
155Hattagú, két nitrogénatomot tartalmazó heterociklusokN Npiridazin1,2-diazinN13N21Npirimidin1,3-diazin2 N3NNpirazin1,4-diazinNNS E'"N sp 2 (h 2 1 h 1 2 h 1 3 2p 1 z )'NS NpK b : 12,7 (piridin 8,8)az elektronfelhő erősen torzultPirimidinszármazékok biológiai tulajdonságai1. Az uracil, timin, citozin a nukleinsavak építőköveiOOHONHO NHObarbitursavCH 3NCH 3NHOHNtimin (5-metiluracil)NHOOOHNH 2NH 2NHNNNNuracilONOH2,4-dihidroxipirimidinNOHcitozinNHO2. B 1 -vitamin (aneurin = tiamin-hidroklorid): szénhidrát anyagcsere, főbbenergiaszolgáltató folyamatok, idegek működése, idegrendszer energiaellátása,szívműködésNClNMeOHMe NNH 3SCl3. A barbitursav 5,5-diszubsztituált származékai bénítják az idegrendszert. Azadagolástól, alkalmazástól (perorális vagy intravénás) függően altató-,nyugtatóhatást vagy narkózist idéznek elő
156NOHEtEtNOHEtPhHONOHHONOHNéhány ismert barbiturát „rajongó‖:Veronál LuminalRyunosuke Akutagawa – japán író, (―Az éneklő borz‖) barbiturát túladagoláskövetkeztében halt meg (öngyilkosság), július 24, 1927.Adolf Hitler - metamfetamin és kokain élvező volt, barbiturátokat szedett alvászavarellen.Judy Garland véletlen barbiturát túladagolásban halt meg.Marilyn Monroe, George Sanders: amerikai színészek is.Jimi Hendrix: barbiturát túladagolás és hányás belélegzésJohnny Cash: túlzásba vitte a barbiturátok szedését karrierje csúcsánElvis Presley: utolsó éveiben sok barbiturátot szedett, de vitatott, hogy ez hozzájárultvolna a haláláhozMargaux Hemingway: amerikai színésznő, az író unokája, fenobarbitál túladagolásbanhunyt el Pier Angeli: színésznő, 1971 Jean Seberg: színésznő, Párizs, 1979, mindketten barbiturát túladagolás4. A szulfapirimidinek baktericid szerek:RNH 2 NSO 2HNNR'Szulfaguanidin (R, R' = H, Me)Szuperszeptil (R,R' = Me)Purinvázas vegyületekPurin = imidazo[4,5-d]pirimidinE. Fischer régi képlete:1 N2 C3 N6CH75 C NHdCcN4 9aCH 8b
157HHHNNNNHONOHNNNHHONNOHNNHNNHpurinvázOHxantin húgysav adenin guanin2,6-diOHpurin 2,6,8-triOHpurin 6-aminopurin 2-amino-6-OHpurinNNH 2NNNNHNH 2 NNOHNNNHMeNOMeNHNOMeNMeNONONMeNONMeNONMeNHkoffein teobromin teofillin1,3,7-trimetilxantin 3,7-dimetilxantin 1,3-dimetilxantinKávécserje (Coffea arabica)Teacserje (Thea sinensis)Nukleinsavak1865-ben egy brüni (Brno) apátságban magányosan kertészkedő szerzetes, GregorMendel néhány kvantitatív következtetést von le borsókeresztezési kísérleteiből, és ezzel -anélkül, hogy tudna róla - megalapozza korunk talán legfontosabb tudományát, a genetikát.Felismerései annyira újszerűek, hogy noha dolgozatát kora egyik vezető biológusának iselküldi, azok nyomtalanul és visszhangtalanul süllyednek el, amíg 1900-ban hárman(DeVries, Correns, Tschermak) újra fel nem fedezik őket. Négy évvel Mendel dolgozata után,1869-ben, egy bázeli katonaorvos, Friedrich Miescher sebesült katonák gennyel átitatott<strong>kötés</strong>eiből izolál és ír le egy új, foszfortartalmú, nagymolekulájú szerves anyagot, amelyetnukleinnek nevez el (ma DNS-nek hívjuk). Ez a felfedezés is meglepő, olyannyira, hogy a korbiokémikus pápája, Hoppe-Seyler két évig visszatartja a közleményt, amíg saját maga megnem ismétli Miescher kísérleteit, így meggyőződvén azok hitelességéről.
158Gregor Mendel (1822-1884) Friedrich Miescher (1844-1895) Felix Hoppe-Seyler (1825-1895)Nagy tömegű, polimer vegyületek, az élő szervezetben a genetikai információtárolását és a peptidek, valamint a fehérjék bioszintézisét irányítják.A különféle sejtekből nyert nukleinsavak teljes hidrolízisével pentózokat, purin- éspirimidinbázisokat, valamint foszforsavat lehet izolálni.Építőegységek:nukleotidok = szerves bázis + cukor + foszforsavnukleozidok = cukor + szerves bázisnukleoprotein (protamin + nukleinsav)hidrolízis (víz)nukleinsavakRNS / DNS(polimer)fehérje (protamin)hidrol.nukleotidok(monomer)hidrol. (OH )nukleozidok H 3 PO 4hidrol. (H 3 O )pirimidin és puringyûrûsvegyületekpentózokHO543OHO12ROHD-ribóz2-dezoxi-DribózROHHOONH 2NH 2OHNHNMeNNNHNNONHONHONHNNHH 2 NNNHuracil timin citozin adenin guaninU T C A GRNS DNS RNS / DNS RNS / DNS RNS / DNS
159Nukleozidok szerkezete (N-glikozidok)RNS ribonukleozidokHOO87NN9NH 26N 1N 23HOONNONNHNH 2OH OHadenozin9-(-D-ribofuranozil)adeninOH OHguanozin9-(-D-ribofuranozil)guaninHOOO1 NNH2654N3HOOOHNONOH OHcitidin3-(-D-ribofuranozil)citozinOH OHuridin3-(-D-ribofuranozil)uracilDNS dezoxiribonukleozidokHO5'4'3'OHO2'dezoxiadenozin9-(2'-dezoxi--D-ribofuranozil)adenin1'NNNH 2NNONNHHOO N N NH 2OHdezoxiguanozin9-(2'-dezoxi--D-ribofuranozil)guaninNH2ONHNMeHOOONHOOONOHdezoxicitidin3-(2'-dezoxi--D-ribofuranozil)citozinOHtimidin3-(2'-dezoxi--D-ribofuranozil)timinHa a timidinben a 3’-OH = N 3 (azidocsoport) „AZT‖ (AIDS vírus szaporodását csökkenti))
160ZidovudineNukleinsavak primer szerkezeteA polinukleotid láncban a láncvégeken csak az egyik hidroxilcsoport észteresített. Atapasztalat szerint P-terminális az 5’-helyzetben van észteresítve, míg az O-terminális (vagyisa szabad hidroxilcsoport) 3’-OH csoport. Formailag úgy tekinthető a polinukleotidlánc, hogybennük a nukleozid-5’-foszfátok acilezik egymást a 3’-helyzetű hidroxilcsoportokonkeresztül. DNS-molekulákban általában nincs szabad láncvég, gyűrűvé záródnak össze aláncvégek.A polinukleotidlánc alapváza a polifoszforsav-diészter makromolekula, mely pentózfoszfátösszekapcsolással alakul ki.1 2 3 nN O N ONNOHO pentóz O P Opentóz O P OpentózOOpentóz O P OHOHOHOHO-terminusP-terminus
161Nukleinsavak másodlagos szerkezeteWatson és Crick, 1953 a nukleinsavak szerkezetére tettek javaslatot: két lánc,spirális, egyetlen tengely köré csavarodva, jobbraforgó spirál, de a molekulák a két láncbanellentétes irányban haladnak. A két láncot purin- és pirimidin-bázisok kapcsolják össze. A bázisoksíkja merőleges a fonal tengelyére. Párokban kapcsolódnak, az egyik lánc bázisa hidrogénhíddalkötődik a másik lánc bázisához. Az egyik purin kell legyen, a másik pirimidin ahhoz, hogy akapcsolódás kialakulhasson. A feltételezett specifikus párosodás a genetikai anyag lehetségesmásoló mechanizmusára utal.A és T, valamint a G és C hidrogén<strong>kötés</strong>sel kapcsolódhatnak össze, így a bázisokhozkötődő dezoxiribóz molekulák csaknem azonos távolságra kerülnek egymástól (~ 11 angström)HN N H2.8 A oOMeNO2.9 A oHHNcukorNNN H NN N H NNNNOcukor cukorN H Ocukor11.1 A o H10.8 A oA T G CAzonos típusú bázisok között nem tud kialakulni stabilis hidrogén<strong>kötés</strong>, másrészt acukormolekulák túl messze, vagy túl közel lennének egymáshoz.HN N HONHNHOMecukorNNNH NH NH13.5 A oNNcukorcukorNNOH NO8.5 A oNcukorA G C Ttúl hosszútúl rövidA purin- és pirimidinbázisok eltérő kapcsolódása (pl. A-C) sem jöhet létre, mivel így nem tudnakialakulni stabilizáló hidrogén<strong>kötés</strong>.
162HN N HHHNcukorNNNNONcukorA CA kettős spirál szerkezeteA DNS önreprodukciója:DNS-polimeráz enzim hatására szétcsavarodik, és ezzel párhuzamosan megindul akomplementer szál képződése. Ez dezoxiribonukleozid-5’-foszfátból képződik úgy, hogy kétszomszédos nukleozid-trifoszfát között - pirofoszforsav lehasadással – az enzim foszforsavdiészter<strong>kötés</strong>t hoz létre. Az eredeti bázishoz hidrogén<strong>kötés</strong>sel kapcsolódik a komplementerbázis, és így kialakul az új kettős hélix.
163Az RNS szerkezeteEgy szálból épül fel, rövidebb nukleotid láncot tartalmaz. A fehérje szintézisért felelős.
164