R - Szerves Kémiai Tanszék
R - Szerves Kémiai Tanszék
R - Szerves Kémiai Tanszék
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
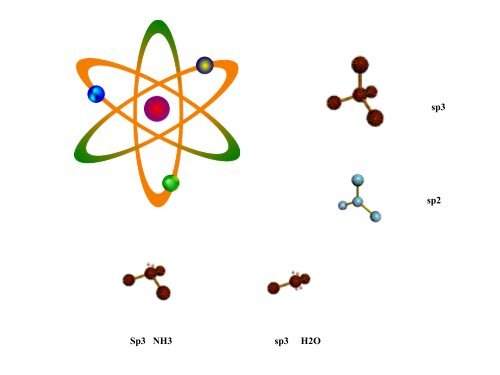
sp3<br />
sp2<br />
Sp3 NH3 sp3 H2O
Attractive and repulsive forces acting between two H atoms<br />
Potential energy of the system during bond formation<br />
2
A VB módszer két atom között létrejövő kötést két AO (azonos előjelű részük közt<br />
létrejövő) "átlapolásával" értelmezi (lokalizált kötés):<br />
s<br />
s<br />
<br />
p<br />
s<br />
<br />
p<br />
p<br />
<br />
p<br />
p<br />
<br />
A molekulapálya elmélet: valamennyi atom atompályája (AO) részt vesz a kötés<br />
kialakításában. Így delokalizált kötések jönnek létre<br />
3
Hibridizáció elmélet<br />
sp 3<br />
4
sp 2<br />
5
sp<br />
6
Rezonancia elmélet<br />
7
Allil kation<br />
Allil gyök<br />
Benzil kation<br />
8
csökken<br />
csökken<br />
Elektroneltolódási jelenségek<br />
<br />
A<br />
<br />
B<br />
dipólusmomentum<br />
Br<br />
Br<br />
nincs dipólusmomentum<br />
Br<br />
Br<br />
van dipólusmomentum<br />
Szén pillératomhoz kapcsolódó atom/atomcsoport a -kötőelektron párra gyakorolt hatását<br />
induktív effektusnak nevezzük (I).<br />
Ez lehet: elektronküldés (+I), vagy elektronszívás (-I)<br />
Az EN-i értékek miatt az atomok/csoportok többsége –I effektusú.<br />
9
Ugyanakkor a konjugáció is gyakorolhat induktív effektust, az sp 2 hibridállapotú atomok p z<br />
pályáinak kölcsönhatása révén.<br />
Mezomer effektus: p és π elektronpályák (beleértve a nemkötő elektronpárokat is) átfedése<br />
következtében létrejövő konjugatív jellegű elektroneltolódási jelenség.<br />
(–M): elektronszívás<br />
(+M): elektronküldés<br />
•sp 2 szénatomok p z<br />
elektronjainak kölcsönhatása nemkötő elektronpárokkal (+M)<br />
LCAO-MO: hétcentrumos pálya (7 MO), 8 delokalizálódó elektronnal<br />
10
•sp 2 szénatomok p z<br />
elektronjainak kölcsönhatása üres (vagy megüresedett) p z<br />
pályákkal (-M)<br />
Összegzés<br />
11
Hiperkonjugáció<br />
A kémiai reakciók felosztása<br />
12
Reaktív részecskék képződése<br />
Reagensek<br />
Gyökök: CH 3 ∙, CH 2 =CH-CH 2 ∙<br />
Nukleofilek: HO – , Cl – , NH 3<br />
Elektrofilek: AlCl 3 , H + , NO 2<br />
+<br />
13
E pot<br />
átmeneti állapot<br />
E pot<br />
átmeneti állapotok<br />
A<br />
B<br />
reakciókoordináta<br />
A<br />
B<br />
köztitermék<br />
reakciókoordináta<br />
a) b)<br />
Kinetikai fogalmak<br />
A reaktánsoknak jelentős energiára kell szert tenniük, azaz a reakció végbemeneteléhez le kell<br />
küzdeniük az aktiválási energiát, amely a reakció kinetikai feltétele.<br />
Termodinamikai fogalmak<br />
A szabadentalpia-csökkenés egy adott reakció termodinamikai feltétele.<br />
14
Sav-bázis alapfogalmak<br />
Lewis sav: elektronpár-akceptor<br />
Lewis-bázis: elektronpár-donor<br />
pl. H + + :OH = HOH<br />
:NH 3 + H 2 O = NH 4<br />
+<br />
+ OH <br />
15
Szerkezeti (konstitúciós izoméria)<br />
Váz (lánc)<br />
Tautoméria<br />
Helyzet<br />
Funkciós<br />
17
Savkatalízis<br />
Báziskatalízis<br />
18
Konfigurációs izoméria<br />
Geometriai izoméria<br />
Kiralitás<br />
19
Abszolút konfiguráció: valamely királis képződményt alkotó elemek, ligandumok térábrában<br />
megjeleníthető tényleges térbeli elrendeződése<br />
Relatív konfiguráció: két különböző királis molekula konfigurációjának megfeleltetése egymásnak<br />
fizikai vagy kémiai módszerekkel, ismert abszolút konfigurációjú (vagy önkényesen rögzített<br />
konfigurációjú) referenciavegyületre való visszavezetés.<br />
21
atomic number: Br > O > C > H<br />
priority: Br > O > C > H<br />
23
Alkánok<br />
24
Etán konformációs izomerjei<br />
25
A bután konformációi<br />
26
A metán klórozása<br />
27
A metán brómozása<br />
28
Cikloalkánok<br />
31
Alkének<br />
34
Alkének elektrofil addíciós reakciója<br />
35
A bróm addíciója alkénekre<br />
36
Hidrogén-halogenid addíciója<br />
38
Katalitikus hidrogénezés<br />
39
Alkének savas hidratációja<br />
40
Alkének gyökös addíciós reakciója<br />
Lánckezdő lépés<br />
Láncvívő lépések<br />
41
Hidroborálás<br />
A diborán szerkezete<br />
43
Ozonolízis<br />
44
Polimerizáció<br />
45
Oxidáció persavval<br />
46
Oxidáció vicinális diolokká<br />
47
Butadién<br />
48
Alkinek reakciói<br />
Hidrogén-halogenid addíció<br />
49
Víz addíció<br />
50
Halogén addíció<br />
Katalitikus hidrogénezés: Lindlar kat. (Pd/CaCO3)<br />
51
Hidroborálás<br />
52
Redukció Na/ammóniaval<br />
53
Etinilezési reakciók<br />
54
Aromás vegyületek<br />
55
Fontosabb aromás vegyületek<br />
56
Aromacitás feltételei: planáris (sík) gyűrűs szerkezet, sp2 hibridállapotú atomok<br />
közel egyenlő kötéstávolságok<br />
átlapoló p z<br />
pályák<br />
4n+2 p elektron (Hückel szabály), n = 0,1,2, stb.<br />
58
Az aromás elektrofil szubsztitúció mechanizmusa<br />
60
A benzol brómozása<br />
61
Nitrálás<br />
63
Szulfonálás<br />
64
Alkilezés<br />
65
Az alkilezési reakció korlátai<br />
66
Acilezés<br />
67
Halogénezés oldalláncba<br />
68
Oxidáció<br />
Mindig benzoesavhoz vezet<br />
69
Aromás nukleofil szubsztitúció (addíció-elimináció)<br />
70
Aromás nukleofil szubsztitúció (elimináció-addíció)<br />
de<br />
71
Az aromás elektrofil szubsztitúció irányítási szabályai<br />
Reaktivitás és regioszelektivitás<br />
72
Induktív és mezomer effektusok<br />
Induktiv effektus – elektron szívás (-I) vagy küldés (+I) egy -kötésen keresztül<br />
Mezomer effektus (nemkötő vagy -elektronok megváltoztatják az aromás rendszer elektroneloszlását )<br />
elektronszívó csoportok<br />
73
elektronküldő csoportok<br />
74
Halogének, nitrozo- és szulfinil(tionil)csoportok irányítása<br />
-I > +M<br />
77
Az aromás gyűrű elektronsűrűségéért (a -komplex stabilitásért/reaktivitásért) az induktív<br />
és a mezomer effektus együttesen felelős<br />
Egy adott -komplex stabilitásáért (irányítás, regioszelektivitás) kizárólagosan a mezomer<br />
effektus felelős – o,p-irányítás: +M effektus (ok: eggyel több határszerkezet)<br />
78
Halogénezett vegyületek<br />
79
R-<br />
80
Elimináció, E2 mechanizmus<br />
85
Zajcev szabály<br />
86
E2 sztereokémiája<br />
Az antiperiplanáris helyzet a kedvező, mert<br />
a két -kötés így igazodik legjobban a kettős<br />
kötés kialakításához.<br />
87
Elimináció E1 mchanizmus<br />
88
Alkoholok<br />
•az oxigénatom magános elektronpárjai viszonylag nehezen polározhatók, az oxigénatom ún,<br />
merev (kemény, "hard") bázis;<br />
•jó távozó csoportok az erős savak anionjai (ún. konjugált bázisai), rossz távozó csoportok pedig<br />
értelemszerűen a gyenge savak anionjai (konjugált bázisai). Ezért jó távozó csoport pl. a H 2 O<br />
(mert a H 3 O + erős sav) és rossz távozó csoport az OH - (mert a H 2 O igen gyenge "sav" - hétköznapi<br />
értelemben nem is sav, hanem semleges molekula)<br />
89
Alkoholok szubsztitúciós reakciói<br />
90
Szubsztitúció tionol-kloriddal (SOCl 2 )<br />
Oxidációs reakciók<br />
Krómsavval vagy piridimium-klorokromáttal (PCC)<br />
91
Dehidratálás<br />
94
Fenolok reakciói<br />
Kolbe szintézis<br />
Reimer-Tiemann szintézis<br />
Brómozás<br />
95
Fries átrendeződés<br />
Acilezés<br />
96
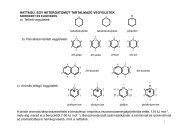
Természetes fenolok:<br />
Timol (kakukkfű)<br />
Rezveratrol (gyümölcsök)<br />
OH O<br />
R 1 O<br />
R 2<br />
OH<br />
OH<br />
OH O<br />
R 1 O<br />
R 2<br />
O<br />
O<br />
+<br />
H.<br />
H 2 O<br />
HO<br />
.<br />
.<br />
HO<br />
HOO<br />
OH O<br />
H 2 O<br />
HOOH<br />
R 1 O<br />
R 2<br />
O<br />
O<br />
.<br />
H<br />
98
Éterek<br />
Williamson féle szintézis<br />
Vízelvonás alkoholokból: csak szimmetrikus éterek esetén kedvező<br />
99
Éterek hasítása<br />
Oxidáció: peroxid képződés, robbanékony<br />
100
Gyűrűs éterek<br />
O<br />
O<br />
O<br />
tetrahidrofurán 1,4-dioxán oxirán<br />
O<br />
Ipari előállítás<br />
Laboratóriumi előállítás<br />
101
Oxiránok reakciói<br />
102
103