Tópico 5 - Editora Saraiva
Tópico 5 - Editora Saraiva
Tópico 5 - Editora Saraiva
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
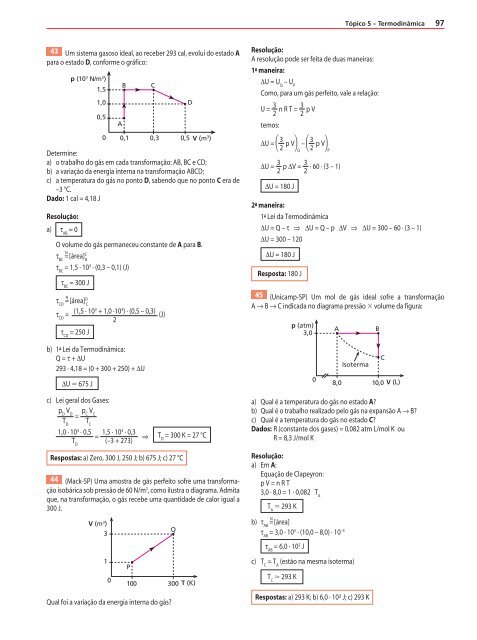
43 Um sistema gasoso ideal, ao receber 293 cal, evolui do estado A<br />
para o estado D, conforme o gráf ico:<br />
p (10 3 N/m 2 )<br />
1,5<br />
1,0<br />
0,5<br />
A<br />
B<br />
C<br />
V (m3 0 0,1 0,3 0,5 )<br />
Determine:<br />
a) o trabalho do gás em cada transformação: AB, BC e CD;<br />
b) a variação da energia interna na transformação ABCD;<br />
c) a temperatura do gás no ponto D, sabendo que no ponto C era de<br />
–3 °C.<br />
Dado: 1 cal = 4,18 J<br />
Resolução:<br />
a) τ = 0 AB<br />
O volume do gás permaneceu constante de A para B.<br />
τ = BC N [área] C<br />
B<br />
τ = 1,5 · 10 BC 3 · (0,3 – 0,1) (J)<br />
τ BC = 300 J<br />
τ = CD N [área] D<br />
C<br />
τ = CD (1,5 · 103 + 1,0 ·103 ) · (0,5 – 0,3)<br />
(J)<br />
2<br />
τ = 250 J<br />
CD<br />
b) 1 a Lei da Termodinâmica:<br />
Q = τ + ΔU<br />
293 · 4,18 = (0 + 300 + 250) + ΔU<br />
ΔU 675 J<br />
c) Lei geral dos Gases:<br />
pD VD =<br />
TD pC VC TC 1,0 · 103 · 0,5<br />
=<br />
TD 1,5 · 103 · 0,3<br />
(–3 + 273)<br />
D<br />
⇒ T D = 300 K = 27 °C<br />
Respostas: a) Zero, 300 J, 250 J; b) 675 J; c) 27 °C<br />
44 (Mack-SP) Uma amostra de gás perfeito sofre uma transformação<br />
isobárica sob pressão de 60 N/m 2 , como ilustra o diagrama. Admita<br />
que, na transformação, o gás recebe uma quantidade de calor igual a<br />
300 J.<br />
V (m 3 )<br />
3<br />
1<br />
0<br />
P<br />
100<br />
Qual foi a variação da energia interna do gás?<br />
Q<br />
300 T (K)<br />
Resolução:<br />
A resolução pode ser feita de duas maneiras:<br />
1a maneira:<br />
ΔU = U – U Q P<br />
Como, para um gás perfeito, vale a relação:<br />
U = 3<br />
n R T =<br />
3<br />
p V<br />
2 2<br />
temos:<br />
ΔU = 3<br />
2 p V –<br />
Q<br />
3<br />
2 p V P<br />
ΔU = 3<br />
p ΔV =<br />
3<br />
· 60 · (3 – 1)<br />
2 2<br />
ΔU = 180 J<br />
<strong>Tópico</strong> 5 – Termodinâmica<br />
2a maneira:<br />
1a Lei da Termodinâmica<br />
ΔU = Q – τ ⇒ ΔU = Q – p ΔV ⇒ ΔU = 300 – 60 · (3 – 1)<br />
ΔU = 300 – 120<br />
ΔU = 180 J<br />
Resposta: 180 J<br />
97<br />
45 (Unicamp-SP) Um mol de gás ideal sofre a transformação<br />
A → B → C indicada no diagrama pressão volume da f igura:<br />
p (atm)<br />
3,0<br />
0<br />
A<br />
8,0<br />
Isoterma<br />
B<br />
C<br />
10,0 V (L)<br />
a) Qual é a temperatura do gás no estado A?<br />
b) Qual é o trabalho realizado pelo gás na expansão A → B?<br />
c) Qual é a temperatura do gás no estado C?<br />
Dados: R (constante dos gases) = 0,082 atm L/mol K ou<br />
R = 8,3 J/mol K<br />
Resolução:<br />
a) Em A:<br />
Equação de Clapeyron:<br />
p V = n R T<br />
3,0 · 8,0 = 1 · 0,082 TA T 293 K<br />
A<br />
b) τ AB = N [área]<br />
τ AB = 3,0 · 10 5 · (10,0 – 8,0) · 10 –3<br />
τ AB = 6,0 · 10 2 J<br />
c) T C = T A (estão na mesma isoterma)<br />
T C 293 K<br />
Respostas: a) 293 K; b) 6,0 · 10² J; c) 293 K