Elektriksel Malzemeler Ders Notları Yrd. Doç. Dr. Nil Toplan 1 Bağ ...
Elektriksel Malzemeler Ders Notları Yrd. Doç. Dr. Nil Toplan 1 Bağ ...
Elektriksel Malzemeler Ders Notları Yrd. Doç. Dr. Nil Toplan 1 Bağ ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
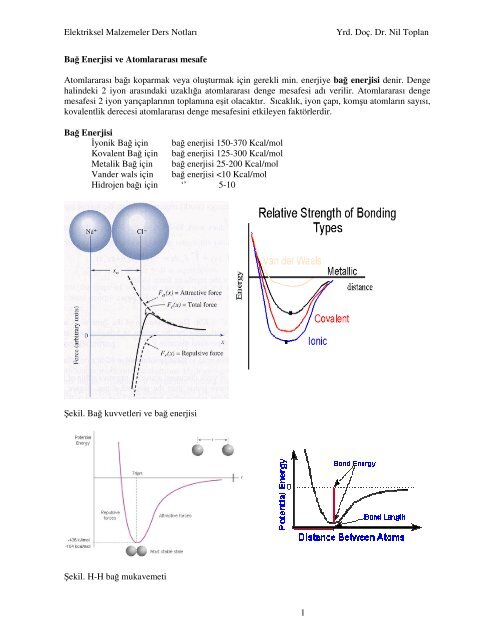
Bağ Enerjisi ve Atomlararası mesafe<br />
Atomlararası bağı koparmak veya oluşturmak için gerekli min. enerjiye bağ enerjisi denir. Denge<br />
halindeki 2 iyon arasındaki uzaklığa atomlararası denge mesafesi adı verilir. Atomlararası denge<br />
mesafesi 2 iyon yarıçaplarının toplamına eşit olacaktır. Sıcaklık, iyon çapı, komşu atomların sayısı,<br />
kovalentlik derecesi atomlararası denge mesafesini etkileyen faktörlerdir.<br />
Bağ Enerjisi<br />
İyonik Bağ için bağ enerjisi 150-370 Kcal/mol<br />
Kovalent Bağ için bağ enerjisi 125-300 Kcal/mol<br />
Metalik Bağ için bağ enerjisi 25-200 Kcal/mol<br />
Vander wals için bağ enerjisi
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
Atomlararası Denge Mesafesi<br />
<strong>Malzemeler</strong> çok sayıda atomların bağ kuvvetleri etkisi altında bir arada dizilmesiyle oluşur.<br />
Atomlararası uzaklık atomların diziliş biçimini ve yapısını belirlemede büyük rol oynar.<br />
Atomlararası mesafeyi en basit şekilde anlatmak için zıt işaretli iki iyondan oluşan bir model alınır.<br />
İki iyon arasındaki çekme kuvveti sayesinde iyonlar arası mesafe azalır. İyonlar birbirine<br />
değdiklerinde aynı yüklü elektronlar arasındaki itme kuvvetleri uzaklığın azalmasını zorlaştırırlar.<br />
İtme kuvvetleri yakın mesafede çok şiddetlidir. Mesafe uzadıkça hızla azalan itme kuvveti “0” olur .<br />
Çekme ve itmenin eşit olduğu noktada kuvvet sıfırdır ve iyonlar arası denge oluşur. Denge<br />
halindeki iki iyon arasındaki uzaklığa, atomlar arası denge mesafe adı verilir.<br />
Atomlararası mesafeyi etkileyen faktörler:<br />
Sıcaklık<br />
Denge halindeki iki atomun arasındaki uzaklık bunların atom yarıçaplarının toplamına eşittir. Bu<br />
mesafeler sıcaklığı arttırmamız durumunda artacaktır<br />
Saf Metal da Mesafe = R+R =2R<br />
İki tür Metal da mesafe = R1+R2<br />
İyon çapı<br />
Bir atomdan valans elektronları uzaklaştırılırsa çapı küçülür, ilave edilirse çapı büyür. Bu tür<br />
malzemelerde atomlararası mesafe iyon çaplarının toplamına eşittir.<br />
Örnek : //<br />
Nötr Fe atomunun yarıçapı R=1,241 Å<br />
Fe +2 ‘nin R=0,74 Å<br />
Fe +3 ‘nin R=0,64 Å<br />
O -2 ‘nin R=1,41 Å<br />
FeO malzemesinde atomlararası mesafe = 1,41+0,74 = 2,15 Å<br />
Bir atomu kuşatan atomların sayısı= Koordinasyon sayısı<br />
Bir atomu çevreleyen atomların sayısı arttıkça bunların elektronlarının arasındaki zıt etkileşme<br />
nedeniyle atomlararası mesafe de artacaktır. HMK sistemde bir atoma en yakın komşu atomların<br />
sayısı (KS) 8 dir. YMK sistemde ise KS=12dir. YMK sistemde komşu atomlar, HMK sistemdeki<br />
atomlara göre biraz daha uzaktırlar ve YMK yapıdaki atomlararası mesafe daha fazladır. Örneğin<br />
HMK nötr demirde atomlararası mesafe 1.241 A iken YMK nötr Fe de biraz artarak 1.269 A<br />
olmaktadır.<br />
Kovalentlik derecesi<br />
Kovalent bağlı cisimlerde kovalentlik derecesi dolayısıyla paylaşılan elektron sayısı arttıkça<br />
atomlar birbirlerini daha kuvvetli çekeceklerinden atomlararası mesafe azalır. Çünkü ne kadar çok<br />
elektron paylaşılırsa, atomlar birbirini daha kuvvetli çekeceklerdir. Dolayısı ile atomları birbirinden<br />
ayırmak için de daha fazla enerjiye ihtiyaç duyulacaktır.<br />
Örnek://<br />
C-C = 1,54 Å<br />
C≡C = 1,2 Å<br />
Bir malzemeye ait bağ enerjisi çukuru ne kadar derin ise, o malzemenin atomlararası bağını<br />
koparmak için o kadar fazla enerjiye ihtiyaç vardır. Dolayısı ile malzemenin ergime sıcaklığı da o<br />
oranda yüksek olur. Ergime sıcaklığı yüksek olan malzemelerin ısıl genleşmeleri daha düşüktür.<br />
2
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
2.5. Koordinasyon Sayısı<br />
Gerçek malzemeler yalnızca iki atom arasında değil, çok sayıda atomların bağ kuvvetleri etkisinde<br />
kütle halinde dizilmeleri sonucu oluşurlar. Koordinasyon sayısı bir atoma teğet komşu atomların<br />
sayısına denilmektedir. Bireysel atomlardan oluşan gazlarda atomlar arası bağ olmadığından<br />
koordinasyon sayısı sıfır sayılır.<br />
Merkez atom yarıçapı “r” onu çevreleyen atomların yarıçapı “R” ise r/R oranı bize koordinasyon<br />
sayısını verir. Minimum atomik boyut oranları ( r/R) koordinasyon sayısının belirlenmesinde<br />
etkilidir. R (-) iyon çapı, r (+) iyon çapı<br />
Tablo. Koordinasyon sayısı ve atom çapları arasındaki oran ilişkisi<br />
Koordinasyon Sayısı Minimum r/R oranı<br />
3 0,155<br />
4 0,255<br />
6 0,414<br />
8 0,732<br />
12 1,00<br />
KS: 4 ([Ni(CO)4] , [Cu(CN)4] 3- , Si, Ge, ZnS) KS: 6 (NaCl)<br />
KS=8 (CsCl) KS: 12 (Pb)<br />
3
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
BÖLÜM 4. KRİSTAL YAPILAR<br />
<strong>Malzemeler</strong>deki hataları ihmal edersek, atomik düzenlemeyi 3 aşamada inceleyebiliriz.<br />
Düzensizlik (Amorf yapı)<br />
Kısa mesafede düzenlilik (Moleküler yapı)<br />
Uzun mesafede “ (Kristal yapı)<br />
Atomların dizilme şekillerine bağlı olarak, malzemelerin özellikleri ve mikroyapıları değişmektedir.<br />
Bir malzemeyi meydana getiren yapılardan amorf yapı, atomların düzensiz veya rastgele dizilmesi<br />
(gazlar, sıvılar ve katı maddelerden cam amorf yapıya örnektir) ile, moleküler yapı, moleküllerin<br />
zayıf bağlarla bağlanarak birarada bulunması ile (Moleküler yapılı malzemelerde, molekül<br />
içerisinde düzenli bir diziliş sözkonusu iken moleküller arası rastgele bir dizilişe sahiptir. H2O,<br />
CO2, O2, N2 ve birçok polimer malzemeler moleküler yapıya sahiptir). Kristal yapı ise atomların<br />
belirli bir geometrik düzene göre dizilmesi ile oluşmaktadır (bütün metaller, çoğu seramik<br />
malzemeler ve bazı polimerler kristal yapıya sahiptirler).<br />
Şekil 1. Amorf ve kristalin yapılar<br />
Atomların üç boyutlu uzayda belli bir düzene göre dizilmeleri sonucu oluşan kristal yapıda düzenli<br />
diziliş birbirinin tekrarlanması şeklinde olur. Düzenli yapının en küçük birimine “ birim hücre “<br />
denir. Birim hücre, tüm kafesin bütün özelliklerine sahiptir. Bunlar yan yana dizilerek kristal<br />
yapının tamamı elde edilir. Bir kristal yapıyı tanımlamak için birim hücresini tanımlamak yeterlidir.<br />
Birim hücrenin kenar uzunlukları ve kenarları arasındaki açılar kafes parametresidir. Kafes<br />
parametrelerinin farklı kombinasyonları sonucu olarak değişik geometrik şekillere sahip 14 tane<br />
kristal kafes mevcuttur. Metallerde en fazla görülen HMK, YMK ve HSP kristal kafesleridir.<br />
KristalYapı<br />
Birim<br />
Hücre<br />
4
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
Kristal yapı türleri<br />
Genelde 7 farklı kristal türü veya sistemi vardır. Uzayda en genel halde bir eksen takımı seçilsin ve<br />
bu eksen takımı arasındaki açılar α, β ve γ olsun ve uzay bu eksenler boyunca eşit aralıklı paralel<br />
düzlemler geçirilerek eşit hacimlere ayrılsın. Aşağıdaki şekilde de görüldüğü gibi x ekseni boyunca<br />
a, y ekseni boyunca b ve z ekseni boyunca c aralıklarıyla geçirilen düzlemlerin ayırdığı eşit<br />
hacimler eğik ve genel prizma şeklindedir. Birim hücre olarak adlandırdığımız bu prizmanın α, β ve<br />
γ açılarına ve a,b,c kenarlarına özel değerler verilerek 7 kristal türünün birim hücreleri elde edilir.<br />
a<br />
β<br />
α<br />
γ<br />
Şekil 2. Kafes parametreleri<br />
b<br />
Kübik kafes yapıları<br />
Tablo 1. 7 farklıkristal sistemlerine ait kafes parametreleri<br />
Geometrik olarak kübik kristalde atomlar üç farklı şekilde dizilerek basit kübik (BK), hacim<br />
merkezli kübik (HMK) ve yüzey merkezli kübik (YMK) kafeslerini oluşturabilirler.<br />
Basit Kübik (B.K)<br />
c<br />
Kristal Türü a,b,c α , β , γ<br />
Kübik a=b=c α =β= γ=90°<br />
Tetragonal a=b≠c α =β= γ=90°<br />
Ortorombik a≠b≠c α =β= γ=90°<br />
Monoklinik a≠b≠c α = γ =90 β ≠90°<br />
Triklinik a≠b≠c α ≠β ≠γ ≠90°<br />
Rombohedral a=b=c α ≠β≠ γ ≠90°<br />
Hegzagonal a1=a2=a3≠c Açılar β= γ= 90 ve<br />
α = 120°<br />
R R<br />
5<br />
a0=2R<br />
Köşelerde birbirine teğet değen atomlar vardır. Ancak kararsız bir diziliş türü olduğu için<br />
doğada bu yapıda cisim yoktur.
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
Hacim merkezli kübik (H.M.K)<br />
Hacim merkezli kübik yapıda küpün her köşesinde ve merkezinde bir atom bulunur ve köşe<br />
atomları merkeze teğettir. Gerçekte her köşedeki atom 8 komşu birim hücre tarafından<br />
paylaşılmaktadır. Bir köşede birim hücreye ancak 1/8 lik bir dilim düşer. √3a=4R<br />
Yüzey merkezli kübik (Y.M.K)<br />
Yüzey merkezli kübik yapıda küpün her köşesinde ve yüzey merkezlerinde bir atom bulunur.<br />
Yüzey merkezindeki atomların bir yarısı, göz önüne alınan hücreye, diğer yarısı komşu hücreye<br />
aittir.<br />
Örnek: Kübik kristal sistemdeki her bir hücre için atom sayılarını belirleyiniz?<br />
Kübik sistemde birim hücredeki toplam atom sayısı;<br />
Ntoplam=Ni+1/4Nkenar +1/2 Nyüzey +1/8 Nköşe<br />
Birim hücre BK için : {1/8} * 8 köşe = 1<br />
Hacim merkezli kübik hücre (HMK) için : ({1/8} * 8 köşe)+1 merkezdeki = 2<br />
Yüzey merkezli kübik hücre (YMK) için : ({1/8} * 8 köşe)+(1/2)6 yüzey = 4<br />
6
<strong>Elektriksel</strong> <strong>Malzemeler</strong> <strong>Ders</strong> Notları <strong>Yrd</strong>. Doç. <strong>Dr</strong>. <strong>Nil</strong> <strong>Toplan</strong><br />
Hegzagonal sıkı paket yapı (HSP)<br />
Polimorfizm ( Allotropi)<br />
Birden fazla kristal yapıya sahip olan malzemeler allotrofik veya polimorfik malzemelr olarak<br />
bilinir. (Sıcaklık ve basınca bağlı olarak birden fazla kristal yapıda bulunabilme özelliği) Allotropi<br />
saf elementlerde, polimorfizm ise bileşiklerde kullanılır. Bir metal birden fazla kistal yapıya sahip<br />
olabilir Fe ve Ti elementleri gibi. Silika gibi birçok seramik malzemelerde de polimorfik<br />
dönüşümler görülür. <strong>Malzemeler</strong>in ısıtılması ve soğutulması sırasında polimorfik veya allotropik<br />
dönüşümler hacim değişikliğine neden olur. Bu hacim değişimi uygun bir şekilde kontrol edilmezse<br />
malzemenin çatlama ve hasarına neden olur.<br />
Örnek : Demir oda sıcaklığında H.M.K<br />
>910 C 0 Y.M.K<br />
>1400 C 0 H.M.K yapıya sahiptir.<br />
Karmaşık yapılar<br />
Elmas kübik yapı ( Si, Ge, Sn, C gibi elementlerde)<br />
NaCL ve CsCl (Sezyum klorür) yapılar<br />
Kristal silika<br />
Kristalleşmiş polimerler<br />
Paketleme Faktörü ( Atomsal Dolgu Faktörü ) (Atom Dizim Katsayısı )<br />
Bu faktör atomların dolu küreler olduğunu varsayarak bulunan birim hücredeki atomların toplam<br />
hacminin birim hücre hacmine bölünmesiyle bulunur.<br />
Paketlemefaktörü<br />
=<br />
Αtomsayı<br />
× heratomunhacmi<br />
Birimhücrehacmi<br />
Örnek : H.M.K nın atomsal dolgu faktörünü hesaplayınız.<br />
Paketlemefaktörü<br />
4<br />
2×<br />
Πr<br />
3<br />
8 r<br />
3<br />
3 Π 8Π<br />
= = = =<br />
a<br />
3 3 64<br />
0<br />
⎛ 4r<br />
⎞<br />
⎜<br />
⎟<br />
⎝ 3 ⎠<br />
0,<br />
68<br />
Metallerde en yüksek atomik paketleme faktörü 0.74 değeri ile YMK ve HSP yapıdadır. HMK<br />
yapıda 0.68 iken basit küpte 0.53tür.<br />
7