Pobierz - Katedra Chemii Fizycznej
Pobierz - Katedra Chemii Fizycznej
Pobierz - Katedra Chemii Fizycznej
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
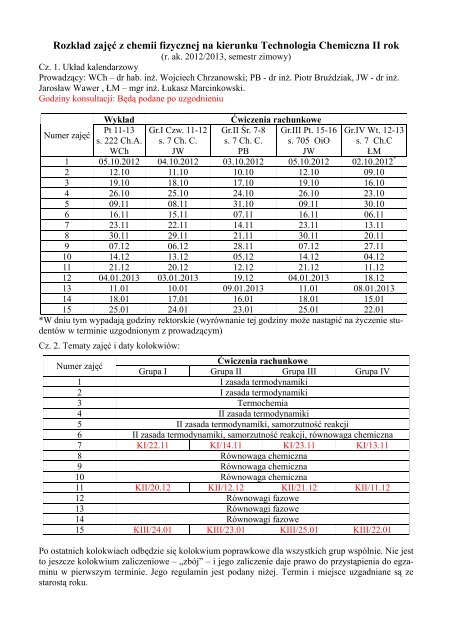
Rozkład zajęć z chemii fizycznej na kierunku Technologia Chemiczna II rok<br />
(r. ak. 2012/2013, semestr zimowy)<br />
Cz. 1. Układ kalendarzowy<br />
Prowadzący: WCh – dr hab. inŜ. Wojciech Chrzanowski; PB - dr inŜ. Piotr Bruździak, JW - dr inŜ.<br />
Jarosław Wawer , ŁM – mgr inŜ. Łukasz Marcinkowski.<br />
Godziny konsultacji: Będą podane po uzgodnieniu<br />
Wykład<br />
Ćwiczenia rachunkowe<br />
Pt 11-13 Gr.I Czw. 11-12 Gr.II Śr. 7-8 Gr.III Pt. 15-16 Gr.IV Wt. 12-13<br />
Numer zajęć<br />
s. 222 Ch.A. s. 7 Ch. C. s. 7 Ch. C. s. 705 OiO s. 7 Ch.C<br />
WCh JW<br />
PB<br />
JW<br />
ŁM<br />
1 05.10.2012 04.10.2012 03.10.2012 05.10.2012 02.10.2012 *<br />
2 12.10 11.10 10.10 12.10 09.10<br />
3 19.10 18.10 17.10 19.10 16.10<br />
4 26.10 25.10 24.10 26.10 23.10<br />
5 09.11 08.11 31.10 09.11 30.10<br />
6 16.11 15.11 07.11 16.11 06.11<br />
7 23.11 22.11 14.11 23.11 13.11<br />
8 30.11 29.11 21.11 30.11 20.11<br />
9 07.12 06.12 28.11 07.12 27.11<br />
10 14.12 13.12 05.12 14.12 04.12<br />
11 21.12 20.12 12.12 21.12 11.12<br />
12 04.01.2013 03.01.2013 19.12 04.01.2013 18.12<br />
13 11.01 10.01 09.01.2013 11.01 08.01.2013<br />
14 18.01 17.01 16.01 18.01 15.01<br />
15 25.01 24.01 23.01 25.01 22.01<br />
*W dniu tym wypadają godziny rektorskie (wyrównanie tej godziny moŜe nastąpić na Ŝyczenie studentów<br />
w terminie uzgodnionym z prowadzącym)<br />
Cz. 2. Tematy zajęć i daty kolokwiów:<br />
Numer zajęć<br />
Ćwiczenia rachunkowe<br />
Grupa I Grupa II Grupa III Grupa IV<br />
1 I zasada termodynamiki<br />
2 I zasada termodynamiki<br />
3 Termochemia<br />
4 II zasada termodynamiki<br />
5 II zasada termodynamiki, samorzutność reakcji<br />
6 II zasada termodynamiki, samorzutność reakcji, równowaga chemiczna<br />
7 KI/22.11 KI/14.11 KI/23.11 KI/13.11<br />
8 Równowaga chemiczna<br />
9 Równowaga chemiczna<br />
10 Równowaga chemiczna<br />
11 KII/20.12 KII/12.12 KII/21.12 KII/11.12<br />
12 Równowagi fazowe<br />
13 Równowagi fazowe<br />
14 Równowagi fazowe<br />
15 KIII/24.01 KIII/23.01 KIII/25.01 KIII/22.01<br />
Po ostatnich kolokwiach odbędzie się kolokwium poprawkowe dla wszystkich grup wspólnie. Nie jest<br />
to jeszcze kolokwium zaliczeniowe – „zbój” – i jego zaliczenie daje prawo do przystąpienia do egzaminu<br />
w pierwszym terminie. Jego regulamin jest podany niŜej. Termin i miejsce uzgadniane są ze<br />
starostą roku.
Semestr 3 (zimowy)<br />
Program wykładu z przedmiotu „Chemia fizyczna”<br />
dla kierunku Technologia Chemiczna: II rok<br />
Termodynamika chemiczna: Pojęcia podstawowe. Pierwsza zasada termodynamiki. Termochemia.<br />
Druga zasada termodynamiki. Kryteria samorzutności i równowagi. Układy otwarte. Cząstkowe molowe<br />
wielkości.<br />
Równowaga chemiczna: Izoterma van’t Hoffa. Standardowa entalpia swobodna reakcji. Stałe równowagi<br />
reakcji (definicje, powiązania wzajemne, zaleŜność od temperatury i ciśnienia). Równanie<br />
Gibbsa-Helmholtza.<br />
Równowagi fazowe: Ogólne warunki równowagi fazowej. Reguła faz Gibbsa. Równowagi<br />
w układach jedno- dwu- i trójskładnikowych. Interpretacja i posługiwanie się diagramami fazowymi.<br />
Destylacja prosta i frakcjonowana.<br />
Roztwory: Własności koligatywne. Charakterystyka termodynamiczna roztworu doskonałego<br />
i roztworów rzeczywistych. Definicja aktywności rozpuszczalnika, substancji rozpuszczonej, współczynników<br />
aktywności. Funkcje nadmiarowe.<br />
Semestr 4 (letni)<br />
Elektrochemia: Jonika: Roztwory elektrolitów. Jonowe i średnie jonowe aktywności i współczynniki<br />
aktywności. Koncepcja oddziaływań międzyjonowych i struktury roztworów elektrolitów wg<br />
Debye’a-Huckela. Dyskusja wzorów na współczynnik aktywności wyprowadzonych na gruncie modelu<br />
Debye’a-Huckela. Przewodnictwo elektryczne roztworów elektrolitów: Podstawowe prawidłowości,<br />
przewodności jonowe, teoria przewodnictwa elektrolitów. Solwatacja jonów. Liczby przenoszenia.<br />
Elektrodyka: Elektroliza. Ogniwa galwaniczne: siła elektromotoryczna, klasyfikacja ogniw<br />
i półogniw, charakterystyka termodynamiczna, zastosowania praktyczne. Akumulatory. Skoki potencjału<br />
w ogniwach galwanicznych. Potencjały elektrodowe. Skala wodorowa potencjałów elektrodowych.<br />
Szereg napięciowy metali. Zastosowania potencjometrii (pomiar pH, miareczkowanie potencjometryczne).<br />
Kinetyka chemiczna: Pojęcia podstawowe. Kinetyka reakcji prostych. Kinetyka i mechanizmy reakcji<br />
złoŜonych (reakcje równoległe, następcze, odwracalne, łańcuchowe, wybuchowe). Teoria zderzeń<br />
aktywnych. Teoria kompleksu aktywnego. Kataliza homogeniczna i heterogeniczna – podstawowe<br />
informacje o kinetyce i mechanizmach reakcji katalitycznych. Kinetyka elektrochemiczna: Polaryzacja<br />
elektrod. Nadnapięcie. Polarografia. Równanie Tafela.<br />
Zjawiska powierzchniowe i koloidy: Adsorpcja: rodzaje adsorpcji, izotermy adsorpcji (Langmuira,<br />
BET, Gibbsa). Napięcie powierzchniowe: podstawowe zaleŜności, metody pomiaru, struktura warstewek<br />
powierzchniowych. Układy koloidalne: klasyfikacja i otrzymywanie. Budowa cząstek koloidalnych.<br />
Zjawiska elektrokinetyczne. Koagulacja. Własności optyczne układów koloidalnych.<br />
(zalecana literatura podana jest na osobnej stronie)
Literatura zalecana do przedmiotu „Chemia fizyczna” dla kierunku<br />
Technologia Chemiczna, II rok.<br />
WYKŁAD<br />
1. P. W. Atkins, Chemia fizyczna, PWN 2001.<br />
2. P. W. Atkins, Podstawy chemii fizycznej, PWN 1999.<br />
3. P. W. Atkins, Przewodnik po chemii fizycznej, PWN 1997.<br />
4. K. Pigoń i Z. Ruziewicz, Chemia fizyczna, PWN 1980, zwłaszcza nowe wydanie, PWN 2006.<br />
5. Chemia fizyczna, praca zbiorowa, PWN 1980.<br />
6. G. M. Barrow, Chemia fizyczna, PWN 1978.<br />
7. L. Sobczyk i A. Kisza, Chemia fizyczna dla przyrodników, PWN 1975.<br />
8. W. Libuś, Chemia fizyczna, część I, Wydawnictwo PG, 1970.<br />
9. W. Libuś i Z. Libuś, Elektrochemia, PWN 1987.<br />
10. H. D. Fosterling i H. Kuhn, Eksperymentalna chemia fizyczna, WNT 1976.<br />
11. L. Sobczyk i wsp., Eksperymentalna chemia fizyczna, PWN 1982.<br />
12. W Kołos, Chemia kwantowa, PWN 1978 (i nowsze wydania).<br />
13. A. Gołębiewski, Elementy mechaniki i chemii kwantowej, PWN 1982.<br />
14. R. F. Nalewajski, Podstawy i metody chemii kwantowej, PWN 2001.<br />
Seria Wykłady z chemii fizycznej wydawana przez WNT od roku 1994.<br />
15. H. Buchowski i W. Ufnalski, Podstawy termodynamiki<br />
16. H. Buchowski i W. Ufnalski, Fizykochemia gazów i cieczy<br />
17. H. Buchowski i W. Ufnalski, Gazy, ciecze i płyny<br />
18. H. Buchowski i W. Ufnalski, Roztwory<br />
19. W. Ufnalski, Równowagu chemiczne<br />
20. H. Buchowski, Elementy termodynamiki statystycznej<br />
21. E. T. Dutkiewicz, Fizykochemia powierzchni<br />
22. W. Kołos i J. Sadlej, Atom i cząsteczka<br />
23. J. Sadlej, Spektroskopia molekularna<br />
24. A. Molski, Wprowadzenie do kinetyki chemicznej<br />
25. A. Kisza, Elektrochemia. Jonika<br />
26. A. Kisza, Elektrochemia. Elektrodyka<br />
Dr hab. inŜ. Wojciech Chrzanowski
Literatura zalecana do przedmiotu „Chemia fizyczna” dla kierunku<br />
Technologia Chemiczna, II rok.<br />
ĆWICZENIA RACHUNKOWE<br />
1. I. Uruska (red.), Zbiór zadań z chemii fizycznej, Wydawnictwo PG, Gdańsk 1997.<br />
2. M. Pilarczyk, Zadania z chemii fizycznej, Wydawnictwo PG, Gdańsk 1996.<br />
3. J. Demichowicz-Pigoniowa, Obliczenia fizykochemiczne, Wydawnictwo PWr, Wrocław 1997.<br />
4. P. W. Atkins, C. A. Trapp, M. P. Cady, C. Giunta Chemia fizyczna. Zbiór zadań z rozwiązaniami,<br />
PWN 2001.<br />
5. A. W. Adamson, Zadania z chemii fizycznej, PWN, Warszawa 1978.<br />
6. A. J. Kartuszyńska, C. A. Lelczuk, A. G. Stromberg, Zbiór zadań z termodynamiki chemicznej,<br />
PWN, Warszawa 1977.<br />
7. H. E. Avery, D. J. Shaw, Ćwiczenia rachunkowe z chemii fizycznej, PWN, Warszawa 1974.<br />
8. W. Rekość, S. Kiciak, Ćwiczenia rachunkowe z chemii fizycznej, Wydawnictwo PP, Poznań<br />
1973.<br />
9. E. W. Kisielewa, G. S. Karietnikow, J. W. Kudriawcew, Zbiór zadań z chemii fizycznej, PWN,<br />
Warszawa 1971.<br />
10. W.Chrzanowski, zadania z chemii fizycznej, strony dydaktyczne www Katedry <strong>Chemii</strong> <strong>Fizycznej</strong><br />
(KChFiz) PG.<br />
Dr hab. inŜ. Wojciech Chrzanowski
Zasady zaliczania przedmiotu „Chemia fizyczna” na kierunku Technologia Chemiczna, II rok<br />
(r. ak. 2012/2013, semestr zimowy)<br />
Zasady ogólne i egzamin:<br />
1. Obowiązują ogólne zasady uczęszczania na zajęcia, zgodnie z regulaminem studiów.<br />
2. Do egzaminu w pierwszym terminie mogą przystąpić osoby mające zaliczone ćwiczenia rachunkowe oraz<br />
laboratoryjne z przedmiotu „Chemia fizyczna”.<br />
3. Zasady zaliczania zajęć laboratoryjnych określone są odrębnym regulaminem. Zasady zaliczania ćwiczeń<br />
rachunkowych podane są niŜej.<br />
4. Przewiduje się egzamin w terminie zerowym (wyłącznie ustny) dla osób rekomendowanych przez prowadzących<br />
ćwiczenia rachunkowe (konieczne jest takŜe zaliczenie laboratorium). Oba zaliczenia z wynikiem<br />
przynajmniej 4,0. Terminy tych egzaminów ustala się indywidualnie z wykładowcą. Formalnie egzamin w<br />
terminie zerowym jest terminem pierwszym i stwarza jedynie szansę dogodniejszego układu sesji dla najlepszych<br />
studentów i studentek.<br />
5. Egzamin w terminach normalnych i poprawkowych jest dwuetapowy: pisemny i ustny. Do egzaminu ustnego<br />
przystępują tylko osoby, które na pisemnym przekroczyły granicę ustaloną przez wykładowcę/egzaminatora<br />
(ok. 33,3% moŜliwych do zdobycia punktów). Osoby, które na egzaminie pisemnym przekroczą<br />
limit 50% nie muszą przystępować do egzaminu ustnego, lecz mogą do niego przystąpić, jeśli chcą<br />
uzyskać ocenę wyŜszą od uzyskanej z egzaminu pisemnego (ryzykując wszakŜe uzyskaniem oceny niŜszej<br />
niŜ wynikałoby to z pracy pisemnej).<br />
6. Egzamin poprawkowy odbywa się w sesji poprawkowej i przystępują do niego osoby, które: a) nie zdawały<br />
egzaminu w terminie pierwszym z jakiegokolwiek powodu, b) nie zdały egzaminu w terminie pierwszym,<br />
c) nie zaliczyły ćwiczeń rachunkowych w trakcie semestru, ale zaliczyły je na podstawie kolokwium zaliczeniowego.<br />
Nieobecność na uzgodnionych terminach egzaminów usprawiedliwiają tylko nadzwyczajne<br />
okoliczności (powody przedstawione na piśmie).<br />
Tryb zaliczania ćwiczeń rachunkowych:<br />
7. W ciągu semestru odbędą się trzy sprawdziany (kolokwia) pisemne w terminach podanych<br />
w harmonogramie zajęć. Punktowane one są następująco: KI – 20 pkt, KII – 15 pkt, KIII – 15 pkt.<br />
8. Do zaliczenia potrzeba minimum 50% moŜliwych do uzyskania punktów (25 pkt).<br />
9. W ostatnim tygodniu zajęć i pierwszych dniach sesji (przed pierwszym terminem egzaminu) moŜliwe będzie<br />
napisanie kolokwium poprawkowego. Do kolokwium mają prawo przystąpić tylko te osoby, które nie<br />
zaliczyły przedmiotu na podstawie kolokwiów kursowych, lecz zgromadziły minimum 15 punktów z trzech<br />
kolokwiów (równieŜ osoby, które z powodów losowych – usprawiedliwienia pisemne – nie przystąpiły do<br />
któregoś z kolokwiów kursowych). Osobom tym wykreśla się najsłabiej napisane z kolokwiów kursowych<br />
i piszą one zadania tylko z tego działu. Czas pisania: 60 minut z działów na 15 punktów (2 zadania), czyli<br />
z przemian fazowych i równowag chemicznych, a 75 minut z termodynamiki (20 punktów, 3 zadania). Po<br />
zastąpieniu najsłabszego wyniku nowym – nadal obowiązuje zasada uzyskania 50%, czyli 25 punktów<br />
z trzech kolokwiów. Osoby, które chciałyby poddać się powyŜszej procedurze, a nie muszą (czyli chciałyby<br />
tylko podwyŜszyć sobie ocenę) mogą to zrobić, zgłaszając chęć przystąpienia wcześniej u mnie, aby<br />
moŜna było przygotować odpowiednią liczbę formularzy. Osoby, które nie zaliczą po kolokwium poprawkowym,<br />
nie mają prawa zdawania egzaminu w pierwszym terminie.<br />
10. Kolokwium zaliczeniowe piszą te osoby, które nie zaliczyły przedmiotu w wyŜej opisanym trybie. Odbywa<br />
się ono w sesji pomiędzy pierwszym a drugim terminem egzaminu dla całego roku. Trwa 2 godziny (4 zadania)<br />
i do zaliczenia wymagane jest uzyskanie 50% moŜliwych do zdobycia punktów<br />
Materiały dydaktyczne, wyniki kolokwiów oraz informacje dla studentów publikowane są na stronach dydaktycznych<br />
Katedry <strong>Chemii</strong> <strong>Fizycznej</strong>:<br />
http://www.pg.gda.pl/chem/Dydaktyka/Fizyczna/katchemfizdyd.html<br />
Harmonogram sesji (oba terminy egzaminów oraz kolokwium zaliczeniowego) ustalany jest pomiędzy przedstawicielem<br />
Samorządu Studentów na danym roku a kierownikiem przedmiotu najpóźniej do 15 grudnia<br />
(sesji letniej do 15 maja), ale im wcześniej, tym lepiej.<br />
We wszelkich sprawach spornych (zazwyczaj nie bywa) studenci mają prawo odwołać się do decyzji Kierownika<br />
KChFiz, pana prof. dr hab. inŜ. Janusza Stangreta.<br />
Dr hab. inŜ. Wojciech Chrzanowski