Struktur und biologische Aktivitäten der chitinbindenden Mistellektine
Struktur und biologische Aktivitäten der chitinbindenden Mistellektine
Struktur und biologische Aktivitäten der chitinbindenden Mistellektine
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
Ergebnisse<br />
Durch die Entfernung stören<strong>der</strong> Begleitkomponenten verkürzen sich außerdem die Spülzeiten<br />
<strong>der</strong> Chitin-„Beads“-Säule nach dem Auftragen des IEC-Eluats, was zu einer erhöhten cbML-<br />
Ausbeute führt. Weiterhin lässt sich das Affinitätsmaterial mehrfach verwenden (bis zu 15<br />
cbML-Isolierungen aus jeweils 500 g Misteln), während es nach einer, direkt aus dem<br />
Rohextrakt durchgeführten Isolierung <strong>der</strong> cbMLs, ohne vorheriger Ionenaustauschchromatographie,<br />
aufgr<strong>und</strong> nicht wie<strong>der</strong> zu entfernen<strong>der</strong> Verunreinigungen direkt entsorgt<br />
werden muß.<br />
Die weitere Reinigung <strong>der</strong> noch leicht hellbraunen affinitätsgereinigten <strong>und</strong> lyophilisierten<br />
<strong>chitinbindenden</strong> <strong>Mistellektine</strong> erfolgte über RP HPLC auf einer C4-Säule. Dabei werden oft<br />
auftretende Verunreinigungen durch die <strong>Mistellektine</strong> vom Typ II RIP <strong>und</strong> durch die<br />
Viscotoxine endgültig aus <strong>der</strong> cbML-Fraktion entfernt, da sie unter den eingesetzten<br />
Bedingungen mit höheren Retentionszeiten eluieren (Daten nicht gezeigt). Bei einer TFA-<br />
Konzentration von 0.1% <strong>und</strong> unter dem in Abschnitt 2.2.4.1 beschriebenen linearen<br />
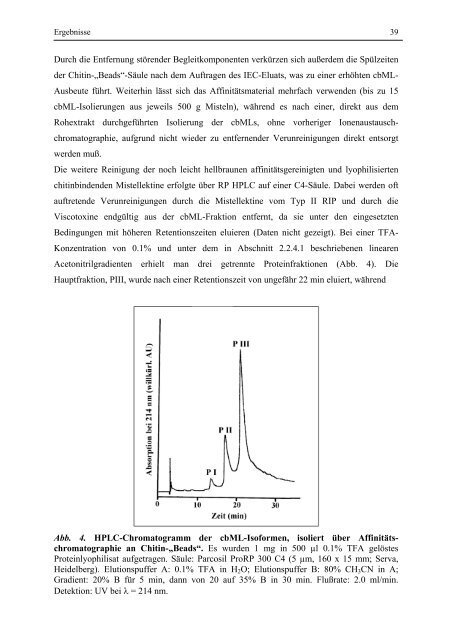
Acetonitrilgradienten erhielt man drei getrennte Proteinfraktionen (Abb. 4). Die<br />
Hauptfraktion, PIII, wurde nach einer Retentionszeit von ungefähr 22 min eluiert, während<br />
Abb. 4. HPLC-Chromatogramm <strong>der</strong> cbML-Isoformen, isoliert über Affinitätschromatographie<br />
an Chitin-„Beads“. Es wurden 1 mg in 500 µl 0.1% TFA gelöstes<br />
Proteinlyophilisat aufgetragen. Säule: Parcosil ProRP 300 C4 (5 µm, 160 x 15 mm; Serva,<br />
Heidelberg). Elutionspuffer A: 0.1% TFA in H2O; Elutionspuffer B: 80% CH3CN in A;<br />
Gradient: 20% B für 5 min, dann von 20 auf 35% B in 30 min. Flußrate: 2.0 ml/min.<br />
Detektion: UV bei λ = 214 nm.<br />
39