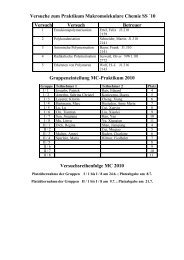
Praktikum TC I Chemische Reaktionstechnik Durchmischung und ...
Praktikum TC I Chemische Reaktionstechnik Durchmischung und ...
Praktikum TC I Chemische Reaktionstechnik Durchmischung und ...
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
_____________________________________________________________________________________________________<br />
<strong>Praktikum</strong> <strong>TC</strong> I <strong>Chemische</strong> <strong>Reaktionstechnik</strong><br />
<strong>Durchmischung</strong> <strong>und</strong> Stofftransport in Blasensäulen<br />
1 Einleitung<br />
Universität Paderborn<br />
Die Universität der Informationsgesellschaft<br />
Der Blasensäulenreaktor ist besonders für Reaktionen geeignet, bei denen unter anderem<br />
Stoffaustauschvorgänge zwischen einer Gas- <strong>und</strong> einer Flüssigphase maßgebend sind. Er<br />
besteht in der einfachsten Form aus einem senkrecht stehenden Rohr. Das in die Flüssigkeitsfüllung<br />
von unten eingeleitete Gas wird mit Düsen oder einer Filterplatte zu Blasen<br />
dispergiert. Damit wird ohne Hilfsmittel (Zerstäuber, Rührer, Füllkörper, Böden) eine große<br />
Phasengrenzfläche erzielt, wie sie für gute Stoffaustauschvorgänge notwendig ist. Die Blasen<br />
sorgen außerdem für eine gute <strong>Durchmischung</strong> des Reaktorinhalts, so dass nur geringe<br />
Temperatur- <strong>und</strong> Konzentrationsprofile auftreten. Gleichzeitig ist es dadurch möglich, einen<br />
suspendierten Katalysator in der Schwebe zu halten. Die Flüssigphase ruht oder wird im<br />
Gleich- bzw. Gegenstrom zur Gasphase geführt.<br />
Es sind somit folgende Reaktionsarten möglich: Reaktionen zwischen einer Gas- <strong>und</strong> einer<br />
Flüssigphase, Reaktionen zwischen Gasen, bei denen die Flüssigphase als Lösungsmittel<br />
dient, Reaktionen zwischen Gasen, bei denen die Flüssigphase als Träger für einen<br />
Katalysator dient.<br />
Durch den guten Wärmeübergang zwischen Reaktorwandung <strong>und</strong> -inhalt ist es möglich, eine<br />
vorgegebene Temperatur einzuhalten <strong>und</strong> somit aus einer Gruppe konkurrierender<br />
Reaktionen bei temperaturabhängiger Selektivität die gewünschte Reaktion anzusteuern.<br />
Der Blasensäulenreaktor findet Anwendung vorwiegend bei Oxidierungs- <strong>und</strong> Chlorierungsreaktionen<br />
an Kohlenwasserstoffen, sowie neuerdings auch in der Biotechnologie.<br />
2 Theoretische Gr<strong>und</strong>lagen<br />
Fakultät Naturwissenschaften<br />
Department Chemie<br />
Technische Chemie <strong>und</strong><br />
<strong>Chemische</strong> Verfahrenstechnik<br />
Prof. Dr. H.-J. Warnecke<br />
Die Vorgänge in einem Blasensäulenreaktor werden durch eine große Anzahl von Parametern<br />
beschrieben, die zum größten Teil miteinander verknüpft sind. In dem durchzuführenden<br />
Versuch sollen<br />
• der <strong>Durchmischung</strong>skoeffizient der Flüssigphase,<br />
• der relative Gasgehalt,<br />
• die spezifische Phasengrenzfläche <strong>und</strong><br />
• die flüssigkeitsseitige Stoffübergangszahl für ein Gas in Wasser bzw. Elektrolytlösung<br />
betrachtet werden.
Abb.1: Konzentrationsprofil des Farbstoffes in der Blasensäule<br />
2
2.1 <strong>Durchmischung</strong>skoeffizient der Flüssigphase<br />
Wird an einem Ort x = L eine Markierungssubstanz kontinuierlich gelöst zugeführt, so bildet<br />
sich längs der Säule in der Flüssigphase ein stationäres Konzentrationsprofil aus. Nimmt man<br />
an, dass keine Reaktion stattfindet, so lautet die von Damköhler aufgestellte differentielle<br />
Stoffbilanz für den stationären eindimensionalen Fall<br />
D dc<br />
u<br />
dx<br />
dc<br />
2<br />
− = 0<br />
2<br />
dx<br />
(1)<br />
wenn der <strong>Durchmischung</strong>skoeffizient D <strong>und</strong> die lineare Strömungsgeschwindigkeit u als<br />
ortsunabhängig angesehen werden.<br />
An der Stelle x = 0 trete die Flüssigphase in den Reaktor mit der Tracerkonzentration cE = 0<br />
ein. Als Randbedingung für den Reaktoreingang ergibt sich für den Fall eines nicht rückvermischten<br />
Zulaufteiles (Pfropfstrom) ein Ausdruck für die Tracerkonzentration c(0) im<br />
reaktorseitigen Zulaufquerschnitt<br />
(s. Anhang <strong>und</strong> Abb. S. 2).<br />
D ⎛ dc⎞<br />
c( 0)<br />
= cE+<br />
⎜ ⎟<br />
(2)<br />
u ⎝ dx⎠<br />
0<br />
bzw. mit cE = 0<br />
D ⎛ dc⎞<br />
c(<br />
0)<br />
= ⎜ ⎟ .<br />
(2a)<br />
u ⎝ dx⎠<br />
0<br />
Weiter ist oberhalb der Markierungsstelle x = L die Konzentration im stationären Fall<br />
konstant, sie sei cA genannt:<br />
cx ( ≥ L) = c (3)<br />
A<br />
Mit Hilfe der beiden Randbedingungen (2) <strong>und</strong> (3) erhält man aus Gl. (1) das Konzentrationsprofil:<br />
⎡ u ⎤<br />
c= cAexp<br />
− ( L−u) ⎣<br />
⎢ D ⎦<br />
⎥<br />
(4)<br />
bzw.<br />
ln ( )<br />
c u<br />
=− L− x<br />
cA<br />
D (5)<br />
(s. Anhang).<br />
2.2 Stoffübergang in Blasensäulen<br />
Findet Stoffübergang statt, so kommt in der Bilanzgleichung (1) noch ein Stoffübergangsterm<br />
hinzu. Die Gleichung nimmt damit folgende Form an:<br />
D ( )<br />
dc<br />
u<br />
dx<br />
dc<br />
2<br />
*<br />
− + kLa c − c = 0<br />
2<br />
dx<br />
(6)<br />
mit:<br />
a Phasengrenzfläche pro Reaktorvolumen A<br />
V R<br />
c* stellt die sich mit dem Ostwald'schen Koeffizienten α (Kehrwert der Henry-Konstante)<br />
ergebende flüssigkeitsseitige Gleichgewichtskonzentration an der Phasengrenzfläche dar.<br />
*<br />
c = xgpα (7)<br />
3
Durch Multiplikation mit L/u erhält man aus (6) die (bis auf die Konzentration)<br />
dimensionslose Form:<br />
2<br />
1 dc dc *<br />
− + St( c − c)<br />
= 0<br />
2<br />
Bo dz dz<br />
(8)<br />
mit<br />
kLaL St =<br />
u<br />
uL<br />
Bo =<br />
D<br />
x<br />
z =<br />
L<br />
Stanton-Zahl<br />
Bodensteinzahl<br />
relative Ortskoordinate.<br />
(9)<br />
(10)<br />
(11)<br />
Damit ergibt sich für die Bilanzgleichung<br />
2<br />
1 dc dc<br />
− + St( α x p c)<br />
0<br />
2<br />
g − = .<br />
Bo dz dz<br />
Unter der Annahme eines ortsunabhängigen relativen Gasgehaltes εg gilt bei einem Druck am<br />
Kopf der Blasenschicht pk für den Druck als Funktion der reduzierten Säulenhöhe z (siehe<br />
auch Gl. (25)):<br />
( )( )<br />
4<br />
(12)<br />
p= p + ρgL 1−ε 1 −z<br />
(13)<br />
k g<br />
Nimmt man eine höhenunabhängige Zusammensetzung der Gasphase an, was aufgr<strong>und</strong> der<br />
geringen Löslichkeit von Sauerstoff in Wasser statthaft ist, so ist eine analytische Lösung der<br />
Bilanzgleichung möglich. Mit der Randbedingung für das Ende des Reaktors:<br />
⎛ dc⎞<br />
dc<br />
⎜ ⎟ =<br />
⎝ dx⎠<br />
dz<br />
⎛ ⎞<br />
⎜ ⎟ = 0 (siehe Anhang Gl. (A4))<br />
⎝ ⎠<br />
L<br />
1<br />
lautet die Lösung für das stationäre Konzentrationsprofil bei vorliegendem Stoffübergang:<br />
Br e br<br />
c<br />
r e r e e<br />
r<br />
r<br />
− r z Br e br rz b<br />
=<br />
+ e a bz<br />
r r<br />
r r<br />
−<br />
r e r e<br />
St<br />
− +<br />
2<br />
1<br />
2 1 1<br />
1 2 2 + + −<br />
2 1 2 2<br />
2 1 2 2<br />
1 2<br />
1 − 2<br />
(15)<br />
mit<br />
Bo ⎛<br />
r12<br />
, = ⎜1±<br />
2 ⎝<br />
4St<br />
⎞<br />
1+ ⎟<br />
Bo ⎠<br />
(16)<br />
⎛ b ⎞<br />
B= ⎜a−cE−<br />
⎟ Bo − b<br />
⎝ St⎠ (17)<br />
b=−αx ρg 1 −ε<br />
L<br />
(18)<br />
( )<br />
( )<br />
g g<br />
( )<br />
(14)<br />
a = α x p + ρg 1 −ε<br />
L<br />
(19)<br />
g k g<br />
Eine wesentlich stärkere Vereinfachung liegt in der Annahme einer homogenen Flüssigphase.<br />
Man gelangt damit zu einem Modell mit konzentrierten Parametern.<br />
Die Bilanzgleichung lautet für den stationären Fall dann:<br />
&<br />
*<br />
Vc − c + k ac − cV =0. (20a)<br />
( ) ( )<br />
E L R
Multiplikation mit L<br />
VR<br />
L<br />
ergibt mit τ = =<br />
VR V<br />
u<br />
*<br />
uc ( E − c) + kLaLc ( − c)<br />
= 0<br />
(20b)<br />
bzw. mit Gl.(7)<br />
uc ( E − c) + kLaL( α xg p− c)<br />
= 0. (21)<br />
Für das Produkt kLa erhält man daraus<br />
uc ( E − c)<br />
kLa =−<br />
.<br />
L( α xgp−c) c ist hierbei die mittlere Konzentration des gelösten Gases im Inneren der Flüssigphase.<br />
(22)<br />
2.3 Relativer Gasgehalt in Blasensäulen<br />
Als relativer Gasgehalt εg wird in einem Mehrphasenreaktor das auf das Zweiphasenvolumen<br />
VR bezogene Gasvolumen Vg bezeichnet. Bei zweiphasigen Systemen lässt sich das Gasvolumen<br />
als Differenz zwischen Blasenschichtvolumen VR <strong>und</strong> Flüssigkeitsvolumen VF aus-<br />
drücken:<br />
Vg<br />
VR − VF<br />
εg = = .<br />
VR<br />
V<br />
(23)<br />
R<br />
Besitzt der Reaktor eine konstante Querschnittsfläche A, so gilt mit V V<br />
L <strong>und</strong><br />
A A L<br />
R F = = F<br />
L−LF εg = .<br />
L<br />
(24)<br />
L ist die Betriebshöhe des begasten Reaktors <strong>und</strong> LF die Höhe der Flüssigphase ohne<br />
Begasung. Außer dem bis jetzt beschriebenen mittleren relativen Gasgehalt ist der örtliche<br />
relative Gasgehalt wichtig. Als einfache Meßmethode bietet sich die Messung des statischen<br />
Druckverlaufs mit der Höhe im Reaktor an. Für die Druckdifferenz zwischen einem Ort x des<br />
Reaktors <strong>und</strong> dem Kolonnenkopf gilt bei Vernachlässigung von Reibungs- <strong>und</strong> Trägheitskräften<br />
sowie des spezifischen Gewichts des Gases gegenüber dem der Flüssigphase<br />
( ) − K = ρ( − )( −εg)<br />
px p g L x<br />
Abb. 2: Bestimmung des örtlichen relativen Gasgehaltes<br />
5<br />
1 . (25)
Für den Differenzdruck (p1 - p2) zwischen zwei Messstellen x 1 <strong>und</strong> x 2 ergibt sich daraus:<br />
[ ( ) ( ) ]( )<br />
p1− p2 = gρ L−x1 − L−x2 1−ε<br />
g<br />
( )( )<br />
p1 − p2 = gρ x2 −x1 1−ε<br />
g .<br />
Damit ist in dem Säulenabschnitt, der durch die beiden Messstellen begrenzt wird, ein<br />
mittlerer relativer Gasgehalt von<br />
p1 − p2<br />
ε g = 1−<br />
gρx − x<br />
(27)<br />
( )<br />
2 1<br />
vorhanden. Wird der in der Säule herrschende Druck mit Steigrohren <strong>und</strong> einem Medium<br />
gleicher Dichte wie die Flüssigphase gemessen, so gilt für den zwischen zwei beliebigen<br />
Steigrohrmündungen liegenden Abschnitt:<br />
* *<br />
hS − hS<br />
hS − h<br />
1 2 1 S2<br />
εg = 1− =<br />
x2 − x1<br />
x1−x (28)<br />
2<br />
wobei hS2 - hS1 die Druckdifferenz (cm Wassersäule) zwischen den Steigrohren ist.<br />
2.4 Spezifische Phasengrenzfläche a in Blasensäulenreaktoren<br />
Einer der wichtigsten Parameter in Blasensäulenreaktoren stellt die spezifische Phasengrenzfläche<br />
a dar. Da bei der Auswertung immer das Produkt kLa anfällt (siehe 2.2), die<br />
spezifische Phasengrenzfläche im Gegensatz zum Stoffübergangskoeffizienten aber abhängig<br />
ist von dem verwendeten Blasensäulenreaktortyp, ist es wünschenswert, das Produkt kLa<br />
aufzuspalten.<br />
Eine der Methoden, um die spezifische Phasengrenzfläche zu ermitteln, ist die fotografische<br />
Bestimmung des Blasendurchmessers. Bezieht man das 6-fache Volumen der Blasen auf die<br />
Fläche der Blasen, so erhält man den Sauter'schen Durchmesser dS<br />
mit:<br />
N Anzahl der Klassen<br />
d Durchmesser der Einzelblase<br />
n Zahl der Blasen in einer Klasse.<br />
d<br />
S<br />
=<br />
N<br />
∑<br />
i<br />
N<br />
∑<br />
i<br />
3<br />
d n<br />
i i<br />
2<br />
d n<br />
i i<br />
Der Sauter'sche Durchmesser <strong>und</strong> die spezifische Phasengrenzfläche sind über folgende<br />
Beziehung miteinander verknüpft:<br />
g<br />
a =<br />
d<br />
6 ε .<br />
(30)<br />
S<br />
6<br />
(26)<br />
(29)
3 Versuchsdurchführung<br />
Die Versuchsdurchführung erfolgt an einer Blasensäule mit 10 cm Durchmesser bei 260 cm<br />
Betriebshöhe. Das zu untersuchende System ist Wasser - Luft. Bestimmt werden soll der<br />
<strong>Durchmischung</strong>skoeffizient der Flüssigphase, die Höhenabhängigkeit des relativen Gasgehaltes,<br />
die spezifische Phasengrenzfläche sowie der flüssigkeitsseitige Stoffübergangskoeffizient<br />
für Sauerstoff.<br />
3.1 Inbetiebnahme des Blasensäulenreaktors<br />
Zur Inbetriebnahme des Blasensäulenreaktors ist zunächst der Vorratsbehälter mindestens zu<br />
ca. 2/3 mit entsalztem Wasser über den Versorgungsschlauch zu füllen. Dieser Füllstand<br />
sollte während der Bestimmung des <strong>Durchmischung</strong>skoeffizienten durch ständige Wasserzufuhr<br />
annähernd aufrechterhalten werden.<br />
Bei geöffnetem Hahn A <strong>und</strong> geschlossenem Hahn B sowie geöffnetem Ventil 2 <strong>und</strong> geschlossenem<br />
Ventil 1 wird nun die Pumpe eingeschaltet. Langsam Ventil B öffnen.<br />
Bevor die Blasensäule mit Flüssigkeit gefüllt wird, wird die Gaszufuhr angestellt. Dazu<br />
werden das Absperrventil an der Blasensäule <strong>und</strong> danach das Auslassventil am<br />
Druckminderer geöffnet. Am Gasrotameter wird der vom Assistenten vorgegebene<br />
Gasdurchsatz eingestellt.<br />
Über Handregler 1 <strong>und</strong> Handregler 2 werden nun die Ventile 1 <strong>und</strong> 2 betätigt <strong>und</strong> damit die<br />
Flüssigkeitszufuhr zur Säule hergestellt.<br />
Zur Beschickung des Blasensäulenreaktors mit Flüssigkeit aus dem Vorratsgefäß sind die<br />
Ventile 1 <strong>und</strong> 2 über die Regeleinheit der Flüssigkeitsversorgung einzustellen. Der Volumenstrom<br />
wird am Wasserrotameter abgelesen.<br />
Einstellungen 0 bar = geschlossen<br />
ca. 1,2 bar = geöffnet<br />
3.2 Bestimmung des <strong>Durchmischung</strong>skoeffizienten<br />
Zur Bestimmung des <strong>Durchmischung</strong>skoeffizienten des Reaktors wird am Ausgang des<br />
Reaktors ca. 2 l/h Farbstofflösung (0,1 g Farbstoff pro Liter Wasser) mit Hilfe einer Pumpe<br />
zudosiert. In Abständen von 26 cm werden Proben aus dem Reaktor entnommen <strong>und</strong> photometrisch<br />
auf den Farbgehalt untersucht.<br />
Die Blasensäule benötigt eine Einlaufzeit TEinst ca. 4τ bis zur Einstellung eines stationären<br />
Zustandes. Aus diesem Gr<strong>und</strong> ist in regelmäßigen zeitlichen Abständen an einer beliebigen<br />
Probeentnahmestelle eine Probe zu entnehmen <strong>und</strong> die Farbstoffkonzentration zu prüfen. Erst<br />
wenn die gemessenen Proben keine größere Abweichung bzw. keinen Gang mehr zeigen,<br />
kann die Bestimmung des Konzentrationsprofils erfolgen.<br />
Nach Beendigung der Messungen sind das Entnahmeventil der Druckluftleitung sowie das<br />
Absperrventil an der Blasensäule zu schließen. Danach ist die Flüssigkeitszufuhr der Blasensäule<br />
zu unterbrechen, die Pumpe auszustellen <strong>und</strong> das gefärbte Wasser abzulassen.<br />
3.3 Bestimmung des Stoffübergangskoeffizienten für Sauerstoff<br />
Das Vorratsgefäß wird vollständig mit Wasser gefüllt. Das entsalzte Wasser im Vorratsgefäß<br />
wird zur Austreibung des Luftsauerstoffs mit Stickstoff begast. An der N2-Gasniederdruckleitung<br />
wird ein Sek<strong>und</strong>ärdruck von 0,2 bar eingestellt. Danach sind das Ventil an der<br />
Druckleitung <strong>und</strong> der Hahn nacheinander zu öffnen. Nachdem das Vorratsgefäß mindestens<br />
30 min. mit Stickstoff begast wurde, wird die Blasensäule mit dem sauerstoffarmen Wasser<br />
aus dem Vorratsgefäß wie zuvor gefüllt.<br />
7
Da die Löslichkeit des Sauerstoffs temperaturabhängig ist, wird der Zulauf der Blasensäule<br />
temperiert.<br />
Die Kalibrierung der Sauerstoffelektrode erfolgt nach Einweisung durch den Assistenten.<br />
Die Sauerstoffeingangskonzentration wird bestimmt, indem man eine Wasserprobe der<br />
untersten Messstelle untersucht. Wichtig: Die Luftzufuhr muss unterbrochen werden! Es wird<br />
gewartet, bis sich ein konstanter Wert einstellt. Luftzufuhr wieder anstellen! Zur Bestimmung<br />
des Produktes aus Stoffübergangskoeffizient kL <strong>und</strong> spezifischer Phasengrenzfläche a wird<br />
das stationäre höhenabhängige Konzentrationsprofil des Sauerstoffs in der Flüssigkeit beim<br />
Absorptionsvorgang bestimmt. Zur Messung der Sauerstoffkonzentration mit der<br />
Sauerstoffelektrode werden an allen 10 Messstellen (in Abständen von 26 cm) Probenströme<br />
aus der Säule mit Hilfe einer Pumpe entnommen <strong>und</strong> durch eine Durchflussmesszelle<br />
geleitet.<br />
Zur Bestimmung der Höhenabhängigkeit des relativen Gasgehaltes sind 9 mit dem Säuleninhalt<br />
kommunizierende Steigrohre vorhanden. Sie zeigen die Höhendifferenz des Wassers<br />
zwischen dem Kolonnenkopf <strong>und</strong> den jeweiligen Abzweigstellen, die in einem Abstand von<br />
26 cm angebracht sind. Ein Gesamtsteigrohr gibt den integralen Gasgehalt an. Der Druck des<br />
Kolonnenkopfes ist am Quecksilbermanometer nach Vorschrift abzulesen.<br />
Nach den Messungen wird die Begasung des Reaktors <strong>und</strong> die Flüssigkeitszufuhr zur Säule<br />
abgestellt. Das Photometer <strong>und</strong> das Sauerstoffmessgerät sind abzuschalten. Darauf ist Ventil<br />
A zu öffnen <strong>und</strong> Ventil B zu schließen, die Pumpe auszustellen <strong>und</strong> der Hauptschalter der<br />
Regeleinheit auf Null zu stellen. Das Wasser aus der Blasensäule wird abgelassen.<br />
3.3.1 Messprinzip der Sauerstoffelektrode<br />
Die Unterlagen des Herstellers WTW liegen aus!<br />
8
Abb. 3 <strong>und</strong> 4: Versuchsaufbau<br />
9
Abb.5: Aufbau der Blasensäule<br />
10
4 Auswertung<br />
4.1 <strong>Durchmischung</strong>skoeffizient<br />
Der <strong>Durchmischung</strong>skoeffizient wird gemäß Gleichung (5) aus dem gemessenen Farbstoffprofil<br />
berechnet.<br />
4.2 Stoffübergangskoeffizient<br />
Mit Gleichung (15) wird im Auswerteprogramm das Konzentrationsprofil für verschiedene<br />
Stantonzahlen berechnet. Als Ergebnis erhält man die Stantonzahl, für die das errechnete<br />
Profil mit dem gemessenen am besten übereinstimmt (Fehlerquadratminimum).<br />
Zur Auswertung mit Computer werden folgende Parameter benötigt.<br />
Vl [l/s] Gasvolumenstrom<br />
V g [l/s] Flüssigkeitsvolumenstrom<br />
Eo Extinktion am Ausgang<br />
E Extinktionen der Messstellen<br />
CO,E [mol/l] Sauerstoffeingangskonzentration<br />
CO [mol/l] Sauerstoffkonzentration der j-ten Messstelle<br />
εg integraler Gasgehalt<br />
PK [Torr] Druck am Kolonnenkopf<br />
T [ oC] Reaktortemperatur<br />
Nach Gleichung (22) wird das Produkt kLa berechnet.<br />
Als mittlere Konzentration c in der Flüssigphase wird eingesetzt:<br />
1. der gemessene Wert in mittlerer Höhe (Messstelle 5)<br />
2. der Mittelwert (cA + cE)/2 aus Zulaufkonzentration cE <strong>und</strong> Ablaufkonzentration cA .<br />
Aus (22) ergibt sich somit<br />
bzw. mit<br />
u<br />
ka L =−<br />
L<br />
cA + cE<br />
cE<br />
−<br />
cA + cE<br />
c −<br />
2<br />
*<br />
2<br />
ka L<br />
u St<br />
c c<br />
c c<br />
c<br />
E − E<br />
L = = −<br />
c − c c c<br />
c<br />
=−<br />
+<br />
−<br />
2<br />
*<br />
* +<br />
−<br />
2<br />
11<br />
A E<br />
A E<br />
Man vergleiche die nach diesem einfachen Modell erhaltenen St-Zahlen mit jener, die sich<br />
nach dem Dispersionsansatz ergibt. Gibt es nach (32) einen oberen möglichen Wert der St-<br />
Zahl? Wie erklärt sich dieser? Ist eine Mittelwertbildung gemäß 2. für das gemessene Profil<br />
zulässig?<br />
.<br />
(31)<br />
(32)
4.3 Relativer Gasgehalt<br />
Berechnen Sie den relativen Gasgehalt nach Gleichung (28) für die einzelnen Säulenabschnitte.<br />
Als Bezugshöhe für die Auftragung des relativen Gasgehaltes gegen die<br />
reduzierte Säulenhöhe gilt die Mitte des von den Messstellen begrenzten Säulenabschnittes.<br />
4.4 Entfällt<br />
4.5 Entfällt<br />
4.6 Zu den Ergebnissen<br />
Begründen Sie den Verlauf des relativen Gasgehaltes <strong>und</strong> das Auftreten mehrerer Bereiche<br />
unterschiedlicher <strong>Durchmischung</strong>.<br />
Welche Betriebsparameter haben Einfluss auf die gemessenen Größen? Sind die Annahmen,<br />
die zur Ableitung der Messgleichungen (Gl. (5) <strong>und</strong> (15)) gemacht wurden, voll vertretbar?<br />
Wurden bei der Auswertung weitere Vereinfachungen unbewusst vorgenommen? Woran<br />
können Sie feststellen, welche Messpunkte zur Bestimmung des<br />
<strong>Durchmischung</strong>skoeffizienten aus der Steigung der Ausgleichsgeraden nicht geeignet sind?<br />
Vergleichen Sie das gemessene <strong>und</strong> das errechnete Profil graphisch. Wie gut ist die Annahme<br />
eines konstanten Molenbruchs in der Gasphase erfüllt. Kennen Sie noch andere Beschreibungsarten<br />
(Modelle) für Reaktoren?<br />
Diskutieren Sie die evtl. Abhängigkeit des Stoffübergangskoeffizienten von der<br />
Gasgeschwindigkeit. Welche weiteren Methoden zur Bestimmung der spezifischen Phasengrenzfläche<br />
gibt es noch?<br />
Welche Vorstellungen über den Mechanismus des Stoffüberganges gibt es?<br />
5 Symbolverzeichnis<br />
A [cm2] Fläche<br />
a [cm-1] spezifische Phasengrenzfläche<br />
Bo Bodenstein'sche Kennzahl uL D<br />
D [cm2/s] <strong>Durchmischung</strong>skoeffizient<br />
c [Mol/l] Konzentration in der Flüssigkeit (im Phaseninneren)<br />
c<br />
12<br />
* [Mol/l] Flüssigkeitsseitige Konzentration an der Phasengrenze im Gleichgewicht<br />
hS [cm] Wasserhöhe im Steigrohr<br />
kL [cm/s] Stoffübergangskoeffizient der Flüssigphase<br />
L [cm] Reaktorlänge<br />
p [bar] Druck<br />
St Stantonzahl kaL l u<br />
u [cm/s] Strömungsgeschwindigkeit<br />
V [cm3] Volumen<br />
x [cm] Ort im Reaktor<br />
z dimensionsloser Ort [x/L]<br />
α mol ⎡ ⎤<br />
⎢ ⎥<br />
⎣latm⎦<br />
Ostwald'scher Absorptionskoeffizient 1 ⎡ ⎤<br />
⎣<br />
⎢He⎦<br />
⎥<br />
εg relativer Gasgehalt<br />
κ hydrostatischer Druck am Boden der Säule
Indices<br />
A Ausgangs<br />
B Betriebs<br />
E Eintritts<br />
F Flüssigkeits<br />
G Gas<br />
K Kopf<br />
13
6 Anhang<br />
Annahme: Der Reaktor sei in drei Abschnitte geteilt: Eingangsabschnitt, Reaktionsraum <strong>und</strong><br />
Ausgangsabschnitt. Der erste <strong>und</strong> der dritte Abschnitt repräsentieren dabei den Zulauf <strong>und</strong><br />
den Ablauf, in denen weder Reaktion noch Rückvermischung stattfinden.<br />
Abb. 6: Randbedingungen<br />
Randbedingung für den Eingang<br />
Bilanz über die Eingangsfläche bei x = 0<br />
(Konvektion 0- + Dispersion 0- = Konvektion 0+ + Dispersion 0+ )<br />
( uc) D ( )<br />
dc<br />
uc D<br />
dx<br />
dc<br />
1 1 − − 0 1<br />
2 2 +<br />
0 2<br />
−<br />
dx +<br />
0<br />
0<br />
⎛ ⎞<br />
⎜ ⎟ = −<br />
⎝ ⎠<br />
⎛ ⎞<br />
⎜ ⎟<br />
⎝ ⎠<br />
mit u1 = u2 (da konstanter Querschnitt) <strong>und</strong> D1 = 0<br />
folgt<br />
D ⎛ dc⎞<br />
c1 = c2<br />
− ⎜ ⎟<br />
u ⎝ dx⎠<br />
+<br />
0<br />
uL<br />
bzw. mit z = x/L <strong>und</strong> c1 =cE <strong>und</strong> c2 = c(0) <strong>und</strong> Bo =<br />
D<br />
1 ⎛ dc⎞<br />
cE = c(<br />
0)<br />
− ⎜ ⎟ .<br />
Bo ⎝ dz⎠<br />
+<br />
14<br />
0<br />
(A1)<br />
(A2)<br />
(A2a)<br />
Randbedingung für den Ausgang<br />
Bilanz über den Reaktorquerschnitt bei x = L<br />
( uc) D ( )<br />
dc<br />
uc D<br />
dx<br />
dc<br />
2 2 − − L 2 3 3 +<br />
L 3<br />
−<br />
dx +<br />
L<br />
L<br />
⎛ ⎞<br />
⎜ ⎟ = −<br />
⎝ ⎠<br />
⎛ ⎞<br />
⎜ ⎟<br />
(A3)<br />
⎝ ⎠<br />
mit der Forderung, die Konzentration soll nach Verlassen des Reaktorausganges unverändert<br />
bleiben, d. h. keine Reaktion im Abschnitt 3, c2 = c3 (Stetigkeitsbedingung), sowie D3 = 0<br />
folgt aus (A3):<br />
− ⎛ ⎞<br />
D⎜ ⎟ =<br />
⎝ ⎠ −<br />
dc<br />
0<br />
(A4)<br />
dx L<br />
6.1 Lösung der Damköhlergleichung ohne Quelle <strong>und</strong> Senke (ohne Reaktion)<br />
D dc<br />
u<br />
dx<br />
dc<br />
2<br />
− = 0<br />
2<br />
dx<br />
(A5)<br />
Exponentialansatz:<br />
für die Ableitungen folgt daraus:<br />
r x<br />
c= Ae
in (A5) eingesetzt<br />
d c<br />
dx<br />
=<br />
rAe rx<br />
dc<br />
r Ae<br />
dx<br />
rx<br />
2<br />
2<br />
= 2<br />
2 rx rx<br />
DAr e − uAre = 0<br />
2<br />
Dr − ur = 0<br />
r<br />
12 ,<br />
r<br />
2<br />
u u<br />
= ±<br />
2D 4D<br />
u<br />
r2<br />
= .<br />
D<br />
Daraus ergibt sich für den Lösungsansatz:<br />
r2x c = A1 + A2 e<br />
dc<br />
r2 x<br />
= r2 A2 e .<br />
dx<br />
1<br />
= 0<br />
Bestimmung der Konstanten A1 <strong>und</strong> A2 mit Hilfe der Randbedingungen<br />
(A12) für x = 0 <strong>und</strong> für c1 =cE in (A2) einsetzen:<br />
D 0<br />
cE<br />
+ A2r2e = A1+ A2e u<br />
mit (A11) ergibt sich:<br />
cE + A = A + A<br />
<strong>und</strong> daraus<br />
A1 = cE <strong>und</strong> für cE =0<br />
A 1= 0<br />
Mit der Stetigkeitsbedingung<br />
2<br />
15<br />
0<br />
(A6)<br />
(A7)<br />
(A8)<br />
(A9)<br />
(A10)<br />
(A11)<br />
(A12)<br />
(A13)<br />
2 1 2 (A14)<br />
cL ( ) = cA ergibt sich aus (A12)<br />
r L<br />
cA= A2e −r2L<br />
A2= cAe Unter der Bedingung cE = 0 ergibt sich somit als Lösung von (A5)<br />
−r ( L−x) c= c e<br />
A<br />
2 (A15)<br />
(A16)<br />
2 (A17)<br />
u<br />
− −<br />
( L x)<br />
D c= cAe (A18)<br />
Man vergewissere sich durch Differentiation von Gl. (A18) nach x <strong>und</strong> Bilden der Ausdrücke<br />
2<br />
d c dc<br />
<strong>und</strong> , dass die Damköhlergleichung ohne Quelle <strong>und</strong> Senke Gl. (1) bzw. (A5) erfüllt<br />
2<br />
dx dx<br />
ist.
6.2 Lösung der Damköhlergleichung mit Stoffübergangsterm<br />
Dimensionslose Form:<br />
2<br />
1 dc dc<br />
− + St( α x p c)<br />
0<br />
2<br />
g − = .<br />
Bo dz dz<br />
Mit dem hydrostatischem Druck:<br />
κ = ρgL( 1 −εg)<br />
ist<br />
p= pk+ κ( 1 − z)<br />
siehe Gl. (13)<br />
2<br />
1 dc dc<br />
− − St c = − αxSt 2<br />
g ( p k + κ−κ z)<br />
Bo dx dx<br />
=−St a −St<br />
b z<br />
mit ( )<br />
a = pk +κ α xg<br />
<strong>und</strong> b =−αxgκ Trennung in homogenen <strong>und</strong> inhomogenen Teil<br />
16<br />
(A19)<br />
(A20)<br />
(A21)<br />
i) homogener Teil<br />
2<br />
1 dc dc<br />
− − St c = 0<br />
2<br />
Bo dz dz (A22)<br />
r z<br />
mit e-Ansatz c = A e unter sinngemäßer Verwendung des Exponentialansatzes <strong>und</strong> der<br />
Ableitungen (A6) <strong>und</strong> (A7) in (A22) ergibt sich:<br />
1 2 rz rz rz<br />
Ar e −Are− StAe = 0<br />
Bo<br />
2<br />
r −Bo r− Bo St = 0<br />
r<br />
12 ,<br />
r<br />
12 ,<br />
ii) partikuläre Lösung des inhomogenen Teils<br />
Die Lösung wird die Form haben:<br />
<strong>und</strong> damit:<br />
ergibt sich durch einsetzen in (A21)<br />
2<br />
Bo Bo<br />
= ± + Bo St<br />
2 4<br />
Bo ⎛ 4St<br />
⎞<br />
= ⎜1±<br />
1+ ⎟<br />
2 ⎝ Bo ⎠<br />
cpart = −γ − β z<br />
(A23)<br />
dc<br />
dz<br />
2<br />
dc<br />
dz<br />
part<br />
part<br />
2<br />
=−β<br />
= 0
β + St γ + St β z= −Sta−Stbz ergibt sich für das lineare Glied z 1 durch Koeffizientenvergleich<br />
<strong>und</strong> für das konstante Glied z 0<br />
Damit lautet die allgemeine Lösung:<br />
St β z = −St<br />
b z<br />
β =−b<br />
β + St γ = −St<br />
a<br />
b<br />
γ =− a +<br />
St .<br />
( hom ) ( )<br />
c = c ogen + c partikulä r<br />
17<br />
(A24)<br />
(A25)<br />
rz b<br />
1 rz 2<br />
c= A1e + A2e + a−<br />
+ bz<br />
(A26)<br />
St<br />
Aus den Randbedingungen werden 2 Gleichungen für A1 <strong>und</strong> A2 gewonnen (s. auch A13-16).<br />
an der Stelle z=1<br />
an der Stelle z=0<br />
⎛ dc⎞<br />
⎜ ⎟ = 0<br />
⎝ dz⎠<br />
1<br />
r1 r2<br />
A r e + A r e + b=<br />
0<br />
1 1 2 2<br />
A A r<br />
r e<br />
b<br />
r e<br />
2<br />
1 =− 2 −<br />
1 ⎛ dc⎞<br />
c( 0)<br />
= cE+<br />
⎜ ⎟<br />
Bo ⎝ dz⎠<br />
r2−r1 −r1<br />
1 1<br />
b 1<br />
A1+ A2 + a−<br />
= cE<br />
+ 1 1+ 2 2 +<br />
St Bo<br />
A<br />
0<br />
( A r A r b)<br />
r<br />
r b<br />
A<br />
c<br />
Bo Bo Bo a<br />
⎛ 1 ⎞ ⎛ 1 ⎞<br />
b<br />
⎜1−⎟<br />
+ 2 ⎜1−<br />
⎟ = E + − +<br />
⎝ ⎠ ⎝ ⎠<br />
St<br />
1<br />
Aus (A28) <strong>und</strong> (A30) erhält man zwei Ausdrücke für die Konstanten A 1 <strong>und</strong> A 2. A 1, A 2 ,a, b<br />
<strong>und</strong> r 1,2 eingestetzt in (A26) ergibt Gl. (15).<br />
(A4)<br />
(A27)<br />
(A28)<br />
(A2a)<br />
(A29)<br />
(A30)
Volumenstrom Gas [l/min]<br />
20<br />
18<br />
16<br />
14<br />
12<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
Durchflußwerte für Rotameter L25/1000-7160<br />
0 2 4 6 8 10 12 14 16 18 20<br />
Volumenstrom [SKT]<br />
18
6.3 Gesättigte Sauerstoffkonzentrationen in destilliertem Wasser in<br />
Abhängigkeit von Temperatur <strong>und</strong> barometrischem Druck<br />
Druck [Torr]<br />
Temp [°C]<br />
740 745 750 755 760 765 770<br />
16 9,57 9,64 9,70 9,77 9,83 9,90 9,96<br />
17 9,37 9,43 9,50 9,56 9,63 9,69 9,76<br />
18 9,18 9,24 9,30 9,37 9,43 9,49 9,56<br />
19 8,99 9,05 9,12 9,18 9,24 9,30 9,36<br />
20 8,81 8,87 8,93 9,00 9,06 9,12 9,18<br />
21 8,64 8,70 8,76 8,82 8,88 8,94 9,00<br />
22 8,48 8,53 8,59 8,65 8,71 8,77 8,83<br />
23 8,32 8,37 8,43 8,49 8,554 8,61 8,66<br />
24 8,16 8,22 8,28 8,33 8,39 8,45 8,50<br />
25 8,01 8,07 8,13 8,18 8,24 8,29 8,35<br />
26 7,87 7,93 7,98 8,04 8,09 8,15 8,20<br />
27 7,73 7,79 7,84 7,89 7,95 8,00 8,11<br />
28 7,60 7,65 7,70 7,76 7,81 7,86 7,97<br />
29 7,47 7,52 7,57 7,63 7,68 7,73 7,84<br />
30 7,34 7,39 7,44 7,50 7,55 7,60 7,70<br />
7 Literaturübersicht<br />
1. Fitzer Fritz Technische Chemie<br />
Eine Einführung in die chemische <strong>Reaktionstechnik</strong><br />
2. Brauer, Heinz Gr<strong>und</strong>lagen der Einphasen- <strong>und</strong> Mehrphasenströmungen<br />
3. Brötz, Walter Gr<strong>und</strong>riß der chemischen <strong>Reaktionstechnik</strong><br />
4. Kölbel Blasensäulen-Reaktoren<br />
Sonderdruck aus Dechema-Monogaphien Band 68/1971<br />
5. Küsters Blasensäulen-Reaktoren<br />
Dissertation TU Aachen 1976<br />
6. Deckwer <strong>Reaktionstechnik</strong> in Blasensäulen<br />
19
Universität Paderborn<br />
Fakultät Naturwissenschaften<br />
Chemie <strong>und</strong> Chemietechnik<br />
Arbeitsbereich: Halle NW<br />
.<br />
.<br />
Betriebsanweisung<br />
gem § 20 GefStoffV<br />
§ 3 VAwS<br />
Gefahrstoffbezeichnung<br />
20<br />
Arbeitsplatz: <strong>Praktikum</strong> Blasensäule<br />
Tätigkeit: Versuchsdurchführung<br />
(CAS-)Registry: 61-73-4<br />
Name: METHYLENBLAU<br />
Produkt: (C.I. 52015)<br />
Synonyme: METHYLTHIONINIUMCHLORID<br />
3,7-BIS(DIMETHYLAMINO)-PHENAZATHIONIUMCHLORID<br />
Summenformel: C16H18ClN3S<br />
Molmasse: 319.00<br />
Gefahren für Mensch <strong>und</strong> Umwelt<br />
Gefahrenhinweise: Xn - Mindergiftig (ges<strong>und</strong>heitsschädlich)<br />
Wassergefährdungsklasse 2: wassergefährdender Stoff<br />
R 22: ges<strong>und</strong>heitsschädlich beim Verschlucken<br />
Schutzmaßnahmen <strong>und</strong> Verhaltensregeln<br />
Im gesamten Arbeitsbereich sind Schutzbrille <strong>und</strong> Arbeitskittel zu tragen.<br />
Schutzhandschuhe sind zu tragen, wenn Hautkontakt nicht<br />
ausgeschlossen werden kann.<br />
Feuer, Rauchen <strong>und</strong> offenes Licht sind verboten.<br />
Verhalten im Gefahrfall<br />
Es ist nach dem "Alarmplan bei Brand- <strong>und</strong> Explosionsgefahr der Uni-<br />
Paderborn" zu verfahren.<br />
Erste Hilfe<br />
Bei Kontakt mit den Augen mit viel Wasser spülen <strong>und</strong> einen Augenarzt<br />
aufsuchen. Beschmutzte <strong>und</strong> getränkte Kleidung sofort ausziehen.<br />
In jedem Fall ist der Betriebsleiter <strong>und</strong> ein ausgebildeter Ersthelfer zu<br />
informieren.<br />
Überwachung <strong>und</strong> sachgerechte Entsorgung<br />
gemäß den Richtlinien der Uni Pb zur Entsorgung "besonders<br />
überwachungsbedürftigen Abfälle"<br />
Notruf: 112<br />
Betriebsleiter:<br />
Prof. Dr.-Ing- H.-J. Warnecke<br />
. Raum.: NW 1.711<br />
Tel.: 60-3613<br />
Ersthelfer:<br />
Thomas Arens, . 30 43<br />
Dietrich Heinrichs, . 35 61