Phosphorylierungen bei Signalproteinen erkennen ... - BIOspektrum
Phosphorylierungen bei Signalproteinen erkennen ... - BIOspektrum
Phosphorylierungen bei Signalproteinen erkennen ... - BIOspektrum
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
272 WISSENSCHAFT · SPECIAL: PROTEOMICS<br />
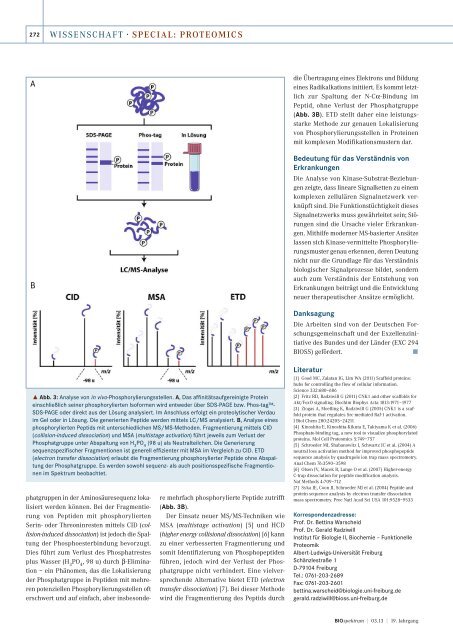
A<br />
B<br />
˚ Abb. 3: Analyse von in vivo-Phosphorylierungsstellen. A, Das affinitätsaufgereinigte Protein<br />
einschließlich seiner phosphorylierten Isoformen wird entweder über SDS-PAGE bzw. Phos-tag-<br />
SDS-PAGE oder direkt aus der Lösung analysiert. Im Anschluss erfolgt ein proteolytischer Verdau<br />
im Gel oder in Lösung. Die generierten Peptide werden mittels LC/MS analysiert. B, Analyse eines<br />
phosphorylierten Peptids mit unterschiedlichen MS/MS-Methoden. Fragmentierung mittels CID<br />
(collision-induced dissociation) und MSA (multistage activation) führt jeweils zum Verlust der<br />
Phosphatgruppe unter Abspaltung von H 3 PO 4 (98 u) als Neutralteilchen. Die Generierung<br />
sequenzspezifischer Fragmentionen ist generell effizienter mit MSA im Vergleich zu CID. ETD<br />
(electron transfer dissociation) erlaubt die Fragmentierung phosphorylierter Peptide ohne Abspaltung<br />
der Phosphatgruppe. Es werden sowohl sequenz- als auch positionsspezifische Fragmentionen<br />
im Spektrum beobachtet.<br />
phatgruppen in der Aminosäuresequenz lokalisiert<br />
werden können. Bei der Fragmentierung<br />
von Peptiden mit phosphorylierten<br />
Serin- oder Threoninresten mittels CID (collision-induced<br />
dissociation) ist jedoch die Spaltung<br />
der Phosphoesterbindung bevorzugt.<br />
Dies führt zum Verlust des Phosphatrestes<br />
plus Wasser (H 3 PO 4 , 98 u) durch β-Elimination<br />
– ein Phänomen, das die Lokalisierung<br />
der Phosphatgruppe in Peptiden mit mehreren<br />
potenziellen Phosphorylierungsstellen oft<br />
erschwert und auf einfach, aber insbesonde-<br />
re mehrfach phosphorylierte Peptide zutrifft<br />
(Abb. 3B).<br />
Der Einsatz neuer MS/MS-Techniken wie<br />
MSA (multistage activation) [5] und HCD<br />
(higher energy collisional dissociation) [6] kann<br />
zu einer verbesserten Fragmentierung und<br />
somit Identifizierung von Phosphopeptiden<br />
führen, jedoch wird der Verlust der Phosphatgruppe<br />
nicht verhindert. Eine vielversprechende<br />
Alternative bietet ETD (electron<br />
transfer dissociation) [7]. Bei dieser Methode<br />
wird die Fragmentierung des Peptids durch<br />
die Übertragung eines Elektrons und Bildung<br />
eines Radikalkations initiiert. Es kommt letztlich<br />
zur Spaltung der N-Cα-Bindung im<br />
Peptid, ohne Verlust der Phosphatgruppe<br />
(Abb. 3B). ETD stellt daher eine leistungsstarke<br />
Methode zur genauen Lokalisierung<br />
von Phosphorylierungsstellen in Proteinen<br />
mit komplexen Modifikationsmustern dar.<br />
Bedeutung für das Verständnis von<br />
Erkrankungen<br />
Die Analyse von Kinase-Substrat-Beziehungen<br />
zeigte, dass lineare Signalketten zu einem<br />
komplexen zellulären Signalnetzwerk verknüpft<br />
sind. Die Funktionstüchtigkeit dieses<br />
Signalnetzwerks muss gewährleitet sein; Störungen<br />
sind die Ursache vieler Erkrankungen.<br />
Mithilfe moderner MS-basierter Ansätze<br />
lassen sich Kinase-vermittelte Phosphorylierungsmuster<br />
genau <strong>erkennen</strong>, deren Deutung<br />
nicht nur die Grundlage für das Verständnis<br />
biologischer Signalprozesse bildet, sondern<br />
auch zum Verständnis der Entstehung von<br />
Erkrankungen <strong>bei</strong>trägt und die Entwicklung<br />
neuer therapeutischer Ansätze ermöglicht.<br />
Danksagung<br />
Die Ar<strong>bei</strong>ten sind von der Deutschen Forschungsgemeinschaft<br />
und der Exzellenzinitiative<br />
des Bundes und der Länder (EXC 294<br />
BIOSS) gefördert. ó<br />
Literatur<br />
[1] Good MC, Zalatan JG, Lim WA (2011) Scaffold proteins:<br />
hubs for controlling the flow of cellular information.<br />
Science 332:680–686<br />
[2] Fritz RD, Radziwill G (2011) CNK1 and other scaffolds for<br />
Akt/FoxO signaling. Biochim Biophys Acta 1813:1971–1977<br />
[3] Ziogas A, Moelling K, Radziwill G (2005) CNK1 is a scaffold<br />
protein that regulates Src-mediated Raf-1 activation.<br />
J Biol Chem 280:24205–24211<br />
[4] Kinoshita E, Kinoshita-Kikuta E, Takiyama K et al. (2006)<br />
Phosphate-binding tag, a new tool to visualize phosphorylated<br />
proteins. Mol Cell Proteomics 5:749–757<br />
[5] Schroeder MJ, Shabanowitz J, Schwartz JC et al. (2004) A<br />
neutral loss activation method for improved phosphopeptide<br />
sequence analysis by quadrupole ion trap mass spectrometry.<br />
Anal Chem 76:3590–3598<br />
[6] Olsen JV, Macek B, Lange O et al. (2007) Higher-energy<br />
C-trap dissociation for peptide modification analysis.<br />
Nat Methods 4:709–712<br />
[7] Syka JE, Coon JJ, Schroeder MJ et al. (2004) Peptide and<br />
protein sequence analysis by electron transfer dissociation<br />
mass spectrometry. Proc Natl Acad Sci USA 101:9528–9533<br />
Korrespondenzadresse:<br />
Prof. Dr. Bettina Warscheid<br />
Prof. Dr. Gerald Radziwill<br />
Institut für Biologie II, Biochemie – Funktionelle<br />
Proteomik<br />
Albert-Ludwigs-Universität Freiburg<br />
Schänzlestraße 1<br />
D-79104 Freiburg<br />
Tel.: 0761-203-2689<br />
Fax: 0761-203-2601<br />
bettina.warscheid@biologie.uni-freiburg.de<br />
gerald.radziwill@bioss.uni-freiburg.de<br />
<strong>BIOspektrum</strong> | 03.13 | 19. Jahrgang