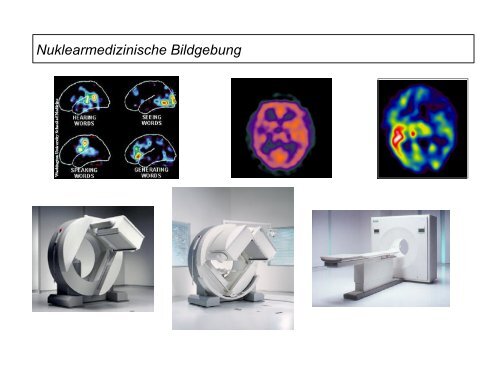
Nuklearmedizinische Bildgebung - Klinik für Epileptologie
Nuklearmedizinische Bildgebung - Klinik für Epileptologie
Nuklearmedizinische Bildgebung - Klinik für Epileptologie
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong>
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Inhalt:<br />
- geschichtlicher Überblick<br />
- physikalische Grundlagen<br />
- Erzeugung von radioaktiven Isotopen<br />
- Meßtechnik<br />
- <strong>Bildgebung</strong> mit radioaktiven Isotopen<br />
Planare Szintigraphie<br />
Single-Photon-Emission-Computed-Tomography (SPECT)<br />
Positronen-Emissions-Tomographie (PET)<br />
(Bildernachweis: Dössel, 2000; Morneburg, 1995; Siemens, Philips, Internet)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Prinzip<br />
- aktiver Abbildungsvorgang durch Zuführung von Energie<br />
(radioaktive Substanzen)<br />
und<br />
- passiver Abbildungsvorgang durch Ausnutzung<br />
körper-eigener Signale (Funktion und Metabolismus)<br />
- unterschiedliche Intensitätsverteilung in den Geweben<br />
des Körpers, abh. von Funktion und Metabolismus
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Historie<br />
Antoine H. Becquerel (1852-1908)<br />
Entdeckung natürlich vorkommender Radioisotope<br />
Marie Curie (1867-1934) und Pierre Curie (1859-1906)<br />
Herstellung künstlicher Radioisotope<br />
Prägung des Begriffs „Radioaktivität“<br />
1903 Nobelpreis <strong>für</strong> Physik an Becquerel und den Curies<br />
1911 Nobelpreis <strong>für</strong> Chemie an M. Curie<br />
1935 Georg von Hevesy<br />
verwendet 32 P <strong>für</strong> metabolische Studien mit Geiger-Müller-Zählrohr<br />
1943 Nobelpreis <strong>für</strong> Chemie an Hevesy
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
1949 B. Cassen et al.: erste Radionuklid-<strong>Bildgebung</strong><br />
( 131 J in der Schilddrüse)<br />
1951-1953 Erste Ideen zur PET<br />
W.H. SWEET, The use of nuclear disintegration in the diagnosis and treatment<br />
of brain tumor, New England Journal of Medicine 1951; 245:875-878.<br />
G.L. BROWNELL, W.H. SWEET, Localization of brain tumors with positron<br />
emitters, Nucleonics 1953, 11:40-45.<br />
1957 H.O. Anger<br />
Entwicklung der nach ihm benannten Szintillations-Kamera<br />
(planare <strong>Bildgebung</strong>)<br />
1960 D.E. Kuhl und R.Q. Edwards<br />
Konstruktion des Mark IV-SPECT-Scanners mit der Anger-Kamera<br />
(~10 Jahre vor Röntgen-CT)<br />
1962 S. Rankowitz und J.S. Robertson<br />
tomographische Bilddarstellung mit Positronenstrahlern
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
1975 M.E. Phelps (Los Angeles); M.M Ter-Pogossian (St. Louis);<br />
T.F. Budinger (Berkeley)<br />
erste PET-Tomographen<br />
(Innovationsschub durch Rekonstruktionsalgorithmen der CT)<br />
1977 W.I. Kayes und R.J. Jaszczak<br />
kommerzielle Entwicklung der SPECT<br />
1978 erste kommerzielle PET<br />
(Auflösung: 1.5 - 2.0 cm)<br />
1979 M.E. Phelps et al.; M. Reivich et al.<br />
Erste PET-Untersuchungen des regionalen zerebralen Glukosestoffwechsels<br />
im lebenden (!) menschlichen Gehirn<br />
1983 M. Singh und D. Doria<br />
Einsatz der Compton-Kamera bei der SPECT<br />
seit den 1990er Jahren<br />
exponentielles Wachstum der Installationen (Infrastruktur!)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
PET-Einrichtungen in Deutschland<br />
1988<br />
aus: H.J. Wieler (Hrsg):<br />
PET in der klinischen Onkologie, Steinkopf, Darmstadt, 1999<br />
1998
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radiopharmaka<br />
- spritzen<br />
- schlucken<br />
- inhalieren<br />
Detektor<br />
SPECT<br />
Verarbeitung/<br />
Quantifizierung<br />
der<br />
Tracerverteilung<br />
PET
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Ziel:<br />
Darstellung (patho-)physiologischer und biochemischer Prozesse<br />
(Transport, Stoffwechsel, Ausscheidung, ...)<br />
Anforderungen an Radiopharmaka<br />
- Zerfallsstrahlen außerhalb des Körpers meßbar<br />
(keine oder nur geringe Absorption)<br />
- Visualisierung realer Stoffwechselprozesse<br />
(Wahl geeigneter Nuklide als Tracer)<br />
- Markierung darf das Verhalten des Tracers im Körper nicht ändern<br />
- Erhaltung physiologischer Konzentrationen der Stoffwechselsubstanzen<br />
- geringe Strahlenbelastung<br />
(relativ kurze Halbwertszeiten)<br />
- Kosten-Nutzen-Relation
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Definitionen:<br />
Z: Ordnungszahl; Zahl der Protonen im Kern (Ladungszahl)<br />
A: Massenzahl; Zahl der Nukleonen im Kern<br />
(Protonen + Neutronen)<br />
N: Zahl der Neutronen im Kern: N = A - Z<br />
X: Symbol des chemischen Elements<br />
A<br />
Z<br />
X<br />
p<br />
e -<br />
H<br />
1<br />
1
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Definitionen:<br />
Nuklid: Atomsorte mit einer durch N und Z festgelegten Kernart<br />
Radio-Nuklid: Nuklid mit meßbarer Zerfallsrate (radioaktiv, instabil)<br />
Isotope: Nuklide mit gleicher Ordnungszahl Z aber unterschiedlichem<br />
N und A → gleiches Element<br />
Isobare: Nuklide mit gleicher Massenzahl A (Z und N verschieden)<br />
→ unterschiedliches Element<br />
Isotone: Nuklide mit gleicher Neutronenzahl N (Z und A verschieden)<br />
→ unterschiedliches Element
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radio-Nuklide <strong>für</strong> die nuklearmedizinische <strong>Bildgebung</strong>:<br />
Forderungen:<br />
- müssen sich an die interessierenden Stoffwechselmoleküle binden<br />
- stabile Isotope müssen in biochemischen Molekülen (oder deren<br />
(Analogen) vorkommen:<br />
- Halbwertszeit<br />
- Reichweite im Gewebe<br />
C, N, O, H, F
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Ionisierende Strahlung:
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Reichweite (Durchdringungsvermögen) ionisierender Strahlung:<br />
Reichweite<br />
Strahlenart Energie [MeV] Luft Wasser<br />
α 1 0,6 cm 0,008 mm<br />
6 5,0 cm 0,06 mm<br />
β 0,1 10 cm 0,13 mm<br />
1 300 cm 4,2 mm<br />
3 1200 cm 15,0 mm<br />
γ 0,01 1 m 0,15 cm<br />
0,1 230 m 2,7 cm<br />
1 190 m 22,0 cm<br />
10 380 m 45,0 cm
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radioaktiver Zerfall:
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radioaktiver Zerfall:<br />
Stabilität eines Elements hängt vom Verhältnis<br />
Ordnungszahl (Z) zu Anzahl der Neutronen (N) ab
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radioaktiver Zerfall:<br />
Zerfallsgesetz:<br />
wobei:<br />
N(t) = Zahl der Nuklide zur Zeit t<br />
N 0 = Zahl der Nuklide zur Zeit t = 0<br />
λ = Zerfallskonstante [t-1]<br />
Halbwertszeit:<br />
N(<br />
t)<br />
= N0e<br />
1 2 = T<br />
ln<br />
λ<br />
2<br />
−<br />
λt
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radioaktiver Zerfall:<br />
Aktivität einer radioaktiven Probe:<br />
(Zahl der Zerfälle pro Zeiteinheit)<br />
A(<br />
t)<br />
dN<br />
− λt<br />
= − =<br />
λN0e<br />
= A0<br />
dt<br />
Einheit: Zahl der Zerfälle/Sekunde = Becquerel = Bq<br />
(früher: Curie (Ci); 1 Ci = 3,7 . 10 10 Bq)<br />
typische Aktivitäten bei nuklearmedizinischer Diagnostik:<br />
100 MBq - 1000 MBq<br />
e<br />
−<br />
λt
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Herstellung von Radionukliden:<br />
natürlich vorkommende radioaktive Isotope haben zu lange<br />
Halbwertszeiten, daher <strong>für</strong> nuk.med. <strong>Bildgebung</strong> uninteressant<br />
→ künstliche Radionuklide<br />
E(p) > 10 MeV<br />
wg. Coulomb-Abstoßung<br />
der Kerns
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Herstellung von Radionukliden:<br />
Radionuklidgenerator<br />
Gewinnung von 99 Tc m aus 99 Mo<br />
- 99 Mo aus Kernreaktor (z.B. n-Einfang)<br />
- Transport in Bleibehältern als Na + MoO 4 -<br />
in <strong>Klinik</strong> (T 1/2 = 66,7 h)<br />
- 99 Mo → 99 Tc m (T 1/2 = 6,03 h)<br />
- Pertechnetat (Na + TcO 4 - ) wasserlöslich<br />
- Auswaschen (Elution)<br />
- Aufziehen in Spritze (NaCl) und Injizieren<br />
- nach 24h genügend neues 99 Tc m<br />
- Wiederholen des Auswaschens („Melken“)<br />
- Generator nach 1 Woche verbraucht
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Herstellung von Radionukliden:<br />
Radionuklidgenerator
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radionuklide <strong>für</strong> diagnostische Anwendungen:
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radionuklide <strong>für</strong> diagnostische Anwendungen:
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radionuklide <strong>für</strong> diagnostische Anwendungen:<br />
- Anbindung an Atom bzw Molekül (Radiopharmaka)<br />
Tracer:<br />
- Radionuklide werden nur „mitgespült“ (Blut, Atemluft)<br />
- Diffusion in spezifische Organe (Perfusion)<br />
- direkte Beteiligung an chemischen Prozessen (z.B. Stoffwechsel)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Radiopharmazeutika <strong>für</strong> diagnostische Anwendungen:<br />
Radionuklide werden an Pharmazeutika gebunden, die <strong>für</strong> bestimmte<br />
metabolische Aktivitäten spezifisch sind<br />
(z.B. Krebs, Herzperfusion, Hirnperfusion)<br />
Gammastrahler<br />
99m Tc-Sestamibi (Herzperfursion, Krebs)<br />
99m Tc-markiertes Hexamethyl-Propylenamin (Hirnperfusion)<br />
Positronenstrahler<br />
11 C T1/2 = 20 min<br />
(Nervenrezeptoren, metabolische Aktivität)<br />
13 N T1/2 = 10 min<br />
NH 3 (Blutfluß, regionale Herzperfusion)<br />
15 O T1/2 = 2.1 min<br />
CO 2 (zerebraler Blutfluß), O 2 (Sauerstoffverbrauch Herz), H 2O<br />
(Sauerstoffverbrauch Herz und Blutperfusion)<br />
18 F T1/2 = 110 min<br />
2-Deoxy-2-[ 18 F]-Fluorglukose<br />
(FDG, Neurologie, Kardiologie, Onkologie, metabolische Aktivität)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Problemstellung in der nuklearmedizinischen Diagnostik:<br />
- Aktivität der in den Körper eingebrachten Probe zum Zeitpunkt der<br />
Applikation bekannt<br />
- Aktivität zu jedem späteren Zeitpunkt bekannt (Zerfallsgesetz)<br />
- wie verteilt sich Aktivität im Körper?<br />
(wo ist wann wieviel?) dA/dV = f(x,y,z,t) = ?<br />
- geeignete Messung der zeitabhängigen Aktivitätsverteilung<br />
- Bildrekonstruktion (wie bei Röntgen-CT), Filme<br />
- funktionelle Abläufe im Körper
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Zählrohr<br />
Gas<br />
Prinzipschaltbild<br />
Z = Zähldraht (Anode)<br />
M = Zählrohrmantel (Kathode)<br />
R = Arbeitswiderstand<br />
C = Zählrohrkapazität<br />
U = Zählrohrspannung
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Zählrohr<br />
Arbeitsweise des Zählrohrs ist abh. von Potentialdifferenz
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Zählrohr<br />
- Bereich I (Rekombinationszone):<br />
Potentialdifferenz reicht nicht aus, um Ladungsmenge (erzeugt durch<br />
γ-Quant) „abzusaugen“; Ladungsträger (Gas) rekombinieren<br />
- Bereich II (Ionisationsbereich):<br />
über Draht abfließende Ladungsmenge ungefähr gleich der erzeugten<br />
Ladungsmenge<br />
- Bereich III (Proportionalitätsbereich):<br />
Ladungsverstärkung; e - werden so stark beschleunigt, dass sie wiederum<br />
neue Gasteilchen ionisieren; abfließende Ladungsmenge proportional zur<br />
erzeugten Ladungsmenge<br />
- Bereich IV (Geiger-Müller-Bereich):<br />
abfließende Ladungsmenge unabh. von erzeugten Ladung; Zählen von<br />
Ereignissen (keine Auswertung der Impulshöhe)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Szintillationszähler
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Szintillationszähler<br />
- γ-Quant wird im Szintillationskristall absorbiert und erzeugt<br />
Photonen (Photoeffekt und Compton-Streuung)<br />
- Zahl der Photonen proportional zur abgegebenen γ-Energie<br />
bei vollständiger Absorption: ein Lichtblitz pro γ-Quant und<br />
Zahl der Photonen ~ E γ<br />
- Photomultiplier:<br />
Herauslösen von e - durch Photoeffekt in 1. Dynode;<br />
Beschleunigung auf 2. Dynode, jedes e - erzeugt Sekundär - e - ;<br />
nach ca. 10 Dynoden meßbarer Impuls am Ausgang
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Detektoren <strong>für</strong> g-Quanten Szintillationszähler
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Kollimatoren<br />
- definieren den Nachweisbereich<br />
bei SPECT und planarer Szintigraphie<br />
(Auswahl der Schicht)<br />
- ideal: zylindrischer Stab<br />
- Material (γ-Absorber): Blei, Wolfram<br />
- je kleiner der Durchmesser des Kollimators, desto besser die<br />
räumliche Auflösung<br />
Aber:<br />
- je kleiner der Durchmesser des Kollimators, desto geringer die<br />
Zahl der nachgewiesenen Quanten und desto höher das Rauschen
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Punktbildfunktion von Kollimatoren<br />
- bewege punktförmigen γ-Strahler vor dem<br />
Detektor vorbei und erfasse Zählrate in Abh.<br />
vom Ort<br />
- es entsteht „Halbschattenbereich“ und Plateau<br />
- Radius R der PBF ergibt sich aus Strahlensatz:<br />
D<br />
R=<br />
L<br />
⎛<br />
Z +<br />
⎜<br />
⎝<br />
L<br />
2<br />
mit<br />
D = Kollimatordurchmesser<br />
L = Kollimatorlänge<br />
Z = Abstand Kollimator - γ-Strahler<br />
PBF schmal, wenn D/L und Z klein<br />
⎞<br />
⎟<br />
⎠<br />
Kollimatorelement
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Typische Kenngrößen von Kollimatoren
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Fokussierende Kollimatoren<br />
Isoimpulslinienverteilung<br />
(„Empfindlichkeitskeule“)<br />
Punktbildfunktion
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Impulshöhenanalysator<br />
- Streuung von γ-Quanten im Gewebe<br />
überwiegend durch Compton-Streuung<br />
- Abbildung des Ortes der Compton-<br />
Streuung und nicht des γ-Strahlers<br />
- Artefakte bei der Aktivitätsabbildung<br />
Reduzierung des Anteils gestreuter<br />
γ-Quanten durch<br />
Impulshöhenanalysator
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Impulshöhenanalysator
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Impulshöhenanalysator<br />
Annahmen (ideale Detektion und idealer Detektor):<br />
- vollständige Absorption aller γ-Quanten im Szintillator<br />
- gleicher Prozentsatz der Umwandlung Energie in Licht<br />
- gleicher Prozentsatz von Photonen auf Dynoden des Photomultipliers<br />
⇒ Fläche unter Kurve des Impulses am Ausgang ~ E γ<br />
- Energieauflösung des Detektors abh von Statistik, mit der ein<br />
γ-Quant unterschiedlich viele Photonen und Photo-e - erzeugt
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Impulshöhenanalysator<br />
E γ, gestreut < E γ, primär<br />
definiere Impulshöhenfenster derart, dass gestreute γ-Quanten<br />
möglichst optimal unterdrückt werden<br />
- untere Schwelle des Fensters zu hoch:<br />
Reduktion der primären γ-Quanten<br />
- untere Schwelle des Fensters zu niedrig:<br />
Anteil der gestreuten γ-Quanten zu hoch<br />
⇒ Schwelle geeignet wählen !!
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Gamma-Kamera (Anger-Kamera)<br />
Idee: simultane Erfassung der Aktivitätsverteilung in einem<br />
großen Körperbereich mit hoher Ortsauflösung<br />
naiver Ansatz:<br />
- je Kollimator ein Detektor, aber: Photomultiplier zu teuer !<br />
Ansatz von Anger:<br />
- relativ wenig Photomultiplier (37 - 100)<br />
- hohe Ortsauflösung durch Verwendung einer Widerstandsmatrix
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Gamma-Kamera (Anger-Kamera)<br />
- Lichtblitz (Szintillator) verteilt sich auf<br />
verschiedene Multiplier<br />
- „Schwerpunkt“ der Mulitplier-Signale<br />
entspricht Ort (x,y) der<br />
γ-Quant-Absorption<br />
+<br />
−<br />
k(x − x )<br />
x=<br />
z<br />
+ −<br />
k(y − y )<br />
y =<br />
z<br />
+ −<br />
z = x + x + y<br />
- z = Maß <strong>für</strong> Impulshöhe<br />
+<br />
+<br />
y<br />
−
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Gamma-Kamera (Anger-Kamera)
<strong>Nuklearmedizinische</strong> <strong>Bildgebung</strong><br />
Gamma-Kamera (Anger-Kamera)<br />
Typische Werte:<br />
37 - 100 Photomultiplier, Durchmesser: 20 - 50 cm<br />
Dicke Szintillationskristall:<br />
6 mm (200 keV-Quanten) - 12 mm (511 keV-Quanten)<br />
Ortsauflösung: 3 - 5 mm<br />
Qualität der Gamma-Kamera abh. von gleichmäßiger und stabiler<br />
Empfindlichkeit der Photomultiplier<br />
Regelmäßiges Kalibrieren der Anordnung mit bekannter<br />
Aktivitätsverteilung; Korrekturverfahren