x - Gmehling
x - Gmehling
x - Gmehling
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
11.02.99<br />
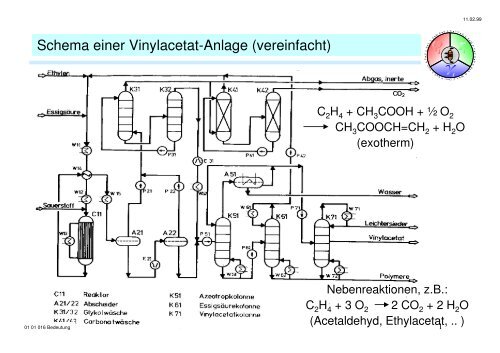
Schema einer Vinylacetat-Anlage (vereinfacht)<br />
C 2 H 4 + CH 3 COOH + ½ O 2<br />
CH 3 COOCH=CH 2 + H 2 O<br />
(exotherm)<br />
101 01 016 Bedeutung<br />
Nebenreaktionen, z.B.:<br />
C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O<br />
(Acetaldehyd, Ethylacetat, .. )<br />
1
Stoff- und Wärmetransportmechanismen<br />
Stofftransport<br />
Wärmetransport<br />
molekulare Ebene molekulare Diffusion Wärmeleitung<br />
makroskopische Ebene<br />
(„effektiver Transport“)<br />
Konvektion<br />
(zu unterscheiden:<br />
freie und erzwungene<br />
Konvektion)<br />
konvektiver<br />
Wärmetransport<br />
(an konvektivenStofftransport<br />
gebunden)<br />
Wärmestrahlung<br />
(insbesondere bei<br />
hoher Temperatur)<br />
2
Filmtheorie<br />
P Gas<br />
Grenzfläche<br />
(Interface)<br />
Phase''<br />
(z.B. reines Gas)<br />
oder Gipskristall,<br />
Kandis, ..<br />
∆z'<br />
c '<br />
i<br />
Phase'<br />
Prandtl‘sche Grenzschicht<br />
c'<br />
z<br />
nɺ<br />
β<br />
nɺ<br />
iL<br />
= β A c<br />
L<br />
β ≈ D<br />
∆ z<br />
( ' − c ' )<br />
Molenstrom [kmol/h]<br />
Stoffübergangskoeffizient<br />
[m/h]<br />
A Phasengrenzfläche [m 2 ]<br />
c Konzentration [kmol/m 3 ]<br />
i<br />
3
Polarographie (1921 Heyrovsky, Chemie-Nobelpreis 1959)<br />
4
CO 2 -Abtrennung durch Pottaschewäsche in der Vinylacetatanlage<br />
K 2<br />
CO 3<br />
C 2<br />
H 4<br />
nɺ<br />
iL<br />
= β<br />
L<br />
( ' ) − c '<br />
A c<br />
i<br />
CO 2<br />
, C 2<br />
H 4<br />
KHCO 3<br />
-Lösung<br />
Optimaler Stofftransport<br />
bei großen<br />
Stofftransportkoeffizienten<br />
(d.h. turbulenten<br />
Bedingungen), großen<br />
Oberflächen (d.h. kleinen<br />
Gasblasen) und großen<br />
Konzentrationsdifferenzen<br />
Kein reines Gas; auch Stofftransportwiderstand auf der Gasseite,<br />
Filmtheorie Zweifilmtheorie<br />
5
Filmtheorie<br />
(Stoffübergang G L)<br />
c''<br />
(<br />
''<br />
c<br />
i' ' )<br />
nɺ<br />
= β A c −<br />
G<br />
iG<br />
nɺ<br />
iL<br />
= β<br />
L<br />
( − c<br />
' )<br />
A c<br />
Im stationären<br />
Zustand:<br />
'<br />
i<br />
Phase''<br />
Annahme:<br />
Phasengleichgewicht<br />
c '' i<br />
Grenzfläche<br />
∆z''<br />
∆z'<br />
c ' i<br />
c<br />
Phase'<br />
= H c<br />
'' '<br />
c '' = K .<br />
i c iji'<br />
i<br />
c'<br />
z<br />
nɺ<br />
iL<br />
=<br />
nɺ<br />
iG<br />
H ij<br />
c''<br />
c<br />
Phase''<br />
'*<br />
'' = H<br />
c'' = K . c ijc<br />
'* i<br />
Henry-Koeffizient,<br />
Verteilungskoeffizient<br />
K = Henry-Koeffizient,<br />
Verteilungskoeffizient....<br />
i<br />
c '* i<br />
Phase'<br />
∆z'<br />
c'<br />
z<br />
6
Stofftransport Zweifilmtheorie<br />
c '' − c =<br />
c<br />
'<br />
i<br />
''<br />
i<br />
'<br />
− =<br />
c<br />
nɺ<br />
iG<br />
βGA<br />
nɺ<br />
iL<br />
β A<br />
L<br />
(1)<br />
c''<br />
Gas<br />
c'' i<br />
c' i<br />
c' i<br />
*<br />
Flüssigkeit<br />
c'<br />
DurchAdditionvonGl.1und2<br />
L G<br />
( nɺ = nɺ = nɺ<br />
)<br />
i i i<br />
⎛<br />
'* ' 1 1 ⎞ nɺ<br />
i<br />
ci<br />
− c = +<br />
⎜<br />
Hij βG β ⎟<br />
⎝<br />
L ⎠ A<br />
Konzentrationen an der<br />
Phasengrenzfläche :<br />
Nach Einführung des Stoffdurchgangskoeffizienten<br />
k [ m/h ]:<br />
c H c c H c<br />
'* '' '<br />
'' =<br />
ij i i<br />
=<br />
ij i<br />
Durch Substitution erhält man:<br />
n<br />
H c − c = ɺ<br />
( )<br />
'* ' iG<br />
ij i i<br />
βG<br />
(<br />
'* '<br />
c ) i<br />
ci<br />
− =<br />
nɺ<br />
G<br />
iG<br />
β H A<br />
ij<br />
A<br />
(2)<br />
1 1 1<br />
= +<br />
kL HijβG βL<br />
erhält man für den Stoffdurchgang:<br />
i<br />
L<br />
(<br />
'* '<br />
)<br />
nɺ<br />
= k A c − c<br />
7
Messmethoden zur Bestimmung von A, k L und k L A<br />
Best_A_kl_a.cdr<br />
Grenzfläche A:<br />
n = k A c<br />
i L,i<br />
∆ i<br />
G<br />
Fotografie<br />
L<br />
Sonde<br />
G<br />
L<br />
isokinetische<br />
Absaugung<br />
Stoffdurchgangskoeffizient k L<br />
G, P CO2 G<br />
k A L<br />
definierte<br />
Fläche<br />
c 0,N2 H 4 Luft<br />
L L, c CO2 Hydrazinmethode<br />
Luft c N2 H 4<br />
(für wässrige Systeme)<br />
8
CO 2 -Abtrennung durch Pottaschewäsche in der Vinylacetatanlage<br />
K 2<br />
CO 3<br />
C 2<br />
H 4<br />
a) Änderungen der Konzentration<br />
b) Änderung des Druckes und damit<br />
der Oberfläche als f(Höhe)<br />
c) Koaleszenz<br />
d) Einfluss der chemischen Reaktion<br />
auf den Stofftransport<br />
CO 2<br />
, C 2<br />
H 4<br />
KHCO 3<br />
-Lösung<br />
9
Beschleunigung des Stofftransports durch chemische Reaktion<br />
Beschleunigung wird<br />
durch Enhancement-<br />
Faktor beschrieben!<br />
A(1) + B(2) C<br />
a e: langsame Reaktion momentane Reaktion an der Phasengrenzfläche<br />
10
11.02.99<br />
Schema einer Vinylacetat-Anlage (vereinfacht)<br />
Durchmesser der Rohre<br />
abhängig von Kinetik,<br />
Reaktionsenthalpie und<br />
Effektivität des<br />
Wärmetransports (Kühlung)<br />
C 2 H 4 + CH 3 COOH + ½ O 2<br />
CH 3 COOCH=CH 2 + H 2 O<br />
(exotherm)<br />
Wie sehen die<br />
Wärmetauscher aus?<br />
101 01 016 Bedeutung<br />
Nebenreaktionen, z.B.:<br />
C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O<br />
(Acetaldehyd, Ethylacetat, .. )<br />
12
Stoff- und Wärmetransportmechanismen<br />
Stofftransport<br />
Wärmetransport<br />
molekulare Ebene molekulare Diffusion Wärmeleitung<br />
makroskopische Ebene<br />
(„effektiver Transport“)<br />
Konvektion<br />
(zu unterscheiden:<br />
freie und erzwungene<br />
Konvektion)<br />
konvektiver<br />
Wärmetransport<br />
(an konvektivenStofftransport<br />
gebunden)<br />
Wärmestrahlung<br />
(insbesondere bei<br />
hoher Temperatur)<br />
13
Wärmeleitung<br />
einfachster Fall: ebene Wand z.B. Stahl [stationärer Zustand]<br />
T 0<br />
T 1<br />
1. Fouriersche Gleichung<br />
Q ɺ<br />
z<br />
λ - Wärmeleitzahl [W/mK]<br />
z - Wanddicke [m]<br />
A - Fläche [m 2 ]<br />
Q ɺ - Wärmestrom [W]<br />
- Wärmestromdichte [W/m 2 ]<br />
qɺ<br />
Qɺ<br />
= − λ A<br />
dT<br />
dz<br />
Für den Wärmestrom Q ɺ [W] gilt:<br />
Qɺ<br />
λ<br />
λ<br />
= A ( T − T ) = A ∆<br />
z<br />
z<br />
Wärmestromdichte:<br />
0 1<br />
T<br />
Qɺ<br />
qɺ<br />
λ<br />
λ<br />
= = ( T − T ) = ∆<br />
A z z<br />
0 1<br />
T<br />
14
Wärmeleitung durch eine mehrschichtige Wand<br />
Im stationären Fall gilt:<br />
15
Wärmeleitzahlen λ [ W/mK] für ausgewählte Stoffe bei 20°C*<br />
* Nach dem Wiedemann-Franzschen Gesetz besitzen elektrisch gut<br />
leitende Stoffe auch einen geringen Widerstand bei der Wärmeleitung<br />
Schlechteste Wärmeleiter sind Gase. Darauf beruht Einsatz poröser<br />
Isoliermaterialen.<br />
16
Wärmeleitfähigkeit<br />
verschiedenster<br />
fester, flüssiger und<br />
gasförmiger<br />
Verbindungen in<br />
Abhängigkeit von der<br />
Verbindungen<br />
( VDI-Wärmeatlas<br />
1985, 5. Auflage )<br />
17
Beispiel: Wärmeleitzahl λ von Toluol (flüssig) bei 25°C<br />
Messung der Wärmeleitzahl von<br />
Flüssigkeiten und Gasen nicht<br />
einfach (Konvektion muss<br />
vermieden werden !!).<br />
18
Wärmestrahlung<br />
Bilanz für eingestrahlte Energie<br />
• • • •<br />
Q = Q + Q + Q<br />
r<br />
a<br />
d<br />
r a d<br />
reflektiert<br />
absorbiert<br />
durchgelassen<br />
Grenzfälle<br />
idealer Spiegel:<br />
schwarzer Körper:<br />
diathermer Körper:<br />
• •<br />
Q r<br />
• •<br />
= Q a<br />
• •<br />
= Q d<br />
Q =<br />
Q<br />
Q<br />
Ausgestrahlte Energie eines schwarzen Körpers<br />
nach Stefan-Bolzmann:<br />
•<br />
4<br />
Qs<br />
= Cs<br />
A T W<br />
C s<br />
Strahlungszahl des schwarzen Körpers<br />
(5.676 . 10 -8 W/m 2 K 4 )<br />
Wiensches Verschiebungsgesetz:<br />
−<br />
λ max T = 2.<br />
885⋅10 3 mK<br />
19
Wärmestrahlung<br />
λ<br />
T<br />
T<br />
Temperatur Sonne:<br />
max<br />
T<br />
= 2.885⋅10<br />
2.885⋅10<br />
=<br />
500⋅10<br />
= 5770K<br />
−3<br />
−9<br />
−3<br />
mK<br />
m<br />
mK<br />
500 nm<br />
Verteilung der relativen Strahlungsenergie E λ<br />
des schwarzen Körpers auf die Wellenlänge λ bei<br />
verschiedenen Temperaturen T nach M. Planck<br />
sichtbares Spektralgebiet schraffiert<br />
20
Strahlung des<br />
schwarzen<br />
Körpers<br />
21
In der Realität gibt es keine schwarzen Körper<br />
GrauerKörper:<br />
ɺ<br />
4<br />
Q=CsεAT [W]<br />
ε Emissionsverhältnis<br />
Pt-Schwarz, Lampenruß ε = 0.9 – 0.97<br />
Ziegel ε = 0.9<br />
Schamott (Steamcracker) ε = 0.6<br />
Stahl ε = 0.6<br />
Polierte Oberflächen ε = 0.04<br />
Kupfer poliert ε = 0.03<br />
durch Keramik-<br />
Coating ε = 0.9<br />
22
Konvektiver Stofftransport (freie bzw. erzwungene Konvektion)<br />
Konvektiver Stofftransport: Wichtigster Stofftransport in der Praxis (Heizen,<br />
Wärmetauscher)<br />
Zu unterscheiden:<br />
Wärmeübergang<br />
Wärmedurchgang<br />
Konvektiver Wärmetransport an Stofftransport gebunden<br />
Qɺ<br />
= α ⋅ A ⋅ ∆T<br />
α<br />
Wärmeübergangskoeffizient W/m2 K (Wert hängt von<br />
Strömungseigenschaften, Oberflächenbeschaffenheit, Dicke der<br />
Prandtlschen Grenzschicht, ... ab)<br />
23
Beispiele für Wärmeübergangszahlen α [ W/m 2 K]*<br />
α [ W/m 2 K] niedrig mittel hoch<br />
Luft 8 40 80<br />
Wasser 100 1000 4000<br />
siedendes Wasser 1000 6000 30000<br />
kondensierendes<br />
Wasser<br />
kondensierende<br />
organische Dämpfe<br />
5000 14000 25000<br />
500 1000 2000<br />
zu berechnen über dimensionslose Kennzahlen:*<br />
Nusselt - Zahl Nu = tatsächlicher Wärmestrom<br />
Wärmestrom durch Wärmeleitung<br />
Nu = f(Re,Pr) z.B.: Nu = C Re n Pr m<br />
αz<br />
=<br />
λ<br />
* VDI-Wärmeatlas<br />
24
Wärmestromdichte als f(∆T) für Wasser bei 1 bar<br />
H. Martin, Kap. 3.2<br />
in Fluid-Verfahrenstechnik,<br />
Band 1, S. 281<br />
Herausgeber:<br />
R. Goedecke<br />
Wiley-VCH, Weinheim (2006)<br />
25
Nukijama-Kurve<br />
Nukijama-Kurve, A freie Konvektion, B Blasenverdampfung,<br />
C instabile Filmverdampfung, D stabile Filmverdampfung<br />
Nukijama, S.: The maximum and minimum values of the heat Q transmitted from<br />
metal to boiling water under atmospheric pressure. J. Jap. Soc. Mech. Eng. 37 (1934)<br />
367-374, engl. Übersetzung in Int. Heat Mass Transfer 9 (1966) 1419-1433<br />
26
Wärmedurchgang (z.B. Wärmetauscher, Rohrbündelreaktor, .. )<br />
Wärme<br />
T<br />
T<br />
1<br />
T<br />
W,1<br />
∆z<br />
T<br />
W,2<br />
z<br />
T<br />
2<br />
27
Wärmedurchgang<br />
•<br />
Q<br />
= T1<br />
Aα1<br />
•<br />
Q ∆z<br />
Aλ<br />
−<br />
T W ,1<br />
= T W<br />
−T<br />
, 1 W ,2<br />
T<br />
T<br />
1<br />
T<br />
Wärme<br />
W,1<br />
bzw. unter Verwendung<br />
der Wärmedurchgangszahl k:<br />
•<br />
Q<br />
=<br />
k A ∆T<br />
•<br />
Q<br />
Aα<br />
2<br />
=<br />
T<br />
W ,2<br />
−T<br />
2<br />
∆z<br />
T<br />
W,2<br />
z<br />
T<br />
2<br />
wobei für k gilt:<br />
•<br />
Q<br />
A<br />
⎛ 1<br />
⎜<br />
⎝α1<br />
+<br />
∆z<br />
1<br />
+<br />
λ α<br />
2<br />
⎞<br />
⎟<br />
⎠<br />
=<br />
T<br />
1<br />
−T<br />
2<br />
1<br />
k<br />
=<br />
1<br />
α<br />
1<br />
+<br />
∆z<br />
1<br />
+<br />
λ α<br />
2<br />
28
∆T bei Gleichstrom<br />
29
∆T bei Gegenstrom<br />
30
∆T beim Wärmetauscher<br />
Durch eine Wärmebilanz lässt sich zeigen, dass ∆T durch<br />
logarithmische Temperaturdifferenz ersetzt werden muss:<br />
∆ T<br />
=<br />
ln<br />
∆<br />
T<br />
A<br />
ln<br />
− ∆<br />
T<br />
∆TA<br />
∆T<br />
E<br />
E<br />
Damit ergibt sich die folgende Beziehung für den<br />
Wärmedurchgang beim Wärmetauscher:<br />
Qɺ<br />
= k A ∆<br />
T ln<br />
31
Einfluss der Stromführung auf die Fläche eines Wärmeaustauschers<br />
1000 kg/h Öl (c p<br />
=0,45 kcal/kg K) sollen mit<br />
Wasser (c p<br />
=1,0 kcal/kg K) von 100°C auf 50°C<br />
abgekühlt werden. Das Wasser soll von 20°C<br />
auf max. 40°C erwärmt werden. Welche Menge<br />
an Wasser wird benötigt und wie groß ist die<br />
Austauschfläche bei Gleich- und bei Gegenstromführung?<br />
(k=200 kcal/m 2 h K)<br />
32
Temperaturprofile bei der Kühlung und Kondensation überhitzter Dämpfe<br />
Bei Unstetigkeiten im<br />
Temperaturverlauf z.B.<br />
der Kondensation von<br />
Dämpfen:<br />
Berechnung der<br />
Gesamtfläche aus den<br />
einzelnen Teilflächen<br />
A ges = A 1 + A 2<br />
33
Umlaufverdampfer (natürlicher Umlauf) einer Rektifikationskolonne<br />
34
Wärmeaustauscher (Rohrbündelreaktor)<br />
35
Think Big (LURGI)<br />
36
Temperaturverlauf Rohrreaktor bei exothermer Reaktion<br />
Temperatur<br />
ɺ ɺ ɺ ɺ<br />
Q R<br />
> Q A<br />
A B<br />
Thot spot = f (r,V,c Ao<br />
,∆h R<br />
,k W<br />
,k(T)) z.B. . −r Α = k(T) c A<br />
Q R < Q A<br />
ɺ<br />
dQA kW dA ∆T= kW<br />
2 π<br />
Reaktionsmedium ɺ<br />
dQ R<br />
= k(T)<br />
⋅cA ⋅dVR ⋅( −∆h<br />
R)<br />
2<br />
steigende k(T)<br />
= k(T) ⋅cA<br />
⋅ π⋅r ⋅dL ⋅( −∆h<br />
R )<br />
sinkende Konz. c A<br />
∆T L2<br />
= ⋅ ⋅ ⋅ ⋅ ⋅r ⋅dL<br />
⋅∆T<br />
Temperatur T<br />
∆T L1<br />
T Kühlmittel<br />
(z.B. siedendes Wasser bei entsprechendem Druck)<br />
Länge L<br />
37
Zusammenfassung Wärmetransport<br />
1) Wärmeleitung<br />
T<br />
Qɺ<br />
∂<br />
= −λ<br />
⋅ A ⋅<br />
∂z<br />
λ = Wärmeleitzahl<br />
[ W/mK ]<br />
2) Wärmestrahlung<br />
Qɺ<br />
=<br />
C<br />
s<br />
⋅ A<br />
⋅ T<br />
4<br />
(schwarzer<br />
Körper)<br />
Qɺ<br />
= ε ⋅C<br />
s<br />
⋅ A<br />
⋅T<br />
4<br />
(grauer<br />
Körper)<br />
3) Konvektion<br />
Wärmeübergang<br />
Qɺ<br />
= α ⋅A<br />
⋅∆T<br />
α<br />
α<br />
α<br />
= Wärmeübergangszahl [ W/m<br />
2<br />
K]<br />
= f(Geometrie,Strömungseigenschaften,...)<br />
= f(Nu,Pr ,Re,...)<br />
38
Zusammenfassung: Wärmedurchgang, Wärmeaustauscher<br />
•<br />
Q<br />
=<br />
k<br />
⋅<br />
A<br />
⋅ ∆T<br />
k = Wärmedurchgangszahl (W/m 2 K)<br />
z. B. ebene Wand<br />
1<br />
k<br />
1 zi<br />
1<br />
= + ∑ +<br />
α λ α<br />
I<br />
i<br />
II<br />
I<br />
II<br />
Wärmeaustauscher:<br />
Möglichkeiten der Stromführung<br />
a) Gleichstrom<br />
b) Gegenstrom<br />
∆T<br />
ln<br />
∆T<br />
ln<br />
=<br />
=<br />
∆Tgroß<br />
− ∆T<br />
∆Tgroß<br />
ln<br />
∆T<br />
klein<br />
klein<br />
logarithmische Temperaturdifferenz<br />
c) Kreuzstrom<br />
•<br />
Q = k ⋅ A<br />
⋅<br />
∆<br />
T ln<br />
39
Inhalt der Vorlesung „Grundlagen der Technischen Chemie“<br />
Unterschied Labor - Technik<br />
a) größerer Maßstab b) Wirtschaftlichkeit<br />
Geschichte der industriellen Chemie<br />
Rohstoff und Energiesituation<br />
Grundfließbild, Verfahrensfließbild<br />
Grundbegriffe (Umsatz, Selektivität,<br />
Ausbeute)<br />
Produkte der chemischen Industrie<br />
Grundlagen<br />
Thermische Trennverfahren<br />
Rektifikation, Extraktion, Absorption, Kristallisation,<br />
Adsorption, Membrantrennverfahren<br />
Aufstellung und Lösung von Bilanzgleichungen<br />
a) Reaktionstechnik (CSTR, PFR)<br />
b) Grundoperationen (z.B. Rektifikation)<br />
Herstellung der Grundchemikalien<br />
Erdöldestillation, Chemische Raffinerie<br />
Steamcracker (C4- und Aromatenaufarbeitung)<br />
Steamreforming<br />
Produktstammbäume<br />
Reaktionskinetik (homogen)<br />
Stofftransport<br />
Wärmetransport<br />
Thermodynamik<br />
a) Reaktionsenthalpie, chemisches<br />
Gleichgewicht<br />
b) Phasengleichgewicht<br />
c) Stoffdaten<br />
Ausgewählte Chemische Prozesse<br />
Vinylchlorid<br />
Ethylenoxid<br />
Kostenrechnung<br />
40
Einsatzmöglichkeiten der Thermodynamik<br />
im Chemieingenieurwesen<br />
• Berechnung der Reaktionsenthalpie (∆h R (T,P))<br />
• Berechnung des Gleichgewichtsumsatzes als f(T,P,x i )<br />
für einfache reversible Reaktionen und Simultangleichgewichte<br />
• Berechnung der verschiedenen Phasengleichgewichte<br />
(VLE, LLE, ..) zur Auslegung thermischer<br />
Trennverfahren<br />
• Berechnung weiterer wichtiger Daten (Enthalpien,<br />
Dichten, Wärmekapazitäten, ... ∆h R (P))<br />
• Auslegung von Kreisprozessen<br />
41
Reaktionsenthalpie, Standardreaktionsenthalpie<br />
Reaktionsenthalpie ist identisch mit der Differenz der<br />
Enthalpieinhalte von Produkten und Edukten<br />
∆h R (T,P) = Σ ν i h i (T,P)<br />
Tabellierung aller ∆h R (T,P) nicht möglich!<br />
Festlegung eines Standardzustandes (25 °C, 1 atm) (Flüssigkeit,<br />
Feststoff, fiktives ideales Gas)<br />
auch dann verbleibt große Anzahl möglicher<br />
Standardreaktionsenthalpien<br />
42
Berechnung der Standardreaktionsenthalpie<br />
aus den Standardbildungsenthalpien<br />
Die Standardbildungsenthalpie ist gleich der<br />
Standardreaktionsenthalpie aus den Elementen.<br />
Einige experimentell zugänglich, z.B.:<br />
C + O 2 → CO 2 ∆h R<br />
o<br />
H 2 + ½ O 2 → H 2 O ∆h R<br />
o<br />
H 2 → H 2 ∆h Ro = 0<br />
Standardbildungsenthalpien der Elemente = 0. Andere Werte über<br />
andere Reaktionsenthalpien, z.B. Verbrennungsenthalpien, ..<br />
zugänglich:<br />
C 6 H 6 + 7.5 O 2 → 6 CO 2 + 3 H 2 0 ∆h Verbrennung<br />
43
Berechnung der Standardreaktionsenthalpie aus den<br />
Standardbildungsenthalpien<br />
CH 3 OH → C + 2 H 2 + ½ O 2 -∆h o B,CH3OH<br />
CO → C + ½ O 2 -∆h o B,CO<br />
2 C + 2 H 2 + O 2 → CH 3 COOH ∆h o B,CH3COOH<br />
CH 3 OH + CO → CH 3 COOH ∆h R<br />
o<br />
∆h Ro = ∆h o B,CH3COOH -∆h o B,CH3OH -∆h o B,CO = Σν i ∆h o B,i<br />
Temperaturabhängigkeit der Standardreaktionsenthalpie<br />
(Kirchhoffsches Gesetz):<br />
∆h Ro (T) = ∆h Ro (T o ) + Σ ν i c Pio dT<br />
44
Druckabhängigkeit der Reaktionsenthalpie<br />
0.5 N<br />
2<br />
+ 1.5 H<br />
2<br />
⇌ NH3<br />
Druckabhängigkeit mit<br />
Hilfe von<br />
Zustandsgleichungen<br />
über Realanteile (h-h id ) T,P<br />
berechenbar<br />
L.J. Gillespie, J.A. Beattie, Phys. Rev. 36, 743 (1930) (Ullmann)<br />
46
A + B 2 C<br />
Chemisches Gleichgewicht<br />
dG =- SdT +VdP +Σ µ i dn i<br />
Es gilt: -dn A =-dn B = 1/2 dn C<br />
bzw. dn A = dn dn B ; C =- 2 dn A<br />
dG = -SdT +VdP +(2µ - µ C A - µ B ) dn A<br />
G weist ein Minimum für gegebene<br />
Temperatur T und gegebenen Druck P<br />
auf, wenn dG/dn A<br />
= 0, d.h.:<br />
µ A + µ B = 2µ C bzw. allgemein: Σ ν i µ i = 0<br />
o f o<br />
µ<br />
i<br />
= µ<br />
i<br />
+ RT ln = ∆g<br />
B,i<br />
+ RT<br />
f<br />
i<br />
o<br />
i<br />
o<br />
∑ ∑ ∑ ⎜ i<br />
ν = = +<br />
⎟ iµ<br />
i<br />
0 νi∆g<br />
B,i<br />
RT ln<br />
o<br />
⎝ fi<br />
⎠<br />
o<br />
∆g R<br />
ln<br />
⎛<br />
f<br />
f<br />
f<br />
i<br />
o<br />
i<br />
⎞<br />
ν i<br />
G<br />
dG/dn A = 0<br />
∆g<br />
o<br />
R<br />
= −RT lnK<br />
= −RT ln<br />
⎛ f<br />
⎜<br />
⎝ f<br />
A<br />
o<br />
A<br />
⎛ f<br />
⎜<br />
⎝<br />
⎞<br />
⎟<br />
⎠<br />
C<br />
o<br />
fC<br />
ν<br />
A<br />
⎞<br />
⎟<br />
⎠<br />
ν<br />
C<br />
⎛ f<br />
⎜<br />
⎝ f<br />
B<br />
o<br />
B<br />
⎞<br />
⎟<br />
⎠<br />
ν<br />
B<br />
n A<br />
korrekte Gleichgewichtskonstante<br />
47
Thermodynamische Grundlagen<br />
aA + bB cC +<br />
dD<br />
Standardreaktionsenthalpie:<br />
o<br />
∆ = ∑<br />
o<br />
h<br />
R<br />
ν<br />
i∆hB,<br />
i<br />
Kirchhoff:<br />
K =<br />
⎛<br />
⎜<br />
⎝<br />
⎛<br />
⎜<br />
⎝<br />
f<br />
f<br />
f<br />
f<br />
C<br />
o<br />
C<br />
A<br />
o<br />
A<br />
⎞<br />
⎟<br />
⎠<br />
⎞<br />
⎟<br />
⎠<br />
c<br />
a<br />
o<br />
o<br />
o<br />
∆h R<br />
( T ) = ∆hR<br />
( To<br />
) + ν<br />
i<br />
cP,<br />
Chemisches Gleichgewicht:<br />
⎛<br />
⎜<br />
⎝<br />
⎛<br />
⎜<br />
⎝<br />
f<br />
f<br />
f<br />
f<br />
D<br />
o<br />
D<br />
B<br />
o<br />
B<br />
⎞<br />
⎟<br />
⎠<br />
⎞<br />
⎟<br />
⎠<br />
d<br />
b<br />
T<br />
∫∑<br />
G = ! Minimum<br />
= f (T )<br />
T<br />
o<br />
i<br />
a + bT + cT<br />
dT<br />
o<br />
o<br />
− RT ln K = ∆g R<br />
= ∑ν<br />
i∆g<br />
B,<br />
2<br />
i<br />
van’t Hoff:<br />
o<br />
d ln K ∆hR<br />
=<br />
2<br />
dT RT<br />
(<br />
o<br />
o<br />
= Standardzustand für ∆g<br />
)<br />
f<br />
i<br />
B,<br />
i<br />
48
Darstellung von f i und f i<br />
o<br />
Darstellung der Fugazität f i<br />
Weg A :<br />
Weg B :<br />
Standardfugazität :<br />
f o<br />
( T P)<br />
f = y ϕ P<br />
i i i<br />
f = x γ f ≈<br />
x γ P<br />
o<br />
s<br />
i i i i i i i<br />
f<br />
( ) o s s<br />
s<br />
i<br />
, i i<br />
i<br />
= ϕ<br />
i<br />
P<br />
i<br />
exp<br />
v<br />
c<br />
P − P<br />
RT<br />
s<br />
≈<br />
P<br />
i<br />
o<br />
∆g B<br />
Standardfugazität der tabellierten - Werte bei 1 atm :<br />
Gase (idealer Gaszustand) :<br />
f o<br />
i<br />
= 1<br />
atm<br />
Flüssigkeiten, Feststoffe :<br />
i i i<br />
c<br />
v i molares Volumen der Flüssigkeit bzw. des Feststoffes<br />
f<br />
o<br />
s<br />
= ϕ<br />
P<br />
s<br />
exp<br />
v<br />
c<br />
i<br />
(<br />
s<br />
1atm<br />
− P ) s<br />
RT<br />
i<br />
≈<br />
49<br />
P<br />
i
18.03.99<br />
Thermodynamische Größen für den idealen Gaszustand<br />
11 00 005 ChemEquil<br />
50
Gleichgewichtsumsatz unabhängig von der Wahl des<br />
Standardzustands<br />
C 2 H 4 + H 2 O C 2 H 5 OH<br />
Gibbssche Bildungsenthalpien<br />
im Standardzustand:<br />
C 2<br />
H 4<br />
∆g , kJ / mol<br />
o,<br />
id<br />
B<br />
68.11<br />
∆g , kJ / mol<br />
o , L<br />
B<br />
------<br />
Dampfdruck Wasser bei 25 °C:<br />
0.0312 atm<br />
H 2<br />
O<br />
C 2<br />
H 5<br />
OH<br />
-228.572<br />
-168.28<br />
-237.167<br />
------<br />
Standardzustand: ideales Gas ∆g Ro = -168.28 - 68.11 + 228.572 = -7.818 kJ/mol<br />
fC H OH<br />
/ 1atm<br />
2 5<br />
K<br />
1<br />
= 23.425 .<br />
=<br />
=<br />
fC H<br />
/ 1atm ⋅ fH O<br />
/ 1atm<br />
2 4 2<br />
Standardzustand H 2 O: Flüssigkeit ∆g Ro = -168.28 - 68.11 + 237.167 = 0.777 kJ/mol<br />
2 0.7309 = fC H OH<br />
/ 1atm<br />
2 5<br />
K2<br />
= 0.<br />
7309<br />
=<br />
s<br />
fC H<br />
/ 1atm<br />
⋅ fH O<br />
/ P<br />
2 4 2 H2O<br />
K 1 = K 2 /P s H2O = 0.7309/0.0312 = 23.427<br />
51
d ln K<br />
dT<br />
∆h<br />
RT<br />
Gleichgewichtsumsatz als f(T) für<br />
R<br />
endo- und exotherme Reaktionen 2<br />
=<br />
o<br />
z.B. NH 3 ,<br />
SO 3 , ..<br />
z.B. Synthesegas-<br />
Erzeugung<br />
52
Maximaler und real erreichbarer Umsatz<br />
für eine exotherme Reaktion<br />
Zwischenkühlung,<br />
z.B. Hordenreaktor<br />
Kaltgaszugabe<br />
53
Gleichgewichtsreaktion in der Gasphase<br />
a A + b B c C + d D<br />
K=<br />
o c o d<br />
( fC<br />
fC<br />
) ( f<br />
D<br />
f<br />
D<br />
)<br />
o a o<br />
( f f ) ( f f ) b<br />
A<br />
A<br />
Annahme: ideales Gas Standardzustand für die tabellierten ∆g Bio<br />
-Werte, d.h. f io<br />
= 1 atm<br />
Fugazität in der Gas( Dampf )-Phase per Definition:<br />
K=<br />
o c<br />
o<br />
( y ) ( )<br />
Cϕ<br />
CP<br />
f<br />
C<br />
y<br />
DϕDP<br />
f<br />
D<br />
o a<br />
o<br />
( y ϕ P f ) ( y ϕ P f )<br />
A<br />
A<br />
A<br />
B<br />
B<br />
B<br />
B<br />
d<br />
b<br />
B<br />
=<br />
f i = y i ϕ i P = ϕ i P i<br />
o c<br />
o d<br />
( P ) ( )<br />
CϕC<br />
f<br />
C<br />
PDϕ<br />
D<br />
f<br />
D<br />
o a<br />
o<br />
( P ϕ f ) ( P ϕ f ) b<br />
Wenn für den Druck P ebenfalls die Einheit atm verwendet wird, ergibt sich:<br />
A<br />
A<br />
A<br />
B<br />
B<br />
B<br />
K=<br />
y<br />
y<br />
c<br />
C<br />
a<br />
A<br />
y<br />
y<br />
d<br />
D<br />
b<br />
B<br />
c d<br />
ϕ ϕ<br />
C D ⎛<br />
a b<br />
⎜<br />
ϕ ϕ ⎝<br />
A<br />
B<br />
P<br />
1atm<br />
⎞<br />
⎟<br />
⎠<br />
Σν<br />
i ν i<br />
= K<br />
y<br />
K<br />
ϕ<br />
Σ<br />
⎛ P ⎞<br />
⎜ ⎟<br />
⎝1atm<br />
⎠<br />
P<br />
K=<br />
P<br />
c<br />
C<br />
a<br />
A<br />
P<br />
P<br />
d<br />
D<br />
b<br />
B<br />
c d<br />
ϕ<br />
Cϕ<br />
D ⎛<br />
a b<br />
⎜<br />
ϕ ϕ ⎝<br />
A<br />
B<br />
1<br />
1atm<br />
⎞<br />
⎟<br />
⎠<br />
Σν<br />
i ν i<br />
= K<br />
P<br />
K<br />
ϕ<br />
Σ<br />
⎛ 1 ⎞<br />
⎜ ⎟<br />
⎝1atm<br />
⎠<br />
54
28.02.03<br />
„Druckabhängigkeit“ der Gleichgewichtskonstante K P<br />
Die Gleichgewichtskonstante einer chemischen Reaktion sollte<br />
nur von der Temperatur abhängen<br />
NH 3 -Synthese (450°C) 1/2 N 2 + 3/2 H 2 NH 3<br />
K = K P K ϕ<br />
P,atm 1 100 600 1000 1500 2000 3500<br />
K P * 10 3 6.59 7.24 12.94 23.28 69.62 133.7 1075<br />
Mit Hilfe der thermodyn. Standardgrößen und c P<br />
id<br />
: K = 6.62*10 -3<br />
K ϕ<br />
über Zustandsgleichung<br />
P,atm 1 100 600 1000 …..<br />
Kϕ 1.00 .914 0.512 0.284 …..<br />
Reales Verhalten führt zu höheren Umsätzen, wenn Kϕ < 1<br />
11 00 008 ChemEquil<br />
55
28.02.03<br />
„Druckabhängigkeit“ der Gleichgewichtskonstante K P<br />
der NH 3 -Synthese bei 450°C<br />
1.4<br />
1.2<br />
1<br />
1/2 N 2 + 3/2 H 2 NH 3<br />
K P atm -1<br />
0.8<br />
0.6<br />
0.4<br />
0.2<br />
6.59 10 -3<br />
0<br />
11 00 008 ChemEquil<br />
0 500 1000 1500 2000 2500 3000 3500<br />
P, atm<br />
56
K P<br />
.10 -3<br />
Einfluss der Gasphasenrealität auf den Gleichgewichtsumsatz der<br />
Ammoniak - Synthese<br />
K =<br />
0<br />
NH<br />
3 3<br />
0 0.5 0<br />
( f / f ) ( f / f ) 1. 5<br />
N<br />
2<br />
f<br />
N<br />
NH<br />
Temperatur 450°C : K=6.62 . 10 -3<br />
25.<br />
20.<br />
15.<br />
10.<br />
5.<br />
exp. Daten:<br />
Larson, A.T., Dodge, B.F.,<br />
J.Amer.Chem.Soc. 1923,45,2918<br />
Gillespie, L.J., Beattie, J.A.,<br />
Phys.Rev. 1930,36,743<br />
Ideales Gas<br />
SRK (mit binären Parametern)<br />
PSRK<br />
VTPR<br />
0.5N + 1.5H<br />
NH<br />
2<br />
0. 200. 400. 600. 800. 1000.<br />
/<br />
f<br />
H<br />
2<br />
2<br />
H<br />
2<br />
P [atm]<br />
2<br />
(aus<br />
Gleichgewichtsumsatz X<br />
K<br />
= KP<br />
⋅ Kϕ<br />
tabellierten<br />
0.9<br />
0.6<br />
0.3<br />
3<br />
∆g<br />
= e<br />
0<br />
B<br />
0<br />
R<br />
∆g<br />
−<br />
RT<br />
, ∆h<br />
0<br />
B<br />
exp. Daten:<br />
, c<br />
0<br />
P<br />
Ideales Gas<br />
−<br />
Daten)<br />
Larson, A.T., Dodge, B.F.,<br />
J.Amer.Chem.Soc. 1923,45,2918<br />
Gillespie, L.J., Beattie, J.A.,<br />
Phys.Rev. 1930,36,743<br />
SRK (mit binären Parametern)<br />
PSRK<br />
VTPR<br />
0<br />
0. 200. 400. 600. 800. 1000.<br />
P[atm]<br />
57
Umsatz der Ammoniak-Synthese als f(T, P)<br />
58
Gleichgewichtsreaktion in der flüssigen Phase<br />
a A + b B c C + d D<br />
Annahme:<br />
K=<br />
o c o d<br />
( f ) ( )<br />
C<br />
f<br />
C<br />
f<br />
D<br />
f<br />
D<br />
o<br />
( ) a o<br />
f f ( f f ) b<br />
A<br />
A<br />
Standardzustand für die tabellierten ∆g Bi o -Werte die<br />
reine Flüssigkeit bei einem Druck von 1 atm*, d.h.:<br />
f i o = ϕ i s P i s Poy i * ≈ P i<br />
s<br />
Unter Verwendung der folgenden Beziehung für die<br />
Fugazität in der flüssigen Phase bei P und T:<br />
B<br />
B<br />
Poynting-Faktor Poy i<br />
per Definition:<br />
Poy<br />
i<br />
L s<br />
v<br />
i<br />
(P − P<br />
i<br />
)<br />
≈ exp<br />
RT<br />
Druck beim Standardzustand<br />
( P = 1 atm ),<br />
sonst P = Systemdruck<br />
f i = x i γ i ϕ i s P i s Poy i ≈ x i γ i P i<br />
s<br />
c<br />
ergibt sich vereinfacht: ( x γ ) ( )<br />
C<br />
x<br />
Dγ<br />
D<br />
K=<br />
a<br />
( x γ ) ( x γ )<br />
x<br />
=<br />
x<br />
x<br />
x<br />
c d<br />
γ<br />
Cγ<br />
D<br />
a b<br />
γ γ<br />
d c d<br />
C C D<br />
=<br />
b a b<br />
A A B B A B A B<br />
K<br />
x<br />
K<br />
γ<br />
Reales Verhalten<br />
führt zu höheren<br />
Umsätzen, wenn<br />
K γ < 1<br />
59
20.01.00<br />
Umsatz bei der MTBE-Synthese<br />
1.00<br />
Umsatz XIsobuten<br />
0.90<br />
0.80<br />
0.70<br />
0.60<br />
K=K x K γ<br />
Methanol + Isobuten MTBE<br />
Eduktverhältnis 1.06:1<br />
P = 15 atm<br />
(J.Chem.Eng.Data 37(1992)339)<br />
0 20 40 60 80 100 120<br />
Temperatur [°C]<br />
ideal<br />
UNIFAC<br />
Exp. Daten<br />
11 00 013a ChemEquil<br />
60
Isobuten-Umsatz bei der MTBE-Synthese<br />
mit<br />
Butan<br />
K<br />
x<br />
K γ<br />
=<br />
=<br />
x<br />
γ<br />
x<br />
MeOH<br />
γ<br />
MeOH<br />
MTBE<br />
x<br />
MTBE<br />
γ<br />
i −Buten<br />
i −Buten<br />
61
18.03.99<br />
Simultangleichgewichte, z.B. Synthesegaserzeugung<br />
4 2 2 R<br />
2 2 2 R<br />
( )<br />
( )<br />
CH + H O CO + 3H ∆ h = 206.13kJ/mol 25°<br />
C<br />
CO + H O CO + H ∆ h = − 41.14kJ/mol 25°<br />
C<br />
11 00 014 ChemEquil<br />
62
Ermittlung der Molmengen bei Simultangleichgewichten<br />
(Beispiel: Gasphasenreaktion)<br />
63
Die ersten Schritte der Relaxationsmethode<br />
(Synthesegaserzeugung T =1100 K, P = 40 atm)<br />
CH 4 + H 2 O CO + 3 H K<br />
2<br />
1 = 301 atm 2<br />
CO + H 2 O CO 2 + H K<br />
2<br />
2 = 0.94<br />
Schritt Reaktor n CH4<br />
n H2O<br />
n CO<br />
n H2<br />
n CO2<br />
∆n i<br />
Σ n i<br />
1.00000 3.20000 0.00000 0.00000 0.00000 4.20000<br />
1 1 0.34394 2.54394 0.65606 1.96818 0.00000 0.65606 5.51212<br />
1 2 0.34394 2.22979 0.34191 2.28233 0.31415 0.31415 5.51212<br />
2 1 0.33596 2.22181 0.34990 2.30627 0.31415 0.00798 5.52808<br />
2 2 0.33596 2.22051 0.34859 2.30757 0.31545 0.00131 5.52808<br />
3 1 0.33581 2.22035 0.34874 2,30803 0.31545 0.00015 5.52838<br />
3 2 0.33581 2.22033 0.34872 2.30806 0.31548 0.00002 5.52838<br />
4 1 0.33580 2.22033 0.34872 2.30807 0.31548
Die ersten Schritte der Relaxationsmethode<br />
(Synthesegaserzeugung T =1100 K, P = 40 atm)<br />
CH 4 + H 2 O CO + 3 H K<br />
2<br />
1 = 301 atm 2<br />
CO + H 2 O CO 2 + H K<br />
2<br />
2 = 0.94<br />
65
Die ersten Schritte der Relaxationsmethode<br />
(Synthesegaserzeugung T =1100 K, P = 40 atm)<br />
CH 4 + H 2 O CO + 3 H K<br />
2<br />
1 = 301 atm 2<br />
CO + H 2 O CO 2 + H K<br />
2<br />
2 = 0.94<br />
Anfangsmolmengen :<br />
n = 1mol n = 1− ∆ n n = ∆n<br />
CH ,0<br />
CH CO<br />
4 4<br />
n = 3.2 mol n = 3.2 − ∆ n n = 3∆n<br />
H O,0<br />
H O H<br />
2 2 2<br />
∑<br />
n<br />
i<br />
= 4.2 + 2∆n<br />
3<br />
∆ ( ∆ )<br />
( − ∆ )( − ∆ )( + ∆ )<br />
3 3 2 3 2 2<br />
CO H2 CO H2 CO H2<br />
2 2<br />
CH4 H2O CH4 H2O<br />
CH H O ( ∑ i )<br />
4 2<br />
p p y y P n n P n 3 n P<br />
301= = = =<br />
p p y y n n n 1 n 3.2 n 4.2 2 n<br />
3 2<br />
∆n( 3∆n)<br />
P<br />
( 1− ∆n)( 3.2 − ∆ n)( 4.2 + 2∆n)<br />
⎛<br />
⎞<br />
F = 301− = 0 → ∆ n = 0.65606<br />
⎜<br />
2<br />
⎟<br />
⎝<br />
⎠<br />
2<br />
66
Eindimensionales Suchverfahren: goldener Schnitt<br />
d 1 - d<br />
=<br />
L d 1<br />
1 1<br />
d 1<br />
= 0.61803... ∆n<br />
allg.: d = 0.61803...<br />
i<br />
. di-1<br />
F( ∆n)<br />
0<br />
0<br />
d 1<br />
d 1<br />
∆n (L)<br />
z.B. ∆n = 1 beim 1. Reaktor und<br />
ersten Schritt der<br />
Synthesegaserzeugung, 0.34394<br />
(2.Reaktor, 1. Schritt)<br />
F( ∆n)<br />
d 2<br />
d 2<br />
0<br />
0<br />
∆n (L)<br />
n-1<br />
Ungewißheitsintervall: L<br />
n=0.618..<br />
67
Ermittlung der Gleichgewichtszusammensetzung einer<br />
Isomerisierungsreaktion durch G-Minimierung<br />
n-Butan i-Butan<br />
Temperatur 25 ° C<br />
Druck 1 atm.<br />
Annahme : ideales Gas<br />
Gibbssche<br />
Standardbildungsgrößen bei 25°C:<br />
∑<br />
(<br />
o<br />
)<br />
Komponente<br />
∆g , J / mol<br />
o<br />
B<br />
i-Butan (1) -20878<br />
n-Butan (2) -17154<br />
o<br />
o<br />
G = µ n µ = µ<br />
+ RT lny P = ∆ g +<br />
RT lny P<br />
i<br />
i i i i i Bi i<br />
∑<br />
d. h. G = n ∆ g +<br />
RT lny P<br />
i<br />
i<br />
i Bi i<br />
Für 1mol und einemDruck P = 1atm<br />
∑<br />
(<br />
o<br />
ln )<br />
g = y ∆ g +<br />
RT y<br />
i Bi i<br />
68
Gibbssche Enthalpie für eine Isomerisierungsreaktion<br />
Für 1mol und einemDruck P = 1atm<br />
∑<br />
i<br />
(<br />
o<br />
ln )<br />
g = y ∆ g +<br />
RT y<br />
z.B. y<br />
1=0.1:<br />
i Bi i<br />
g = 0.1(-20878)+0.9(-17154)<br />
( )<br />
+8.31433⋅298.15<br />
0.1ln0.1+0.9ln0.9<br />
g= -18332J/mol<br />
Konzentrationsverlauf der<br />
Gibbsschen Enthalpie für das<br />
System Isobutan (1) – n-Butan (2)<br />
bei 25 °C und 1 atm<br />
69
18.03.99<br />
G<br />
Minimierung der Gibbsschen Enthalpie<br />
= ∑ µ n = Min.<br />
i<br />
i<br />
!<br />
o f o<br />
µ<br />
i<br />
= µ<br />
i<br />
+ RT ln = ∆g<br />
B,i<br />
+<br />
f<br />
Annahme: ideales Gas (f i = p i )<br />
Standardzustand ideales Gas (f io = 1atm)<br />
i<br />
o<br />
i<br />
RT ln<br />
f<br />
f<br />
i<br />
o<br />
i<br />
o<br />
µ<br />
i<br />
= ∆gB,i<br />
+ RT ln pi<br />
nP<br />
i<br />
pi<br />
=<br />
∑n<br />
j<br />
( atm)<br />
⎛<br />
⎜<br />
⎞<br />
n P ⎟<br />
5<br />
o<br />
i<br />
F = ∑ni<br />
∆ g<br />
B,i(T) + RTln = Minimum<br />
i<br />
⎜<br />
∑n<br />
j ⎟<br />
j<br />
⎝<br />
⎠<br />
n i so wählen, dass F Minimum<br />
aufweist. Jedoch muss auch<br />
Nebenbedingung (Elementenbilanz)<br />
erfüllt werden<br />
11 00 021 ChemEquil<br />
Ermittlung von G min durch nichtlineares Regressionsverfahren<br />
(z.B. Simplex-Nelder-Mead) mit<br />
Nebenbedingungen (Lagrangesche Multiplikatoren)<br />
70
Beispiel:*<br />
Berechnung der Lage des chemischen Gleichgewichts<br />
durch Minimierung von G<br />
Anfangsmolmengen:<br />
Zielfunktion:<br />
⎛<br />
⎞<br />
n P<br />
F = n ⎜ ∆ g (T) + RTln ⎟ + 1− n − n − n<br />
5<br />
∑<br />
i<br />
4 2 2 R<br />
*Annahme: ideales Gas<br />
( )<br />
o<br />
i<br />
i B,i CH4 CO CO<br />
2<br />
⎜<br />
∑n<br />
j ⎟<br />
j<br />
⎝<br />
2 2 2 R<br />
⎠<br />
( )<br />
( )<br />
CH + H O CO + 3H ∆ h = 206.13kJ/mol 25°<br />
C<br />
CO + H O CO + H ∆ h = − 41.14kJ/mol 25°<br />
C<br />
n = 1mol; n = 3.2mol<br />
CH4 H2O<br />
2 2<br />
( ) ( )<br />
CH H O H O CO CO<br />
+ 10.4 − 4n − 2n + 3.2 − n − n − 2n = Minimum<br />
4 2 2 2<br />
o<br />
C<br />
n = 1<br />
o<br />
H<br />
n = 2 ⋅ 3.2 + 4 = 10.4<br />
o<br />
O<br />
n = 3.2<br />
Standardzustand, ideales Gas bei 1atm<br />
2<br />
71
18.03.99<br />
Gleichgewichtskonzentrationen des Simultangleichgewichts des<br />
Steamreforming-Verfahrens als Funktion der Temperatur bei 40 atm<br />
( )<br />
( )<br />
CH + H O CO + 3H ∆ h = 206.13kJ/mol 25°<br />
C<br />
4 2 2 R<br />
CO + H O CO + H ∆ h = − 41.14kJ/mol 25°<br />
C<br />
2 2 2 R<br />
0.8<br />
Molanteil<br />
0.6<br />
0.4<br />
n<br />
n<br />
H 2 O<br />
CH 4<br />
= 3.2<br />
CH4<br />
H2O<br />
CO<br />
H2<br />
0.2<br />
CO2<br />
11 00 023 ChemEquil<br />
0<br />
600 800 1000 1200 1400<br />
Temperatur, K<br />
72
11.02.99<br />
Schema einer Vinylacetat-Anlage (vereinfacht)<br />
C 2 H 4 + CH 3 COOH + ½ O 2<br />
CH 3 COOCH=CH 2 + H 2 O<br />
(exotherm)<br />
101 01 016 Bedeutung<br />
Nebenreaktionen, z.B.:<br />
C 2 H 4 + 3 O 2 2 CO 2 + 2 H 2 O<br />
(Acetaldehyd, Ethylacetat, .. )<br />
73
Konzentration im Ausgangsgemisch / Verkaufspreis<br />
74
Allgemeines Schema eines Trennprozesses<br />
Trennhilfsmittel<br />
Feed<br />
Stufe<br />
Ströme<br />
unterschiedlicher<br />
Zusammensetzung<br />
Trennhilfsmittel<br />
Energie<br />
Zusatzstoff<br />
Trennprozess<br />
Rektifikation<br />
Kristallisation<br />
...<br />
Absorption<br />
Extraktion<br />
Adsorption<br />
Membrantrennverfahren<br />
(Flüssig-Flüssig-,<br />
Fest-Flüssig-,<br />
überkritische Gase<br />
Energie + Zusatzstoff<br />
azeotrope und extraktive Rektifikation<br />
75
11.02.99<br />
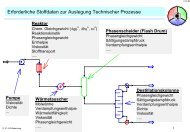
Trennprozess und benötigtes Phasengleichgewicht<br />
Trennprozeß Phase α Phase β Phase γ Gleichgewicht<br />
Rektifikation Flüssigkeit Dampf - VLE<br />
(vapor-liquid)<br />
Rektifikation Flüssigkeit Flüssigkeit Dampf VLLE<br />
(vapor-liquidliquid)<br />
Absorption Flüssigkeit Gas (Dampf) - GLE<br />
(gas-liquid)<br />
Extraktion Flüssigkeit Flüssigkeit - LLE<br />
(liquid-liquid)<br />
Kristallisation Feststoff Flüssigkeit - SLE<br />
(solid-liquid)<br />
03 00 007 VLE<br />
76
11.02.99<br />
Zu berücksichtigende Aspekte bei der Auslegung von Trennprozessen<br />
?<br />
T<br />
x 1<br />
?<br />
Rektifikation ? Kristallisation ?<br />
α 12<br />
=<br />
γ<br />
s<br />
1 P1<br />
≈ 1<br />
?<br />
γ<br />
s<br />
2 P2<br />
Geeignetes Lösungsmittel<br />
für die extraktive oder<br />
azeotrope Rektifikation ?<br />
y 1<br />
x 1<br />
?<br />
Trennprobleme ?<br />
AB A<br />
C<br />
Trenn-<br />
Prozess ?<br />
N th =?<br />
Kolonnenhöhe ?<br />
?<br />
ABCD<br />
?<br />
S = n<br />
[2(n-1)]!<br />
n! (n-1)!<br />
T n-1<br />
101 01 012 Bedeutung<br />
CD<br />
B<br />
D<br />
Trennsequenz ?<br />
78
11.02.99<br />
Oxosynthese<br />
Propylen + CO + H 2<br />
HRh(CO)[P(C H SO Na) ]<br />
6 4 3 3 3<br />
(n / i)-Butyraldehyd<br />
51 bar<br />
125 °C<br />
Reaktorauslegung:<br />
Reaktionskinetiken<br />
Gaslöslichkeiten<br />
Verteilungskoeffizienten<br />
LLE<br />
VLE<br />
Co-Solvents ?<br />
55 bar<br />
Kolonnenauslegung:<br />
Gaslöslichkeiten<br />
VLE<br />
Phasen:<br />
Gas / Dampf<br />
organisch<br />
wässrig<br />
Propylen<br />
CO + H 2<br />
ungereinigtes<br />
(n/i)-Butyraldehyd<br />
79
Vorausberechnung des “Schicksals” einer Chemikalie in der Umwelt<br />
KOW_vert.cdr<br />
Luft<br />
K = v · H / RT<br />
Luft-Wasser<br />
W<br />
i,W<br />
Aerosol<br />
W<br />
i<br />
,W<br />
i<br />
s<br />
= v · · P / RT<br />
≈ (1/c )<br />
i s,W ·<br />
P / RT<br />
i s<br />
γ ∞ γ i<br />
,W<br />
K<br />
Boden-Wasser<br />
= 0.0082 KOW<br />
Boden<br />
K<br />
Fisch-Wasser<br />
= 0.045 KOW<br />
=BCF<br />
Sediment<br />
Wasser<br />
K<br />
Sediment-Wasser<br />
= 0.0164 KOW<br />
K = = 0.1508 ·<br />
OW<br />
c i<br />
O<br />
c i<br />
W<br />
∞<br />
γ<br />
∞ ,O<br />
i<br />
80
Gleichgewichtsstufe – Typische Fragestellung<br />
Theoretical Stage_d.cdr<br />
Druck<br />
Temperatur<br />
bei einem<br />
Typisches Problem<br />
Dampf-Flüssig-Gleichgewicht :<br />
Phase<br />
Phase<br />
β<br />
β β<br />
z 1, z 2, ....<br />
α<br />
α<br />
α<br />
z , z , ....<br />
1 2<br />
81
Dynamische<br />
Apparatur<br />
(NORMAG)<br />
24.03.99<br />
12 00 011 Exp. Best.<br />
82
18.02.02<br />
80<br />
Isothermes Dampf-Flüssig-Gleichgewicht<br />
des binären Systems Ethanol(1) - Wasser(2) bei 70°C<br />
03 00 010 VLE<br />
Druck P [kPa]<br />
Siedelinie<br />
70<br />
60<br />
50<br />
Taulinie<br />
40<br />
T = 343.15 K<br />
30<br />
0.0 0.2 0.4 0.6 0.8 1.0<br />
y 1 , x 1<br />
x 1 y 1<br />
P [kPa]<br />
0.062 0.374 48.33<br />
0.095 0.439 53.20<br />
0.131 0.482 56.53<br />
0.194 0.524 60.12<br />
0.252 0.552 62.39<br />
0.334 0.583 64.73<br />
0.401 0.611 66.34<br />
0.593 0.691 70.11<br />
0.680 0.739 71.23<br />
0.793 0.816 72.35<br />
0.810 0.826 72.41<br />
0.943 0.941 72.59<br />
0.947 0.945 72.59<br />
Mertl I., Collect.Czech.<br />
Chem.Commun.,<br />
37, 366-373, 1972<br />
84
18.02.02<br />
Anzahl der benötigten experimentellen Daten für ein System mit 10<br />
Komponenten (∆x=0.1)<br />
Art des Systems<br />
(Anzahl<br />
Komponenten)<br />
Anzahl der<br />
Systeme<br />
Meßpunkte/<br />
System<br />
Gesamtzahl<br />
Meßpunkte/<br />
System<br />
Gesamtzahl<br />
Meßpunkte<br />
1 10 1 10 10<br />
2 45 9 405 415<br />
3 120 36 4320 4735<br />
4 210 84 17640 22375<br />
5 252 126 31752 54127<br />
6 210 126 26460 80587<br />
7 120 84 10080 90667<br />
8 45 36 1620 92287<br />
9 10 9 90 92377<br />
10 1 1 1 92378<br />
Bei 10 Messpunkten pro Tag: Mehr als 37 Jahre für einen Druck (z.B. 1 atm)<br />
03 00 017 VLE<br />
87
18.03.99<br />
Phasengleichgewichtsbeziehungen für VLE<br />
Ausgehend von der Gleichgewichtsbedingung:<br />
Gibbs: µ iα = µ iβ = µ iγ = .....<br />
Lewis: f iα = f iβ = f iγ = .....<br />
und der Definition der Hilfsgrößen γ ι und ϕ i :<br />
γ<br />
i<br />
≡<br />
f<br />
x<br />
L<br />
i<br />
o<br />
ifi<br />
L<br />
ϕ i<br />
≡<br />
f<br />
x<br />
L<br />
i<br />
i<br />
P<br />
V<br />
ϕ i<br />
≡<br />
f<br />
y<br />
V<br />
i<br />
i<br />
P<br />
erhält man für das Dampf-Flüssig-Gleichgewicht (VLE):<br />
f =<br />
L<br />
i<br />
f<br />
V<br />
i<br />
L<br />
V<br />
A:<br />
xϕ<br />
P = y ϕ P<br />
B :<br />
i i i i<br />
o<br />
xγ f =<br />
i<br />
i<br />
i<br />
V<br />
yϕ<br />
P<br />
i<br />
i<br />
03 00 018 VLE<br />
88
11.02.99<br />
Möglichkeiten zur Berechnung von Dampf-Flüssig-Gleichgewichten<br />
WegAWegB.cdr<br />
Weg A<br />
f i L = f V i<br />
Weg B<br />
xi ϕi L P = yi ϕ V<br />
i P<br />
x γ f 0 = y<br />
i i i i<br />
ϕ<br />
v<br />
i<br />
P<br />
ln<br />
ϕ<br />
i<br />
=<br />
1<br />
RT<br />
∞<br />
∫<br />
v<br />
⎡<br />
⎛<br />
∂P<br />
⎞<br />
⎢<br />
⎜<br />
⎟<br />
⎢<br />
⎝<br />
∂<br />
n<br />
⎠<br />
⎣<br />
i T ,v,<br />
n<br />
j<br />
RT<br />
⎤<br />
Pv<br />
− ⎥<br />
dv<br />
−<br />
ln<br />
v<br />
⎥<br />
RT<br />
⎦<br />
Standardzustand:<br />
reine Flüssigkeit<br />
bei T und P:<br />
vereinfacht:<br />
x γ ϕ S P Poy = y ϕ P<br />
i i i i s i i<br />
v i<br />
x γ P S = y P<br />
i i i i<br />
benötigt:<br />
benötigt:<br />
1) Zustandsgleichung für die Berechnung<br />
des PVTn i - Verhaltens beider Phasen:<br />
Soave-Redlich-Kwong<br />
Peng-Robinson<br />
...<br />
03 00 024 VLE<br />
1) Ausdruck für γ (T, P, n )<br />
i<br />
a) gE-Modell (g E = RT x i ln γi) :<br />
Wilson, NRTL, UNIQUAC, ...<br />
b) Gruppenbeitragsmethode:<br />
UNIFAC, Mod. UNIFAC (Do), ...<br />
2) Zuverlässige Mischungsregeln 2) P (T) (z.B. Antoine, Wagner)<br />
i S<br />
i<br />
Σ<br />
89
28.04.99<br />
Gibbssche Mischungsenthalpie ∆g<br />
Für konstante Temperatur gilt:<br />
∆g=RT<br />
∑<br />
i<br />
x lna<br />
i<br />
i<br />
∑<br />
∑<br />
∆g=RT ⎡<br />
⎣<br />
x<br />
i ilnx i+ x<br />
i ilnγ<br />
⎤<br />
i ⎦<br />
E<br />
g 1<br />
d.h.<br />
∆g<br />
= ∆g ideal<br />
+ ∆g real<br />
∆g<br />
ideal<br />
= RT<br />
∑<br />
i<br />
x<br />
i<br />
ln x<br />
i<br />
g E E<br />
g 2<br />
∑<br />
∑<br />
∆ g = g = x g =<br />
RT x ln γ<br />
E<br />
E<br />
real i i i i i i<br />
0 0.5 1<br />
RT<br />
lnγ<br />
i<br />
E<br />
⎛<br />
∂G<br />
⎞<br />
= ⎜<br />
⎟<br />
=<br />
⎝<br />
∂ni<br />
⎠<br />
T , P,<br />
n<br />
j<br />
g<br />
E<br />
i<br />
g<br />
E<br />
i<br />
x 1<br />
= RT lnγ<br />
i<br />
03 00 026 VLE<br />
90
06.01.00<br />
Ermittlung von Aktivitätskoeffizienten und Werte der Gibbsschen<br />
Exzessenthalpie aus experimentellen VLE-Daten bei 70°C<br />
s<br />
x γ P =<br />
i i i<br />
y P<br />
i<br />
γ<br />
i<br />
=<br />
yiP<br />
x P<br />
i<br />
s<br />
i<br />
γ ∞<br />
1<br />
Ethanol (1)<br />
Wasser (2)<br />
70 o C, Mertl. et al.<br />
γ ∞<br />
2<br />
g<br />
E<br />
RT<br />
= Σ x lnγ = Σx<br />
i i i<br />
g<br />
E<br />
i<br />
RT<br />
x 1 y 1 P [kPa] T [K] γ 1 γ 2 g E /RT<br />
343.15<br />
343.15<br />
343.15<br />
...... ...... ...... ......<br />
→<br />
...... ...... ......<br />
0.062 0.374 48.32 353.15 → 4.041 1.038 0.1211<br />
0.095 0.439 53.18 353.15 → 3.407 1.061 0.1698<br />
0.131 0.482 56.51 353.15 → 2.883 1.084 0.2087<br />
g 2 E /RT<br />
ln γ 2<br />
ln γ 1<br />
g 1 E /RT<br />
03 00 027 VLE<br />
91
11.02.99<br />
Einfache g E -(Aktivitätskoeffizienten)-Modelle<br />
RT<br />
lnγ<br />
i<br />
=<br />
⎛ ∂G<br />
⎜<br />
⎝ ∂n<br />
E<br />
i<br />
⎞<br />
⎟<br />
⎠<br />
T , P,<br />
n<br />
j<br />
=<br />
g<br />
E<br />
i<br />
G<br />
E<br />
=<br />
H<br />
E<br />
−TS<br />
E<br />
Randbedingung: g E = 0 für x i =1<br />
Einfachstes g E -Modell: Porterscher Ansatz*<br />
2<br />
RT ln γ 1 = A x 2<br />
g E = A x 1 x 2<br />
2<br />
RT ln γ 2 = A x 1<br />
Flexibles g E -Modell: Redlich-Kister-Expansion<br />
g E = x 1 x 2 [ A + B (x 1 - x 2 ) + C (x 1 - x 2 ) 2 + ..... ]<br />
03 00 028 VLE<br />
* A.W. Porter, Trans. Faraday Soc. 16, 336-345 (1921)<br />
92
23.04.99<br />
Entwicklung von g E -Modellen<br />
Ideale Mischung (h E = 0, s E = 0, v E = 0)<br />
∆g<br />
=<br />
RT<br />
∑<br />
x<br />
i<br />
E<br />
g<br />
ln xi<br />
→ = 0<br />
RT<br />
Flory – Huggins (h E = 0, s E ≠ 0, v E = 0)<br />
φ i = Volumenanteil der Komponente i<br />
03 00 029 VLE<br />
∆g<br />
=<br />
RT<br />
∆g<br />
=<br />
RT<br />
E<br />
g<br />
φi<br />
lnφ xi<br />
ln<br />
RT x<br />
∑ x → = ∑<br />
i i<br />
Wilson (1964) (h E ≠ 0, s E ≠ 0, v E = 0)<br />
ξ i = lokaler Volumenanteil der Komponente i<br />
E<br />
g<br />
ξi<br />
lnξ xi<br />
ln<br />
RT x<br />
∑ x → = ∑<br />
i i<br />
i<br />
i<br />
93
02.02.05<br />
Wilson (1964)<br />
Λ<br />
12<br />
=<br />
v 2 ⎛ ∆λ12<br />
⎞ v1<br />
⎛ ∆λ<br />
exp⎜<br />
− ⎟;<br />
Λ = exp⎜<br />
−<br />
21<br />
21<br />
v1<br />
⎝ RT ⎠ v<br />
2 ⎝ RT<br />
⎞<br />
⎟<br />
⎠<br />
Λ<br />
2<br />
1 1<br />
1<br />
2 2<br />
2<br />
ij<br />
=<br />
v<br />
v<br />
j<br />
i<br />
g<br />
E<br />
/ RT<br />
= ∑ i<br />
x<br />
i<br />
ξi<br />
ln<br />
x<br />
⎡ λij<br />
− λii<br />
⎤<br />
⎢−<br />
⎥<br />
⎣ ⎦<br />
= v<br />
exp<br />
RT v<br />
1<br />
1 2<br />
2<br />
2 2<br />
1<br />
j<br />
i<br />
i<br />
⎡<br />
exp⎢−<br />
⎣<br />
∆λij<br />
⎤<br />
RT<br />
⎥<br />
⎦<br />
v i molares Volumen der reinen Flüssigkeit i<br />
∆λ ij Wechselwirkungsparameter zwischen<br />
den Komponenten i und j (J/mol)<br />
Wilson, G.M., J. Am. Chem. Soc. 86, 127 (1964)<br />
ξ =<br />
1<br />
x<br />
x<br />
21<br />
11<br />
x<br />
=<br />
11<br />
x<br />
x<br />
x11v<br />
1<br />
v + x<br />
2<br />
1<br />
1<br />
lnγ<br />
1<br />
= −ln<br />
lnγ<br />
2<br />
= −ln<br />
exp<br />
exp<br />
21<br />
v<br />
2<br />
( − λ12<br />
/ RT )<br />
( − λ / RT )<br />
11<br />
⎛<br />
ξ<br />
2<br />
x<br />
x<br />
12<br />
22<br />
=<br />
=<br />
x<br />
12<br />
x<br />
x<br />
x22v<br />
2<br />
v + x<br />
1<br />
2<br />
1<br />
exp<br />
exp<br />
g E<br />
= −x1ln( x1<br />
+ Λ12x2)<br />
− x2<br />
ln( Λ21x1<br />
x2)<br />
RT<br />
+<br />
22<br />
v<br />
2<br />
( − λ21<br />
/ RT )<br />
( − λ / RT )<br />
12<br />
21<br />
( x ) ⎜<br />
⎟ 1<br />
+ Λ12x2<br />
+ x2<br />
−<br />
⎝ x1<br />
+ Λ12x2<br />
Λ21x1<br />
+ x2<br />
⎠<br />
⎛<br />
12<br />
21<br />
( x ) ⎜<br />
⎟ 2<br />
+ Λ21x1<br />
− x1<br />
−<br />
⎝ x1<br />
+ Λ12x2<br />
Λ21x1<br />
+ x2<br />
⎠<br />
Λ<br />
Λ<br />
22<br />
Λ<br />
Λ<br />
⎞<br />
⎞<br />
03 00 031 VLE<br />
E<br />
g<br />
RT<br />
= −∑ x ln∑ x Λ<br />
i<br />
i<br />
j<br />
j<br />
ij<br />
lnγ<br />
i<br />
⎛<br />
= −ln⎜<br />
⎝<br />
∑<br />
j<br />
⎞<br />
x ⎟<br />
jΛij<br />
+ 1−<br />
⎠<br />
∑<br />
k ∑<br />
xkΛki<br />
x Λ<br />
j<br />
j<br />
kj<br />
94
Ableitung der Wilson-Gleichung<br />
E<br />
g<br />
ξ1 ξ2<br />
= x1ln<br />
+<br />
x2<br />
ln<br />
RT x x<br />
1 2<br />
x11v<br />
1<br />
x22v<br />
2<br />
ξ1 = ξ<br />
2<br />
=<br />
x v + x v x v +<br />
x v<br />
11 1 21 2 12 1 22 2<br />
E<br />
g<br />
⎛ x v<br />
⎞ ⎛ x v<br />
⎞<br />
11 1 22 2<br />
= x1 ⎜ ln<br />
⎟ +<br />
x2<br />
⎜ ln<br />
⎟<br />
RT ⎝ x1x11v 1 + x1x21v 2 ⎠ ⎝ x2x12v1 +<br />
x2x22v<br />
2<br />
⎠<br />
( −<br />
λ )<br />
( −<br />
λ )<br />
( −<br />
λ )<br />
( −<br />
λ )<br />
x x exp / RT x exp / RT<br />
21 2 21 x12<br />
1 12<br />
= =<br />
x x exp / RT x x exp / RT<br />
11 1 11 22 2 22<br />
( −<br />
λ RT )<br />
( −<br />
λ RT )<br />
( −<br />
λ RT )<br />
( −<br />
λ RT )<br />
exp<br />
21<br />
/ exp<br />
12<br />
/<br />
x1x21 = x2x11 x2x12 =<br />
x1x22<br />
exp / exp /<br />
11 22<br />
E<br />
g<br />
RT<br />
mit<br />
⎛ ⎞ ⎛ ⎞<br />
⎜ ⎟ ⎜ ⎟<br />
x v<br />
x v<br />
x<br />
⎜ 11 1<br />
ln<br />
⎟ x<br />
⎜ 22 2<br />
= ln<br />
⎟<br />
1 +<br />
2<br />
⎜ exp ( −<br />
λ / RT )<br />
⎟ ⎜ exp ( λ / RT )<br />
⎟<br />
21 −<br />
12<br />
⎜ x1x11v 1 + x2x11v 2 x x v +<br />
x x v<br />
exp ( −<br />
λ / RT )<br />
⎟ ⎜ 1 22 1 2 22 2<br />
exp ( −<br />
λ / RT )<br />
⎟<br />
⎝ 11 ⎠ ⎝ 22<br />
⎠<br />
( λ − λ ) ∆λ<br />
( λ − λ )<br />
v ⎛<br />
2 12 11<br />
⎞<br />
2 12 1 21 22 1 21<br />
12 21 12<br />
exp v ⎛ ⎞<br />
exp .: v ⎛ ⎞<br />
bzw<br />
21<br />
exp v ⎛ ∆λ<br />
⎞<br />
λ = λ Λ = ⎜ − ⎟ = ⎜ − ⎟ Λ = ⎜ − ⎟ = exp ⎜ − ⎟<br />
v1 ⎝ RT ⎠ v1 ⎝ RT ⎠ v2 ⎝ RT ⎠ v2<br />
⎝ RT ⎠<br />
( λ − λ ) v<br />
− ( λ −<br />
λ )<br />
E<br />
g<br />
⎛ v<br />
⎛ ⎞ ⎞ ⎛ ⎛ ⎞<br />
⎞<br />
2 21 11 1<br />
12 22<br />
= − x1 lnx + x exp ⎜ − ⎟ − x lnx +<br />
x exp<br />
⎜ ⎟<br />
RT ⎜ 1 2 v RT ⎟ 2 ⎜ 2 1<br />
v RT<br />
⎟<br />
⎝ 1 ⎝ ⎠ ⎠ ⎝ 2<br />
⎝ ⎠<br />
⎠<br />
E<br />
g<br />
( ) ln( )<br />
x ln x x x x x<br />
RT = − + Λ − Λ +<br />
1 1 2 12 2 1 21 2<br />
95
11.02.99<br />
Druckverlauf im ternären System Aceton(1)-Chloroform(2)-Methanol(3)<br />
Aceton (1)<br />
Chloroform (2)<br />
Methanol (3) Weitere „local composition“-Modelle:<br />
640<br />
P [mmHg]<br />
NRTL (non random two liquid theory) (1968)<br />
Parameter: ∆g 12 , ∆g 21 , α 12<br />
UNIQUAC (universal quasichemical theory) (1975)<br />
Parameter: ∆u 12 , ∆u 21 , (van der Waalssche Größen r i , q i )<br />
P calc [mm Hg]<br />
600<br />
560<br />
520<br />
480<br />
440<br />
400<br />
400 440 480 520 560 600 640<br />
P exp [mm Hg]<br />
03 00 036 VLE<br />
Wilson, ϑ = 50°C<br />
Goral M., Kolasinska G., Oracz P., Warycha S.,<br />
Fluid Phase Equilib., 23, 89-116, 1985<br />
96
Erforderlich zur Anpassung zuverlässiger g E -Modellparameter<br />
• Zuverlässige VLE-Daten (eventuell auch γ ∞ (T), h E , ...)<br />
• Nichtlineare Regressionsmethode ( e.g. Simplex-Nelder-<br />
Mead, ...)<br />
• Geeignete Zielfunktion, z.B.<br />
1<br />
2 !<br />
F = ∑∑( X<br />
cal, i, j<br />
− X<br />
exp, i,<br />
j ) = Min<br />
n<br />
1<br />
!<br />
F = ∑∑ X<br />
cal, i, j<br />
− X<br />
exp, i,<br />
j<br />
= Min<br />
n<br />
F<br />
1 ⎡ X<br />
!<br />
cal, i, j<br />
− X ⎤<br />
exp, i,<br />
j<br />
= ∑∑ ⎢<br />
⎥ = Min<br />
n ⎢⎣<br />
X<br />
exp, i,<br />
j ⎥⎦<br />
2<br />
F<br />
1 X<br />
!<br />
cal, i, j<br />
− X<br />
exp, i,<br />
j<br />
= ∑∑<br />
= Min<br />
n X<br />
exp, i,<br />
j<br />
oder Kombinationen davon.<br />
• Verwendung der experimentellen Reinstoffdampfdrücke von<br />
großer Bedeutung!<br />
97
SIMPLEX-Nelder-Mead-Methode<br />
z.B.:<br />
Die Zahlen geben Werte<br />
der Zielfunktion F(x) an<br />
F<br />
=<br />
∑<br />
i<br />
Komp<br />
∑<br />
j<br />
Daten<br />
( ) γ − γ<br />
2<br />
i, j,ber<br />
i, j,exp<br />
343.15 K<br />
x 1<br />
γ 1,exp<br />
γ 2,exp<br />
∆λ 1 2<br />
∆λ<br />
2 1<br />
γ 1<br />
∞<br />
0.062 4.041 1.038<br />
0.095 3.407 1.061<br />
γ i<br />
γ 2<br />
∞<br />
0.131 2.883 1.084<br />
..... ....... .......<br />
x 1<br />
Nelder J.A., Mead R., Comp. J. 7,308 (1965)<br />
Simplex2g.cdr<br />
98
Dortmunder Datenbank (DDB)<br />
bisher nur<br />
10 – 15 %<br />
publiziert<br />
99
03.02.03<br />
VLE Dataset (DECHEMA<br />
Chemistry Data Series)<br />
log 10<br />
s<br />
B<br />
Pi<br />
[ mm Hg]<br />
= A −<br />
ϑ ° + C<br />
[ C]<br />
Appendix:<br />
v 1 = 58.69 cm 3 /mol<br />
v 2 = 18.07 cm 3 /mol<br />
r 1 =2.1055 q 1 =1.972<br />
r 2 =0.9200 q 2 =1.400<br />
03 00 042 VLE<br />
cal/mol<br />
A12<br />
= ∆λ<br />
oder ∆g oder ∆u<br />
12 12 12<br />
100
Flussdiagramm Bubble-T (Wilson)<br />
Ethanol(1) – Wasser(2) Wilson<br />
T= 343.15 K x 1<br />
= 0.252 P, y 1<br />
= ?<br />
P 1s<br />
( Antoine ) = 542.3 Torr<br />
v 1<br />
= 58.69 cm 3 /mol<br />
∆λ 12<br />
= 471.04 cal/mol<br />
Λ 12<br />
P 2s<br />
= 233.17 Torr<br />
v 2<br />
= 18.07 cm 3 /mol<br />
∆λ 21<br />
= 883.75 cal/mol<br />
= v 2<br />
/v 1<br />
exp (-∆λ 12<br />
/RT)<br />
= 18.07/58.69 exp ( - 471.04/(1.98721 343.15))<br />
Λ 12<br />
= 0.1543<br />
Λ 21<br />
= 0.8887<br />
lnγ<br />
1<br />
= −ln<br />
12<br />
21<br />
( x ) ⎜<br />
⎟ 1<br />
+ Λ12x2<br />
+ x2<br />
−<br />
⎝ x1<br />
+ Λ12x2<br />
Λ21x1<br />
+ x2<br />
⎠<br />
ln γ 1<br />
= - ln ( 0.252 + 0.1543 0.748) +<br />
0.748 ( 0.1543/(0.252 + 0.1543 0.748) –<br />
( 0.8887/(0.8887 0.252 + 0.748))<br />
ln γ 1<br />
= 0.63144 γ 1<br />
= 1.880 γ 2<br />
= 1.165<br />
P = 0.252 1.880 542.3 + 0.748 1.165 233.17<br />
P = 256.96 + 203.25 = 460.2 Torr<br />
y 1<br />
= 256.96/460.2 = 0.5583<br />
⎛<br />
Λ<br />
Λ<br />
⎞<br />
Input: x i , T<br />
Parameter für<br />
g E , P i<br />
s<br />
Berechnung<br />
von γ i , P i<br />
s<br />
Berechnung<br />
von P, y i<br />
P = Σx i γ i P i<br />
s<br />
y i = x i γ i P is /P<br />
Output: P, y i<br />
102
11.02.99<br />
Phasengleichgewichtsdiagramme für unterschiedlich stark reales Verhalten<br />
Benzol(1)-<br />
Toluol(2)<br />
Methanol(1)<br />
-Wasser(2)<br />
Propanol(1)-<br />
Wasser(2)<br />
03 00 044 VLE<br />
103
11.02.99<br />
Verschiedene Phasengleichgewichtsdiagramme<br />
1-Butanol(1)-<br />
Wasser(2)<br />
Aceton(1)-<br />
Chloroform(2)<br />
03 00 045 VLE<br />
104
Überblick über die verfügbaren und benötigten VLE ( h E , γ∞) Daten<br />
für binäre Systeme<br />
Benötigte VLE-Daten im Rahmen der Prozessentwicklung:<br />
1000 (500) Komponenten von technischem Interesse<br />
VLE-Daten für ca. 500 000 (125 000) binäre Systeme erforderlich.<br />
Verfügbare Daten:<br />
1 VLE Datensatz (10240 Systeme) : 2.05 % (8.20 %)<br />
> 1 VLE Datensatz (6140 Systeme): 1.23 % (4.91 %)<br />
1 VLE Datensatz + 1 h E + 1 γ∞ (996 Systeme): 0.20 % (0.80 %)<br />
> 1 VLE Datensatz + 1 h E + 1 γ∞ (767 Systeme): 0.15 % (0.61 %)<br />
Status der Dortmunder Datenbank (VLE, h E , γ∞) (Sept. 2007) :<br />
DDB<br />
VLE<br />
53 700 isotherme / isobare Datensätze<br />
γ∞<br />
49 700 Datenpunkte in reinen<br />
Lösungsmitteln<br />
h E<br />
18 100 Datensätze
Gruppenbeitragsmethoden (z.B. UNIFAC)<br />
Ethanol:<br />
n-Hexan:<br />
-OH -CH 3<br />
-CH 2 -CH 2 -CH 2<br />
-CH 2 -OH<br />
-CH 3 -CH 2<br />
-OH<br />
-CH 3 -CH 2<br />
-CH 2 -CH 2 -CH 2 -CH 3<br />
ln γi = ln γi C + ln γi R<br />
ln γ C i = f(x i, q i, r i)<br />
r =<br />
ln γ = ν (lnΓ - ln Γ )<br />
i R<br />
Ψ nm<br />
q =<br />
i<br />
i<br />
Σ ν<br />
Σ ν<br />
Σ<br />
(i)<br />
k<br />
(i)<br />
k<br />
Q<br />
R<br />
k<br />
k<br />
k (i) k k (i)<br />
= exp (-a nm<br />
/ T)<br />
106
UNIFAC Matrix (Dezember 2007)<br />
UNIFAC Parameter Matrix<br />
December 2008<br />
New Structural<br />
Groups:<br />
51 NCO<br />
52 Epoxides<br />
53 Anhydrides<br />
54 Carbonates<br />
55 Sulfones<br />
56 HCONR<br />
57 ACCN<br />
58 Lactames<br />
59 Lactones<br />
60 Peroxides<br />
61 Acetals<br />
62 ACNR2<br />
63 ACNHR<br />
64 ACBr<br />
65 Oxime<br />
66 Furane<br />
67 PO4<br />
08 00 006 GC-gE<br />
Hansen et al., Ind. Eng. Chem. Res.<br />
30, No.10, 2352-2355 (1991)<br />
1<br />
1 CH 2<br />
2<br />
2 C=C<br />
3<br />
3 ACH<br />
published parameters<br />
4<br />
4 ACCH 2<br />
5<br />
5 OH<br />
6<br />
6 CH OH<br />
3<br />
7<br />
7 H 2<br />
O<br />
8<br />
8<br />
9<br />
delivery 1998<br />
ACOH<br />
9 CH 2CO<br />
10<br />
10 CHO<br />
11<br />
11 CCOO<br />
12<br />
12 HCOO<br />
13<br />
13 CH 2 O<br />
delivery 1999<br />
14<br />
14 CH 2NH<br />
2<br />
15<br />
15 CH 2NH<br />
16<br />
16 (C)3N<br />
17<br />
17 ACNH 2<br />
delivery 2000<br />
18<br />
18 Pyridin<br />
19<br />
19 CH CN<br />
2<br />
20<br />
20 COOH<br />
21<br />
21 CCl<br />
22<br />
22 CCl 2<br />
23<br />
23 CCl 3<br />
delivery 2001<br />
24 CCl<br />
24<br />
4<br />
25<br />
25 ACCl<br />
26<br />
26 CNO 2<br />
27<br />
27 ACNO 2<br />
28<br />
28 CS 2<br />
delivery 2002<br />
29<br />
29 CH 3SH<br />
30<br />
30 Furfural<br />
31<br />
31 DOH<br />
32<br />
32 I<br />
33<br />
33 Br<br />
34 delivery 2003<br />
34 C C<br />
35<br />
35 DMSO<br />
36<br />
36 Acryl<br />
37<br />
37 ClC = C<br />
38 ACF<br />
38<br />
39 DMF<br />
39 delivery 2004<br />
40 CF<br />
40<br />
2<br />
41 COO<br />
41<br />
42<br />
42 SiH 2<br />
43<br />
43 SiO<br />
44<br />
44 NMP<br />
45<br />
45 CClF<br />
46<br />
46 CON<br />
47 OCCOH<br />
47<br />
48<br />
48 CH2S<br />
49<br />
49 Morpholin<br />
50<br />
50 Thiophen<br />
51 NCO<br />
51<br />
52<br />
52 Epoxy<br />
53 Anhydrides<br />
53<br />
54 Carbonates<br />
54<br />
55 Sulfones<br />
55<br />
56 HCONR<br />
56<br />
57<br />
57<br />
ACCN<br />
58<br />
58 Lactames<br />
59<br />
59 Lactones<br />
60<br />
60 Peroxides<br />
61<br />
61 Acetals<br />
62<br />
62 ACNR2<br />
63<br />
63 ACNHR<br />
64<br />
64 ACBr<br />
65<br />
65 Oxime<br />
66<br />
66 Furane<br />
67<br />
67 PO 4<br />
delivery 2005<br />
delivery 2006<br />
delivery 2007<br />
new or revised parameters,<br />
delivery 2008<br />
no parameters<br />
available<br />
108
Abschätzung von Aktivitätskoeffizienten<br />
UNIFAC-Wechselwirkungsparametermatrix<br />
a nm<br />
(K) einiger ausgewählter Strukturgruppen<br />
Hauptgruppe 1 2 3 4 5 6 7 8 9<br />
1 CH 2 0.0 86.02 61.13 76.5 986.5 697.2 1318.0 1333.0 476.4<br />
2 C=C -35.36 0.0 38.81 74.15 524.1 787.6 270.6 526.1 182.6<br />
3 ACH -11.12 3.446 0.0 167.0 636.1 637.35 903.8 1329.0 25.77<br />
4 ACCH 2 -69.7 -113.6 -146.8 0.0 803.2 603.25 5695.0 884.9 -52.1<br />
5 OH 156.4 457.0 89.6 25.82 0.0 -137.1 353.5 -259.7 84.0<br />
6 CH 3 OH 16.51 -12.52 -50.0 -44.5 249.1 0.0 -180.95 -101.7 23.39<br />
7 H 2 O 300.0 496.1 362.3 377.6 -229.1 289.6 0.0 324.5 -195.4<br />
8 ACOH 275.8 217.5 25.34 244.2 -451.6 -265.2 -601.8 0.0 -356.1<br />
9 CH 2 CO 26.76 42.92 140.1 365.8 164.5 108.65 472.5 -133.1 0.0<br />
10 CHO 505.7 56.3 23.39 106.0 -404.8 -340.18 232.7 - 128.0<br />
11 CCOO 114.8 132.1 85.84 -170.0 245.4 249.63 200.8 -36.72 372.2<br />
12 CH 2 O 83.36 26.51 52.13 65.69 237.7 238.4 -314.7 - 191.1<br />
13 CNH 2 -30.48 1.163 -44.85 - -164.0 -481.65 -330.4 - -<br />
14 ACNH 2 1139.0 2000.0 247.5 762.8 -17.4 -118.1 -367.8 -253.1 -450.3<br />
15 CCN 24.82 -40.62 -22.97 -138.4 185.4 157.8 242.8 - -287.5<br />
16 COOH 315.3 1264.0 62.32 268.2 -151.0 1020.0 -66.17 - -297.8<br />
17 CCl 91.46 97.51 4.68 122.91 562.2 529.0 698.24 - 286.28<br />
18 CCl 2 34.01 18.25 121.3 140.78 747.7 669.9 708.7 - 423.2<br />
19 CCl 3 36.7 51.06 288.5 33.61 742.1 649.1 826.76 - 552.1<br />
20 CCl 4 -78.45 160.9 -4.7 134.7 856.3 860.1 1201.0 10000.0 372.0<br />
21 ACCl -141.26 -158.8 -237.68 375.5 246.9 661.6 920.4 - 128.1<br />
109
Dampf- Flüssig- Gleichgewichte von Alkan-Keton-Systemen<br />
alkan_keto_UNIFAC.cdr, 23.11.2000<br />
1.0<br />
y 1<br />
0.5<br />
n-Octan +<br />
Cyclopentanon<br />
(90°C)<br />
Cyclohexan +<br />
Cyclohexanon<br />
(75°C)<br />
n-Heptan +<br />
3-Pentanon<br />
(65°C)<br />
0.0<br />
0.5<br />
0.0<br />
y 1<br />
y 1<br />
x 1 x 1<br />
2-Butanon +<br />
n-Octan<br />
(65°C)<br />
2-Butanon +<br />
Cyclohexan<br />
(1 atm)<br />
n-Hexan +<br />
2-Butanon<br />
(60°C)<br />
Experimentelle und nach der UNIFAC-<br />
Methode berechnete Dampf-Flüssig-<br />
Gleichgewichte binärer Kohlenwasserstoff-Keton-Systeme<br />
UNIFAC<br />
experimentell<br />
0.5<br />
Aceton +<br />
Cyclohexan<br />
(1 atm)<br />
Aceton +<br />
n-Hexan<br />
(20°C)<br />
2-Methylbutan +<br />
Aceton<br />
(1 atm)<br />
0.0<br />
0.0 0.5 0.0 0.5 0.0 0.5 1.0<br />
x 1<br />
110
Mitglieder des UNIFAC Konsortiums (Mai 2008)
Verlauf der Isothermen einer kubischen Zustandsgleichung<br />
⎛ ∂P<br />
⎞<br />
⎜ ⎟<br />
⎝ ∂v<br />
⎠<br />
T<br />
2<br />
⎛ ∂ P<br />
=<br />
⎜<br />
2<br />
⎝ ∂v<br />
⎞<br />
⎟<br />
⎠<br />
kr T kr<br />
=<br />
0<br />
Siedelinie<br />
Taulinie<br />
113
P rep<br />
rep<br />
P = P +<br />
=<br />
van der Waals-Zustandsgleichung (1873)<br />
(Nobelpreis für Physik 1910)<br />
P<br />
att<br />
RT<br />
v − b<br />
P<br />
att<br />
=<br />
−<br />
a<br />
v<br />
• a - intermolekulare Anziehung<br />
• b - Volumen der dichtesten Packung<br />
2<br />
v<br />
3<br />
⎛<br />
− ⎜b<br />
⎝<br />
+<br />
RT<br />
P<br />
⎞<br />
⎟v<br />
⎠<br />
2<br />
+<br />
a<br />
P<br />
v<br />
−<br />
ab<br />
P<br />
114<br />
=<br />
0
11.02.99<br />
Ermittlung von a und b aus kritischen Daten<br />
02 01 016 PvT<br />
P RT a<br />
= − v 2<br />
− b v<br />
am kritischen Punkt gilt:<br />
⎛ ∂P ⎞ RT 2a<br />
⎜ = − + = 0<br />
2 3<br />
v<br />
⎟<br />
⎝ ∂ ⎠ − v<br />
T<br />
kr<br />
( v b)<br />
2<br />
⎛ ∂ P ⎞ 2RT 6a<br />
⎜ 2 ⎟ = - = 0<br />
3 4<br />
⎝ ∂v<br />
⎠T<br />
( v - b)<br />
v<br />
kr<br />
daraus folgt:<br />
RT<br />
kr<br />
( v − b)<br />
kr<br />
2RT<br />
kr<br />
( v − b)<br />
kr<br />
=<br />
2a<br />
v<br />
2 3<br />
kr<br />
=<br />
6a<br />
v<br />
3 4<br />
kr<br />
nach Division und Substitution:<br />
a<br />
9RT v<br />
kr kr<br />
kr<br />
=<br />
8<br />
v<br />
3<br />
damit erhält man für P kr<br />
:<br />
P<br />
die allgemeine Form lautet also:<br />
bzw. nach Division durch P kr<br />
bzw. 3 R T kr<br />
/ 8 v kr<br />
b<br />
=<br />
RT 9RT v 3RT<br />
= − =<br />
kr kr kr kr<br />
kr 2<br />
vkr − vkr 3 8vkr 8vkr<br />
P RT 9 8 RTkr<br />
v<br />
= − v v 3 v 2<br />
−<br />
kr<br />
P 8T 3<br />
= − 3v 1 v<br />
r<br />
r 2<br />
r<br />
−<br />
r<br />
kr<br />
T P v<br />
Tr = Pr = vr<br />
=<br />
T P v<br />
115<br />
kr kr kr
Messung kritischer Punkte am Beispiel von Ethan<br />
H 2<br />
O:<br />
T kr = 647.3 K<br />
P kr = 220.4 bar<br />
T kr - 0.5 K<br />
T kr = 305.41 K<br />
T kr + 0.5 K<br />
116
Der azentrische Faktor ω<br />
1<br />
117
Die perfekte Zustandsgleichung – aber wie?<br />
Perfecteos_d.cdr<br />
P<br />
A New Equation<br />
of State<br />
KEY<br />
α<br />
ρ (P,T)<br />
T<br />
c<br />
χ<br />
P<br />
z c<br />
c<br />
ω<br />
v c<br />
∂P<br />
∂v<br />
2<br />
∂ P<br />
2<br />
∂v<br />
Tc<br />
Tc<br />
z = z c!<br />
= 0<br />
= 0<br />
EXPTL.<br />
PRESENT<br />
STUDY<br />
v<br />
118
09.01.00<br />
Otto Redlich, John M. Prausnitz, Jürgen <strong>Gmehling</strong><br />
RT<br />
v −b<br />
P = −<br />
1/<br />
2<br />
T<br />
a<br />
v<br />
( v + b)<br />
05 00 001b EOSMIX<br />
119
Giorgio Soave<br />
P<br />
=<br />
RT<br />
v −<br />
b<br />
−<br />
v<br />
a ( T )<br />
( )<br />
v<br />
+<br />
b<br />
Peng-Robinson-Zustandsgleichung:<br />
P =<br />
RT<br />
v − b<br />
−<br />
v<br />
a( T)<br />
( v + b) + b( v − b)<br />
log (P r<br />
s )<br />
experimentelle Werte<br />
für Ethanol<br />
RK<br />
SRK<br />
T kr<br />
= 516.2 K<br />
P kr<br />
= 63.83 bar<br />
ω = 0.635<br />
Soave-Redlich-Kwong Gleichung (SRK)<br />
1/T r
11.02.99<br />
P-x(y)-Diagramm für das System Stickstoff (1) + Methan (2)<br />
Zustandsgleichung: Soave-Redlich-Kwong; k 12 = 0.03014<br />
177.59 K<br />
166.48 K<br />
144.26 K<br />
133.15 K<br />
Mischungsregeln:<br />
b = Σz i<br />
b i<br />
a ij =(a ii<br />
a jj ) 0.5 (1-k ij )<br />
a = Σ Σz i z j a ij<br />
110.93 K<br />
05 00 008 EOSMIX<br />
121
Definition von Realanteilen:<br />
Berechnung von Realanteilen<br />
m R ≡ (m-m id ) T,P<br />
Realanteil ist die Differenz aus realem Wert und dem Wert bei gleichem Druck<br />
und gleicher Temperatur im idealen Gaszustand:<br />
Beispiele:<br />
Volumen:<br />
Gibbssche Enthalpie:<br />
RT<br />
P<br />
id<br />
( v − v ) = ( z 1)<br />
T, P<br />
−<br />
⎡⎛<br />
∂g<br />
⎞<br />
⎢⎜<br />
⎟<br />
⎣⎝<br />
∂P<br />
⎠<br />
⎛ ∂g<br />
⎝ ∂P<br />
id<br />
P<br />
id<br />
( g − g ) = ∫ − ⎜ ⎟ dP<br />
T,<br />
P<br />
0<br />
T<br />
⎞<br />
⎠<br />
T<br />
⎥ ⎦<br />
⎤<br />
RT⎤<br />
P ⎥ ⎦<br />
P<br />
id<br />
( g − g ) = ∫ v − dP<br />
T,<br />
P<br />
0<br />
⎡<br />
⎢<br />
⎣<br />
122
20.02.03<br />
Gleichungen zur Berechnung von Realanteilen<br />
volumenexplizite<br />
Zustandsgleichung<br />
druckexplizite<br />
Zustandsgleichung<br />
RT<br />
ln ϕ ≡<br />
id<br />
( g − g ) T, P<br />
(<br />
id<br />
h −h ) T, P<br />
P<br />
∫<br />
0<br />
P<br />
∫<br />
0<br />
⎛<br />
⎜v<br />
−<br />
⎝<br />
RT<br />
P<br />
⎞<br />
⎟ dP<br />
⎠<br />
⎡ ⎛ ∂v<br />
⎞<br />
⎢v<br />
−T<br />
⎜ ⎟<br />
⎣ ⎝ ∂T<br />
⎠<br />
P<br />
⎤<br />
⎥dP<br />
⎦<br />
v<br />
∫<br />
∞<br />
⎛<br />
⎜<br />
⎝<br />
RT<br />
v<br />
⎞<br />
− P ⎟dv<br />
+ RT(z −1−<br />
ln z)<br />
⎠<br />
v<br />
⎡ ⎛ ∂P<br />
⎞<br />
− ∫ ⎢P<br />
−T<br />
⎜ ⎟<br />
⎣ ⎝ ∂T<br />
∞ ⎠v<br />
⎤<br />
⎥dv<br />
+ Pv − RT<br />
⎦<br />
(<br />
id<br />
s − s ) T, P<br />
P<br />
∫<br />
0<br />
⎡<br />
⎢−<br />
⎣<br />
⎛<br />
⎜<br />
⎝<br />
∂v<br />
∂T<br />
⎞<br />
⎟<br />
⎠<br />
P<br />
+<br />
R ⎤<br />
⎥dP<br />
P ⎦<br />
v<br />
∫<br />
∞<br />
⎡⎛<br />
∂P<br />
⎞<br />
⎢⎜<br />
⎟<br />
⎣⎝<br />
∂T<br />
⎠<br />
v<br />
−<br />
R<br />
v<br />
⎤<br />
⎥dv<br />
⎦<br />
+ R ln z<br />
P<br />
⎛<br />
( ) ∫ ⎟ ⎞<br />
⎜<br />
∂ 2<br />
id<br />
v<br />
cP<br />
− cP<br />
= −T<br />
T,P<br />
2<br />
⎝ ∂T<br />
0 ⎠<br />
P<br />
dP<br />
∞<br />
id<br />
(<br />
v<br />
− cv<br />
) = −T<br />
T,P ∫<br />
2<br />
⎛ ∂ P ⎞<br />
⎜<br />
⎟<br />
⎝ ∂T<br />
⎠<br />
c<br />
2<br />
v<br />
v<br />
dv<br />
123
Berechnung der Enthalpie über Realanteile<br />
h<br />
Referenzzustand<br />
id<br />
h (T)<br />
0,id id<br />
= h + c dT<br />
T<br />
∫<br />
∆ 0 B<br />
P<br />
T 0<br />
V id<br />
(h - h )<br />
T 1 ,P s<br />
VerdampfungsenthalpienEOS.cdr<br />
0,id<br />
∆h B<br />
∆h (T )<br />
v 1<br />
L id<br />
(h - h )<br />
T 1<br />
,P s<br />
T 0<br />
T 1<br />
T<br />
T kr<br />
124
Einfluss des Druckes auf die Reaktionsenthalpie<br />
realer Gase<br />
Druck<br />
P<br />
III<br />
II<br />
∆hR ( T,P)<br />
T = konstant<br />
I<br />
(<br />
o<br />
)<br />
o<br />
R I II III<br />
∆ h T,P = ∆ h + ∆ h + ∆h<br />
I<br />
II<br />
Edukte<br />
R<br />
(<br />
id<br />
)<br />
∆ h = ν h − h<br />
( )<br />
∆ h = ∆h T,P<br />
Edukte,T,P<br />
ideales Gas<br />
(1 atm)<br />
Produkte<br />
o<br />
R<br />
( )<br />
∆h T,P<br />
IV<br />
Edukte<br />
III<br />
Pr odukte<br />
(<br />
id<br />
)<br />
∆ h = ν h − h<br />
Pr odukte,T,P<br />
Enthalpie<br />
o<br />
R R i<br />
( ) (<br />
id<br />
)<br />
∑<br />
∆ h (T,P) = ∆ h T,P + ν h − h<br />
i,T,P<br />
125
Druckeinfluss auf die Reaktionsenthalpie: Ammoniaksynthese (450°C)<br />
0.5 N 2 + 1.5 H 2 NH 3<br />
Standardreaktionsenthalpie (ideales Gas) ∆h Ro = - 52 878 J/mol<br />
Fragestellung: Reaktionsenthalpie bei 600 atm?<br />
VTPR<br />
N 2<br />
H 2<br />
NH 3<br />
id<br />
( h − h )<br />
450 ° C, 600 atm<br />
815 J/mol<br />
1 152 J/mol<br />
- 4 896 J/mol<br />
Referenzzustands-<br />
Gleichungen<br />
945 J/mol<br />
1037 J/mol<br />
-5032 J/mol<br />
∆h R (600 atm) = - 52 878 – 0.5 . 815 – 1.5 . 1152 – 4896 = - 59 909 J/mol<br />
L.J. Gillespie, J.A. Beattie, Phys. Rev. 36, 743 (1930) (Ullmann): - 59 650 J/mol<br />
126
Druckabhängigkeit der Reaktionsenthalpie<br />
am Beispiel der Ammoniaksynthese<br />
450 °C<br />
∆hR [kJ/mol]<br />
-55<br />
-62<br />
0 200 400 600 800<br />
Druck [atm]<br />
- - - VTPR<br />
_____<br />
Referenzzustandsgleichung<br />
__ __ __<br />
Ullmann (Ammonia)<br />
127
Mögliche Anwendungsbeispiele bei Kenntnis des realen Verhaltens<br />
Synthese thermischer Trennprozesse<br />
Berechnung von<br />
(Auswahl selektiver Zusatzstoffe,<br />
Phasengleichgewichten<br />
Festlegung Trennsequenz, ...)<br />
(VLE, LLE, SLE, GLE, ...)<br />
Auslegung von<br />
Trennkolonnen (N ) th<br />
applic_d.cdr<br />
Berechnung von<br />
Chemisches<br />
Exzeßgrößen<br />
Gleichgewicht (K γ, K ϕ)<br />
(h E, c P E , v E , ...)<br />
Sicherheitsfragen<br />
Kenntnis des<br />
Standardbildungsgrößen<br />
( ∆h B o , ∆g B o ) verhaltens ( γi, ϕi, PVT)<br />
(Flammpunkte, ...)<br />
realen Gemisch-<br />
gewünscht für<br />
Umweltschutz<br />
Analytik (GLC, ..)<br />
(K OW → Ausbreitung,<br />
Bioakkumulation, ...)<br />
Arbeitsschutz (Sicherheitskleidung,<br />
Exposition, ...)<br />
diffusiver Stofftransport<br />
reaktionskinetische Ansätze<br />
(LM-Effekte, kinetische Ausdrücke, ...)<br />
Berechnung thermodynamischer<br />
Größen (h, s, ..., ∆h , ∆h (P), ...)<br />
v<br />
R<br />
128