Falk Gastro-Kolleg Leber und Gallenwege - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Leber und Gallenwege - Dr. Falk Pharma GmbH
Falk Gastro-Kolleg Leber und Gallenwege - Dr. Falk Pharma GmbH
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
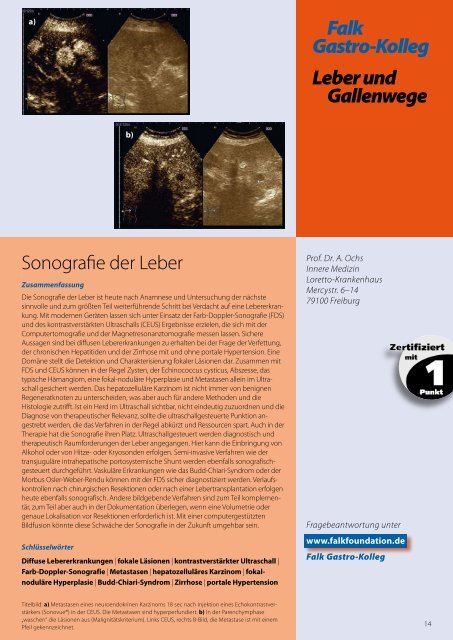
a)<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Leber</strong> <strong>und</strong><br />
<strong>Gallenwege</strong><br />
b)<br />
Sonografie der <strong>Leber</strong><br />
Zusammenfassung<br />
Die Sonografie der <strong>Leber</strong> ist heute nach Anamnese <strong>und</strong> Untersuchung der nächste<br />
sinnvolle <strong>und</strong> zum größten Teil weiterführende Schritt bei Verdacht auf eine <strong>Leber</strong>erkrankung.<br />
Mit modernen Geräten lassen sich unter Einsatz der Farb-Doppler-Sonografie (FDS)<br />
<strong>und</strong> des kontrastverstärkten Ultraschalls (CEUS) Ergebnisse erzielen, die sich mit der<br />
Computertomografie <strong>und</strong> der Magnetresonanztomografie messen lassen. Sichere<br />
Aussagen sind bei diffusen <strong>Leber</strong>erkrankungen zu erhalten bei der Frage der Verfettung,<br />
der chronischen Hepatitiden <strong>und</strong> der Zirrhose mit <strong>und</strong> ohne portale Hypertension. Eine<br />
Domäne stellt die Detektion <strong>und</strong> Charakterisierung fokaler Läsionen dar. Zusammen mit<br />
FDS <strong>und</strong> CEUS können in der Regel Zysten, der Echinococcus cysticus, Abszesse, das<br />
typische Hämangiom, eine fokal-noduläre Hyperplasie <strong>und</strong> Metastasen allein im Ultraschall<br />
gesichert werden. Das hepatozelluläre Karzinom ist nicht immer von benignen<br />
Regeneratknoten zu unterscheiden, was aber auch für andere Methoden <strong>und</strong> die<br />
Histologie zutrifft. Ist ein Herd im Ultraschall sichtbar, nicht eindeutig zuzuordnen <strong>und</strong> die<br />
Diagnose von therapeutischer Relevanz, sollte die ultraschallgesteuerte Punktion angestrebt<br />
werden, die das Verfahren in der Regel abkürzt <strong>und</strong> Ressourcen spart. Auch in der<br />
Therapie hat die Sonografie ihren Platz. Ultraschallgesteuert werden diagnostisch <strong>und</strong><br />
therapeutisch Raumforderungen der <strong>Leber</strong> angegangen. Hier kann die Einbringung von<br />
Alkohol oder von Hitze- oder Kryosonden erfolgen. Semi-invasive Verfahren wie der<br />
transjuguläre intrahepatische portosystemische Shunt werden ebenfalls sonografischgesteuert<br />
durchgeführt. Vaskuläre Erkrankungen wie das Budd-Chiari-Syndrom oder der<br />
Morbus Osler-Weber-Rendu können mit der FDS sicher diagnostiziert werden. Verlaufskontrollen<br />
nach chirurgischen Resektionen oder nach einer <strong>Leber</strong>transplantation erfolgen<br />
heute ebenfalls sonografisch. Andere bildgebende Verfahren sind zum Teil komplementär,<br />
zum Teil aber auch in der Dokumentation überlegen, wenn eine Volumetrie oder<br />
genaue Lokalisation vor Resektionen erforderlich ist. Mit einer computergestützten<br />
Bildfusion könnte diese Schwäche der Sonografie in der Zukunft umgehbar sein.<br />
Schlüsselwörter<br />
Diffuse <strong>Leber</strong>erkrankungen | fokale Läsionen | kontrastverstärkter Ultraschall |<br />
Farb-Doppler-Sonografie | Metastasen | hepatozelluläres Karzinom | fokalnoduläre<br />
Hyperplasie | Budd-Chiari-Syndrom | Zirrhose | portale Hypertension<br />
Prof. <strong>Dr</strong>. A. Ochs<br />
Innere Medizin<br />
Loretto-Krankenhaus<br />
Mercystr. 6–14<br />
79100 Freiburg<br />
Fragebeantwortung unter<br />
www.falkfo<strong>und</strong>ation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
Titelbild: a) Metastasen eines neuroendokrinen Karzinoms 18 sec nach Injektion eines Echokontrastverstärkers<br />
(Sonovue®) in der CEUS. Die Metastasen sind hyperperf<strong>und</strong>iert. b) In der Parenchymphase<br />
„waschen“ die Läsionen aus (Malignitätskriterium). Links CEUS, rechts B-Bild, die Metastase ist mit einem<br />
Pfeil gekennzeichnet.<br />
14
Sonografie der <strong>Leber</strong><br />
Einleitung<br />
Die Sonografie der <strong>Leber</strong> ist die Königsdisziplin der bildgebenden Diagnostik. Sie ist<br />
schmerzlos, ohne Strahlenbelastung, wiederholbar <strong>und</strong> breit verfügbar. Sie stellt deshalb<br />
die Untersuchungsmethode der ersten Wahl bei Verdacht auf <strong>Leber</strong>erkrankungen<br />
dar. Nachteil ist die Notwendigkeit der Herausarbeitung der Bef<strong>und</strong>e während der<br />
Untersuchung, die hohe Abhängigkeit von der Erfahrung des Untersuchers <strong>und</strong> die<br />
nicht standardisierte Bilddokumentation. Tabelle 1 gibt die Fragestellungen an die<br />
Sonografie der <strong>Leber</strong> wieder. In Kombination mit der Farb-Doppler-Sonografie (FDS),<br />
dem kontrastverstärkten Ultraschall (CEUS) <strong>und</strong> den inzwischen zahlreichen ultraschallgestützten<br />
diagnostischen <strong>und</strong> therapeutischen Interventionen hat sich das<br />
Spektrum der Indikationen erheblich erweitert. Die Methode ist inzwischen so weit<br />
fortgeschritten, dass sie sich mit anderen – meist erheblich aufwendigeren <strong>und</strong><br />
teureren – radiologischen Methoden messen kann bzw. ihnen überlegen ist. Gerade<br />
bei sonografisch nachweisbaren fokalen Läsionen, deren Dignität bei gleichzeitiger<br />
therapeutischer Konsequenz nicht festzulegen ist, können durch eine Punktion die<br />
Diagnostik beschleunigt <strong>und</strong> Kosten eingespart werden. Auf Erkrankungen der Gallenblase<br />
<strong>und</strong> der <strong>Gallenwege</strong> wird hier nicht detailliert eingegangen.<br />
P Die Sonografie ist das wichtigste<br />
bildgebende Verfahren bei diffusen<br />
<strong>und</strong> fokalen <strong>Leber</strong>erkrankungen.<br />
Indikationen zur sonografischen Untersuchung der <strong>Leber</strong><br />
• Diffuse <strong>Leber</strong>erkrankungen<br />
• Fokale <strong>Leber</strong>erkrankungen<br />
• Biliäre Erkrankungen<br />
• Vaskuläre Erkrankungen<br />
• Orientierend vor Eingriffen<br />
• (Anatomie, Segmentzuordnung, Normvarianten)<br />
• Verlaufskontrolle (nach Therapie von Malignomen,<br />
ablativen Verfahren, Transplantation, anderen Interventionen)<br />
• Ultraschallgesteuerte Diagnostik <strong>und</strong> Therapie<br />
Tab. 1<br />
P Technische Verbesserungen:<br />
„harmonic imaging“,<br />
Farb-Doppler-Sonografie,<br />
kontrastverstärkter Ultraschall<br />
Technik der Untersuchung <strong>und</strong> Segmentanatomie<br />
Untersucht wird mit „curved array“-Schallköpfen <strong>und</strong> Frequenzen von 3,5–10 MHz<br />
(z. B. zur Beurteilung der <strong>Leber</strong>oberfläche bei Zirrhose). Durch technische Verbesserungen,<br />
wie das „harmonic imaging“ oder die Kombination aus f<strong>und</strong>amentalem Schall<br />
<strong>und</strong> der „compo<strong>und</strong> scan“-Methode konnte sowohl die Eindringtiefe als auch die Auflösung<br />
verbessert werden. Die Farb-Doppler-Sonografie (FDS) kommt zur Beurteilung<br />
der Gefäße zum Einsatz. Modifikationen des „contrast harmonic imaging“ erlauben es,<br />
bei niedriger Schallenergie („mechanical index“) Echokontrastverstärker einzusetzen<br />
(CEUS). Insbesondere fokale Läsionen sollten den <strong>Leber</strong>segmenten nach Couinaud<br />
zugeordnet werden (Abb. 1), die sich operativ gezielt entfernen lassen [2, 3, 15].<br />
15
Abb. 1<br />
<strong>Leber</strong>segmente nach Couinaud.<br />
Die Segmente ergeben sich durch die Schnittstellen von <strong>Leber</strong>venen <strong>und</strong> Pfortaderästen.<br />
Segment I entspricht dem Lobus caudatus, Segment IV dem Lobus quadratus. Letzterer wird<br />
rechts durch die hier nicht dargestellte Gallenblase begrenzt <strong>und</strong> links durch den Pfortaderhauptstamm.<br />
P Fettleber, chronische Hepatitis,<br />
<strong>Leber</strong>fibrose <strong>und</strong> <strong>Leber</strong>zirrhose sind<br />
wichtige diffuse <strong>Leber</strong>erkrankungen<br />
mit typischen sonografischen<br />
Charakteristika.<br />
Die Größenbestimmung der <strong>Leber</strong> ist nicht exakt, meist werden Vertikal- <strong>und</strong> Tiefendurchmesser<br />
in der rechten Medioklavikularlinie (MCL) bestimmt. Vor Resektionen ist<br />
die viel genauere Volumetrie der Computertomografie (CT) sinnvoll. Die Form der<br />
<strong>Leber</strong> ist ebenfalls variabel, ist aber als Einzelparameter gering aussagekräftig [1], es<br />
sei denn, es finden sich typische Veränderungen der Oberfläche wie bei der Zirrhose.<br />
„Diffuse“ parenchymatöse <strong>Leber</strong>erkrankungen<br />
Tab. 2<br />
Diffuse Erkrankung<br />
Fettleber<br />
Akute <strong>und</strong><br />
chronische<br />
Hepatitis<br />
Akute <strong>und</strong> chronische<br />
Stauungsleber<br />
Vaskuläre<br />
Erkrankungen<br />
Fibrose<br />
Zirrhose<br />
Kommentar<br />
Charakteristisch echogene, helle („bright“) <strong>Leber</strong> ab<br />
ca. 30% Verfettung der Hepatozyten, posteriore<br />
Schallabschwächung bei starker Verfettung. Zonale<br />
Minderverfettungen in einer hellen <strong>Leber</strong> sprechen für<br />
eine ausgeprägte Verfettung.<br />
Kein sicheres sonomorphologisches Korrelat, akut eher<br />
echoarm, bei fulminanter Hepatitis sind Zeichen der<br />
portalen Hypertension möglich. Lymphknoten im<br />
Ligamentum hepatoduodenale <strong>und</strong> eine Verfettung<br />
sind gehäuft bei Hepatitis C nachweisbar.<br />
Aszites <strong>und</strong> erweiterte <strong>Leber</strong>venen sind charakteristisch,<br />
bei längerem Verlauf entsteht eine Fibrose oder<br />
Zirrhose.<br />
Inhomogene, eher echogene Areale <strong>und</strong> Vergrößerung<br />
des Lobus caudatus bei Budd-Chiari-Syndrom,<br />
ektatische Gefäße beim Morbus Osler.<br />
Uncharakteristisch grobe <strong>und</strong> ungleichmäßige Binnenechos<br />
sind möglich. Abgrenzung zur Verfettung <strong>und</strong><br />
Zirrhose schwierig. (Transiente Elastografie?)<br />
Gebuckelte Oberfläche <strong>und</strong> Zeichen der portalen<br />
Hypertension sind sehr sensitiv <strong>und</strong> spezifisch, die<br />
<strong>Leber</strong>größe korreliert mit der Prognose. Zusatzinformationen<br />
über FDS <strong>und</strong> Hilfsparameter wie<br />
Aszites, Kollateralen, Milzvergrößerung.<br />
16
Diffuse <strong>Leber</strong>erkrankungen<br />
Tabelle 2 zeigt die in der Sonografie fassbaren Bef<strong>und</strong>e bei diffusen Erkrankungen. Die<br />
<strong>Leber</strong>verfettung lässt sich ab etwa 30% Verfettung der Hepatozyten nachweisen <strong>und</strong><br />
zeigt dann eine zunehmende Echogenität mit potenzieller posteriorer Schallabschwächung.<br />
Der Verfettungsgrad korreliert auch mit dem Ausmaß zonaler Minderverfettung.<br />
Die <strong>Leber</strong>venen sind schlechter erkennbar als in der normalen <strong>Leber</strong>. Bei<br />
schwerer Fettleberhepatitis kann eine portale Hypertension auftreten. Die Sonografie<br />
ist auch ein wichtiger Baustein bei der Etablierung der Diagnose einer nicht-alkoholischen<br />
Steatohepatitis (NASH). Die mikrovesikuläre Verfettung (teilweise auch bei<br />
NASH, typisch für die Schwangerschaftsfettleber) ist meist nicht darzustellen. Eine<br />
zonale Minderverfettung kann tumorartig imponieren <strong>und</strong> löst eine weitere Diagnostik<br />
aus (Abb. 2).<br />
P Fettleber: weiße <strong>Leber</strong>, eventuell<br />
fokale Minderverfettung<br />
Abb. 2<br />
Fettleber mit regional<br />
minder- oder mehrverfetteten<br />
Arealen bei<br />
Adipositas <strong>und</strong><br />
Diabetes mellitus.<br />
Bei der akuten Hepatitis ist das sonografische Erscheinungsbild uncharakteristisch.<br />
Die Bedeutung der Sonografie liegt hier im Ausschluss einer mechanischen Cholestase<br />
oder eines chronischen <strong>Leber</strong>leidens (Tumor, Zirrhose). Die Echogenität ist normal<br />
oder etwas vermindert. Als Begleitphänomene können eine mäßige Splenomegalie<br />
<strong>und</strong> eine wandverdickte <strong>und</strong> leere Gallenblase beobachtet werden. Bei sehr schweren<br />
Verläufen kann Aszites als Ausdruck einer beginnenden portalen Hypertension auftreten.<br />
Lymphknoten im Bereich des Ligamentum hepatoduodenale [4] korrelieren mit<br />
der Aktivität einer chronischen Hepatitis C, werden aber auch bei der EBV-Infektion<br />
oder bei primär biliärer Zirrhose gef<strong>und</strong>en. Im weiteren Verlauf können Inhomogenitäten<br />
bis hin zu nodulären Veränderungen auftreten, z. B. beim Morbus Wilson.<br />
P Uncharakteristisches Bild<br />
bei der akuten Hepatitis<br />
Die akute <strong>und</strong> chronische Stauungsleber lässt sich sonografisch gut charakterisieren.<br />
Nach längerer Laufzeit kann eine Fibrose oder Zirrhose entstehen (cirrhose cardiaque).<br />
Aszites ist fast immer vorhanden.<br />
Das sonografische Erscheinungsbild ist bei Fibrose <strong>und</strong> Zirrhose variabel. Eine frühe<br />
Zirrhose kann sonografisch entgehen. Mit einer neuen Methode zur Bestimmung der<br />
<strong>Leber</strong>steife, der sogenannten transienten Elastografie, lässt sich der Schweregrad der<br />
Fibrose oder Zirrhose relativ gut bestimmen. Besonders gut ist die Korrelation von<br />
FibroScan® <strong>und</strong> <strong>Leber</strong>histologie bei homogenen Krankheitsbildern wie bei der<br />
Hepatitis C. Hier kann sogar auf das Ausmaß der portalen Hypertension geschlossen<br />
werden [7, 16]. Nachteil ist, dass das Gerät allein für diese Messung geeignet ist. Bei<br />
fortgeschrittener Zirrhose ist die Diagnose kein Problem (Abb. 3).<br />
P Fibrose <strong>und</strong> frühe Zirrhose sind<br />
manchmal schwer zu beurteilen.<br />
FibroScan® korreliert gut mit <strong>Leber</strong>histologie<br />
bei der <strong>Leber</strong>fibrose.<br />
17
Abb. 3<br />
P Aszites, Splenomegalie, Kollateralen,<br />
monophasischer Fluss in den <strong>Leber</strong>venen<br />
<strong>und</strong> langsamer Fluss in der Pfortader<br />
als Kriterien für eine <strong>Leber</strong>zirrhose.<br />
Dekompensierte Zirrhose.<br />
Gebuckelte Oberfläche,<br />
Aszites, inhomogene<br />
Binnenstruktur.<br />
Durch FDS <strong>und</strong> Hilfsparameter wie Aszites, Splenomegalie <strong>und</strong> Kollateralennachweis<br />
erhöht sich die Treffsicherheit (Abb. 4). Eine langsame Flussgeschwindigkeit des Pfortaderbluts,<br />
ein monophasisches <strong>Leber</strong>venenflussprofil <strong>und</strong> z. B. eine wiedereröffnete<br />
Umbilikalvene sind Zeichen der portalen Hypertension [8]. Eine portale Hypertension<br />
bei Zirrhose ist aber nicht obligat.<br />
Abb. 4<br />
Bef<strong>und</strong>e bei Zirrhose <strong>und</strong> portaler Hypertension.<br />
Vaskuläre Veränderungen der <strong>Leber</strong><br />
Unter dem Budd-Chiari-Syndrom (BCS) versteht man die postsinusoidale portale<br />
Hypertension, meist bedingt durch den thrombotischen Verschluss oder die Verlegung<br />
der <strong>Leber</strong>venen [10]. Eine Häufung findet sich auch bei Frauen mit Nikotinabusus<br />
<strong>und</strong> Kontrazeptiva. Eine Abflussbehinderung durch Membranen („webs“) wird<br />
in Westeuropa eher selten gesehen. Andere Ursachen sind die Kompression durch<br />
primäre Tumoren oder Metastasen. Die Klinik ist fulminant in Form eines <strong>Leber</strong>- <strong>und</strong><br />
Nierenversagens mit Aszites oder subakut oder chronisch. Im letzten Fall wird häufig<br />
eine Zirrhose fehldiagnostiziert. Durch die Sonografie <strong>und</strong> FDS werden immer häufiger<br />
komplette <strong>und</strong> inkomplette Fälle eines BCS diagnostiziert.<br />
P Budd-Chiari-Syndrom: Verschluss<br />
größerer <strong>Leber</strong>venen. Fast immer<br />
verb<strong>und</strong>en mit Aszites.<br />
18
Auch in der konventionellen Sonografie kann ein BCS erkannt werden [2, 3]. Abbildungen<br />
5 <strong>und</strong> 6 zeigen ein BCS. Der Lobus caudatus kann echoarm wie ein Tumor<br />
wirken <strong>und</strong> die Vena cava inferior komprimieren.<br />
Abb. 5<br />
Subakutes BCS mit Aszites,<br />
verschmälerten, echo-<br />
genen <strong>Leber</strong>venen (LV)<br />
<strong>und</strong> verdickter Gallenblasenwand<br />
(GB).<br />
Abb. 6<br />
Akutes BCS.<br />
Längsschnitt über der Vena<br />
cava inferior (VCI), die durch<br />
den akut vergrößerten<br />
Lobus caudatus (LC) hochgradig<br />
komprimiert wird.<br />
Dies führte zu einer unteren<br />
Einfluss-Stauung. Komplette<br />
Beseitigung der<br />
Problematik durch einen<br />
transjugulären intrahepatischen<br />
portosystemischen<br />
Stent-Shunt (TIPS).<br />
Gut darstellbar ist auch eine frische oder chronische Thrombose der Pfortader. Akut<br />
imponiert die Thrombose durch ein weites Gefäß mit echogenem „Inhalt“. Nach kurzer<br />
Zeit geht die Thrombose in die kavernöse Transformation über.<br />
Beim Morbus Osler-Weber-Rendu handelt es sich um eine seltene hereditäre Erkrankung<br />
mit Ausbildung von multiplen Angiodysplasien, die sich gewöhnlich im<br />
<strong>Gastro</strong>intestinaltrakt manifestieren. In der <strong>Leber</strong> können korkenzieherartige Gefäßmalformationen<br />
nachweisbar sein (Abb. 7). Es können sich große arteriovenöse Shunts<br />
ausbilden, die zu einer Herzinsuffizienz führen. Der hepatische Befall kann diagnostiziert<br />
werden, wenn der Durchmesser der Arteria hepatica communis mehr als 1 cm<br />
beträgt [5].<br />
P Arteriovenöse Shunts beim<br />
Morbus Osler-Weber-Rendu<br />
Abb. 7<br />
Typische intrahepatische Gefäßmalformationen bei Morbus Osler.<br />
In der FDS zahlreiche arteriovenöse Shunts (Abb. rechts).<br />
19
Fokale Läsionen<br />
Die Detektion <strong>und</strong> Charakterisierung von <strong>Leber</strong>herden ist eine Domäne der Sonografie.<br />
Die Diagnosen Zyste, Hämangiom, fokal noduläre Hyperplasie, Abszess oder Echinococcus<br />
cysticus sind heute sehr sicher rein sonografisch zu stellen, sofern kein Verdacht<br />
auf eine maligne Erkrankung besteht. Bei bekannten malignen Erkrankungen<br />
oder dem Verdacht darauf, sollte die Abklärung eines <strong>Leber</strong>herds bei Unklarheiten<br />
bioptisch erfolgen, wenn davon therapeutische Entscheidungen abhängig gemacht<br />
werden.<br />
<strong>Leber</strong>zysten (kongenital, dysontogenetisch) werden in 1–3% der Fälle gef<strong>und</strong>en.<br />
Erst ab einer Größe von mehr als 10 cm treten gewöhnlich Beschwerden auf. Da sie<br />
mit einer klaren Flüssigkeit gefüllt sind, erscheint ihr Inhalt echofrei.<br />
P Fokale <strong>Leber</strong>läsionen sind eine<br />
Domäne der Sonografie.<br />
P <strong>Leber</strong>zysten sind echofrei, Beschwerden<br />
erst ab etwa 10 cm Durchmesser.<br />
Während bei vereinzelten typischen Zysten keine weitere Diagnostik nötig ist, sind je<br />
nach Fragestellung komplexe Zysten anders zu werten.<br />
Solide Läsionen können heute mit Kontrastverstärkern <strong>und</strong> entsprechenden Geräten<br />
untersucht werden (CEUS „contrast-enhanced ultrasonography). Bei den Kontrastverstärkern<br />
handelt es sich um ca. 7 µm große gasgefüllte Fett-Tröpfchen, die mit geringer<br />
phaseninvertierter Schallenergie zum Schwingen angeregt werden. Somit kann<br />
man über Minuten das Perfusionsverhalten der <strong>Leber</strong> <strong>und</strong> ihrer Läsionen studieren. Es<br />
wurden ähnlich wie beim <strong>Dr</strong>eiphasen-CT typische Perfusionsmuster erarbeitet, die<br />
nun auch die Beurteilung der arteriellen, portalvenösen <strong>und</strong> Parenchym- oder Spätphase<br />
im Ultraschall erlauben. Abbildung 8 zeigt schematisch das typische Verhalten<br />
der Läsionen.<br />
P Solide Läsionen: Untersuchung durch<br />
Kontrastverstärkung (CEUS)<br />
Nativ<br />
Früharteriell<br />
Portal-venös<br />
Spätphase<br />
Abb. 8<br />
Hämangiom<br />
Adenom<br />
Fokal-noduläre Hyperplasie<br />
Abszess<br />
Metastase<br />
Typische Perfusionsmuster<br />
von Läsionen in der CEUS.<br />
20
Das kapilläre <strong>und</strong> kavernöse Hämangiom stellt einen häufigen sonografischen<br />
Bef<strong>und</strong> dar. Es handelt sich um ektatische Gefäßstrukturen mit geringem Blutfluss. Bis<br />
zu einer Größe von ca. 3 cm haben Hämangiome ein sonografisch typisches Erscheinungsbild<br />
(Abb. 9).<br />
P Irisblendenphänomen<br />
beim Hämangiom<br />
Abb. 9<br />
Typische Hämangiome.<br />
Echogene, relativ scharf<br />
begrenzte Herde im rechten<br />
<strong>Leber</strong>lappen. Im oberen<br />
Anteil des größeren<br />
Hämangioms sieht man<br />
ein Gefäß.<br />
Wie in der kontrastmittelgestützten CT zeigt das typische Hämangiom in der arteriellen<br />
Phase auch in der CEUS meist ein peripheres globuläres Enhancement <strong>und</strong> läuft<br />
dann von außen nach innen zu (Irisblendenphänomen) [11, 17]. In der Spätphase<br />
kann es gegenüber der Umgebung hyperreflexiv bleiben. Fibrose- oder Thromboseareale<br />
bleiben ausgespart, was die Diagnose erschweren kann.<br />
Das <strong>Leber</strong>adenom ist ein seltener <strong>und</strong> gutartiger Bef<strong>und</strong> <strong>und</strong> schwierig zu diagnostizieren,<br />
da er keine eindeutige Sonomorphologie zeigt <strong>und</strong> auch in anderer Bildgebung<br />
keine beweisenden Bef<strong>und</strong>e liefert [17]. Da Übergänge in ein hepatozelluläres<br />
Karzinom beschrieben wurden, sollte eine histologische Sicherung <strong>und</strong> gegebenenfalls<br />
die Resektion angestrebt werden. Da Hormone das Wachstum auslösen können,<br />
sollte die Anamnese nach Kontrazeptiva <strong>und</strong> Anabolika fragen. In der CEUS ist besonders<br />
auf die manchmal sehr kurze früharterielle Phase zu achten. Oft ist das Adenom<br />
nur für wenige Sek<strong>und</strong>en zu sehen, ehe es sich der Umgebung angleicht. Gegenüber<br />
der fokal nodulären Hyperplasie fehlen der Narbenstern <strong>und</strong> die prominenten Gefäße<br />
sowie arterioportale Fisteln.<br />
Die fokal noduläre Hyperplasie (FNH) ist ein gutartiger <strong>und</strong> relativ häufiger Bef<strong>und</strong>.<br />
Sie tritt unilokulär oder multilokulär auf. Es sind alle <strong>Leber</strong>zelltypen vorhanden,<br />
aber in zum Teil veränderter Form. Diese trifft vor allem auf die Gallengänge zu, sodass<br />
der Galleabfluss behindert ist. In der FDS <strong>und</strong> CEUS (s. Abb. 8) zeigt sich eine ausgeprägte<br />
arterielle Phase, auch in der Spätphase verbleibt die Läsion meist hyperreflexiv<br />
(Abb. 10).<br />
P Ein <strong>Leber</strong>adenom wächst<br />
meist Hormon-abhängig.<br />
P FNH: prominente Gefäße,<br />
Narbenstern<br />
Sind diese Bef<strong>und</strong>e vorhanden, kann auf eine Biopsie verzichtet werden. Im Gegensatz<br />
zur früheren Ansicht muss heute nicht unbedingt bei Diagnosestellung einer<br />
FNH auf orale Antikonzeptiva verzichtet werden [9].<br />
Abb. 10<br />
FNH ca. 30 sec nach Injektion<br />
eines Echokontrastverstärkers<br />
in der CEUS.<br />
Die Läsion ist bereits hyperreflexiv,<br />
während das<br />
Parenchym der Umgebung<br />
noch echoarm erscheint.<br />
21
Maligne Tumoren<br />
Metastasen stellen die häufigsten bösartigen Herdbef<strong>und</strong>e der <strong>Leber</strong> dar. Sie haben<br />
keine Pfortaderdurchblutung <strong>und</strong> keine Sinusoide. Deshalb sind sie in der Parenchymphase<br />
oft als ausgestanzte Löcher zu sehen (s. Abb. 8), da das Kontrastmittel bereits<br />
abgeflossen ist [12, 13, 17]. Hier sind manchmal Herde mit einem Durchmesser von<br />
unter 5 mm darstellbar, was das therapeutische Vorgehen bei Tumoren entscheidend<br />
beeinflusst. In der arteriellen Phase zeigen Metastasen ein peripheres oder zentrales<br />
Enhancement. Unter Chemotherapie oder nach ablativen Verfahren kann das Fehlen<br />
dieser Durchblutung als Therapieerfolg gewertet werden. In der DEGUM-Multicenterstudie<br />
<strong>und</strong> in der französischen Multicenterstudie [12, 13] erwies sich CEUS als den<br />
anderen Verfahren wie der CT <strong>und</strong> der Magnetresonanztomografie (MRT) zumindest<br />
ebenbürtig. Die besondere Qualität der DEGUM-Studie besteht in der histologischen<br />
Sicherung von 1006 der 1349 untersuchten Läsionen [12]. Es konnte eine Sensitivität<br />
von 95,8% <strong>und</strong> eine Spezifität von 83,1% für alle Läsionen erreicht werden. Die Werte<br />
für Läsionen eines Durchmessers von über 2 cm lagen bei 96,5% bzw. 86%, für Läsionen<br />
unter 2 cm bei 93,3% bzw. 75,9% [12]. Frühere Studien haben gezeigt, dass sich<br />
bei zugr<strong>und</strong>e liegender maligner Erkrankung die CEUS auch zur Detektion von in der<br />
Nativsonografie okkulten Metastasen eignet. Zeigen Metastasen früharteriell ein starkes<br />
Enhancement, sollte an einen neuroendokrinen Tumor gedacht werden (s. Titelbild<br />
a <strong>und</strong> b). Hilfreich ist hier auch die Bestimmung des Tumormarkers „Chromogranin<br />
A“.<br />
Das hepatozelluläre Karzinom (HCC) entsteht in unseren Breiten in 80% der Fälle<br />
auf dem Boden einer Zirrhose. Gr<strong>und</strong>sätzlich stellte jede Form einer Zirrhose einen<br />
Risikofaktor für ein HCC dar. Bei einem Herd in einer Zirrhose <strong>und</strong> einem Alpha-1-Fetoprotein<br />
von mehr als 400 ng/ml ist die Diagnose „HCC“ gesichert. Eine Biopsie ist<br />
nur bei therapeutischen Konsequenzen gerechtfertigt [14]. Bei wenigen <strong>und</strong> kleinen<br />
Herden kann die perkutane Ethanolinjektion (PEI) oder Thermo- oder Kryoablation<br />
mit verschiedenen Techniken sinnvoll sein, die meist sonografiegesteuert erfolgen.<br />
Typisch sind echokomplexe Herde in einer Zirrhose, auch als Mosaikmuster bezeichnet<br />
(Abb. 11).<br />
P <strong>Leber</strong>metastasen: keine Perfusion<br />
in der Parenchymphase<br />
P HCC: meist bei Zirrhose, das<br />
„Mosaikzeichen“ kann weiterhelfen.<br />
Abb. 11<br />
Großes HCC bei einer<br />
Zirrhose durch Hepatitis B.<br />
Die Läsion zeigt sich echokomplex<br />
(Mosaikmuster).<br />
Bei fortgeschrittenen <strong>und</strong> schlecht differenzierten Karzinomen zeigt sich in der CEUS<br />
eine Aussparung in der Parenchymphase. Bei kleineren HCC in einer Zirrhose ist das<br />
Kontrastmittelverhalten aber nicht immer zuverlässig. Die Abgrenzung zu einem Regeneratknoten<br />
ist dann nur über die Biopsie möglich, aber auch hier histologisch<br />
schwierig. Bei einer Autopsie wird in 70–90% der Fälle ein Tumorthrombus in die<br />
Pfortader gef<strong>und</strong>en. Wegen der verschiedenen Therapieoptionen, jetzt auch medikamentös,<br />
ist ein differenzierter Diagnosealgorithmus erforderlich (Abb. 12).<br />
22
AFP normal<br />
US, AFP alle 6 Monate<br />
Abb. 12<br />
AFP hoch Spiral-CT US, AFP alle 6 Monate<br />
nein<br />
Fokale<br />
Läsion<br />
Sonografie <strong>und</strong> AFP<br />
alle 6 Monate<br />
Child-Pugh A<br />
Kein HCC<br />
US, AFP alle 6 Monate<br />
ja<br />
Herd < 1 cm<br />
US alle 3 Monate<br />
HCC<br />
Herd > 2 cm<br />
AFP > 400 ng/ml, CT, MRT<br />
HCC<br />
Herd > 1 cm<br />
Herd 2 cm Biopsie HCC<br />
Vorgehen bei auf HCC-verdächtigten Herden der <strong>Leber</strong>.<br />
Das cholangiozelluläre Karzinom (CCC) kann als Klatskintyp mit luminaler Okklusion<br />
der Gallengänge oder als peripherer Typ in Form einer uncharakteristischen fokalen<br />
Läsion imponieren.<br />
Abszesse<br />
<strong>Leber</strong>abszesse sind Eiteransammlungen, die hämatogen über die Pfortader oder Arterie,<br />
biliär, perkutan iatrogen oder traumatisch oder infiltrierend entstanden sein<br />
können. Frische Abszesse sind echoarm, wenn das nekrotische Gewebe sich noch<br />
nicht verflüssigt hat. Nach kurzer Zeit bildet sich ein peripherer Reaktionssaum, der<br />
Kontrastmittel aufnimmt. Das Zentrum des Abzesses kann feine Schwebeteilchen zeigen<br />
(Amöbenabszess) oder aber auch grobe Reflexe durch Lufteinschlüsse, Verkalkungen<br />
oder Septen. In der CEUS bleibt das nekrotische Zentrum stets ausgespart.<br />
Der Echinococcus cysticus oder granulosus kann – abhängig von den Stadien –<br />
mit hoher Sicherheit sonografisch diagnostiziert werden. Bestätigt wird die Diagnose<br />
durch die Serologie. Auch die kurative Therapie kann in erfahrenen Händen sonografisch<br />
gesteuert durch eine Aspiration <strong>und</strong> Alkoholinstillation (PAIR) erfolgen. Die WHO<br />
hat eine sonografische Klassifikation vorgestellt [6].<br />
P Echinococcus: sichere Diagnose<br />
durch Ultraschall <strong>und</strong> Serologie,<br />
Aspiration <strong>und</strong> Alkoholinstillation<br />
zur Therapie.<br />
Sonografisch gesteuerte Diagnostik <strong>und</strong> Therapie<br />
Auch bei diffusen Erkrankungen sollte die Punktion sonografiegesteuert erfolgen. <strong>Leber</strong>herde<br />
können in der Regel ab einer Größe von 1 cm punktiert werden. Ernstere<br />
Komplikationen nach ultraschallgezielter Punktion von <strong>Leber</strong>herden sind selten. Die<br />
Letalität beträgt 0,08%. Komplikationen wie Blutung, eine gallige Peritonitis, eine Verschleppung<br />
von Tumorzellen, Hämatome oder eine Peritonitis anderer Ursache wurden<br />
bei 0,5% aller Punktionen beschrieben. Die Gesamtrate aller, auch der leichten<br />
Komplikationen, beträgt 5%. Eine Verschleppung von Tumorzellen in den Stichkanal<br />
kommt nur selten vor (0,05%) <strong>und</strong> führt nicht zu einer Verkürzung der Lebensdauer<br />
des Patienten. Tabelle 3 zeigt therapeutische Verfahren, die heute sonografiegesteuert<br />
durchgeführt werden.<br />
Sonografiegesteuerte therapeutische Verfahren<br />
Tab. 3<br />
• Radiofrequenzthermoablation (HCC, Metastasen)<br />
• Kryoablation<br />
• Abzessdrainage, Verödung<br />
• Perkutane Gallengangsdrainage<br />
• Endosonografisch gesteuerte Gallengangsdrainage<br />
• Steuerung <strong>und</strong> Verlaufskontrolle bei TIPS<br />
23
Zu empfehlende Literatur<br />
Literatur<br />
1 Ochs A, Rottler RM, Schölmerich J.<br />
Clinical relevance of abnormal liver findings with ultraso<strong>und</strong>.<br />
Hepatogastroenterology 1994; 41: 9–15.<br />
2 Ochs A.<br />
<strong>Leber</strong>herdbef<strong>und</strong>e <strong>und</strong> <strong>Leber</strong>gefäßveränderungen.<br />
In: Sonographie – Schritt für Schritt zur Diagnose. M. Gross (Hrsg.).<br />
Elsevier, München; Urban & Fischer. 1. Auflage 2007, 106–133.<br />
3 Ochs A.<br />
Sonografie der <strong>Leber</strong>.<br />
<strong>Falk</strong> Fo<strong>und</strong>ation e.V. (Hrsg.) 20. komplett aktualisierte Auflage 2008.<br />
4 Dietrich CF, Lee JH, Herrmann G, Teuber G, Roth WK, Caspary WF, Zeuzem S.<br />
Enlargement of perihepatic lymph nodes in relation to liver histology and viremia<br />
in patients with chronic hepatitis C.<br />
Hepatology 1997; 26: 467–472.<br />
5 Caselitz M, Bahr MJ, Bleck JS, Chavan A, Manns MP, Wagner S, Gebel M.<br />
Sonographic criteria for the diagnosis of hepatic involvement in hereditary<br />
hemorrhagic telangiectasia (HHT).<br />
Hepatology 2003; 37: 1139–1146.<br />
6 Richter J, Hatz C, Häussinger D.<br />
Ultraso<strong>und</strong> in tropical and parasitic diseases.<br />
Lancet 2003; 362: 900–902.<br />
7 Friedrich-Rust M, Zeuzem S.<br />
Nicht invasive Beurteilung des <strong>Leber</strong>fibrosestadiums mit der transienten<br />
Elastografie (FibroScan): Aktueller Stand <strong>und</strong> Perspektiven.<br />
Z <strong>Gastro</strong>enterol 2007; 45: 387–394.<br />
8 Haag K, Rössle M, Ochs A, Huber M, Siegerstetter V, Olschewski M, Berger E,<br />
Lu S, Blum HE.<br />
Correlation of duplex sonography findings and portal pressure in 375 patients<br />
with portal hypertension.<br />
Am J Roentgenol 1999; 172: 631–635.<br />
9 Mathieu D, Kobeiter H, Maison P, Rahmouni A, Cherqui D, Zafrani ES, Dhumeaux D.<br />
Oral contraceptive use and focal nodular hyperplasia of the liver.<br />
<strong>Gastro</strong>enterology 2000; 118: 560–564.<br />
10 Menon KV, Shah V, Kamath PS.<br />
The Budd-Chiari syndrome.<br />
N Engl J Med 2004; 350: 578–585.<br />
11 Dietrich CF, Mertens JC, Braden B, Schuessler G, Ott M, Ignee A.<br />
Contrast-enhanced ultraso<strong>und</strong> of histologically proven liver hemangiomas.<br />
Hepatology 2007; 45: 1139–1145.<br />
12 Strobel D, Seitz K, Blank W, Schuler A, Dietrich C, von Herbay A, Friedrich-Rust M,<br />
Kunze G, Becker D, Will U, Kratzer W, Albert FW, Pachmann C, Dirks K, Strunk H,<br />
Greis C, Bernatik T.<br />
Contrast-enhanced ultraso<strong>und</strong> for the characterization of focal liver lesions –<br />
Diagnostic accuracy in clinical practice (DEGUM multicenter trial).<br />
Ultraschall Med 2008; 29: 499–505.<br />
24
13 Tranquart F, Correas JM, Ladam Marcus V, Manzoni P, Vilgrain V, Aube C, Elmaleh A,<br />
Chami L, Claudon M, Cuilleron M, Diris B, Garibaldi F, Lucidarme O, Marion D,<br />
Beziat C, Rode A, Tasu JP, Trillaud H, Bleuzen A, Le Gouge A, Giraudeau B, Rusch E.<br />
[Real-time contrast-enhanced ultraso<strong>und</strong> in the evaluation of focal liver lesions:<br />
diagnostic efficacy and economical issues from a French multicentric study]<br />
[Artikel in Französisch].<br />
J Radiol 2009; 90: 109–122.<br />
Literatur<br />
14 Allgaier HP, Blum U, Deibert P, Spangenberg HC, Blum HE.<br />
Diagnostik des hepatozellulären Karzinoms.<br />
Schweiz Med Wochenschr 1996; 126: 1975–1983.<br />
15 Takayasu K, Okuda K.<br />
Imaging in Liver Disease. From Diagnosis to Treatment.<br />
Oxford University Press, Oxford, New York, Tokyo, 1st edition 1997.<br />
16 Vizzutti F, Arena U, Romanelli RG, Rega L, Foschi M, Colagrande S, Petrarca A,<br />
Moscarella S, Belli G, Zignego AL, Marra F, Laffi G, Pinzani M.<br />
Liver stiffness measurement predicts severe portal hypertension in patients with<br />
HCV-related cirrhosis.<br />
Hepatology 2007; 45: 1290–1297.<br />
17 Wermke W, Gaßmann B.<br />
Tumordiagnostik der <strong>Leber</strong> mit Echosignalverstärker – Farbatlas. Springer-Verlag<br />
Berlin, Heidelberg, New York, 1998.<br />
25
Fragen zur Sonografie der <strong>Leber</strong><br />
Frage 1:<br />
Das Hämangiom zeigt im kontrastverstärkten Ultraschall<br />
typischerweise<br />
w Ein globuläres Ringenhancement <strong>und</strong> das Irisblendenphänomen<br />
w Ein Auswaschen in der Parenchymphase<br />
w Eine fehlende Kontrastmittelaufnahme<br />
w Ausgeprägte arterielle Gefäße in der Läsion<br />
w Signale erst ab einem Durchmesser von über 5 cm<br />
Frage 2:<br />
Die Farb-Doppler-Sonografie ist nützlich<br />
w In der Detektion des Budd-Chiari-Syndroms<br />
w Bei der Suche nach Kollateralen<br />
w Zur Verlaufskontrolle nach einer <strong>Leber</strong>transplantation<br />
w Zur Nachkontrolle nach einer <strong>Leber</strong>punktion<br />
w Bei allen oben genannten Punkten<br />
Frage 3:<br />
Die Sonografie der <strong>Leber</strong> bei chronischer Hepatitis C<br />
w Ist zur Bestimmung des Entzündungsausmaßes geeignet<br />
w Ersetzt die Bestimmung der Transaminasen <strong>und</strong> der Viruslast<br />
w Sollte zur Verlaufskontrolle Lymphknoten im Ligamentum hepatoduodenale<br />
erfassen<br />
w Ist sinnlos beim Screening auf ein hepatozelluläres Karzinom<br />
w Ersetzt die Punktion bei Verdacht auf eine frühe Fibrose<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Leber</strong> <strong>und</strong><br />
<strong>Gallenwege</strong><br />
Bitte beachten Sie:<br />
Bei der Beantwortung der Fragen<br />
ist immer nur 1 Antwort möglich.<br />
Die Beantwortung der Fragen <strong>und</strong><br />
Erlangung des Fortbildungszertifikats<br />
ist nur online möglich.<br />
Bitte gehen Sie dazu auf unsere Homepage<br />
www.falkfo<strong>und</strong>ation.de.<br />
Unter dem Menüpunkt <strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
können Sie sich anmelden <strong>und</strong> die Fragen<br />
beantworten.<br />
Bitte diesen Fragebogen nicht<br />
per Post oder Fax schicken!<br />
Frage 4:<br />
Welche Aussage zur fokal nodulären Hyperplasie (FNH) ist richtig?<br />
w Eine Biopsie ist immer erforderlich<br />
w Beim Nachweis muss eine Resektion erfolgen<br />
w Die FNH kann durch Laborwerte ausgeschlossen werden<br />
w Die FNH erfordert bei eindeutigen Bef<strong>und</strong>en in der kontrastverstärkten Sonografie<br />
keine weiteren Maßnahmen<br />
w Kontrazeptiva müssen beim Nachweis einer FNH auf jeden Fall abgesetzt werden<br />
Frage 5:<br />
Welche Aussage zum Budd-Chiari-Syndrom (BCS) ist richtig?<br />
w Es handelt sich um einen Verschluss größerer <strong>Leber</strong>venen<br />
w Die Bildung von Aszites ist eine Rarität<br />
w Die Diagnose kann nur durch eine Laparoskopie gestellt werden<br />
w Ein BCS heilt in der Regel spontan <strong>und</strong> folgenlos aus<br />
w Das BCS ist eine typische Erkrankung des Kindesalters<br />
Wichtig:<br />
Fragebeantwortung unter<br />
www.falkfo<strong>und</strong>ation.de<br />
<strong>Falk</strong> <strong>Gastro</strong>-<strong>Kolleg</strong><br />
26
Frage 6:<br />
Das hepatozelluläre Karzinom (HCC) zeigt in der Sonografie<br />
w Stets eine homogene Binnenstruktur<br />
w Eindeutige morphologische Kriterien, die eine Biopsie entbehrlich machen<br />
w Veränderungen, die auf die Höhe des Alpha-1-Fetoproteins schließen lassen<br />
w Pathognomonische Veränderungen, wenn das sogenannte Mosaikzeichen<br />
<strong>und</strong> ein Einbruch in einen Pfortaderast sichtbar sind<br />
w Kontrastverstärkt keinerlei „Anfärbung“<br />
<strong>Falk</strong><br />
<strong>Gastro</strong>-<strong>Kolleg</strong><br />
<strong>Leber</strong> <strong>und</strong><br />
<strong>Gallenwege</strong><br />
Frage 7:<br />
Für die Fettleber ist korrekt:<br />
w Sie zeigt sich sonografisch als „weiße“ <strong>Leber</strong><br />
w Zonale Minderverfettungen in einer Fettleber weisen auf einen hohen<br />
Verfettungsgrad hin<br />
w Die mikrovesikuläre Verfettung ist sonografisch meist nicht zu erfassen<br />
w Die entzündliche Komponente bei NASH ist sonografisch nicht erfassbar<br />
w Alle oben genannten Antworten sind richtig<br />
Frage 8:<br />
Welcher Parameter erlaubt nicht die Diagnose einer Zirrhose?<br />
w Nachweis von Aszites<br />
w Splenomegalie<br />
w Lymphknotenvergrößerung im Ligamentum hepatoduodenale<br />
w Monophasischer Fluss in den <strong>Leber</strong>venen<br />
w Wiedereröffnete Umbilikalvene<br />
Frage 9:<br />
Was trifft für das <strong>Leber</strong>adenom zu?<br />
w Es zeigt eine eindeutige Sonomorphologie<br />
w Es sind bei Verdacht keine Biopsie <strong>und</strong> keine Therapie erforderlich<br />
w Das <strong>Leber</strong>adenom kann in der CEUS für Sek<strong>und</strong>en früharteriell sichtbar werden<br />
w Hormone spielen keine Rolle<br />
w Der zentrale „Narbenstern“ ist in der FDS perf<strong>und</strong>iert<br />
Frage 10:<br />
Welche Aussage zum Echinococcus cysticus ist richtig?<br />
w Echinococcus cysticus kann in entsprechenden Stadien durch Alkoholinstillation<br />
(PAIR) kurativ behandelt werden<br />
w Eine Punktion führt regelhaft zu einem anaphylaktischen Schock<br />
w Die Diagnose erfolgt ausschließlich chirurgisch<br />
w Die Serologie ist unzuverlässig<br />
w Nierenzysten sind bei <strong>Leber</strong>befall obligat<br />
27