4.3.2.1: 1-Phenylpentan-1-ol
4.3.2.1: 1-Phenylpentan-1-ol
4.3.2.1: 1-Phenylpentan-1-ol
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
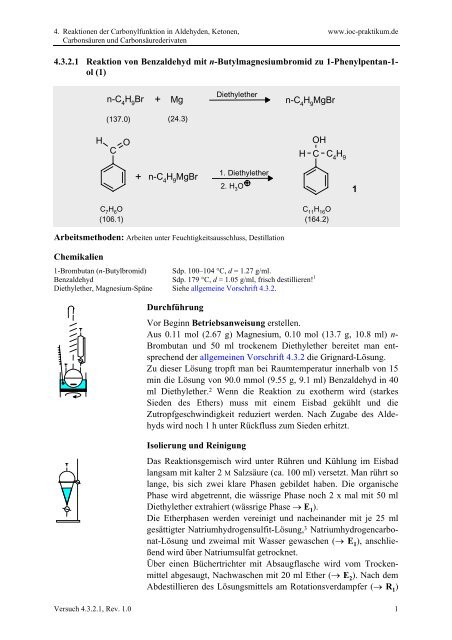
<strong>4.3.2.1</strong> Reaktion von Benzaldehyd mit n-Butylmagnesiumbromid zu 1-<strong>Phenylpentan</strong>-1-<br />
<strong>ol</strong> (1)<br />
n-C 4<br />
H 9<br />
Br<br />
+<br />
Mg<br />
Diethylether<br />
n-C 4<br />
H 9<br />
MgBr<br />
(137.0) (24.3)<br />
H<br />
C O<br />
H<br />
OH<br />
C C 4<br />
H 9<br />
+<br />
n-C 4<br />
H 9<br />
MgBr<br />
1. Diethylether<br />
2. H 3<br />
O<br />
1<br />
C 7<br />
H 6<br />
O<br />
(106.1)<br />
C 11<br />
H 16<br />
O<br />
(164.2)<br />
Arbeitsmethoden: Arbeiten unter Feuchtigkeitsausschluss, Destillation<br />
Chemikalien<br />
1-Brombutan (n-Butylbromid) Sdp. 100–104 °C, d = 1.27 g/ml.<br />
Benzaldehyd Sdp. 179 °C, d = 1.05 g/ml, frisch destillieren! 1<br />
Diethylether, Magnesium-Späne Siehe allgemeine Vorschrift 4.3.2.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
Aus 0.11 m<strong>ol</strong> (2.67 g) Magnesium, 0.10 m<strong>ol</strong> (13.7 g, 10.8 ml) n-<br />
Brombutan und 50 ml trockenem Diethylether bereitet man entsprechend<br />
der allgemeinen Vorschrift 4.3.2 die Grignard-Lösung.<br />
Zu dieser Lösung tropft man bei Raumtemperatur innerhalb von 15<br />
min die Lösung von 90.0 mm<strong>ol</strong> (9.55 g, 9.1 ml) Benzaldehyd in 40<br />
ml Diethylether. 2 Wenn die Reaktion zu exotherm wird (starkes<br />
Sieden des Ethers) muss mit einem Eisbad gekühlt und die<br />
Zutropfgeschwindigkeit reduziert werden. Nach Zugabe des Aldehyds<br />
wird noch 1 h unter Rückfluss zum Sieden erhitzt.<br />
Is<strong>ol</strong>ierung und Reinigung<br />
Das Reaktionsgemisch wird unter Rühren und Kühlung im Eisbad<br />
langsam mit kalter 2 M Salzsäure (ca. 100 ml) versetzt. Man rührt so<br />
lange, bis sich zwei klare Phasen gebildet haben. Die organische<br />
Phase wird abgetrennt, die wässrige Phase noch 2 x mal mit 50 ml<br />
Diethylether extrahiert (wässrige Phase → E 1 ).<br />
Die Etherphasen werden vereinigt und nacheinander mit je 25 ml<br />
gesättigter Natriumhydrogensulfit-Lösung, 3 Natriumhydrogencarbonat-Lösung<br />
und zweimal mit Wasser gewaschen (→ E 1 ), anschließend<br />
wird über Natriumsulfat getrocknet.<br />
Über einen Büchertrichter mit Absaugflasche wird vom Trockenmittel<br />
abgesaugt, Nachwaschen mit 20 ml Ether (→ E 2 ). Nach dem<br />
Abdestillieren des Lösungsmittels am Rotationsverdampfer (→ R 1 )<br />
Versuch <strong>4.3.2.1</strong>, Rev. 1.0 1
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
wird der Rückstand bei vermindertem Druck in einer kleinen<br />
Destillationsapparatur mit Spinne und tarierten Kölbchen fraktionierend<br />
destilliert, Destillationsprotok<strong>ol</strong>l! Fraktionen mit gleichem<br />
Brechungsindex werden vereinigt (→ E 3 ). Man bestimme die<br />
Ausbeute an Reinprodukt (g, %). Ausbeute an 1: 50–60 %, Sdp. 97–<br />
99 °C/0.1 hPa.<br />
1 Benzaldehyd, der einige Zeit gestanden hat, enthält Benzoesäure. Warum?<br />
Chargen, die längere Zeit gestanden haben, müssen frisch destilliert werden.<br />
2 Was ist bei der Zugabe zu beobachten?<br />
3 Wann kann auf das Waschen mit Natriumhydrogensulfit-Lösung verzichtet<br />
werden?<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 :<br />
E 2 :<br />
E 3 :<br />
R 1 :<br />
Die wässrigen Phasen werden zusammengegeben und neutralisiert → Entsorgung (H 2 O mit RHal/Halogenid).<br />
Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton aufnehmen → Entsorgung (RH).<br />
Abdestilliertes Lösungsmittel → Recycling (Diethylether).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 1 (300 MHz, CDCl 3 ): δ = 0.91 (3 H), 1.19–1.48 (4 H), 1.64–1.87 (2 H), 1.21 (1 H),<br />
4.64 (1 H), 7.23–7.39 (5 H).<br />
8.0 7.0<br />
6.0<br />
5.0<br />
4.0<br />
3.0 2.0 1.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 1 (75.5 MHz, CDCl 3 ): δ = 14.05 (CH 3 ), 22.65 (CH 2 ), 28.02 (CH 2 ), 50.63 (CH 2 ), 74.67<br />
(CH), 125.96 (CH), 127.46 (CH), 128.42 (CH), 145.02 (C).<br />
LM<br />
150 140 130 120 110 100 90 80 70 60 50 40 30 20 [ppm] 0<br />
Versuch <strong>4.3.2.1</strong>, Rev. 1.0 2
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
IR-Spektrum von 1 (Film):<br />
100<br />
T [%]<br />
50<br />
3385<br />
2870<br />
2960<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 1 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
C 4<br />
H 9<br />
C 4<br />
H 9<br />
H 2<br />
COH H C O C H<br />
HC CHC 3<br />
H 7<br />
A B C<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Siehe Einführung zu 4.3.2. Die Umsetzung von Aldehyden mit Grignardverbindungen zu sekundären Alkoh<strong>ol</strong>en<br />
ist universell, sowohl aliphatische wie aromatische und heterocyclische Aldehyde können umgesetzt werden. Mit<br />
Formaldehyd entstehen primäre Alkoh<strong>ol</strong>e.<br />
Versuch <strong>4.3.2.1</strong>, Rev. 1.0 3