5.6.3
5.6.3
5.6.3
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
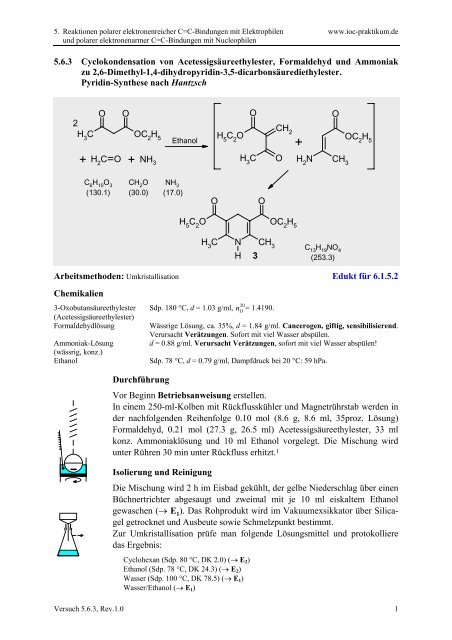
<strong>5.6.3</strong> Cyclokondensation von Acetessigsäureethylester, Formaldehyd und Ammoniak<br />
zu 2,6-Dimethyl-1,4-dihydropyridin-3,5-dicarbonsäurediethylester.<br />
Pyridin-Synthese nach Hantzsch<br />
O O<br />
2<br />
H 3<br />
C OC 2<br />
H 5<br />
+<br />
+<br />
Ethanol<br />
H 5<br />
C 2<br />
O<br />
H 2<br />
C O NH 3<br />
H 3<br />
C O<br />
O<br />
CH 2<br />
+<br />
O<br />
H 2<br />
N CH 3<br />
OC 2<br />
H 5<br />
C 6<br />
H 10<br />
O 3<br />
(130.1)<br />
CH 2<br />
O<br />
(30.0)<br />
NH 3<br />
(17.0)<br />
O<br />
O<br />
H 5<br />
C 2<br />
O<br />
OC 2<br />
H 5<br />
H 3<br />
C N CH 3<br />
H 3<br />
C 13<br />
H 19<br />
NO 4<br />
(253.3)<br />
Arbeitsmethoden: Umkristallisation Edukt für 6.1.5.2<br />
Chemikalien<br />
3-Oxobutansäureethylester Sdp. 180 °C, d = 1.03 g/ml, n 20 D<br />
= 1.4190.<br />
(Acetessigsäureethylester)<br />
Formaldehydlösung Wässrige Lösung, ca. 35%, d = 1.84 g/ml. Cancerogen, giftig, sensibilisierend.<br />
Verursacht Verätzungen. Sofort mit viel Wasser abspülen.<br />
Ammoniak-Lösung d = 0.88 g/ml. Verursacht Verätzungen, sofort mit viel Wasser abspülen!<br />
(wässrig, konz.)<br />
Ethanol<br />
Sdp. 78 °C, d = 0.79 g/ml, Dampfdruck bei 20 °C: 59 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250-ml-Kolben mit Rückflusskühler und Magnetrührstab werden in<br />
der nachfolgenden Reihenfolge 0.10 mol (8.6 g, 8.6 ml, 35proz. Lösung)<br />
Formaldehyd, 0.21 mol (27.3 g, 26.5 ml) Acetessigsäureethylester, 33 ml<br />
konz. Ammoniaklösung und 10 ml Ethanol vorgelegt. Die Mischung wird<br />
unter Rühren 30 min unter Rückfluss erhitzt. 1<br />
Isolierung und Reinigung<br />
Die Mischung wird 2 h im Eisbad gekühlt, der gelbe Niederschlag über einen<br />
Büchnertrichter abgesaugt und zweimal mit je 10 ml eiskaltem Ethanol<br />
gewaschen (→ E 1 ). Das Rohprodukt wird im Vakuumexsikkator über Silicagel<br />
getrocknet und Ausbeute sowie Schmelzpunkt bestimmt.<br />
Zur Umkristallisation prüfe man folgende Lösungsmittel und protokolliere<br />
das Ergebnis:<br />
Cyclohexan (Sdp. 80 °C, DK 2.0) (→ E 2 )<br />
Ethanol (Sdp. 78 °C, DK 24.3) (→ E 2 )<br />
Wasser (Sdp. 100 °C, DK 78.5) (→ E 1 )<br />
Wasser/Ethanol (→ E 1 )<br />
Versuch <strong>5.6.3</strong>, Rev.1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Das Rohprodukt 3 wird aus Ethanol umkristallisiert (→ E 2 ), Ausbeute und<br />
Schmelzpunkt sind zu bestimmen. Ausbeute an 3: 50–60%, Schmp. 184–185<br />
°C.<br />
1 Was ist zu beobachten?<br />
Hinweise zur Entsorgung (E)<br />
E 1 : Wässrige Lösung mit organischen Verunreinigungen → Entsorgung (H 2 O mit RH).<br />
E 2 : Wasserfreie Mutterlaugen → Entsorgung (RH).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 3 (300 MHz, CDCl 3 ): δ = 1.28 (6 H), 2.18 (6 H), 3.25 (4 H), 4.16 (4 H), 5.22 (1 H).<br />
1258.3 Hz<br />
1251.2 Hz<br />
1244.0 Hz<br />
1236.9 Hz<br />
389.8 Hz<br />
382.7 Hz<br />
375.6 Hz<br />
6.0 5.0 4.0 3.0<br />
2.0 1.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 3 (75.5 MHz, CDCl 3 ): δ = 14.50 (CH 3 ), 19.23 (CH 3 ), 24.78 (CH 2 ), 59.69 (CH 2 ), 99.50<br />
(C), 144.84 (C), 168.10 (C).<br />
180<br />
160<br />
140<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
Versuch <strong>5.6.3</strong>, Rev.1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
IR-Spektrum von 3 (KBr):<br />
100<br />
T [%]<br />
50<br />
2865<br />
2900<br />
2940<br />
2990<br />
1690<br />
1500<br />
3350<br />
1655<br />
1630<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
* Formulieren Sie den zu 3 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
O O<br />
O O<br />
O O<br />
H 5<br />
C 2<br />
O<br />
H<br />
OC 2<br />
H 2<br />
N<br />
NH 2<br />
5<br />
H 5<br />
C 2<br />
O<br />
OC 2<br />
H 5<br />
H 3<br />
C<br />
CH H C N<br />
O O 3<br />
3<br />
CH<br />
H<br />
3 H 3<br />
C N CH 3<br />
A O O B C<br />
O<br />
N<br />
H 5<br />
C 2<br />
O<br />
OC 2<br />
H 5<br />
OC 2<br />
H 5<br />
N<br />
H 3<br />
C N CH<br />
H<br />
3 H 2<br />
N CH<br />
N<br />
3<br />
D E F<br />
* Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–F ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A/B und C/D?<br />
Was ist F?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
An Stelle von Formaldehyd können andere aliphtische und aromatische Aldehyde eingesetzt werden. [1–3] Das<br />
1,4-Dihydropyridin wird mit NO/NO 2 oder besser mit Ce(IV) zum Pyridin dehydriert. In Versuch 6.1.5.2 wird<br />
diese Dehydrierung durchgeführt. Literatur, auf der dieser Versuch beruht: [4].<br />
[1] A. Hantzsch, Liebigs Ann. 1882, 215, 1–82.<br />
[2] A.P. Phillips, J. Am. Chem. Soc. 1949, 71, 4003–4007.<br />
[3] J. Svĕtsik, F. Tureček, V. Hanuš, J. Chem. Soc. Perkin Trans. I, 1987, 563–566.<br />
[4] B. E. Norcoss, G. Clement, M. Weinstein, J. Chem. Educ. 1969, 46, 694–695.<br />
N<br />
Versuch <strong>5.6.3</strong>, Rev.1.0 3