5.4.2: 2-Phenyl-1,1-ethylendicarbonsäurediethylester
5.4.2: 2-Phenyl-1,1-ethylendicarbonsäurediethylester
5.4.2: 2-Phenyl-1,1-ethylendicarbonsäurediethylester
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
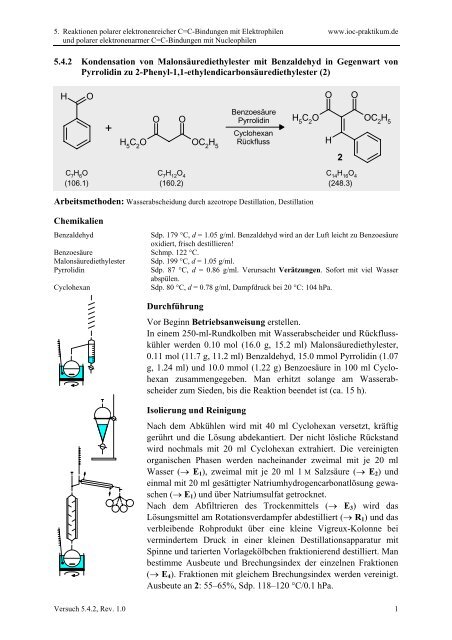
<strong>5.4.2</strong> Kondensation von Malonsäurediethylester mit Benzaldehyd in Gegenwart von<br />
Pyrrolidin zu 2-<strong>Phenyl</strong>-1,1-ethylendicarbonsäurediethylester (2)<br />
H<br />
O<br />
C 7<br />
H 6<br />
O<br />
(106.1)<br />
+<br />
O O<br />
Pyrrolidin H 5<br />
C 2<br />
O OC 2<br />
H 5<br />
H 5<br />
C 2<br />
O OC 2<br />
H 5<br />
C 7<br />
H 12<br />
O 4<br />
(160.2)<br />
Benzoesäure<br />
Cyclohexan<br />
Rückfluss<br />
O<br />
H<br />
2<br />
O<br />
C 14<br />
H 16<br />
O 4<br />
(248.3)<br />
Arbeitsmethoden: Wasserabscheidung durch azeotrope Destillation, Destillation<br />
Chemikalien<br />
Benzaldehyd<br />
Benzoesäure<br />
Malonsäurediethylester<br />
Pyrrolidin<br />
Cyclohexan<br />
Sdp. 179 °C, d = 1.05 g/ml. Benzaldehyd wird an der Luft leicht zu Benzoesäure<br />
oxidiert, frisch destillieren!<br />
Schmp. 122 °C.<br />
Sdp. 199 °C, d = 1.05 g/ml.<br />
Sdp. 87 °C, d = 0.86 g/ml. Verursacht Verätzungen. Sofort mit viel Wasser<br />
abspülen.<br />
Sdp. 80 °C, d = 0.78 g/ml, Dampfdruck bei 20 °C: 104 hPa.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einem 250-ml-Rundkolben mit Wasserabscheider und Rückflusskühler<br />
werden 0.10 mol (16.0 g, 15.2 ml) Malonsäurediethylester,<br />
0.11 mol (11.7 g, 11.2 ml) Benzaldehyd, 15.0 mmol Pyrrolidin (1.07<br />
g, 1.24 ml) und 10.0 mmol (1.22 g) Benzoesäure in 100 ml Cyclohexan<br />
zusammengegeben. Man erhitzt solange am Wasserabscheider<br />
zum Sieden, bis die Reaktion beendet ist (ca. 15 h).<br />
Isolierung und Reinigung<br />
Nach dem Abkühlen wird mit 40 ml Cyclohexan versetzt, kräftig<br />
gerührt und die Lösung abdekantiert. Der nicht lösliche Rückstand<br />
wird nochmals mit 20 ml Cyclohexan extrahiert. Die vereinigten<br />
organischen Phasen werden nacheinander zweimal mit je 20 ml<br />
Wasser (→ E 1 ), zweimal mit je 20 ml 1 M Salzsäure (→ E 2 ) und<br />
einmal mit 20 ml gesättigter Natriumhydrogencarbonatlösung gewaschen<br />
(→ E 1 ) und über Natriumsulfat getrocknet.<br />
Nach dem Abfiltrieren des Trockenmittels (→ E 3 ) wird das<br />
Lösungsmittel am Rotationsverdampfer abdestilliert (→ R 1 ) und das<br />
verbleibende Rohprodukt über eine kleine Vigreux-Kolonne bei<br />
vermindertem Druck in einer kleinen Destillationsapparatur mit<br />
Spinne und tarierten Vorlagekölbchen fraktionierend destilliert. Man<br />
bestimme Ausbeute und Brechungsindex der einzelnen Fraktionen<br />
(→ E 4 ). Fraktionen mit gleichem Brechungsindex werden vereinigt.<br />
Ausbeute an 2: 55–65%, Sdp. 118–120 °C/0.1 hPa.<br />
Versuch <strong>5.4.2</strong>, Rev. 1.0 1
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
Hinweise zur Entsorgung (E), Recycling (R) der Lösungsmittel<br />
E 1 : Wässrige Phase mit organischen Verunreinigungen → Entsorgung (H 2 O mit RH).<br />
E 2 : Wässrige halogenhaltige Phase mit organischen Verunreinigungen → Entsorgung (H 2 O mit RHal/<br />
Halogenid).<br />
E 3 : Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 4 : Destillationsrückstand und verunreinigte Fraktionen in wenig Aceton aufnehmen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Recycling (Cyclohexan).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 2 (300 MHz, CDCl 3 ): δ = 1.26 (3 H), 1.31 (3 H), 4.29 (2 H), 4.33 (2 H), 7.30–7.39 (3<br />
H), 7.39–7.47 (2 H), 7.72 (1 H).<br />
1306.6 Hz<br />
1299.5 Hz<br />
1296.2 Hz<br />
1292.3 Hz<br />
1289.0 Hz<br />
1285.2 Hz<br />
1281.9 Hz<br />
1274.8 Hz<br />
400.1 Hz<br />
393.0 Hz<br />
385.9 Hz<br />
379.0 Hz<br />
371.9 Hz<br />
b)<br />
a) b)<br />
a)<br />
8.0 7.0 6.0 5.0 4.0<br />
3.0 2.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 2 (75.5 MHz, CDCl 3 ): δ = 13.90 (CH 3 ), 14.16 (CH 3 ), 61.66 (CH 2 ), 61.72 (CH 2 ),<br />
126.29 (C), 128.82 (CH), 129.46 (CH), 130.58 (CH), 132.87 (C), 142.13 (CH), 164.13 (C), 166.72 (C).<br />
LM<br />
180 160 140<br />
IR-Spektrum von 2 (Film):<br />
100<br />
T [%]<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
50<br />
3060<br />
3030<br />
2905<br />
2940<br />
2985<br />
1630<br />
1720<br />
0<br />
~<br />
4000 3000 2000 1500 1000 ν [cm -1 ]<br />
Versuch <strong>5.4.2</strong>, Rev. 1.0 2
5. Reaktionen polarer elektronenreicher C=C-Bindungen mit Elektrophilen www.ioc-praktikum.de<br />
und polarer elektronenarmer C=C-Bindungen mit Nucleophilen<br />
* Formulieren Sie den zu 2 führenden Reaktionsmechanismus.<br />
Weitere denkbare Reaktionsprodukte:<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
H 5<br />
C 2<br />
O OC 2<br />
H 5<br />
Ph<br />
OH<br />
HO<br />
Ph<br />
H<br />
OH<br />
H<br />
Ph<br />
H<br />
OH<br />
H 5<br />
C 2<br />
O OC 2<br />
H 5<br />
HO<br />
OH<br />
Ph Ph<br />
A B C D<br />
* Mit welchen spektroskopischen Daten und einfachen Versuchen lassen sich A–D ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen. In welchem Zusammenhang stehen A/D und B/C?<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Die durch Piperidin oder Pyrrolidin in Gegenwart katalytischer Mengen einer Carbonsäure bewirkte Aldolkondensation<br />
ist die Knoevenagel-Kondensation. Als reaktive Methylenverbindung werden hauptsächlich<br />
eingesetzt Malonester, Acetessigester, Cyanessigester, seltener <strong>Phenyl</strong>acetonitril, Benzylketone und alphatische<br />
Nitroverbindungen. Siehe Einführung Kap. 5.4.<br />
F. H. Allen, F.W. Sprangler in Organic Syntheses Coll. Vol. 3 (Hrsg. E.C. Horning), J. Wiley & Sons, New<br />
York, 1955, S. 377–379.<br />
Versuch <strong>5.4.2</strong>, Rev. 1.0 3