4.2.1.1: Propionsäure-1-butylester
4.2.1.1: Propionsäure-1-butylester
4.2.1.1: Propionsäure-1-butylester
Sie wollen auch ein ePaper? Erhöhen Sie die Reichweite Ihrer Titel.
YUMPU macht aus Druck-PDFs automatisch weboptimierte ePaper, die Google liebt.
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
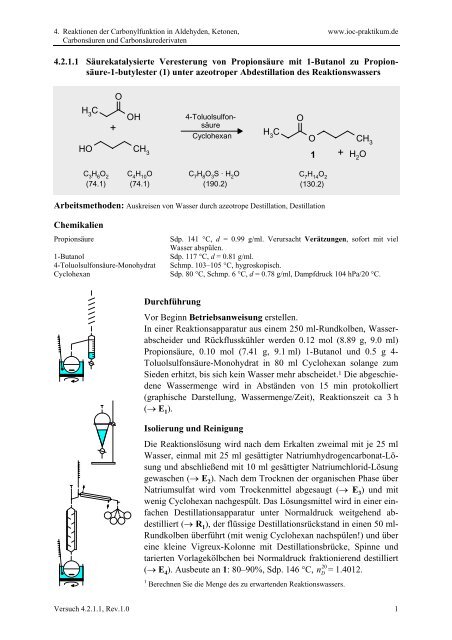
<strong>4.2.1.1</strong> Säurekatalysierte Veresterung von Propionsäure mit 1-Butanol zu Propionsäure-1-<strong>butylester</strong><br />
(1) unter azeotroper Abdestillation des Reaktionswassers<br />
O<br />
H 3<br />
C OH<br />
4-Toluolsulfonsäure<br />
+<br />
Cyclohexan<br />
H 3<br />
C<br />
HO<br />
CH 3<br />
O<br />
O CH 3<br />
1 + H 2<br />
O<br />
C 3<br />
H 6<br />
O 2<br />
(74.1)<br />
C 4<br />
H 10<br />
O<br />
(74.1)<br />
C 7<br />
H 8<br />
O 3<br />
S · H 2<br />
O<br />
(190.2)<br />
C 7<br />
H 14<br />
O 2<br />
(130.2)<br />
Arbeitsmethoden: Auskreisen von Wasser durch azeotrope Destillation, Destillation<br />
Chemikalien<br />
Propionsäure<br />
1-Butanol<br />
4-Toluolsulfonsäure-Monohydrat<br />
Cyclohexan<br />
Sdp. 141 °C, d = 0.99 g/ml. Verursacht Verätzungen, sofort mit viel<br />
Wasser abspülen.<br />
Sdp. 117 °C, d = 0.81 g/ml.<br />
Schmp. 103–105 °C, hygroskopisch.<br />
Sdp. 80 °C, Schmp. 6 °C, d = 0.78 g/ml, Dampfdruck 104 hPa/20 °C.<br />
Durchführung<br />
Vor Beginn Betriebsanweisung erstellen.<br />
In einer Reaktionsapparatur aus einem 250 ml-Rundkolben, Wasserabscheider<br />
und Rückflusskühler werden 0.12 mol (8.89 g, 9.0 ml)<br />
Propionsäure, 0.10 mol (7.41 g, 9.1 ml) 1-Butanol und 0.5 g 4-<br />
Toluolsulfonsäure-Monohydrat in 80 ml Cyclohexan solange zum<br />
Sieden erhitzt, bis sich kein Wasser mehr abscheidet. 1 Die abgeschiedene<br />
Wassermenge wird in Abständen von 15 min protokolliert<br />
(graphische Darstellung, Wassermenge/Zeit), Reaktionszeit ca 3 h<br />
(→ E 1 ).<br />
Isolierung und Reinigung<br />
Die Reaktionslösung wird nach dem Erkalten zweimal mit je 25 ml<br />
Wasser, einmal mit 25 ml gesättigter Natriumhydrogencarbonat-Lösung<br />
und abschließend mit 10 ml gesättigter Natriumchlorid-Lösung<br />
gewaschen (→ E 2 ). Nach dem Trocknen der organischen Phase über<br />
Natriumsulfat wird vom Trockenmittel abgesaugt (→ E 3 ) und mit<br />
wenig Cyclohexan nachgespült. Das Lösungsmittel wird in einer einfachen<br />
Destillationsapparatur unter Normaldruck weitgehend abdestilliert<br />
(→ R 1 ), der flüssige Destillationsrückstand in einen 50 ml-<br />
Rundkolben überführt (mit wenig Cyclohexan nachspülen!) und über<br />
eine kleine Vigreux-Kolonne mit Destillationsbrücke, Spinne und<br />
tarierten Vorlagekölbchen bei Normaldruck fraktionierend destilliert<br />
(→ E 4 ). Ausbeute an 1: 80–90%, Sdp. 146 °C, n 20 D<br />
= 1.4012.<br />
1 Berechnen Sie die Menge des zu erwartenden Reaktionswassers.<br />
Versuch <strong>4.2.1.1</strong>, Rev.1.0 1
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Hinweise zur Entsorgung (E), Reycling (R) der Lösungsmittel<br />
E 1 : Abgeschiedenes Wasser → Entsorgung (H 2 O mit RH).<br />
E 2 : Wässrige Phasen → Entsorgung (H 2 O mit RHal/Halogenid).<br />
E 3 : Kontaminiertes Trockenmittel → Entsorgung (Anorg. Feststoffe).<br />
E 4 : Destillationsrückstand in wenig Aceton lösen, verunreinigte Fraktionen → Entsorgung (RH).<br />
R 1 : Abdestilliertes Lösungsmittel → Redestillation (Cyclohexan).<br />
Auswertung des Versuchs<br />
1 H-NMR-Spektrum von 1 (300 MHz, CDCl 3 ): δ = 0.92 (3 H), 1.12 (3 H), 1.43 (2 H), 1.64 (2 H), 2.32 (2 H),<br />
4.06 (2 H).<br />
5.0 4.0 3.0 2.0 1.0 [ppm] 0.0<br />
13 C-NMR Spektrum von 1 (75.5 MHz, CDCl 3 ): δ = 9.15 (CH 3 ), 13.71 (CH 3 ), 19.14 (CH 2 ), 27.61 (CH 2 ), 30.71<br />
(CH 2 ), 64.17 (CH 2 ), 174.62 (C).<br />
LM<br />
180 160 140<br />
IR-Spektrum von 1 (Film):<br />
100<br />
T [%]<br />
120<br />
100 80<br />
60 40 20 [ppm] 0<br />
50<br />
2875<br />
2960<br />
1740<br />
0<br />
4000 3000 2000 1500 1000 ν ~ [cm -1 ]<br />
* Formulieren Sie den zu 1 führenden Reaktionsmechanismus.<br />
Versuch <strong>4.2.1.1</strong>, Rev.1.0 2
4. Reaktionen der Carbonylfunktion in Aldehyden, Ketonen, www.ioc-praktikum.de<br />
Carbonsäuren und Carbonsäurederivaten<br />
Weitere denkbare Reaktionsprodukte:<br />
OC 4<br />
H 9<br />
H 3<br />
CCH 2<br />
C OC 4<br />
H 9<br />
OC 4<br />
H 9<br />
H 3<br />
C<br />
O CH 3<br />
H 3<br />
CCH<br />
OC 4<br />
H 9<br />
COC 4<br />
H<br />
A<br />
9<br />
B<br />
C<br />
* Mit welchen spektroskopischen Daten lassen sich A–C ausschließen?<br />
* Diskutieren Sie die denkbaren Reaktionsmechanismen.<br />
Literatur, allgemeine Anwendbarkeit der Methode<br />
Die Entfernung des Reaktionswassers aus dem Gleichgewicht durch azeotrope Destillation ist eine allgemeine<br />
Methode zur Darstellung von Carbonsäureestern aus Carbonsäuren und Alkoholen, von Acetalen aus Aldehyden<br />
und Alkoholen (Vers. 4.1.1.2 und 4.1.1.3) und von Enaminen aus Ketonen und sek. Aminen (Vers. 4.1.2.2 und<br />
4.1.2.3). Azeotrop Cyclohexan/Wasser (91:9), Sdp. 69 °C, siehe auch Einführung Kap. 4.2.1.<br />
Versuch <strong>4.2.1.1</strong>, Rev.1.0 3