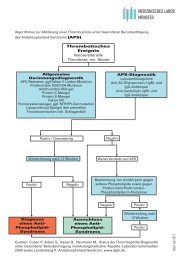
Laborinformation zur Thrombozytenfunktionsdiagnostik
Laborinformation zur Thrombozytenfunktionsdiagnostik
Laborinformation zur Thrombozytenfunktionsdiagnostik
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Präanalytik:<br />
Neben der Anamnese, die bereits eine erste Verdachtsdiagnose liefern kann, ist die Präanalytik essenziell.<br />
Durch Fehler in der Präanalytik kann das Probenmaterial so verändert werden und können die<br />
Analyseergebnisse soweit beeinträchtigt werden, dass sie diagnostisch unbrauchbar sind.<br />
• Die Blutentnahme sollte erst kurz vor Eintreffen des Laborkuriers erfolgen (alternativ:<br />
Abnahme direkt im Labor), da die Untersuchung innerhalb von 4 Stunden nach der<br />
Blutabnahme aufgrund der Labilität der Thrombozyten erfolgen muss.<br />
• Idealerweise sollte die Probengewinnung morgens am ausgeruhten Patienten erfolgen.<br />
• Dabei ist eine zu lange Stauung und ein zu starker Sog zu vermeiden, da es ansonsten <strong>zur</strong><br />
Freisetzung von Fibrinolyse-aktivierenden Substanzen oder des von-Willebrand-Faktors aus dem<br />
Gefäßendothel kommen kann.<br />
• Butterfly-Kanülen mit Kunststoffschlauch oder herkömmliche Injektionsnadeln mit mind. 21<br />
Gauge Durchmesser können <strong>zur</strong> Abnahme in Lithium-Heparinat-Monovetten (ohne Gel)<br />
verwendet werden (alternativ: Hirudin-antikoaguliertes Vollblut).<br />
• Die Patientenprobe muss vollständig gefüllt, darf nicht zentrifugiert und auch keinen großen<br />
Temperaturschwankungen ausgesetzt werden. Die Lagerung und der Transport erfolgen am<br />
besten bei Raumtemperatur.<br />
Testprinzip:<br />
Die Plättchenfunktions-Analyse erfolgt mittels Impedanz-Aggregometrie am Multiplate®-System.<br />
Hierbei wird antikoaguliertes Vollblut mit Thrombozytenaktivatoren in einer Messzelle mit parallel<br />
angeordneten Sensordrähten gemischt. Aktivierte Thrombozyten haften an der Sensoroberfläche und<br />
aggregieren. Die dadurch bedingte Veränderung des elektrischen Widerstandes wird als Fläche unter der<br />
Aggregationskurve aufgezeichnet. Je nach Fragestellung werden ADP, Arachidonsäure, TRAP, Kollagen,<br />
Ristocetin als Aktivatoren eingesetzt.<br />
Referenzbereiche*:<br />
Arachidonsäure<br />
79 – 141 AUC Units<br />
ADP<br />
55 – 117 AUC Units<br />
Ristocetin, high (0,77 mg/ml)<br />
65 – 116 AUC Units<br />
Ristocetin, low (0,2 mg/ml)<br />
13 – 69 AUC Units<br />
TRAP-6<br />
92 – 151 AUC Units<br />
Kollagen<br />
61 – 108 AUC Units<br />
*für Lithium-Heparinat-antikoaguliertes Vollblut entsprechend den Produktinformationen des Herstellers<br />
Anforderung:<br />
• Aufgrund der besonderen essentiellen präanalytischen Anforderungen ist die Analytik nur nach<br />
telefonischer Voranmeldung (Tel. 0251-60916-119 oder -222/-232) möglich.<br />
• Für eine optimale Abarbeitung und Befundung sind klinische Angaben, insbesondere die<br />
Fragestellung und die aktuellen Medikamenten-Anamnese (Dosis, Indikation und Zeitpunkt der<br />
letzten Einnahme), sowie der Entnahmezeitpunkt notwendig.<br />
Abrechnung:<br />
EBM: 32228, GOÄ: 3961<br />
Für weitere Informationen können Sie sich gerne mit Frau Dr. Adam (Tel. 0251-60916-119) in<br />
Verbindung setzen.<br />
Mit freundlichen Grüßen<br />
Ihre Laborärzte<br />
Literatur:<br />
Mani H., Wolf Z., Lindhoff-Last E.; Fortschritte in der Thrombozytenfunktion, Hämostaseologie 2010; 30: 217 – 229<br />
Ivandic B., Frey N.; Neue Ansätze und Indiaktionen <strong>zur</strong> Plättchenfuntkionsdiagnostik in der Kardiologie, Hämostaseologie 2011; 31: 73 – 76<br />
Schneppenheim R., Budde U., von-Willebrand-syndrom und von-Willebrand-Faktor, UNI-Med Verlag, 2004