Antikörperdiagnostik bei autoimmunen Schilddrüsenerkrankungen
Antikörperdiagnostik bei autoimmunen Schilddrüsenerkrankungen
Antikörperdiagnostik bei autoimmunen Schilddrüsenerkrankungen
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
Fortbildungsveranstaltung<br />
Münster, 6. März 2013<br />
Antikörperdiagnostik <strong>bei</strong> <strong>autoimmunen</strong><br />
Schilddrüsenerkrankungen<br />
N<br />
C<br />
Matthias Schott<br />
Funktionsbereich Endokrinologie<br />
Klinik für Endokrinologie und Diabetologie<br />
Universitätsklinikum Düsseldorf
Autoimmune Schilddrüsenerkrankungen<br />
Morbus Basedow<br />
Schilddrüsenfunktion: Hyperthyreose<br />
Autoimmunthyreoiditis<br />
Schilddrüsenfunktion:<br />
Euthyreose / Hypothyreose / (Hyperthyreose)<br />
Formen:<br />
Autoimmunthyreoiditis von Hashimoto‐Typ<br />
‐ hypertrophe Form<br />
‐ atrophische Form<br />
Silent‐Thyreoiditis<br />
Post‐partum Thyreoiditis
Morbus Basedow<br />
Pathogenese<br />
9 Leucin-reiche „repeats“<br />
A<br />
N<br />
C<br />
B<br />
= Cystein Cluster<br />
(Struktur nicht bekannt)<br />
TSAb<br />
TBAb<br />
= Leucin-reiche „repeats “<br />
Struktur basierend auf<br />
RI crystal<br />
Schott M. et al. Trends Endocrinol<br />
Metab (2005)
Morbus Basedow<br />
Klinik, Sonographie & Szintigraphie<br />
Sonographie<br />
Klinik<br />
normale Schilddrüse<br />
Szintigraphie<br />
diffuse Echoarmut und<br />
verstärkte Durchblutung (thyroid storm)<br />
<strong>bei</strong>m Morbus Basedow<br />
uptake: 3.55%
TSH-Rezeptor-Autoantikörper-Assays<br />
Detektionssysteme<br />
„Erstgenerations-<br />
Assay“<br />
„Zweitgenerations-<br />
Assay“<br />
„Drittgenerations-<br />
Assay“<br />
markiertes<br />
TSH<br />
*<br />
TBII<br />
markiertes<br />
TSH<br />
Y<br />
*<br />
TBII<br />
markiertes<br />
TSH<br />
Y<br />
*<br />
TBII<br />
TSH<br />
mAb (M22)<br />
Y<br />
Y<br />
TBII<br />
Y<br />
TSH-R<br />
Y<br />
TSH-R<br />
Y<br />
TSH-R<br />
TSH-R<br />
Y<br />
porciner<br />
TSH-R<br />
humaner<br />
TSH-R<br />
porciner<br />
TSH-R<br />
porciner<br />
TSH-R<br />
automatisiert<br />
Einheiten in U/L<br />
Einheiten in IU/L
Automatisierte TRAK Bestimmung<br />
Elecsys Immunoassay<br />
Analyzer (Roche)<br />
Patienten<br />
• 508 Morbus Basedow<br />
• 142 AIT<br />
• 107 subakute Thyroiditis<br />
• 109 Strumen<br />
• 23 SD-Karzinome<br />
• 446 gesunde Kontrollen<br />
Schott M et al., Clin Endocrinol 2009
Automatisierte TRAK Bestimmung<br />
Deutschland<br />
Universitätsklinik Düsseldorf<br />
M. Schott, D. Hermsen, W. A. Scherbaum<br />
Universitsklinik Essen<br />
A. Eckstein, M. Broecker-Preuss, K. Mann<br />
MVZ Mönchengladbach<br />
J. van Helden<br />
Universitätsklinik Leipzig<br />
J. Kratzsch<br />
Labor Limbach, Heidelberg<br />
J. Roth<br />
Italien<br />
San Gerardo Hospital, Monza<br />
M. Casati<br />
Japan<br />
Noguchi Thyroid Clinic<br />
K. Inomata, T. Nurakami<br />
Ito Hospital, Tokyo<br />
N. Miyazaki, J. Y. Noh<br />
Spain<br />
Hospital Universitario de<br />
Bellvitge<br />
J. Camara Mas<br />
Sponsoring<br />
Roche Diagnostics, Penzberg<br />
J. Jarausch, D. Gassner,<br />
R. Golla, W. Stock<br />
Schott M et al., Clin Endocrinol 2009
Automatisierte TRAK Bestimmung<br />
eingeschlossene Patienten<br />
• 446 gesunde Kontrollen und<br />
370 Patienten mit verschiedenen<br />
Schilddrüsenerkrankungen<br />
(ausgenommen Basedow-<br />
Patienten) für die Berechnung<br />
der Spezifität<br />
• 208 unbehandelte Basedow-<br />
Patienten für die Berechnung der<br />
Sensitivität<br />
Resulte<br />
• höchste Spezifität / Sensitivität<br />
(99%) <strong>bei</strong> einem TRAK-<br />
Grenzwert von 1.75 IU/l<br />
Sensitivity<br />
1<br />
0.9<br />
0.8<br />
0.7<br />
0.6<br />
0.5<br />
0.4<br />
0.3<br />
0.2<br />
0.1<br />
0<br />
Area under curve (AUC):<br />
0.98 (95% CI: 0.97 – 0.99)<br />
0 0.2 0.4 0.6 0.8 1<br />
1-Specificity<br />
• ROC-Plot-Analyse mit “allen Basedow-Patienten”<br />
(einschl. Vortherapie):<br />
Sensitivität: 89%; Spezifität: 99%
Evaluation of the First Automated TRAb Assay<br />
Gerhard‐Plot<br />
CutNRoc Version 2.0.2 UTC:2006-08-29 14:23:00 Build 1<br />
Dateinam e: ???<br />
Bear<strong>bei</strong>ter:<br />
Datum : 31.03.2008 16:07:46<br />
Frequency Distribution<br />
Titel:<br />
Projekt:<br />
A uswertung:<br />
Kom m entar:<br />
200<br />
180<br />
160<br />
crosspoint of highest sensitivity and specificity<br />
resulting in a cut-off for TRAb positivity of 1.75 IU/L<br />
100<br />
90<br />
80<br />
140<br />
70<br />
Frequency<br />
120<br />
100<br />
80<br />
60<br />
60<br />
50<br />
40<br />
30<br />
Specifity[%], Sensitivity[%]<br />
VT+<br />
VT-<br />
Spec.<br />
Sens.<br />
40<br />
20<br />
20<br />
0<br />
0<br />
1,25<br />
2,5<br />
3,75<br />
5<br />
6,25<br />
7,5<br />
8,75<br />
10<br />
11,3<br />
12,5<br />
13,8<br />
15<br />
16,3<br />
17,5<br />
18,8<br />
20<br />
21,3<br />
22,5<br />
23,8<br />
TRAb Concentration<br />
25<br />
26,3<br />
27,5<br />
28,8<br />
30<br />
31,3<br />
32,5<br />
33,8<br />
35<br />
36,3<br />
37,5<br />
38,8<br />
40<br />
10<br />
Schott M et al., Clin Endocrinol 2009<br />
0
Automatisierte TRAK Bestimmung<br />
Vergleich mit anderen Assay‐Systemen<br />
Medizym (porcin / TSH)<br />
Euroimmun (porcin / TSH)<br />
45<br />
45<br />
40<br />
r = 0.922<br />
40<br />
r = 0.941<br />
35<br />
35<br />
Elecsys anti-TSHR [IU/L]<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
Passing/Bablok Regression<br />
y = 1.021 x + 0.049<br />
n = 175<br />
r = 0.922<br />
Elecsys anti-TSHR [IU/L]<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
Passing/Bablok Regression<br />
y = 1.162 x - 0.743<br />
n = 112<br />
r = 0.941<br />
0<br />
0 5 10 15 20 25 30 35 40 45<br />
Medizym T.R.A. [IU/L]<br />
0<br />
0 5 10 15 20 25 30 35 40 45<br />
Euroimmun TRAb ELISA [IU/L]<br />
120<br />
100<br />
BRAHMS LIA (human / TSH)<br />
r = 0.945<br />
45<br />
40<br />
35<br />
Cosmic (porcin / M22)<br />
r = 0.895<br />
Elecsys an ti-TSHR [IU/L]<br />
80<br />
60<br />
40<br />
20<br />
Passing/Bablok Regression<br />
y = 1.093 x + 0.249<br />
n= 316<br />
r = 0.945<br />
0<br />
0 20 40 60 80 100 120<br />
Elecsys anti-TSHR [IU/L]<br />
30<br />
25<br />
20<br />
15<br />
10<br />
5<br />
Passing/Bablok Regression<br />
y = 1.477 x - 0.216<br />
n = 129<br />
r = 0.895<br />
0<br />
0 5 10 15 20 25 30 35 40 45<br />
Hermsen et al.,<br />
Clin Chim Acta 2008<br />
BRAHMS TRAK human LIA [IU/L]<br />
Cosmic TRAb ELISA [IU/L]
Prospektive Studie: Thyreostatische Therapie<br />
vs. Chirurgie vs. Radiojodtherapie<br />
Nachbeobachtung über 5 Jahre<br />
n = initial 179 Patienten<br />
medik. Therapie: n = 48<br />
Chirurgie: n = 47<br />
RJT: n = 36<br />
TRAK-Assay: Erstgenerationsassay mit PEG<br />
L-Thyroxin-Therapie mit Ziel Euthyreose<br />
TRAK-Wert zum Zeitpunkt des Rezidivs:<br />
40,1%, 30,4%, 45,0%, 11,8%, 17,4%, 23,9%,<br />
20,3%, 25,6%, 57,3%, 19,9%, 46,8%, 15,2%,<br />
23,6%, 18,8%, 24,0%<br />
Laurberg P et al., Eur J Endocrinol 2008
Prädiktion des Krankheitsverlaufes des<br />
Morbus Basedow in Abhängigkeit der TRAK<br />
Anzahl Rezidiv Remission<br />
(n = 129)<br />
______________________________________________________________________________________________________________<br />
TRAK > 1,5 IU/l 51 28 (21,7 %) 23 (17,8 %)<br />
TRAK < 1,5 IU/l 78 30 (23,3 %) 48 (37,2 %)<br />
PPV 55%, NPV 62%<br />
TRAK > 1,0 IU/l 74 36 (27,9 %) 38 (29,4 %)<br />
TRAK < 1,0 IU/l 55 22 (17,1%) 33 (25,6 %)<br />
PPV 49%, NPV 60%<br />
______________________________________________________________________________________________________________<br />
n = 129 Basedow-Patienten (58 mit Rezidiv)<br />
follow-up: 11 Monate (11 - 49)<br />
Zimmermann-Belsing et al., Eur J Endocrinol 2002
Prädiktion des Krankheitsverlaufes des<br />
Morbus Basedow in Abhängigkeit der TRAK<br />
TRAb IU/L<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
Median: 2.2 IU/l<br />
8.6 IU/l<br />
Remission<br />
Remission Rezidiv<br />
Relapse<br />
n = 93 Patienten<br />
Mittlere Dauer der thyreostatische<br />
Therapie<br />
insgesamt: 5,1 Mon<br />
-Rez.: 5,4 Mon<br />
-Rem: 4,6 Mon<br />
follow-up:<br />
21,7 Mon<br />
Dauer der Rem: 17,0 Mon<br />
TRAb<br />
(IU/l)<br />
Wahrscheinlichkeit<br />
einer Remission<br />
> 10 3,4% (1/29)<br />
Spez. für Rezidiv 97%<br />
PPV für Rez. 96,4%<br />
> 7 13,9% (5/36)<br />
> 4 15,6% (7/45)<br />
Schott M et al., Horm Metab Res 2004;36:92-96
Prädiktion des Krankheitsverlaufes des<br />
Morbus Basedow in Abhängigkeit der TRAK<br />
PPV 49%, NPV 54% (Spezif: 14%) PPV 83%, NPV 62% (Spezif: 92%)<br />
n = 96 Patienten (nach Absetzen der thyreostatischen Therapie)<br />
Follow-up: 2 Jahre<br />
Rezidive: 47/96 Patienten (49%)<br />
TRAK-Werte: Rezidiv-Gruppe: 11,1 IU/l<br />
Remissions-Gruppe: 4,5 IU/l (p < 0,001)<br />
Quadbeck B. et al. Horm Metab Res 2005
Pharmakotherapie <strong>bei</strong>m<br />
Morbus Basedow<br />
Bedeutung der TSH-Rezeptor-Antikörper für die Diagnose des<br />
Morbus Basedow und die Prognoseabschätzung der<br />
Schilddrüsenüberfunktion und der endokrinen Orbitopathie<br />
- Stellungnahme der Sektion Schilddrüse der DGE -<br />
Eckstein A, Mann K, Kahaly GJ, Grußendorf M,<br />
Reiners C, Feldkamp J, Quadbeck B, Bockisch A und Schott M<br />
... Für einen Teil der Patienten ist eine Prognoseabschätzung des M. Basedow mit hoher<br />
Wahrscheinlichkeit durch eine Bestimmung der TRAK im Verlauf der Erkrankung möglich, so<br />
dass eine Operation bzw. Radiojodtherapie mit hohen TRAK-Werten schon vor Ablauf eines<br />
ganzen Jahres (frühestens nach 6 Monaten <strong>bei</strong> einem TRAK-Wert von >10 IU/l) gegenüber<br />
einer thyreostatischer Therapie empfohlen werden kann. ...<br />
Mittels der TRAK-Bestimmung auf der Basis eines Assays der zweiten Generation kann auch der<br />
Verlauf der EO abgeschätzt werden, womit Therapieentscheidungen beeinflusst werden können.<br />
Eckstein A et al., Med Klinik 2009
Endokrine Orbitopathie<br />
keine Therapie<br />
Steroide<br />
Keine Therapie<br />
4 Monate später<br />
Risikofaktoren:<br />
(stimulierende) TSH-Rezeptor-Autoantikörper (TRAK)<br />
TSH Spiegel<br />
Rauchen<br />
Stress etc.<br />
Quelle: Frau Prof. A. Eckstein / Universitätsklinik Essen
Endokrine Orbitopathie<br />
Mild Graves‘ Ophthalmopathy<br />
Severe Graves‘ Ophthalmopathy<br />
CAS
Endokrine Orbitopathie<br />
TBII [IU/l]<br />
40,0<br />
35,0<br />
30,0<br />
25,0<br />
20,0<br />
15,0<br />
10,0<br />
5,0<br />
0,0<br />
-5,0<br />
5,7<br />
grey zone<br />
no outcome<br />
possible<br />
8,8<br />
TBII values below: 2.3-15.6x better<br />
chance for a good course of GO<br />
TBII values above: 8.7-31.1x higher<br />
risk of a severe course<br />
5,1 4,8<br />
2,9 2,8<br />
2,6 1,5 1,5 1,5 1,5<br />
1-4 5-8 9-12 13-16 17-20 20-24<br />
Months after first symptoms of GO<br />
Eckstein et al, 2006 JCEM
Morbus Basedow<br />
Pathogenese<br />
9 Leucin-reiche „repeats“<br />
A<br />
N<br />
C<br />
B<br />
= Cystein Cluster<br />
(Struktur nicht bekannt)<br />
TSAb<br />
TBAb<br />
= Leucin-reiche „repeats “<br />
Struktur basierend auf<br />
RI crystal<br />
Schott M. et al. Trends Endocrinol<br />
Metab (2005)
Chimerer TSH/LH‐Rezeptor (MC4)<br />
Thyroid. 1997 Dec;7(6):867-77.<br />
Epitopes for thyroid stimulating and blocking autoantibodies on the<br />
extracellular domain of the human thyrotropin receptor.<br />
Tahara K, Ishikawa N, Yamamoto K, Hirai A, Ito K, Tamura Y, Yoshida S,<br />
Saito Y, Kohn LD.<br />
Second Department of Internal Medicine,Chiba City, Japan.
Neuer kommerziell erhältlicher Assay<br />
zur Bestimmung stimulierender TRAK<br />
Fa. Diagnostic Hybrids
Neuer kommerziell erhältlicher Assay<br />
zur Bestimmung stimulierender TRAK<br />
Positiver Nachweis stimulierender TRAK:<br />
EO-Patienten: 150/155 (97%; MC4) und 148/155 (95%; wt)<br />
Basedow-Patienten: 6/45 (13%; MC4) und 20/45 (44%, wt)<br />
TSI-Titer waren 3- bis 8-fach höher in EO-Gruppe gegenüber Basedow-Patienten<br />
Lytton, S. D. et al. J Clin Endocrinol Metab 2010
Neuer, kommerziell erhältlicher Bioassay<br />
für die Messung von stimulierenden TRAK<br />
Starke Korrelation mit dem Clinical Activity Score (insb. Diplopie = Doppelsehen)<br />
Lytton, S. D. et al. J Clin Endocrinol Metab 2010
Thyreoiditen<br />
Terminologie<br />
Thyreoiditisformen<br />
Synonym<br />
Autoimmunthyreoiditis von Hashimoto‐Typ chronisch lymphozytäre Autoimmunthyr.<br />
‐ hypertrophe Form chronic autoimmune thyreoiditis<br />
‐ atrophische Form<br />
Post‐partum Thyreoiditis<br />
Silent‐Thyreoiditis<br />
Subakute Thyreoidits de Quervain<br />
painless postpartum thyroiditis<br />
subacute lymphocytic thyroiditis<br />
painless sporadic thyroiditis<br />
subacute lymphocytic thyroiditis<br />
painful subacute thyroiditis<br />
Giant‐cell thyroiditis<br />
subacute granulomatous thyroiditis<br />
Iatrogene Thyreoiditis<br />
Invasiv sklerosierende Thyreoiditis<br />
Riedel‐Struma<br />
Bakterielle / virale Thyreoiditis
Autoimmunthyreopathien<br />
Sonographie / Szintigraphie<br />
normale Schilddrüse<br />
Morbus Basedow<br />
Autoimmunthyreoiditis<br />
kleine Schilddrüse / diffuse Echoarmut<br />
Schilddrüsenszintigraphie<br />
niedriger uptake
Hypothyreose<br />
Antigene / Pathogenese der AIT<br />
Schilddrüsenhormonsynthese / Antigen(e)<br />
normale<br />
Schilddrüse<br />
Hashimoto-<br />
Thyreoiditis<br />
atrophe<br />
Verlaufsform
Tetramer positive CD8+ T Zellen in<br />
AIT Patienten und Kontrollen<br />
Analyse der mononukleären Zellen des<br />
peripheren Blutes<br />
50<br />
n = 24<br />
n = 4 n = 11 n = 10<br />
Tetramer-positive CD8 Zellen [%]<br />
30<br />
10<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3<br />
TPO TG TPO TG TPO TG TPO<br />
TG<br />
AIT (HLA-A2 pos)<br />
AIT (HLA-A2 neg)<br />
Struma (HLA-A2 pos)<br />
gesunde Kontrollen (HLA-A2 pos)
Tetramer positive CD8+ T Zellen in AIT‐<br />
Patienten in Abhängigkeit der Erstdiagnose<br />
Analyse der mononukleären Zellen des<br />
peripheren Blutes<br />
50<br />
n = 4 n = 8 n = 4 n = 7<br />
Tetramer-positive CD8 Zellen [%]<br />
30<br />
10<br />
10<br />
8<br />
6<br />
4<br />
2<br />
0<br />
1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3 1 2 3<br />
TPO TG TPO TG TPO TG TPO<br />
TG<br />
AIT (Patient <strong>bei</strong> ED)<br />
AIT (ED: 1 - 5 Jahre)<br />
AIT (ED: 5 - 10 Jahre)<br />
AIT (ED: > 10 Jhre)
Schilddrüsen‐Autoantikörper<br />
<strong>bei</strong> Autoimmunthyreoiditis<br />
Histologie<br />
anti-TPO<br />
anti-TG<br />
Mariotti S, Lancet 1992
Antikörper‐Diagnostik <strong>bei</strong> AIT<br />
anti-TPO<br />
anti-TG<br />
Mariotti S,<br />
Lancet 1992<br />
Vanderpump MPJ et al., Clin Endocrinol 1995
Antikörper‐Diagnostik <strong>bei</strong> AIT<br />
National Health and Nutrition Examination Survey (NHANES III)<br />
• 16.533 Personen (von 1988 bis 1994)<br />
• TAK positiv in 10,4%; TPO-AK positiv in 11,3%<br />
• Hypothyreose <strong>bei</strong> 4,6% (0,3% manifest, 4,3% latent)<br />
• von TPO-AK positiven Patienten: 54,5% TAK positiv<br />
• von TAK-positiven Patienten: 70% anti-TPO positiv<br />
Vergleich TSH und Antikörper<br />
TSH > 4,5 mIU/l: pos. anti-TPO (OR = 8,4); pos. TAK (OR = 1,8)<br />
Manifeste Hypothyreose: pos. anti-TPO (OR = 39,7); pos. TAK (n.s.)<br />
TSH < 0,4 mIU/l: pos. anti-TPO (OR = 5,2); pos. TAK (OR = n.s.)<br />
Hollowell, J.G., J Clin Endo Metab 2002, 87:489-499
Schwangerschaft und Immunität<br />
„Neue Sichtweise“<br />
• Immuntoleranz durch<br />
regulatorische T-Zellen<br />
(und andere Zellen?)<br />
„Alte Sichtweise“<br />
• erhöhte Cortisol-Spiegel<br />
in der Schwangerschaft<br />
• daher: Immunsuppression<br />
Weetman AP, Nat Rev Endocrinol 2010
Schwangerschaft und Immunität<br />
Mütterliche Toleranz zum fetalen „Allograft“<br />
Rosa:<br />
Fetus<br />
Blau/Grau:<br />
Mutter<br />
Weetman AP, Nat Rev Endocrinol 2010
Fragestellung: Z.n. Radiojodtherapie der<br />
Mutter / Wann TRAK Messung<br />
Nachbeobachtung über 5 Jahre<br />
HWZ<br />
~3 Wochen Bestimmung der TRAK<br />
Ende 1/3 bis<br />
Anfang 2. Hälfte<br />
der Schwangerschaft<br />
Laurberg P et al., Eur J Endocrinol 1998<br />
(„Evidence based symposium of the ETA“)<br />
n = initial 179 Patienten<br />
medik. Therapie: n = 48<br />
Chirurgie: n = 47<br />
RJT: n = 36<br />
TRAK-Assay: Erstgenerationsassay mit PEG<br />
L-Thyroxin-Therapie mit Ziel Euthyreose<br />
Laurberg P et al., Eur J Endocrinol 2008
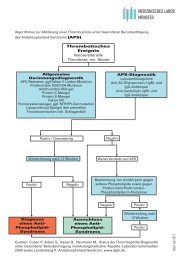
Hohe TRAK während der Schwangerschaft:<br />
Erhöhtes Risiko für neonatale Hyperthyreose<br />
Neugeborene mit Hyperthyreose<br />
… ohne Hyperthyreose<br />
Hamada N et al., Endocr Journal 2011
Fortbildungsveranstaltung<br />
Münster, 6. März 2013<br />
Vielen Dank für Ihre Aufmerksamkeit !