Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Frankfurt Institute for Molecular Life Sciences (FMLS) - CEF-MC
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
36 Cef-inveStigatorS<br />
37<br />
paola fuCInI<br />
1970 in Turin, Italien geboren,<br />
studierte Paola Fucini in ihrer Heimatstadt<br />
Biologie und ging dann zur<br />
Promotion nach München. Von dort<br />
aus führte sie ihr wissenschaftlicher<br />
Weg nach England, wo sie zunächst<br />
in Ox<strong>for</strong>d und später in Cambridge<br />
<strong>for</strong>schte, bevor sie 2002 nach<br />
Deutschland ans Max-Planck-Institut<br />
für Molekulare Genetik in Berlin<br />
zurückkehrte. Von dort aus nahm<br />
sie 2007 den Ruf auf die Assistenzprofessur<br />
an der Goethe-Universität<br />
<strong>Frankfurt</strong> an. Die Familie gibt der<br />
dreifachen Mutter den größten<br />
Rückhalt, und es ist ihr eine Freude,<br />
die Kinder beim Heranwachsen zu<br />
erleben. Fucini hat viele Interessen<br />
und Hobbies wie zum Beispiel Volleyball<br />
spielen, Judo, Lesen von Science<br />
Fiction und Philosophie. Neben ihrer<br />
beruflichen Tätigkeit ist ihre Freizeit<br />
jedoch sehr knapp bemessen, so<br />
dass sie diese am liebsten mit ihrer<br />
Familie verbringt.<br />
struKturanalyse Des rIBosoms<br />
Die ProteinfabriK verSteHen<br />
Was eine Zelle ist und wie sie auf ihre<br />
umgebung reagiert, wird größtenteils<br />
von proteinen bestimmt. Die fähigkeit, ein<br />
funktionales protein zu synthetisieren, ist<br />
daher entscheidend für die eigene existenz.<br />
In allen lebenden Zellen findet die proteinsynthese<br />
am ribosom statt, einem makromolekularen<br />
Komplex. Deshalb ist dieser<br />
translationsapparat eines der wichtigsten<br />
Ziele für antibiotika. mit Hilfe röntgenkristallographischer<br />
sowie kryo-elektronenmikroskopischer-<br />
und nmr-untersuchungen<br />
wollen wir verstehen, wie die verschiedenen<br />
Komponenten des translationsapparates<br />
miteinander agieren, um den translationszyklus<br />
zu steuern.<br />
Dazu untersuchen wir translationsfaktoren,<br />
die an den grundlegenden schritten<br />
der proteinsynthese beteiligt sind. Hierzu<br />
gehört die aufklärung des Bindungs-modus<br />
und der funktion des elongations-faktors<br />
G. Dieser faktor steuert die Bewegung<br />
des ribosoms auf der mrna, so dass bei<br />
jedem schritt des elongations-Zyklus der<br />
anschluss einer neuen aminosäure an die<br />
wachsende polypeptidkette möglich ist.<br />
Diese studien werden ergänzt durch die<br />
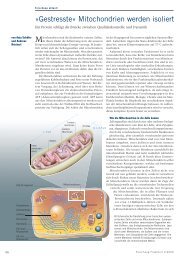
Kotranslationale Proteinfaltung: Strukturmodel<br />
eines in der arbeitsgruppe<br />
fucini untersuchten ribosomenkomplexes.<br />
ribosomen, orte der Proteinsynthese,<br />
sind makromolekulare Komplexe<br />
aus Proteinen und ribonukleinsäuren<br />
(rna), bestehend aus der großen (grün)<br />
und kleinen (cyan) untereinheit. Die<br />
während der Synthese wachsende (naszierende)<br />
Polypeptidekette (gelb) wird<br />
durch t-rna (hellbraun) am ribosom<br />
zurückgehalten und durch einen tunnel<br />
in der großen untereinheit vor Proteasen<br />
geschützt. unmittelbar nach deren<br />
austritt wird das naszierende Polypeptid<br />
bei dessen faltung durch translationale<br />
faktoren, wie den trigger-faktor (rosa),<br />
unterstützt.<br />
strukturelle analyse des faktors lepa, der<br />
in der lage ist, die translokation von ribosomen,<br />
die in unnormaler Kon<strong>for</strong>mation<br />
blockiert sind, rückgängig zu machen. Von<br />
großem Interesse ist für uns auch die steuerung<br />
der Biogenese des ribosoms, denn bei<br />
diesem heiklen schritt müssen mehr als 55<br />
proteine und drei nukleinsäure-stränge,<br />
bestehend aus mehr als 4500 nukleotiden,<br />
zusammengeführt werden.<br />
Die struktur verschiedener antibiotikaribosom-Komplexe<br />
ist ein weiterer schwerpunkt<br />
unserer arbeit. Wir wollen verstehen,<br />
wie diese kleinen liganden die tätigkeit eines<br />
so großen makromolekularen Komplexes<br />
vollständig unterbinden können. Zwei<br />
der untersuchten Inhibitoren, thiostrepton<br />
und micrococcin, gehören zur gleichen antibiotika-Klasse<br />
und binden in der gleichen<br />
umgebung am ribosom. Interessanterweise<br />
blockieren sie es jedoch in zwei unterschiedlichen<br />
Kon<strong>for</strong>mationen, die einem<br />
schritt beim an- und ausschalten der proteinsynthese<br />
entsprechen.<br />
unsere größte Heraus<strong>for</strong>derung sind jedoch<br />
fragen, die sich auf die faltung der<br />
entstehenden polypeptidkette beziehen.<br />
synthetisiert im Kern des ribosoms, hat die<br />
frisch entstandene polypeptidkette einen<br />
langen Weg von etwa 100 angström durch<br />
den so genannten ribosomalen tunnel vor<br />
sich, um an die außenseite des ribosoms zu<br />
gelangen. Diese passage ist ein sehr dynamischer<br />
und stark »personalisierter« Vorgang,<br />
in dem eine kontinuierliche Kommunikation<br />
zwischen dem ribosom und der polypeptidkette<br />
besteht. Das ribosom scheint in<br />
der lage zu sein, das protein, das es synthetisiert,<br />
zu erkennen und entsprechend die<br />
Geschwindigkeit der translation zu regeln<br />
und dessen korrekte abschottung zu organisieren.<br />
Wir versuchen, die polypeptidkette<br />
während der translation am ribosom detailliert<br />
strukturell zu beschreiben und so<br />
die kotranslationale faltung, die Wechselwirkung<br />
mit dem ribosom sowie den mechanismus,<br />
mit dem diese Interaktionen die<br />
proteinbiosynthese regeln, aufzuklären.<br />
Die ergebnisse unserer arbeiten tragen<br />
dazu bei, die Grundlage für die entwicklung<br />
neuer antibiotika zu schaffen sowie für die<br />
Behandlung von Krankheiten, die auf protein-fehlfaltung<br />
basieren.<br />
Kristalliner Komplex der<br />
ribosomalen untereinheit<br />
von Deinococcus radiodurans<br />
mit dem antibiotikum<br />
thiostrepton.