Matura mündlich 2011, Prüfungsstoff
Matura mündlich 2011, Prüfungsstoff
Matura mündlich 2011, Prüfungsstoff
Erfolgreiche ePaper selbst erstellen
Machen Sie aus Ihren PDF Publikationen ein blätterbares Flipbook mit unserer einzigartigen Google optimierten e-Paper Software.
KSH-Chemie <strong>Matura</strong> <strong>mündlich</strong> <strong>2011</strong>, <strong>Prüfungsstoff</strong><br />
<strong>Matura</strong> <strong>mündlich</strong> <strong>2011</strong>, <strong>Prüfungsstoff</strong><br />
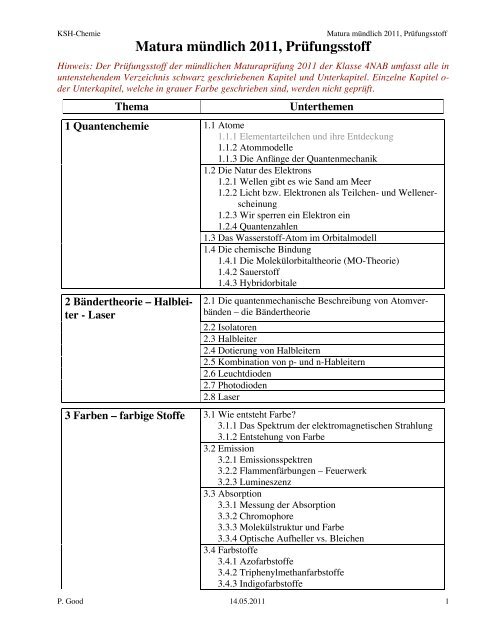
Hinweis: Der <strong>Prüfungsstoff</strong> der <strong>mündlich</strong>en <strong>Matura</strong>prüfung <strong>2011</strong> der Klasse 4NAB umfasst alle in<br />
untenstehendem Verzeichnis schwarz geschriebenen Kapitel und Unterkapitel. Einzelne Kapitel oder<br />
Unterkapitel, welche in grauer Farbe geschrieben sind, werden nicht geprüft.<br />
1 Quantenchemie<br />
Thema Unterthemen<br />
2 Bändertheorie – Halbleiter<br />
- Laser<br />
3 Farben – farbige Stoffe<br />
1.1 Atome<br />
1.1.1 Elementarteilchen und ihre Entdeckung<br />
1.1.2 Atommodelle<br />
1.1.3 Die Anfänge der Quantenmechanik<br />
1.2 Die Natur des Elektrons<br />
1.2.1 Wellen gibt es wie Sand am Meer<br />
1.2.2 Licht bzw. Elektronen als Teilchen- und Wellenerscheinung<br />
1.2.3 Wir sperren ein Elektron ein<br />
1.2.4 Quantenzahlen<br />
1.3 Das Wasserstoff-Atom im Orbitalmodell<br />
1.4 Die chemische Bindung<br />
1.4.1 Die Molekülorbitaltheorie (MO-Theorie)<br />
1.4.2 Sauerstoff<br />
1.4.3 Hybridorbitale<br />
2.1 Die quantenmechanische Beschreibung von Atomverbänden<br />
– die Bändertheorie<br />
2.2 Isolatoren<br />
2.3 Halbleiter<br />
2.4 Dotierung von Halbleitern<br />
2.5 Kombination von p- und n-Hableitern<br />
2.6 Leuchtdioden<br />
2.7 Photodioden<br />
2.8 Laser<br />
3.1 Wie entsteht Farbe?<br />
3.1.1 Das Spektrum der elektromagnetischen Strahlung<br />
3.1.2 Entstehung von Farbe<br />
3.2 Emission<br />
3.2.1 Emissionsspektren<br />
3.2.2 Flammenfärbungen – Feuerwerk<br />
3.2.3 Lumineszenz<br />
3.3 Absorption<br />
3.3.1 Messung der Absorption<br />
3.3.2 Chromophore<br />
3.3.3 Molekülstruktur und Farbe<br />
3.3.4 Optische Aufheller vs. Bleichen<br />
3.4 Farbstoffe<br />
3.4.1 Azofarbstoffe<br />
3.4.2 Triphenylmethanfarbstoffe<br />
3.4.3 Indigofarbstoffe<br />
P. Good 14.05.<strong>2011</strong> 1
KSH-Chemie <strong>Matura</strong> <strong>mündlich</strong> <strong>2011</strong>, <strong>Prüfungsstoff</strong><br />
3 Exkurs Mesomerie<br />
4 Analytik<br />
5 Thermodynamik<br />
5 Exkurs Absolute Entropien<br />
3.5 Ausgewählte „farbige Themen“<br />
3.5.1 Cochenille<br />
3.5.2 Chamäleons<br />
3.5.3 Blütenfarbstoffe<br />
3.5.4 Lebensmittelfarbstoffe<br />
1 Berechnung der Anzahl der Bindungselektronen in einer<br />
Verbindung<br />
2 Formalladungen<br />
3 Mesomerie (Resonanz)<br />
4 Die Bedeutung der Mesomerie für die Stabilität eines Stoffes<br />
5 Die Bedeutung der Mesomerie für die Farbigkeit von Stoffen<br />
6 Die Bedeutung der Mesomerie für die Säuren-/Basenstärke<br />
eines Stoffes<br />
4.1 Massenspektrometrie<br />
4.2 Infrarotspektroskopie (IR-Spektroskopie)<br />
4.3 Kernresonanzspektroskopie (H-NMR)<br />
4.4 Strukturaufklärung organischer Moleküle mittels MS-,<br />
IR- und H-NMR-Spektren<br />
5.1 Eigenschaften von Gasen<br />
5.1.1 Die kinetische Gastheorie<br />
5.1.2 Gasgesetze<br />
5.2 Die Innere Energie U<br />
5.2.1 Molekulare Erklärung der Inneren Energie<br />
5.2.2 Volumen-Arbeit - Änderung der inneren Energie U<br />
durch Leisten von Arbeit am System<br />
5.2.3 Wärmekapazität - Änderung der inneren Energie U<br />
durch Zuführen oder Ableiten von Wärme<br />
5.3 Enthalpie H<br />
5.4 Entropie S<br />
5.5 Die Freie Enthalpie G<br />
5.6 Die Gleichgewichtskonstante K<br />
5.7 Elektrochemie: die Nernst-Gleichung<br />
5.7.1 Konzentrationszellen identischer Halbzellen<br />
5.7.2 Konzentrationszellen unterschiedlicher Halbzellen<br />
5.7.3 Verteilung der Ionen über die Zellmembran – das<br />
Ruhepotential<br />
5.7.4 Das Aktionspotential<br />
5.7.5 Erregungsbildung und –ausbreitung im Herzen<br />
1 Mikrozustände<br />
2 Die Entropie – eine Funktion der Zahl der Mikrozustände<br />
3 Die Entropie von Feststoffen<br />
4 Entropie und Leben<br />
P. Good 14.05.<strong>2011</strong> 2
KSH-Chemie <strong>Matura</strong> <strong>mündlich</strong> <strong>2011</strong>, <strong>Prüfungsstoff</strong><br />
6 Chemie der Komplexe<br />
7 Biochemie<br />
6.1 Komplex-Teilchen<br />
6.1.1 „Verbindungen höherer Ordnung“ nach Alfred<br />
Werner<br />
6.1.2 Komplex-Teilchen<br />
6.1.3 Nomenklatur von Komplexteilchen<br />
6.2 Ligandfeldtheorie – Bindungsverhältnisse in Komplexen<br />
6.2.1 Die Wirkung von Liganden auf d-Elektronen des<br />
zentralen Metall-Teilchens: Aufspaltung der d-<br />
Orbitale im Ligandfeld<br />
6.2.2 Verteilung der Elektronen im oktaedrischen Komplex:<br />
high-spin- und low-spin-Komplexe<br />
6.2.3 Faktoren, welche Δ O beeinflussen<br />
6.3 Mehrzähnige Liganden – Der Chelat-Effekt<br />
6.4 Komplexstabilitäten – die Komplexbildungskonstante K B<br />
6.5 Löslichkeitsgleichgewichte schwerlöslicher Salze<br />
6.5.1 Der Löseprozess eines Salzes – ein chemischer oder<br />
physikalischer Vorgang?<br />
6.5.2 Das Löslichkeitsprodukt<br />
6.5.3 Berechnungen<br />
6.6 Die Wasserhärte<br />
7.1 Einführung<br />
7.2 Proteine<br />
7.2.1 Aminosäuren<br />
7.2.2 Die Peptidbindung<br />
7.2.3 Funktionen von Proteinen<br />
7.2.4 Die Struktur von Proteinen<br />
7.2.5 Enzymkinetik<br />
7.3 Kohlenhydrate<br />
7.3.1 Funktionen der Kohlenhydrate in Organismen<br />
7.3.2 Einteilung der Kohlenhydrate<br />
7.3.3 Die Fischer-Projektion<br />
7.3.4 Monosaccharide<br />
7.3.5 Disaccharide<br />
7.3.6 Polysaccharide<br />
7.4 Lipide<br />
7.4.1 Fette = Triacylglycerine<br />
7.4.2 Phospholipide<br />
7.4.3 Steroidhormone<br />
7.4.4 Cholesterin<br />
7.5 Nukleinsäuren<br />
7.6 Konzepte und Grundmuster des Stoffwechsels<br />
7.6.1 ATP als Energieüberträger<br />
7.6.2 ATP-gekoppelte Reaktionen<br />
7.6.3 Elektronencarrier bei der Oxidation von Nahrungsmitteln<br />
7.6.4 Elektronentransport von NADH/FADH 2 zum O 2 –<br />
Oxidative Phosphorylierung<br />
7.6.5 ATP-Synthese<br />
P. Good 14.05.<strong>2011</strong> 3
KSH-Chemie <strong>Matura</strong> <strong>mündlich</strong> <strong>2011</strong>, <strong>Prüfungsstoff</strong><br />
8 Wirkstoffe - Pharmakologie/Toxikologie<br />
(inkl.<br />
Substanzeigenschaften)<br />
9 Kunststoffe<br />
10 Organometallische Verbindungen<br />
7.7 Stoffwechsel als Netzwerk<br />
7.8 Erzeugung und Speicherung von Stoffwechselenergie<br />
7.8.1 Die Glykolyse<br />
7.8.2 Der Citratzyklus = Krebszyklus = Tricarbonsäurezyklus<br />
(tca = tricarboxylic acid cycle)<br />
7.8.3 Die Fettsäure-Oxidation (= β-Oxidation)<br />
7.8.4 Der Pentosephosphatweg<br />
7.8.5 Die Gluconeogenese<br />
7.8.6 Aminosäureabbau<br />
7.8.7 Harnstoffzyklus<br />
7.8.8 Hormonwirkungen<br />
8.1 Grundlagen<br />
8.1.1 Pharmaka und Gifte<br />
8.1.2 Beschreibung von Wirkstoffen<br />
8.1.3 Chemische Voraussetzungen für physiologische<br />
Wirksamkeit<br />
8.2 Pharmakokinetik: Resorption, Verteilung, Transformaton,<br />
Elimination<br />
8.2.1 Darreichung und Resorption von Wirkstoffen<br />
8.2.2 Verteilung<br />
8.2.3 Verteilung<br />
9.1 Polymerisation<br />
9.2 Polykondensation<br />
9.3 Polyaddition<br />
9.4 Unterscheidung von Kunststoffen aufgrund der Eigenschaften<br />
1 Herstellung von organometallischen Verbindungen<br />
2 Die Grignard-Reaktion<br />
3 Reaktionen von organischen Lithiumverbindungen<br />
P. Good 14.05.<strong>2011</strong> 4