Tuyển tập 50 đề thi học sinh giỏi môn hóa học 8 (kèm đáp án) (by Dameva)
LINK BOX: https://app.box.com/s/rvs4eb986tqjlrcpkpj6dzzupgy7yjxk LINK DOCS.GOOGLE: https://drive.google.com/file/d/1OZDfkEZFqAU2HROfc84yI_G0tRcYVpdf/view?usp=sharing
LINK BOX:
https://app.box.com/s/rvs4eb986tqjlrcpkpj6dzzupgy7yjxk
LINK DOCS.GOOGLE:
https://drive.google.com/file/d/1OZDfkEZFqAU2HROfc84yI_G0tRcYVpdf/view?usp=sharing
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
www.facebook.com/daykem.quynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.blogspot.com<br />
TUYỂN TẬP <strong>50</strong> ĐỀ THI HỌC SINH GIỎI MÔN HÓA HỌC LỚP 8 (<strong>kèm</strong> <strong>đáp</strong> <strong>án</strong>)<br />
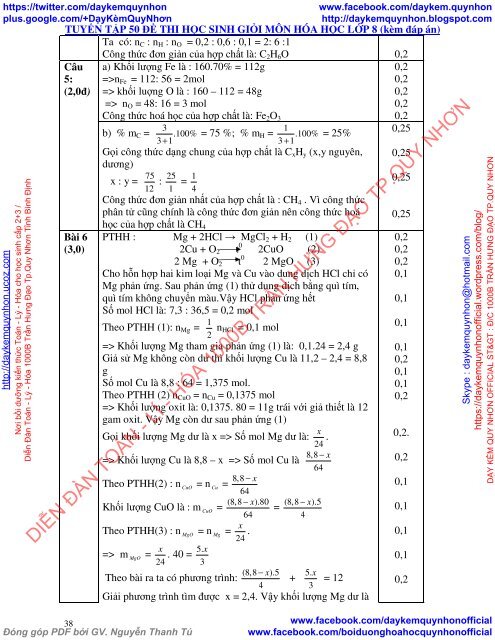
Ta có: n C : n H : n O = 0,2 : 0,6 : 0,1 = 2: 6 :1<br />
Công thức đơn giản của hợp chất là: C 2 H 6 O 0,2<br />
Câu<br />
5:<br />
(2,0đ)<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức To<strong>án</strong> - Lý - Hóa cho <strong>học</strong> <strong>sinh</strong> cấp 2+3 /<br />
Diễn Đàn To<strong>án</strong> - Lý - Hóa 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
Bài 6<br />
(3,0)<br />
a) Khối lượng Fe là : 160.70% = 112g<br />
=>n Fe = 112: 56 = 2mol<br />
=> khối luợng O là : 160 – 112 = 48g<br />
=> n O = 48: 16 = 3 mol<br />
Công thức hoá <strong>học</strong> của hợp chất là: Fe 2 O 3<br />
3 1<br />
b) % m C = .100% = 75 %; % m H = .100%<br />
= 25%<br />
3 + 1<br />
3 + 1<br />
Gọi công thức dạng chung của hợp chất là C x H y (x,y nguyên,<br />
dương)<br />
x : y = 75<br />
12 : 25<br />
1 = 1 4<br />
Công thức đơn giản nhất của hợp chất là : CH 4 . Vì công thức<br />
phân tử cũng chính là công thức đơn giản nên công thức hoá<br />
<strong>học</strong> của hợp chất là CH 4<br />
PTHH : Mg + 2HCl → MgCl 2 + H 2 (1)<br />
2Cu + O 2 t 0 2CuO (2)<br />
2 Mg + O 2 t 0 2 MgO (3)<br />
Cho hỗn hợp hai kim loại Mg và Cu vào dung dịch HCl chỉ có<br />
Mg phản ứng. Sau phản ứng (1) thử dung dịch bằng quì tím,<br />
quì tím không chuyển màu.Vậy HCl phản ứng hết<br />
Số mol HCl là: 7,3 : 36,5 = 0,2 mol<br />
Theo PTHH (1): n Mg = 1 2 n HCl = 0,1 mol<br />
=> Khối lượng Mg tham gia phản ứng (1) là: 0,1.24 = 2,4 g<br />
Giả sử Mg không còn dư thì khối lượng Cu là 11,2 – 2,4 = 8,8<br />
g<br />
Số mol Cu là 8,8 : 64 = 1,375 mol.<br />
Theo PTHH (2) n CuO = n Cu = 0,1375 mol<br />
=> Khối lượng oxit là: 0,1375. 80 = 11g trái với giả <strong>thi</strong>ết là 12<br />
gam oxit. Vậy Mg còn dư sau phản ứng (1)<br />
Gọi khối lượng Mg dư là x => Số mol Mg dư là: 24<br />
x .<br />
=> Khối lượng Cu là 8,8 – x => Số mol Cu là 8,8 64<br />
Theo PTHH(2) : n CuO<br />
= n Cu<br />
= 8,8 − x<br />
64<br />
Khối lượng CuO là : m CuO<br />
=<br />
(8,8 − x).80<br />
64<br />
Theo PTHH(3) : n MgO<br />
= n Mg<br />
= 24<br />
x .<br />
=<br />
(8,8 − x).5<br />
4<br />
DIỄN ĐÀN TOÁN - LÍ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
x 5. x<br />
=> m MgO<br />
= . 40 = 24 3<br />
(8,8 − x).5<br />
5. x<br />
Theo bài ra ta có phương trình: + = 12<br />
4<br />
3<br />
Giải phương trình tìm được x = 2,4. Vậy khối lượng Mg dư là<br />
− x<br />
0,2<br />
0,2<br />
0,2<br />
0,2<br />
0,2<br />
0,25<br />
0,25<br />
0,25<br />
0,25<br />
0,2<br />
0,2<br />
0,2<br />
0,1<br />
0,1<br />
0,1<br />
0,1<br />
0,2<br />
0,1<br />
0,1<br />
0,2<br />
0,2.<br />
0,2<br />
0,1<br />
0,1<br />
0,1<br />
0,1<br />
0,2<br />
Skype : daykemquynhon@hotmail.com<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
38<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial