Vận dụng thuyết lai hóa và thuyết sức đẩy giữa các cặp electron hóa trị dự đoán và giải thích dạng hình học của một số phân tử
https://app.box.com/s/aya9gaj7dfjup66v4qqulj8i0c7wh2n2
https://app.box.com/s/aya9gaj7dfjup66v4qqulj8i0c7wh2n2
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
https://twitter.com/daykemquynhon<br />
plus.google.com/+DạyKèmQuyNhơn<br />
http://daykemquynhon.ucoz.com<br />
Nơi bồi dưỡng kiến thức Toán - Lý - Hóa cho <strong>học</strong> sinh cấp 2+3 /<br />
Diễn Đàn Toán - Lý - Hóa Quy Nhơn 1000B Trần Hưng Đạo Tp.Quy Nhơn Tỉnh Bình Định<br />
www.facebook.com/daykem.quynhon<br />
https://daykemquynhon.blogspot.com<br />
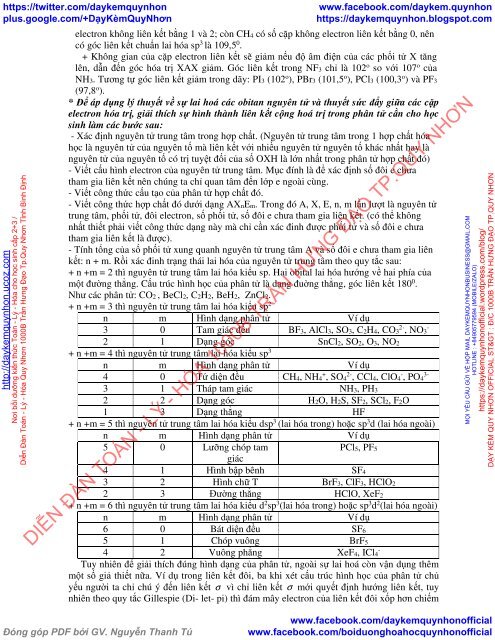
<strong>electron</strong> không liên kết bằng 1 <strong>và</strong> 2; còn CH4 có <strong>số</strong> <strong>cặp</strong> không <strong>electron</strong> liên kết bằng 0, nên<br />
có góc liên kết chuẩn <strong>lai</strong> <strong>hóa</strong> sp 3 là 109,5 0 .<br />
+ Không gian <strong>của</strong> <strong>cặp</strong> <strong>electron</strong> liên kết sẽ giảm nếu độ âm điện <strong>của</strong> <strong>các</strong> phối <strong>tử</strong> X tăng<br />
lên, dẫn đến góc <strong>hóa</strong> <strong>trị</strong> XAX giảm. Góc liên kết trong NF3 chỉ là 102 o so với 107 o <strong>của</strong><br />
NH3. Tương tự góc liên kết giảm trong dãy: PI3 (102 o ), PBr3 (101,5 o ), PCl3 (100,3 o ) <strong>và</strong> PF3<br />
(97,8 o ).<br />
* Để áp <strong>dụng</strong> lý <strong>thuyết</strong> về sự <strong>lai</strong> hoá <strong>các</strong> obitan nguyên <strong>tử</strong> <strong>và</strong> <strong>thuyết</strong> <strong>sức</strong> <strong>đẩy</strong> <strong>giữa</strong> <strong>các</strong> <strong>cặp</strong><br />
<strong>electron</strong> <strong>hóa</strong> <strong>trị</strong>, <strong>giải</strong> <strong>thích</strong> sự <strong>hình</strong> thành liên kết cộng hoá <strong>trị</strong> trong <strong>phân</strong> <strong>tử</strong> cần cho <strong>học</strong><br />
sinh làm <strong>các</strong> bước sau:<br />
- Xác định nguyên <strong>tử</strong> trung tâm trong hợp chất. (Nguyên <strong>tử</strong> trung tâm trong 1 hợp chất <strong>hóa</strong><br />
<strong>học</strong> là nguyên <strong>tử</strong> <strong>của</strong> nguyên tố mà liên kết với nhiều nguyên <strong>tử</strong> nguyên tố khác nhất hay là<br />
nguyên <strong>tử</strong> <strong>của</strong> nguyên tố có <strong>trị</strong> tuyệt đối <strong>của</strong> <strong>số</strong> OXH là lớn nhất trong <strong>phân</strong> <strong>tử</strong> hợp chất đó)<br />
- Viết cấu <strong>hình</strong> <strong>electron</strong> <strong>của</strong> nguyên <strong>tử</strong> trung tâm. Mục đính là để xác định <strong>số</strong> đôi e chưa<br />
tham gia liên kết nên chúng ta chỉ quan tâm đến lớp e ngoài cùng.<br />
- Viết công thức cấu tạo <strong>của</strong> <strong>phân</strong> <strong>tử</strong> hợp chất đó.<br />
- Viết công thức hợp chất đó dưới <strong>dạng</strong> AXnEm. Trong đó A, X, E, n, m lần lượt là nguyên <strong>tử</strong><br />
trung tâm, phối <strong>tử</strong>, đôi <strong>electron</strong>, <strong>số</strong> phối <strong>tử</strong>, <strong>số</strong> đôi e chưa tham gia liên kết. (có thể không<br />
nhất thiết phải viết công thức <strong>dạng</strong> này mà chỉ cần xác đinh được phối <strong>tử</strong> <strong>và</strong> <strong>số</strong> đôi e chưa<br />
tham gia liên kết là được).<br />
- Tính tổng <strong>của</strong> <strong>số</strong> phối <strong>tử</strong> xung quanh nguyên <strong>tử</strong> trung tâm A <strong>và</strong> <strong>số</strong> đôi e chưa tham gia liên<br />
kết: n + m. Rồi xác đinh trạng thái <strong>lai</strong> <strong>hóa</strong> <strong>của</strong> nguyên <strong>tử</strong> trung tâm theo quy tắc sau:<br />
+ n +m = 2 thì nguyên <strong>tử</strong> trung tâm <strong>lai</strong> <strong>hóa</strong> kiểu sp. Hai obital <strong>lai</strong> <strong>hóa</strong> hướng về hai phía <strong>của</strong><br />
<strong>một</strong> đường thẳng. Cấu trúc <strong>hình</strong> <strong>học</strong> <strong>của</strong> <strong>phân</strong> <strong>tử</strong> là <strong>dạng</strong> đuờng thẳng, góc liên kết 180 0 .<br />
Như <strong>các</strong> <strong>phân</strong> <strong>tử</strong>: CO2 , BeCl2, C2H2, BeH2, ZnCl2.<br />
+ n +m = 3 thì nguyên <strong>tử</strong> trung tâm <strong>lai</strong> <strong>hóa</strong> kiểu sp 2<br />
n m Hình <strong>dạng</strong> <strong>phân</strong> <strong>tử</strong> Ví dụ<br />
3 0 Tam giác đều BF3, AlCl3, SO3, C2H4, CO3 2- , NO3 -<br />
2 1 Dạng góc SnCl2, SO2, O3, NO2<br />
+ n +m = 4 thì nguyên <strong>tử</strong> trung tâm <strong>lai</strong> <strong>hóa</strong> kiểu sp 3<br />
n m Hình <strong>dạng</strong> <strong>phân</strong> <strong>tử</strong> Ví dụ<br />
4 0 Tứ diện đều CH4, NH4 + , SO4 2- , CCl4, ClO4 - , PO4 3-<br />
3 1 Tháp tam giác NH3, PH3<br />
2 2 Dạng góc H2O, H2S, SF2, SCl2, F2O<br />
1 3 Dạng thẳng HF<br />
+ n +m = 5 thì nguyên <strong>tử</strong> trung tâm <strong>lai</strong> <strong>hóa</strong> kiểu dsp 3 (<strong>lai</strong> <strong>hóa</strong> trong) hoặc sp 3 d (<strong>lai</strong> <strong>hóa</strong> ngoài)<br />
n m Hình <strong>dạng</strong> <strong>phân</strong> <strong>tử</strong> Ví dụ<br />
5 0 Lưỡng chóp tam<br />
PCl5, PF5<br />
giác<br />
4 1 Hình bập bênh SF4<br />
3 2 Hình chữ T BrF3, ClF3, HClO2<br />
2 3 Đường thẳng HClO, XeF2<br />
+ n +m = 6 thì nguyên <strong>tử</strong> trung tâm <strong>lai</strong> <strong>hóa</strong> kiểu d 2 sp 3 (<strong>lai</strong> <strong>hóa</strong> trong) hoặc sp 3 d 2 (<strong>lai</strong> <strong>hóa</strong> ngoài)<br />
n m Hình <strong>dạng</strong> <strong>phân</strong> <strong>tử</strong> Ví dụ<br />
6 0 Bát diện đều SF6<br />
5 1 Chóp vuông BrF5<br />
4 2 Vuông phẳng XeF4, ICl4 -<br />
Tuy nhiên để <strong>giải</strong> <strong>thích</strong> đúng <strong>hình</strong> <strong>dạng</strong> <strong>của</strong> <strong>phân</strong> <strong>tử</strong>, ngoài sự <strong>lai</strong> hoá còn vận <strong>dụng</strong> thêm<br />
<strong>một</strong> <strong>số</strong> giả thiết nữa. Ví dụ trong liên kết đôi, ba khi xét cấu trúc <strong>hình</strong> <strong>học</strong> <strong>của</strong> <strong>phân</strong> <strong>tử</strong> chủ<br />
yếu người ta chỉ chú ý đến liên kết σ vì chỉ liên kết σ mới quyết định hướng liên kết, tuy<br />
nhiên theo quy tắc Gillespie (Di- let- pi) thì đám mây <strong>electron</strong> <strong>của</strong> liên kết đôi xốp hơn chiếm<br />
DIỄN ĐÀN TOÁN - LÝ - HÓA 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
MỌI YÊU CẦU GỬI VỀ HỘP MAIL DAYKEMQUYNHONBUSINESS@GMAIL.COM<br />
HOTLINE : +84905779594 (MOBILE/ZALO)<br />
https://daykemquynhonofficial.wordpress.com/blog/<br />
DẠY KÈM QUY NHƠN OFFICIAL ST> : Đ/C 1000B TRẦN HƯNG ĐẠO TP.QUY NHƠN<br />
Đóng góp PDF bởi GV. Nguyễn Thanh Tú<br />
www.facebook.com/daykemquynhonofficial<br />
www.facebook.com/boiduonghoahocquynhonofficial