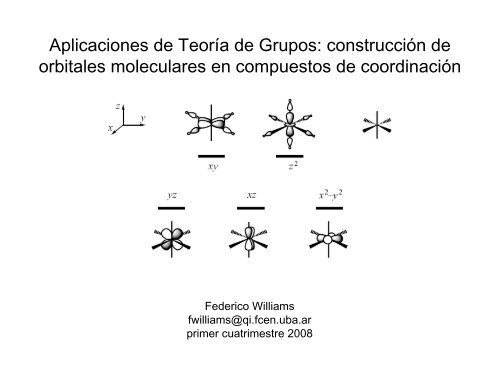
Aplicaciones de Teoría de Grupos: construcción de orbitales ...
Aplicaciones de Teoría de Grupos: construcción de orbitales ...
Aplicaciones de Teoría de Grupos: construcción de orbitales ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Aplicaciones</strong> <strong>de</strong> <strong>Teoría</strong> <strong>de</strong> <strong>Grupos</strong>: <strong>construcción</strong> <strong>de</strong><br />
<strong>orbitales</strong> moleculares en compuestos <strong>de</strong> coordinación<br />
Fe<strong>de</strong>rico Williams<br />
fwilliams@qi.fcen.uba.ar<br />
primer cuatrimestre 2008
La simetría <strong>de</strong> la CLAS <strong>de</strong> 2Hs<br />
Γ H = A 1 +0A 2 +0B 1 +B 2 = A 1 + B 2<br />
CLAS <strong>de</strong> los 2Hs:<br />
C 2v<br />
A 1<br />
B 1<br />
B 2<br />
ψ s - ψ s<br />
ψ s + ψ s<br />
1a 1 2 2a1 2 1b2 2 3a1 2 1b1 2<br />
E<br />
1<br />
1<br />
1<br />
C 2<br />
1<br />
-1<br />
-1<br />
b 2<br />
a 1<br />
σ xz<br />
1<br />
1<br />
-1<br />
σ yz<br />
1<br />
-1<br />
1<br />
Orbitales Moleculares <strong>de</strong> H 2 O (C 2v )<br />
z<br />
x<br />
y<br />
O<br />
b 2 (2p y)<br />
b 1 (2p x)<br />
a 1 (2p z)<br />
a 1 (2s)<br />
2b 2<br />
4a 1<br />
b 1<br />
3a 1<br />
1b 2<br />
2a 1<br />
2H<br />
b 2 (s - s)<br />
a 1 (s + s)<br />
H<br />
x<br />
z<br />
O<br />
H<br />
y
La simetría <strong>de</strong> las CLAS <strong>de</strong> 4Hs:<br />
Γ H = 4E+1C 3 +0C 2 +0S 4 +2σ d = A 1 + T 2<br />
H(3)<br />
T d<br />
A 1<br />
A 2<br />
E<br />
T 1<br />
T 2<br />
x<br />
z<br />
H(2)<br />
C<br />
H(1)<br />
(R x ,R y ,R z )<br />
(x,y,z)<br />
H(4)<br />
y<br />
x 2 +y 2 +z 2<br />
(2z 2 -x 2 -y 2 , x 2 -y 2 )<br />
(xz, yz, xy)<br />
Orbitales Moleculares <strong>de</strong> CH 4 (T d )<br />
C<br />
t 2 (2p x, 2p y, 2p z)<br />
a 1 (2s)<br />
3a 1<br />
2a 1<br />
2t 2<br />
1t 2<br />
t 2<br />
a 1<br />
t 2<br />
4H<br />
s 1+s 2-s 3-s 4<br />
t 2<br />
s 1-s 2+s 3-s 4<br />
t 2<br />
s 1-s 2-s 3+s 4<br />
a 1<br />
s 1+s 2+s 3+s 4
<strong>Teoría</strong> <strong>de</strong> Campo Cristalino: Estructura electrónica <strong>de</strong> compuestos <strong>de</strong> coordinación<br />
Consi<strong>de</strong>ra solo las interacciones electrostáticas<br />
entre los ligandos y el ión metálico.<br />
Consi<strong>de</strong>ramos a los ligandos como cargas puntuales<br />
que crean un campo electrostático <strong>de</strong> una simetría<br />
particular.<br />
Los pasos para estimar la energía <strong>de</strong> los <strong>orbitales</strong> d<br />
en un campo <strong>de</strong> una simetría particular son:<br />
1) Ion metálico aislado. 5 <strong>orbitales</strong> d son<br />
<strong>de</strong>generados<br />
2) Campo ligando promedio. Le energía <strong>de</strong> los<br />
<strong>orbitales</strong> d aumenta <strong>de</strong>bido a las repulsiones entre<br />
los electrones <strong>de</strong>l metal y el ligando.<br />
3) Campo ligando <strong>de</strong> una cierta simetría. Los<br />
<strong>orbitales</strong> d se divi<strong>de</strong>n <strong>de</strong> acuerdo a la simetría (se<br />
pue<strong>de</strong> ver <strong>de</strong> la tabla <strong>de</strong> caracteres).<br />
E<br />
1 2 3<br />
M<br />
free ion<br />
M<br />
the ion in an<br />
averaged<br />
ligand field<br />
x = (3/5)Δ o<br />
y = (2/5)Δ o<br />
Δ o<br />
M<br />
the ion in a<br />
sertain<br />
ligand field<br />
2x = 3y<br />
x + y = Δo x<br />
y
Campo Octaédrico: Compuestos <strong>de</strong> coordinación ML 6<br />
La teoría <strong>de</strong> grupos nos dice que un electron d en un entorno octaédrico<br />
pue<strong>de</strong> estar en dos estados. En uno pue<strong>de</strong> tener una <strong>de</strong> dos funciones <strong>de</strong><br />
onda (o su combinación lineal) que son la base para la representación E g en<br />
el grupo O h . En el otro estado pue<strong>de</strong> tener una <strong>de</strong> tres funciones <strong>de</strong> onda (o<br />
su combinación lineal) que son la base para la representación T 2g en el grupo<br />
O h . Por lo tanto, en el campo octaédrico <strong>de</strong> simetría O h los cinco <strong>orbitales</strong> d<br />
<strong>de</strong>generados se <strong>de</strong>sdoblan en <strong>orbitales</strong>, t 2g (d xy , d yz , d xz ) y e g (d x2-y2 , d z2 ) (ver la<br />
tabla <strong>de</strong> carcteres <strong>de</strong>l grupo <strong>de</strong> simetría puntual O h )<br />
Tres <strong>orbitales</strong> t 2g se estabilizan en 0.4Δ o y dos <strong>orbitales</strong> e g se <strong>de</strong>sestabilizan<br />
en 0.6Δ o<br />
O h<br />
…<br />
E g<br />
…<br />
T 2g<br />
…<br />
ion en el<br />
campo<br />
promedio<br />
e g<br />
t 2g<br />
Δ ο<br />
x<br />
y<br />
ion en el campo<br />
ligando octaedrico<br />
(2z 2 -x 2 -y 2 , x 2 -y 2 )<br />
(xz, yz, xy)<br />
2x = 3y<br />
x + y = Δo x = 0.6Δ o<br />
y = 0.4Δ o
En el caso tetraédrico los <strong>orbitales</strong> d se <strong>de</strong>sdoblan en: (1) <strong>orbitales</strong> t 2 (d xy , d xz ,<br />
d yz ) que son <strong>de</strong>sestabilizados y (2) <strong>orbitales</strong> e (d z2 , d x2-y2 ) que son estabilizados<br />
Δ<br />
y<br />
x<br />
Campo Tetraédrico: Compuestos <strong>de</strong> coordinación ML 4<br />
t 2<br />
e<br />
x = 0.6Δ o<br />
y = 0.4Δ o<br />
d x2-y2<br />
x<br />
3<br />
2<br />
Δ Octaédrico versus Δ Tetraédrico<br />
z<br />
1<br />
4<br />
4<br />
e<br />
y<br />
MX 4<br />
T d<br />
E<br />
T 2<br />
d yz<br />
x<br />
(2z 2 -x 2 -y 2 , x 2 -y 2 )<br />
3<br />
(xy, xz, yz)<br />
2<br />
z<br />
1<br />
4<br />
4<br />
t 2<br />
Si las cargas <strong>de</strong> los ligandos y<br />
la distancia M-L son las<br />
mismas entonces:<br />
Δ t / Δ o = 4 / 9<br />
Complejos tetraédricos<br />
son <strong>de</strong> campo débil<br />
y
Desdoblamiento <strong>de</strong> <strong>orbitales</strong> d correspondientes a los casos cúbico MX 8 (O h ), tetraédrico MX 4 (T d ),<br />
icosaédrico MX 12 (I h ), octaédrico MX 6 (O h ) y cuadrado plano MX 4 (D 4h ).<br />
I h<br />
H g<br />
A 1g<br />
B 1g<br />
B 2g<br />
E g<br />
…<br />
D 4h<br />
(2z 2 -x 2 -y 2 , x 2 -y 2 , xy, xz, yz)<br />
x 2 +y 2 , z 2<br />
x 2 -y 2<br />
xy<br />
(xz, yz)<br />
E<br />
ion libre<br />
campo<br />
ligando<br />
promedio<br />
Oh Td Ih Oh D4h cúbico<br />
cuadrado plano<br />
MX 8<br />
dyz dxz dxy e g<br />
t 2g<br />
d z2<br />
d x2-y2<br />
tetraédrico octaédrico<br />
MX 4<br />
dyz dxz dxy e<br />
t 2<br />
d z2<br />
d x2-y2<br />
MX 12<br />
h g<br />
MX 6<br />
d z2<br />
d x2-y2<br />
e g<br />
dyz dxz t2g dxy MX 4<br />
b 1g<br />
b 2g<br />
a 1g<br />
e g<br />
d x2-y2<br />
d xy<br />
d z2<br />
d yz<br />
d xz
Orbitales moleculares en compuestos <strong>de</strong> coordinación octaédricos con enlaces M-L σ<br />
CLAS <strong>de</strong> los ligandos y <strong>orbitales</strong><br />
<strong>de</strong>l metal según simetría O h<br />
Diagrama <strong>de</strong> interacción en<br />
complejos ML 6 con uniones σ<br />
Orbitales moleculares <strong>de</strong><br />
complejos ML 6 con uniones σ
Complejos octaédricos ML 6 (O h ) con enlaces M-L σ y π. Ligandos donores π.<br />
CLAS <strong>de</strong> los <strong>orbitales</strong> <strong>de</strong> los ligandos disponibles para<br />
la interacción π en complejos octaédricos es:<br />
Γr (π) = T1g + T2g + T1u + T2u El metal <strong>de</strong> transición tiene <strong>orbitales</strong> <strong>de</strong> simetría t 2g<br />
(d xy , d yz , d xz ) y t 1u (p x , p y , p z ) y no tiene <strong>orbitales</strong> <strong>de</strong><br />
simetría t 1g or t 2u . Los <strong>orbitales</strong> <strong>de</strong> simetría t 1u se<br />
utilizan para los enlaces σ con los 6 ligandos.<br />
Por lo tanto, enlaces p entre el metal y el ligando son<br />
solo posibles con <strong>orbitales</strong> <strong>de</strong>l ligando <strong>de</strong> simetría t 2g .<br />
Consi<strong>de</strong>ramos el caso <strong>de</strong> los <strong>orbitales</strong> t 2g <strong>de</strong> los<br />
ligandos ocupados (<strong>de</strong> menor energía) y los t 2g <strong>de</strong>l<br />
metal parcialmente ocupados: donación π ligandometal.<br />
Obtenemos dos OM t2g nuevos: 1t2g y 2t2g .<br />
La diferencia <strong>de</strong> energía entre los <strong>orbitales</strong> moleculares<br />
2t2g y eg y por lo tanto Δo disminuye.<br />
Por lo tanto la donación π <strong>de</strong>l ligando genera campos<br />
débiles. (halógenos, OH- , etc).<br />
Δ ο<br />
M 6 L π-GO's<br />
e g<br />
t 2g<br />
O h<br />
A 1g<br />
E g<br />
T 1g<br />
T 2g<br />
T 1u<br />
Δ ο<br />
(R x ,R y ,R z )<br />
(x,y,z)<br />
e g<br />
2t 2g<br />
1t 2g<br />
x 2 +y 2 +z 2<br />
(2z 2 -x 2 -y 2 , x 2 -y 2 )<br />
(xz, yz, xy)<br />
t 2g
Complejos octaédricos ML 6 (O h ) con enlaces M-L σ y π. Ligandos aceptores π.<br />
En el caso <strong>de</strong> ligandos aceptores π como CO,<br />
CN − etc. los <strong>orbitales</strong> <strong>de</strong> los ligandos adaptados<br />
por simetría <strong>de</strong> simetría t 2g (construidos a partir<br />
<strong>de</strong>l orbital π* CO ) están vacíos y con energía más<br />
alta que los correspondientes a los <strong>orbitales</strong> t 2g<br />
<strong>de</strong>l metal. Los dos <strong>orbitales</strong> e g <strong>de</strong>l metal no son<br />
modificados ya que no interaccionan con los t 2g<br />
<strong>de</strong>l ligando.<br />
El enlace π metal-ligando estabiliza al complejo<br />
aumentando Δ o .<br />
Por lo tanto los ligandos aceptores π generan<br />
campos fuertes.<br />
Δ ο<br />
M 6 L π-GO's<br />
e g<br />
t 2g<br />
Δ ο<br />
2t 2g<br />
e g<br />
1t 2g<br />
t 2g
Complejos octaédricos <strong>de</strong> campo fuerte y campo débil<br />
La energía <strong>de</strong> separación entre los <strong>orbitales</strong> t 2g (no ligantes) y e g (antiligantes) <strong>de</strong>pen<strong>de</strong> en primer or<strong>de</strong>n <strong>de</strong> la<br />
fuerza <strong>de</strong> la interacción σ entre el metal y los ligandos. El valor <strong>de</strong> esta diferencia <strong>de</strong> energía nos permite<br />
distinguir entre complejos <strong>de</strong> campo fuerte (Δ o gran<strong>de</strong>) y complejos <strong>de</strong> campo débil (Δ o pequeño). Mediciones<br />
espectroscópicas <strong>de</strong> las transiciones d-d permiten estimar el valor <strong>de</strong> Δ o y establecer la serie espectroquímica<br />
en la que or<strong>de</strong>namos los ligandos <strong>de</strong> acuerdo a la fuerza <strong>de</strong>l campo (valor <strong>de</strong> Δ o ) que crean.<br />
El valor <strong>de</strong> Δ o y por lo tanto el or<strong>de</strong>n <strong>de</strong> los ligandos en la serie espectroquímica no <strong>de</strong>pen<strong>de</strong> solo <strong>de</strong> las<br />
interacciones σ. En segundo or<strong>de</strong>n <strong>de</strong>pen<strong>de</strong> <strong>de</strong> las interacciones π que pue<strong>de</strong> disminuir el valor <strong>de</strong> Δ o<br />
(donores π tipo I − o Br − ) o aumentar el valor <strong>de</strong> Δ o (aceptores π, ligandos tipo CN − o CO).
Complejos tetraédricos ML 4 (T d ) con enlaces M-L σ<br />
CLAS <strong>de</strong> los ligandos tienen simetría a1 y t2.<br />
Γr (σ) = A1 + T2 M 4 L<br />
Δ t
Complejos tetraédricos ML 4 (T d ) con enlaces M-L σ y π<br />
CLAS <strong>de</strong> los <strong>orbitales</strong> <strong>de</strong> los ligandos disponibles<br />
para la interacción π en complejos tetraédricos es:<br />
Γ r (π) = E + T 1 + T 2<br />
Por lo tanto en complejos tetraédricos ML 4 con<br />
enlaces π M-L los <strong>orbitales</strong> <strong>de</strong>l metal e (d z2 , d x2-y2 ),<br />
t 1 y t 2 (p x , p y , p z ; d xz , d yz , d xy ) tienen simetría<br />
a<strong>de</strong>cuada para formar enlaces π con los ligandos.<br />
Solo dos <strong>orbitales</strong> e <strong>de</strong>l metal se pue<strong>de</strong>n utilizar<br />
para enlaces p dado que los t 2 se utilizan para<br />
enlaces M-L σ.<br />
Los aceptores π pue<strong>de</strong>n estabilizar el orbital<br />
molecular <strong>de</strong> simetría e aumentando Δ t .<br />
a 1<br />
t 2<br />
e, t 2<br />
Δ t<br />
e, t 1 , t 2<br />
a 1 , t 2
Complejos cuadrados planos ML 4 (D 4h ) con enlaces M−L σ
Combinaciones lineales adaptadas por simetría