Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
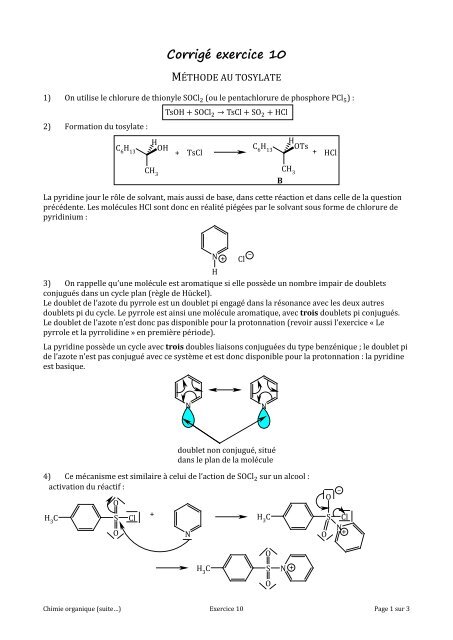
<strong>Corrigé</strong> exercice 10<br />
MÉTHODE AU TOSYLATE<br />
1) On utilise le chlorure de thionyle SOCl 2 (ou le pentachlorure de phosphore PCl 5) :<br />
2) Formation du tosylate :<br />
C 6 H 13<br />
H<br />
OH<br />
CH 3<br />
TsOH + SOCl 2 → TsCl + SO 2 + HCl<br />
+<br />
TsCl<br />
C 6 H 13<br />
H<br />
OTs<br />
+<br />
La pyridine jour le rôle de solvant, mais aussi de base, dans cette réaction et dans celle de la question<br />
précédente. Les molécules HCl sont donc en réalité piégées par le solvant sous forme de chlorure de<br />
pyridinium :<br />
_<br />
N + Cl<br />
H<br />
3) On rappelle qu’une molécule est aromatique si elle possède un nombre impair de doublets<br />
conjugués dans un cycle plan (règle de Hückel).<br />
Le doublet de l’azote du pyrrole est un doublet pi engagé dans la résonance avec les deux autres<br />
doublets pi du cycle. Le pyrrole est ainsi une molécule aromatique, avec trois doublets pi conjugués.<br />
Le doublet de l’azote n’est donc pas disponible pour la protonnation (revoir aussi l’exercice « Le<br />
pyrrole et la pyrrolidine » en première période).<br />
La pyridine possède un cycle avec trois doubles liaisons conjuguées du type benzénique ; le doublet pi<br />
de l’azote n’est pas conjugué avec ce système et est donc disponible pour la protonnation : la pyridine<br />
est basique.<br />
N N<br />
doublet non conjugué, situé<br />
dans le plan de la molécule<br />
<strong>Chimie</strong> organique (suite…) Exercice 10 Page 1 sur 3<br />
B<br />
CH 3<br />
4) Ce mécanisme est similaire à celui de l’action de SOCl2 sur un alcool :<br />
activation du réactif :<br />
C<br />
H 3<br />
O<br />
S<br />
Cl<br />
+<br />
O N<br />
C<br />
H 3<br />
C<br />
H 3<br />
O<br />
S<br />
O<br />
N +<br />
HCl<br />
O<br />
_<br />
S Cl<br />
O N<br />
+
puis réaction avec l'alcool :<br />
C<br />
H 3<br />
C<br />
H 3<br />
O<br />
S<br />
O<br />
octan-2-ol<br />
N + +<br />
R O H<br />
O<br />
S<br />
O<br />
+<br />
O R<br />
H<br />
+<br />
<strong>Chimie</strong> organique (suite…) Exercice 10 Page 2 sur 3<br />
C<br />
H 3<br />
N<br />
O<br />
O<br />
_<br />
O<br />
S<br />
H<br />
N +<br />
O<br />
+<br />
H C 3<br />
S O R +<br />
N +<br />
O<br />
H<br />
tosylate de l’octan-2-ol (B) ion pyridinium<br />
5)<br />
Branche de gauche : obtention de l’ester dextrogyre<br />
Il faut estérifier le (S)-octan-2-ol sans modifier la configuration du carbone asymétrique. La réaction<br />
est donc une estérification par l’acide éthanoïque (D). Cette réaction a été vue en terminale ! On<br />
rappelle que cette réaction est lente, doit être réalisée à chaud et en présence d’un acide fort comme<br />
catalyseur (acide sulfurique). Elle est de plus renversable. Pour éviter l’hydrolyse et ainsi obtenir de<br />
bons rendements en ester, il faut éliminer l’eau qui se forme au fur et à mesure.<br />
H O H H<br />
OH<br />
2SO4 cat<br />
+<br />
O<br />
S S<br />
+ H O<br />
OH<br />
2<br />
O<br />
CH 3<br />
Le carbone asymétrique n’est pas affecté par la réaction, c’est le carbone de l’acide carboxylique qui<br />
réagit. Le mécanisme sera revu en détail en deuxième année PC.<br />
Remarque : pour obtenir une réaction rapide et non renversable, on peut utiliser des dérivés d’acides<br />
carboxyliques comme le chlorure d’éthanoyle ou l’anhydride éthanoïque.<br />
Branche de droite : obtention de l’ester lévogyre<br />
En observant les pouvoirs rotatoires, on peut penser que C est l’énantiomère de l’ester précédent. Il y a<br />
donc eu inversion de configuration du carbone asymétrique, donc intervention d’un mécanismeSN2. Pour substituer un alcool par mécanisme SN2, il faut d’abord transformer OH pour obtenir un bon<br />
groupe partant, ici le tosylate : c’est le rôle de la première étape, dont on le mécanisme faisait l’objet<br />
de la question 4) :<br />
bon nucléofuge<br />
O<br />
H<br />
H O<br />
R<br />
OH +<br />
pyridine<br />
H C<br />
S Cl<br />
R O<br />
3<br />
S S<br />
S<br />
CH3 CH<br />
O<br />
3<br />
CH3 O<br />
chlorure de tosyle +<br />
(S)-octan-2-ol<br />
HCl<br />
A B<br />
capté par la<br />
pyridine (base<br />
faible)<br />
R<br />
CH 3
Le passage de B à C est une substitution nucléophile par mécanisme SN2 avec inversion de Walden :<br />
O<br />
O<br />
_<br />
O<br />
+<br />
R<br />
H<br />
S<br />
CH 3<br />
O<br />
O<br />
S<br />
O<br />
CH 3<br />
<strong>Chimie</strong> organique (suite…) Exercice 10 Page 3 sur 3<br />
O<br />
R<br />
H<br />
R C<br />
CH 3<br />
O<br />
_<br />
O S<br />
Le contre-cation est l’ion tétraéthylammonium. Cet ion est un catalyseur de transfert de phase : en<br />
raison de ses « pattes » hydrophobes, il permet d’entraîner l’anion CH 3COO − avec lui dans la phase<br />
organique pour qu’il y rencontre l’alcool.<br />
+<br />
O<br />
CH 3