Les Végétaux = Macrophytes (hydrophytes + helophytes) + Algues
Les Végétaux = Macrophytes (hydrophytes + helophytes) + Algues
Les Végétaux = Macrophytes (hydrophytes + helophytes) + Algues
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
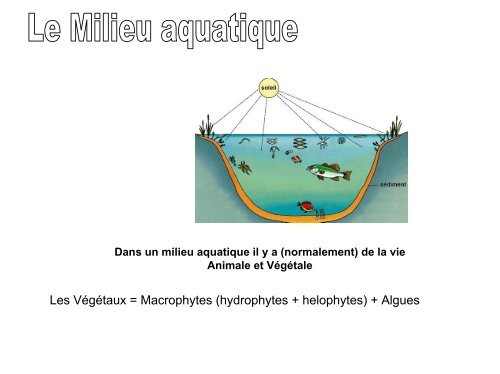
Dans un milieu aquatique il y a (normalement) de la vie<br />
Animale et Végétale<br />
<strong>Les</strong> <strong>Végétaux</strong> = <strong>Macrophytes</strong> (<strong>hydrophytes</strong> + <strong>helophytes</strong>) + <strong>Algues</strong>
<strong>Les</strong> algues sont des êtres vivants capables de photosynthèse dont le cycle de<br />
vie se déroule généralement en milieu aquatique.<br />
Tous les végétaux aquatiques ne sont cependant pas des algues :<br />
certaines Spermaphytes sont retournées secondairement à la<br />
conquête des eaux<br />
<strong>Les</strong> spermaphytes sont les plantes qui produisent des graines
<strong>Les</strong> spermaphytes sont les plantes qui produisent des graines<br />
Potamogeton pectinatus Ces <strong>Végétaux</strong> sont des HYDROPHYTES<br />
-<strong>hydrophytes</strong> flotteurs (les lentilles d'eau)<br />
-<strong>hydrophytes</strong> fixés (enracinés dans le sol)<br />
à feuilles flottantes (comme un nénuphar)<br />
à feuilles submerses (comme l'élodée)
Le phytoplancton : plancton végétal.<br />
Plus précisément il s'agit de l'ensemble des espèces de plancton autotrophes vis-avis<br />
du carbone (cyanobactéries aussi).
<strong>Les</strong> Chlorophycées : algues VERTES<br />
Selon la définition à laquelle on se réfère, le nom peut désigner :<br />
soit l'ensemble des algues vertes<br />
(référence scientifique ancienne passée dans la définition commune)<br />
soit seulement un groupe particulier d'algues vertes d'eau douce<br />
(référence scientifique actuelle).
<strong>Les</strong> cyanobactéries (cyanophycées) sous-classe de bactéries.<br />
Elles étaient autrefois appelées « algues bleues ».<br />
pigments bleus libérés par<br />
bactéries mortes<br />
sur les berges<br />
Certaines cyanobactéries ont parfois la particularité de pouvoir fixer l’N.<br />
Une quarantaine d’espèces de cyanobactéries sécrètent des cyanotoxines qui<br />
sont généralement des neurotoxines et hépatotoxines pouvant affecter<br />
mortellement divers animaux et l'homme.
Algue brune fréquente dans tous les milieux aquatiques.<br />
Entourée d'une coque de silice : le frustule qui résiste au temps<br />
Besoins en N, P mais aussi de Si
Dans un milieu aquatique il y a (normalement) de la vie<br />
Animale et Végétale<br />
Cette vie est possible car il y a :<br />
- Une source d’énergie de chaleur et de lumière<br />
- Une source d’aliments<br />
Lors des TP, vous allez évaluer la quantité d’aliments (nutriments) disponible pour les végétaux<br />
Vous devrez noter les conditions climatiques, permettant ainsi de pouvoir comparer entre groupes. En effet, les<br />
variations de luminosité sont plus rapides que de température (effet tampon de l’eau). L’effet journalier est<br />
important. On devrait dans l’absolu mesurer la luminosité avec un luxmètre mais sur la journée.<br />
Vous mesurerez la luminosité au dessus de l’eau<br />
et la température dans l’air et dans l’eau<br />
et
Pour les Animaux, la source d’alimentation est :<br />
- d’autres animaux<br />
- des végétaux
Pour les <strong>Végétaux</strong>, la source d’alimentation est ?<br />
Organismes autotrophes
C 106 H 263 O 110 N 16 P<br />
Rapport de Redfiel = Rapport C/N/P = 106/16/1<br />
(attention, on est en nombre d’atomes)<br />
N : 14 g/mol<br />
P : 31 g/mol<br />
N/P = 16/1 en nombre d’atomes<br />
Soit 16*14 g d’N pour 1*31 g de P<br />
donc 7,22 fois+ de N que de P (en masses)
C 106 H 263 O 110 N 16 P
C 106 H 263 O 110 N 16 P
C 106 H 263 O 110 N 16 P
C 106 H 263 O 110 N 16 P<br />
C 1484 g 48 g<br />
H 263 g 7,6 g<br />
O 1760 g 57 g<br />
N 224 g 7,2 g<br />
P 31 g 1 g<br />
Donc en théorie,si dans l’eau<br />
N/P > 7,2 : P limitant<br />
N/P < 7,2 : N limitant<br />
La composition algale est variable (pas systématiquement C 106 H 263 O 110 N 16 P)<br />
Donc on considère que si N/P > 10 : P limitant, N/P < 7 : N limitant
Lors des TP, vous allez évaluer la quantité d’aliments (nutriments) disponible pour les végétaux<br />
Si beaucoup d’apports de N et P EUTROPHISATION<br />
C.a.d. les formes d’N et de P
En milieu naturel non pollué, il y a<br />
+ de 16 atomes d’N pour chaque atome de P<br />
Si on apporte de l’N (NO 3 - ) quelle conséquences ?
Évolution d’un lac<br />
Qqs la vitesse d’évolution<br />
Productivité faible<br />
Eaux transparentes (bleu) Secchi jusqu’à 20m<br />
peu de MES ==> peu de sédimentation<br />
O2 jusqu’au fond<br />
pH ≈ 7<br />
Diatomées ; Chlorophycées<br />
Lottes (d’eau douce) ; Salmonidés (Truites)<br />
Ceinture de Vx large de 10 - 30 m<br />
oligotrophe<br />
eutrophe<br />
Apports du Bassin Versant ==> eutrophisation<br />
Comblement<br />
: Évolution naturelle<br />
Forte<br />
Eaux vertes (S < 1 m)<br />
Seston et MES ==> forte sédimentation<br />
O 2 en surface ; déficit au fond ( 8<br />
Diatomées et Cyanobactéries<br />
Brochets ; Cyprinidés<br />
5 - 10 m<br />
Comblement<br />
Réduction de<br />
la profondeur<br />
Colonisation<br />
totale / les<br />
végétaux
Évolution d’un lac : Évolution accélérée par l’action de l’homme<br />
Dystrophie<br />
Sédimentation<br />
Accumulation<br />
de MO<br />
Apports naturels (lessivage de la roche mère)<br />
Utilisation des nutriments et production<br />
NH 4 + ; NO3 - ; PO4 3-<br />
EQUILIBRE<br />
sédimentation<br />
minéralisation<br />
Apports anthropiques (déchets organiques ; P des<br />
lessives et engrais)<br />
NH +<br />
4 ; NO3 - ; PO4 3-<br />
P généralement limitant<br />
DESEQUILIBRE<br />
sédimentation<br />
minéralisation
Une grande partie des textes qui suivent sont issus du « Rodier »
N<br />
organique<br />
N Total<br />
N dissous N particulaire Distinction technique (pratique)<br />
par filtration<br />
N<br />
minérale<br />
N minérale<br />
Ce sont ces formes que vous<br />
allez doser en TP<br />
N<br />
organique<br />
N<br />
minérale<br />
NO 2 - : nitrites, azote nitreux<br />
NH 4 + : ammonium, azote ammoniacal<br />
NO 3 - : nitrates, azote nitrique<br />
NH 4 OH : ammoniaque<br />
NH 3 : ammoniac, azote ammoniacal aussi
En TP, vous allez donc collecter de l’eau dans un bidon d’1 L. Puis vous le filtrerez<br />
sur filtre GF/C (ce filtre doit avoir été pesé avant filtration pour une autre manip :<br />
l’estimation des MEST (Matières En Suspension Totales). Pour les MEST, vous<br />
devez également savoir quel volume exact d’eau a été filtré, car il est en effet<br />
possible que vous ne puissiez pas filtrer 1L complet car le filtre se colmate.<br />
Pour le dosage de N minérale dissous, vous allez donc récupérer l’eau qui a été<br />
filtrée, y ajouter le réactif approprié et passer au spectro<br />
Mort<br />
Fixation<br />
Etres vivants<br />
Matière organique<br />
N 2 (diazote atmosphérique)<br />
MO<br />
Minéralisation<br />
Ammonium<br />
NH 4 +<br />
Equilibre pH<br />
Dénitrification<br />
Nitrite<br />
NH 3<br />
NO 2 -<br />
Nitrate<br />
NO 3 -<br />
Ammoniac<br />
Nitrification
Méthodes de dosage en TP<br />
Vous mesurez le nitrate, le nitrite et l’ammonium par colorimétrie : soit par des trousses de<br />
terrain (comparaison au point d’équilibre de la couleur obtenue avec une grille de couleur pour<br />
obtenir les concentrations), soit sur des mini-spectros dédiés (longueur d’onde fixe) ou le gros<br />
spectro portatif. <strong>Les</strong> concentrations seront en mg/L.<br />
Attention :<br />
Expressions des concentrations ioniques: que ce soit dans les articles, rapports ou résultats<br />
des kits de mesure, on trouve deux unités pour les concentrations azotées. <strong>Les</strong> concentrations sont<br />
généralement données en ppm (parties par million (10 -6 ), ex : mg.l -1 ).<br />
Ces concentrations sont soit ioniques et exprimées en ppm NH 4 + , ppm NO2 - ou ppm NO3 - (par<br />
exemple) ; soit azote-ioniques et exprimées en ppm N-NH 4 + , ppm N-NO2 - ou ppm N-NO3 - .<br />
Sous l’unité ionique, nous tenons compte de la masse de l’ion complet, tandis que sous<br />
l’unité azote-ionique nous ne tenons compte que de la masse de l’azote dans cet ion : par exemple<br />
la première unité mesure la concentration des nitrates et la seconde la concentration de l’azote<br />
sous forme nitrate.<br />
Le choix de la bonne unité dépend de l’intention de l’étude. Par exemple en hydrobiologie où l’on<br />
s’intéressera à la toxicité du nitrite, on utilisera préférentiellement l’échelle ionique. Dans le cas<br />
d’études du cycle de l’azote à l’échelle de l’écosystème, afin de comparer les différents<br />
compartiments où l’azote ne se trouve pas forcément sous la même forme et d’éventuellement<br />
établir un bilan azoté total, on utilise presque systématiquement l’échelle azote-ionique.<br />
Pour passer d’une unité à une autre, la formule générale est :<br />
[ion] = masse de l’ion complet [ion-azote]<br />
masse de l’atome azote
Toutes les formes d'azote (azote organique, ammoniaque, nitrites, etc.) sont susceptibles<br />
d'être à l'origine des nitrates par un processus d'oxydation biologique. Dans les eaux<br />
naturelles non polluées, le taux de nitrates est très variable suivant la saison et l'origine<br />
des eaux; il peut varier de 1 à 15 mg/ L et une concentration de 2 ou 3 mg/ L peut être<br />
considérée comme normale. À l'origine du cours d'eau, la teneur en nitrates est très<br />
souvent comprise entre 0,05 et 0,2 mg/ L, puis elle s'élève progressivement jusqu'à<br />
quelques mg/ L le long du parcours au fur et à mesure que croît la distance aux sources.<br />
Sauf cas particuliers, les teneurs en nitrates des eaux des réseaux de distribution sont peu<br />
élevées; par contre, en zone rurale, certains puits à usage familial peuvent avoir des<br />
concentrations importantes.<br />
Depuis quelques années les années 90, il a été observé une élévation lente mais<br />
inexorable et sans amorce de stabilisation de la teneur en nitrates des eaux souterraines<br />
et superficielles de certaines régions; celle-ci est souvent liée au développement des<br />
élevages, à une fertilisation excessive des zones agricoles par les engrais (*), les fientes<br />
et fumiers divers, voire les boues de stations d'épuration. La migration des nitrates est<br />
nettement plus rapide sur les surfaces cultivables laissées nues pendant l'hiver. <strong>Les</strong> rejets<br />
des collectivités et occasionnellement de certaines industries (engrais, explosifs, oxydants)<br />
peuvent aussi concourir à l'enrichissement en nitrates des eaux superficielles.<br />
L'accroissement, particulièrement significatif dans certaines nappes, varie en raison<br />
inverse de la profondeur. <strong>Les</strong> eaux météoriques contiennent aussi des nitrates en<br />
provenance de l'ammoniaque et des oxydes d'azote présents dans l'atmosphère, dont une<br />
partie est liée à la combustion des produits fossiles (charbon, fuel) et à l'utilisation des<br />
hydrocarbures.
L'accroissement de la pollution atmosphérique contribue à une augmentation de l'apport des<br />
composés azotés au sol qui est actuellement de l'ordre de 17 kg d'azote par hectare et par an.<br />
<strong>Les</strong> nitrates participent aux phénomènes d'eutrophisation (voir Phosphore) ; en période de<br />
faible oxygénation (période estivale) les nitrates peuvent jouer le rôle de donneurs d'oxygène<br />
et éviter l'anaérobiose. En ce qui concerne les eaux destinées à la consommation humaine,<br />
une enquête du ministère de la Santé réalisée en France en 1981 a montré qu'environ 2 % de<br />
la population consommait une eau dont la teneur moyenne en nitrates dépassait 50 mg / L<br />
(NO3-); pour 1 230 000 habitants, elle était comprise entre 50 et 100 mg/ L (N03-) et pour<br />
32000 habitants, elle dépassait 100 mg/L (NO3-). Plus des trois quarts de la population<br />
concernée se situent dans une quinzaine de départements du Nord, et de l'Ouest, dans les<br />
régions Nord, Picardie, Bretagne, lIe-de-France, Pays de la Loire, Centre et Poitou-Charentes.<br />
<strong>Les</strong> distributions rurales sont proportionnellement plus atteintes que les réseaux urbains.<br />
Dans 90 % des cas, les eaux contaminées sont des eaux souterraines généralement en<br />
provenance de nappes de faible puissance situées dans des zones de cultures maraîchères;<br />
la pollution peut aussi se développer dans des grandes nappes situées dans des régions de<br />
cultures intensives. Une enquête, réalisée en France en 1993, a montré que 0,8 % des unités<br />
de distribution desservant plus de 10000 habitants distribuaient une eau dont la teneur<br />
moyenne en nitrates était supérieure ou égale à 50 mg/L.<br />
<strong>Les</strong> nitrates ont une toxicité indirecte par le fait qu'ils se transforment en nitrites; en ce qui<br />
concerne la toxicité à long terme, les enquêtes épidémiologiques, statistiquement valables ne<br />
font pas apparaître de phénomènes de cancérogénèse avec ces deux types de sels. Aux<br />
États-Unis et en Europe, il a été reconnu que l'eau chargée en nitrates employée pour la<br />
préparation des biberons de lait en poudre était susceptible de faire apparaître chez les<br />
nourrissons une cyanose liée à la formation de méthémoglobine. Cette intoxication, provoquée<br />
par l'absorption de petites doses de nitrates, est en réalité due aux nitrites formés par<br />
réduction des nitrates sous l'influence d'une action bactérienne.
<strong>Les</strong> possibilités de prévention de la pollution des eaux par les nitrates résident:<br />
-dans une meilleure maîtrise de la fertilisation avec réadaptation de certaines pratiques<br />
agricoles;<br />
- dans la limitation des rejets insuffisamment contrôlés, d'eaux usées et de résidus divers;<br />
- dans le renforcementdes périmètres de protection.<br />
En dehors de l'amélioration de la qualité par la dilution avec des eaux de meilleure qualité par<br />
interconnection de réseau, il apparaît souvent que l'on est conduit à rechercher une autre<br />
ressource. <strong>Les</strong> méthodes d'élimination des nitrates en excès sont techniquement au point, mais<br />
les prix de revient élevés en ont jusqu'ici limité le développement.<br />
Voir aussi<br />
Banas D., Lata J.C. (2006) <strong>Les</strong> Nitrates. Dans : Le livre blanc des polluants de<br />
l’habitat.<br />
http://pagesperso-orange.fr/sylvie.tarantino/LB%20polluant%20habitat/NitrateLB.pdf
En l'absence de pollution, il n'y a pas ou très peu de nitrites dans les eaux et dans les zones<br />
où l'auto-épuration est active; les teneurs se maintiennent à des niveaux très faibles (de<br />
l'ordre,de 0,01 mg/L). En dessous d'un centième de mg/L, les eaux peuvent être considérées<br />
comme pures ou se trouvant sous l'action d'une auto-épuration active, en présence de<br />
quelques dizièmes de mg/L la pollution est sensible, celle-ci devient significative au-delà de 1<br />
mg/ L.<br />
<strong>Les</strong> nitrites proviennent soit d'une oxydation incomplète de l'ammoniaque, la nitrification<br />
n'étant pas conduite à son terme, soit d'une réduction des nitrates sous l'influence d'une<br />
action dénitrifiante. Une eau qui renferme des nitrites est à considérer comme suspecte car<br />
lui est souvent associée une détérioration de la qualité microbiologique.<br />
Cependant, pour l'interprétation définitive des résultats, il sera nécessaire de tenir compte<br />
des teneurs en nitrates, en azote ammoniacal, en matières organiques et de l'examen<br />
bactériologique. Il est important de signaler que les eaux en contact avec certains terrains et<br />
certaines conduites peuvent contenir des nitrites indépendamment de toute souillure. On<br />
trouve aussi quelquefois des nitrites non liés à une pollution dans les eaux pauvres en<br />
oxygène (sondages profonds...). Leur présence a été signalée dans les eaux de pluie et<br />
dans les eaux provenant de la fonte des neiges du fait de la pollution atmosphérique par les<br />
oxydes d'azote.
L'habitude a été prise de désigner sous le vocable ammoniaque des formes ionisées (NH 4 + ) et<br />
non ionisées (NH 3 ). L'azote ammoniacal est assez souvent rencontré dans les, eaux et traduit<br />
habituellement un processus de dégradation incomplète de la matière organique.<br />
Immédiatement en aval des foyers de pollution, on trouve souvent des teneurs de l'ordre de<br />
0,5 à 3 mg/L tandis que les teneurs en nitrites et en nitrates sont relativement faibles. Plus en<br />
aval, les teneurs en azote ammoniacal diminuent et celles des nitrites puis des nitrates<br />
augmentent. D'une façon générale, l'ammoniaque se transforme assez rapidement en nitrites<br />
et nitrates par oxydation.<br />
En France, l'inventaire des eaux de surface de 1976 faisait apparaître que 80 % des points de<br />
mesure avaient des teneurs moyennes inférieures à 0,025 mg/ L (en NH 3 ). Dans le cas de<br />
prises d'eaux situées en aval de très grandes agglomérations, on peut trouver des valeurs<br />
nettement plus élevées. En ce qui concerne les eaux destinées à la consommation humaine,<br />
une enquête du ministère de la Santé réalisée en France en 1993 a montré que 99,7% des<br />
unités de distribution desservant plus de 10000 habitants distribuaient une eau dont la teneur<br />
en ammonium était inférieure à 0,5 mg/ L. L'azote ammoniacal des eaux superficielles peut<br />
avoir pour origine : la matière végétale des cours d'eau, la matière organique animale ou<br />
humaine (l'homme élimine 15 à 30 g d'urée par jour); les rejets industriels, les engrais, etc. Sa<br />
présence est à rapprocher des autres éléments azotés identifiés dans l'eau : nitrites et nitrates,<br />
et des résultats de l'analyse bactériologique.
Pour l'eau destinée à la consommation humaine, en raison de problèmes particuliers susceptibles<br />
d'introduire une gêne pour le consommateur (goût, odeur), l'OMS recommande comme valeur<br />
limite pour l'ammonium 1,5 mg/ L. <strong>Les</strong> directives du Conseil des communautés européennes<br />
indiquent une concentration maximale admissible de 0,5 mg/L et un niveau guide de 0,05 mg/L. La<br />
réglementation française retient comme teneur limite 0,5 mg/L.<br />
En ce qui concerne la toxicité de l'ammoniaque pour la faune piscicole d'eau douce, il est reconnu<br />
que ce n'est pas la forme ammoniaque ionisé (NH +<br />
4 ) qui est toxique mais la forme ammoniaque<br />
non ionisée (NH3 ) dont la proportion dépend du pH et de la température. La concentration en<br />
ammoniaque non ionisée peut être calculée selon la formule suivante (Pihan et Landragin, 1985) :<br />
N-NH3 = N-NH +<br />
4 × 1/[1+10(10-pH-0,03 T)]<br />
avec N-NH3 et N-NH +<br />
4 en mg.L-1 NH3 %<br />
NH +<br />
4 %<br />
100<br />
0<br />
T : la température en °C.<br />
Le seuil de sensibilité à long terme quelle que soit la vie piscicole<br />
serait de 0,3 mg/L de NH3. La toxicité s'élève rapidement et<br />
devient aiguë selon les espèces entre 0,6 et 1,5 mg/ L, les<br />
salmonidés étant les plus sensibles. En dessous d'une<br />
concentration de 0,1 mg/ L, il ne se passe généralement rien mais<br />
le seuil de sécurité devrait se situer aux environs de 0,02 à 0,04<br />
mg/L de NH3. L'élévation de température diminue légèrement la<br />
toxicité, par contre les fortes teneurs en CO2 et les faibles teneurs<br />
en oxygène l'accroissent. La présence permanente d'ammoniaque<br />
à faible dose crée une certaine accoutumance des poissons à la<br />
toxicité. Par contre, l'exposition répétée avec des intervalles de<br />
temps courts peut conduire à une toxicité cumulative, l'élimination<br />
à partir de l'organisme étant très lente.<br />
80<br />
60<br />
40<br />
20<br />
0<br />
25°C<br />
10°C<br />
20<br />
40<br />
60<br />
80<br />
100<br />
6 8 10 12 pH
Alabaster et Lloyd (1980) rapportent que la CL 50 -96h est de 0,35 mg.L -1 pour la<br />
perche et de 0,42 mg.L -1 pour le gardon. Marcel (1996) indique une CL 50 24h de 0,6<br />
mg.L -1 pour la Carpe ainsi qu'une toxicité à long terme à des expositions de 0,006<br />
mg.L -1 pour la truitelle, de 0,003 mg.L -1 pour la truite et de 0,06 mg.L -1 pour le<br />
poisson-chat.<br />
Pihan et Landragin (1985) notent la relation suivante entre la CL 50 à long terme du<br />
poisson et la teneur en oxygène dissous dans l'eau :<br />
CL 50 N-NH 3 = 0,13 + (0,0027 × O 2 )<br />
avec O 2 en pourcentage de saturation et N-NH 3 en mg.L -1 .<br />
Conseil des communautés européennes du 18 juillet 1978 concernant la qualité<br />
des eaux douces aptes à la vie des poissons fixe un certain nombre de valeurs<br />
pour ce paramètre (voir tableau ci-après).<br />
Le brassage des vases des cours d'eau peut entraîner la libération d'eaux<br />
interstitielles très riches en ammoniaque.
<strong>Les</strong> phosphates font partie des anions facilement fixés par le sol; leur présence naturelle dans les<br />
eaux est liée aux caractéristiques des terrains traversés et à la décomposition de la matière<br />
organique. Des teneurs supérieures à 0,5 mg/L doivent constituer un indice de pollution. Dans les<br />
zones phosphatières, la plupart des eaux contiennent des quantités quelquefois importantes de<br />
phosphates, souvent associés à des fluorures. Dans les eaux de puits, la présence de phosphates<br />
peut avoir pour origine une infiltration en provenance de fosses d'aisance ou de dépôts de fumier<br />
(purin). <strong>Les</strong> eaux de surface ou de nappes peuvent être contaminées par des rejets industriels<br />
(industries agro-alimentaires, ateliers de traitement de surface, laveries) et domestiques ou par le<br />
lessivage des terres cultivées renfermant des engrais phosphatés ou traités par certains pesticides.<br />
<strong>Les</strong> phosphates échappent en majeure partie (80 %) au traitement des stations d'épuration<br />
biologique classiques et de ce fait, se retrouvent dans les rejets. Cependant, la déphosphatation<br />
biologique par ajout d'une zone anaérobie en tête d'un système à boues activées a donné lieu à un<br />
certain nombre de développements techniques. <strong>Les</strong> traitements physico-chimiques de<br />
coprécipitation peuvent éliminer de 80 à 85 % de phosphates suivant le réactif utilisé et le pH.<br />
Le phosphore peut se trouver sous différentes formes oxydées; sous la forme acide, on trouve les<br />
acides méta (HP0 3 ), pyro (H 4 P 2 0 7 ) et ortho (H 3 P0 4 ). En milieu aqueux, les acides méta et pyro<br />
tendent vers une forme plus stable: l'orthophosphate. Pratiquement, c'est sous cette forme qu'on le<br />
rencontre dans les eaux superficielles dont le pH est compris entre 5 et 8.<br />
<strong>Les</strong> directives du Conseil des communautés européennes indiquent comme teneur du phosphore<br />
dans l'eau destinée à la consommation humaine un niveau guide de 0,4 mg/ L et une concentration<br />
maximale admissible de 5 mg/ L exprimée en P 2 O 5 . La réglementation française retient cette même<br />
valeur limite de 5 mg/ L.
Le phosphore joue un rôle important dans le développement des algues; il est susceptible de<br />
favoriser leur multiplication dans les réservoirs et les eaux des lacs, où il contribue à<br />
l'eutrophisation, phénomène évolutif au cours duquel le milieu s'enrichit en matières nutritives<br />
d'une manière excessive, et par voie de conséquence, en algues et phytoplancton. Il en<br />
résulte une véritable dégradation, qui peut devenir irréversible. <strong>Les</strong> éléments responsables de<br />
cet enrichissement sont essentiellement le phosphore et l'azote (un individu élimine environ<br />
1,5 à 3 g d'anhydride phosphorique et 10 à 20 g d'azote par jour), mais le potassium, le<br />
magnésium, les sulfates et certains oligo-éléments peuvent y prendre une part active. Dans<br />
les eaux usées, la part des rejets humains en 1996 ne représentait que 30 à 50 % du<br />
phosphore total (entre 5 et 20 mg/L), le reste provenait des produits de nettoyage. II est<br />
considéré que 1 mg de phosphore peut contribuer à l'élaboration de 70 à 80 mg de matières<br />
organiques. Mais il est difficile de fixer des limites de concentration au-delà desquelles<br />
l'eutrophisation est certaine, car des facteurs morphométriques, hydrologiques, optiques et<br />
climatiques entrent en jeu. <strong>Les</strong> sources d'éléments «eutrophisants» peuvent être diffuses<br />
(apports terrigènes ou éoliens) ou ponctuelles. Dans ce cas, il s'agit surtout des déchets<br />
domestiques et industriels qui contiennent, parfois en quantités très importantes, des matières<br />
organiques fermentescibles. L'effet de ces rejets est d'autant plus marqué s'ils sont pratiqués<br />
dans des zones fermées (étangs côtiers, estuaires, rades) peu propices à un renouvellement<br />
des eaux et où sont créées, dans le benthos, des conditions anaérobies.
<strong>Les</strong> caractéristiques principales de l'eutrophisation sont:<br />
- la multiplication des algues et du plancton qui réduit le passage de la lumière, accroît la<br />
consommation d'oxygène et s'accompagne d'une modification profonde de la faune, tant en<br />
quantité qu'en qualité. L'évolution peut aller de l'élimination de certaines espèces (les espèces<br />
nobles disparaissent alors au profit d'autres indésirables) jusqu'à la cessation de la vie<br />
aquatique;<br />
- la modification des paramètres physico-chimiques du milieu. Suivant le développement de la<br />
situation, on passera d'un système oligotrophe à un système mésotrophe pour aboutir à un<br />
système eutrophique caractérisé par une anaérobiose généralisée.<br />
Quelles qu'elles soient, ces modifications ont une incidence, directe ou indirecte, sur l'homme.<br />
La dégradation des qualités organoleptiques de l'eau (odeur, saveur, turbidité, couleur...)<br />
bouleverse les conditions d'utilisation, ne serait-ce qu'en raison de son aspect inesthétique<br />
(putréfaction). Pour les usages industriels, la quantité de phosphates doit être d'autant plus<br />
limitée que la pression des générateurs de vapeur est plus élevée. Dans la fabrication de la<br />
bière, la présence de phosphates peut modifier l'arôme et diminuer la résistance de la boisson à<br />
l'action bactérienne. <strong>Les</strong> phosphates minéraux naturels contiennent certains radioéléments tels<br />
que le thorium, l'uranium et son descendant le radium 226 dans des proportions de l'ordre du<br />
becquerel par gramme de minerai. Approximativement 1 % du radium 226, 60 à 80 % de<br />
l'uranium présent dans les minerais sont dissous par le traitement acide au cours de la<br />
fabrication des engrais; la majeure partie du radium reste dans les gypses.<br />
Voir aussi :<br />
Banas D., Lata J.C. (2006) <strong>Les</strong> phosphates. Dans : Le livre blanc des polluants de l’habitat.<br />
http://pagesperso-orange.fr/sylvie.tarantino/LB%20polluant%20habitat/PhosphateLB.pdf
Le pH d'une eau représente son acidité ou son alcalinité; à pH 7 une eau est dite neutre, à un pH<br />
inférieur à 7 une eau dite acide et à un pH supérieur à 7, elle est dite basique.<br />
Étant donné le pouvoir tampon de l'eau et sauf dans le cas de rejets industriels particuliers, il est rare<br />
que le pH soit une contre-indication à la potabilité.<br />
C'est cependant l'un des paramètres parmi les plus importants de la qualité de l'eau. Il doit être<br />
étroitement surveillé au cours de toutes opérations de traitement. Le pH des eaux naturelles est lié à la<br />
nature des terrains traversés, il varie habituellement entre 7,2 et 7,6. C'est d'ailleurs à l'intérieur de ces<br />
deux valeurs que se situe généralement le pH des eaux distribuées aux collectivités.<br />
D'une façon générale, les eaux très calcaires ont un pH élevé et celles provenant de terrains pauvres en<br />
calcaires ou siliceux ont un pH voisin de 7 et quelquefois un peu inférieur (environ 6). C'est aussi le cas<br />
dans les zones supérieures de certains ruisseaux lorsqu'une minéralisation suffisante ne s'est pas<br />
encore développée. <strong>Les</strong> eaux de certaines régions volcaniques peuvent être acidifiées par de l'acide<br />
sulfurique.<br />
En pratique, les eaux ayant un pH inférieur à 6 ou supérieur à 8 sont rares. Des pH supérieurs à 8,5 ne<br />
s'observent généralement que dans les eaux stagnantes (marais, étangs, barrages) où la réaction<br />
ionique est influencée par la photosynthèse de la végétation et la nature chimique des fonds avec<br />
déplacement de l'équilibre carbonique.<br />
Le pH est un élément important pour définir le caractère agressif ou incrustant d'une eau. Il intervient<br />
dans ces phénomènes complexes avec d'autres paramètres comme la dureté, le dioxyde de carbone,<br />
l'alcalinité et la température.<br />
Un pH inférieur à 7 peut conduire à la corrosion du ciment ou des métaux des canalisations avec<br />
entraînement de plomb par exemple. Un pH élevé peut conduire à des dépôts incrustants dans les<br />
circuits de distribution.<br />
De plus, au-dessus de pH 8, il y a une diminution progressive de l'efficacité de la décontamination<br />
microbienne par le chlore. Par ailleurs, la chloration diminue le pH.
Pour l'eau destinée à la consommation humaine, l'OMS ne fixe pas de valeur mais précise qu'un faible<br />
pH peut poser des problèmes de corrosion et un pH élevé entraîner des problèmes de goût et de<br />
consommation accrue de savon: elle recommande un pH inférieur à 8 pour une bonne désinfection par<br />
le chlore. <strong>Les</strong> directives du Conseil des communautés européennes précisent que l'eau ne doit pas être<br />
agressive et indiquent comme niveau guide : 6,5 ≤ pH ≤ 8,5 avec une valeur maximale admissible de<br />
9,5; elles rappellent que les valeurs du pH ne s'appliquent pas aux eaux conditionnées. La<br />
réglementation française précise que le pH de l'eau potable doit être supérieur ou égal à 6,5 et inférieur<br />
ou égal à 9 ; cette obligation ne s'applique pas aux eaux conditionnées non minérales.<br />
Pour les eaux de piscine, il est intéressant de les ajuster au pH des larmes (7,4); la réglementation<br />
française indique que le pH doit être compris entre 6,9 et 8,2.<br />
Le pH joue un rôle important dans les traitements de floculation et de coagulation.<br />
La correction des tendances agressives de l'eau s'effectue soit par aération, soit par adjonction de<br />
carbonate de calcium, soit par filtration sur des alcalino-terreux.<br />
La valeur du pH compatible avec la vie des poissons est comprise entre 5 et 9. Cependant, pour la<br />
plupart des espèces aquatiques, la zone de pH favorable se situe entre 6 et 7,2. Toutefois, cette valeur<br />
ne doit pas être séparée de celle des autres paramètres (température, oxygène dissous, salinité, etc.).<br />
Ainsi a pH alcalin, une large partie de NH 4 + se retrouve sous forme de NH3 qui est très toxique pour la<br />
vie aquatique. En dehors des problèmes de pollution chimique, les eaux très alcalines peuvent présenter<br />
des peuplements riches et diversifiés.<br />
Méthodes de dosage<br />
Deux principales méthodes de dosage : soit par colorimétrie (papier pH), soit par une<br />
méthode électrométrique = ddp entre électrode de verre et électrode de référence (comme<br />
le calomel) qui est une fonction linéaire du pH. Vous utiliserez un pH-mètre, qui aura été<br />
préalablement étalonné, et qui prendra les mesures en compensant automatiquement la<br />
température.
L'alcalinité d'une eau correspond à la présence d'hydrogénocarbonates (HCO 3 - ), de carbonates<br />
(CO 3 2- ), d'ions hydroxydes (OH-) et d'une façon plus limitée, aux ions silicates (HSiO3 2- ),<br />
phosphates (PO 4 3- ) ou encore aux espèces moléculaires des acides faibles. On distingue<br />
le titre alcalimétrique (TA) qui mesure la teneur de l'eau en alcalis libres et en carbonates alcalins<br />
caustiques,<br />
du titre alcalinométrique complet (TAC) qui correspond à la teneur en alcalis libres, carbonates et<br />
hydrogénocarbonates.<br />
Dans les eaux naturelles, l'alcalinité, exprimée en HCO 3 - varie de 10 à 350 mg/ L. Certains lacs<br />
oligotrophes (lacs pyrénéens), les eaux périglaciaires et les cours supérieurs des réseaux en région<br />
siliceuse ont généralement des teneurs inférieures à 25 mg/ L. Une alcalinité comprise entre 25 et<br />
50 mg/ L se rencontre dans la plupart des cours d'eau en région à substrat acide (Massif central,<br />
Bretagne,Vosges). Dans les régions calcaires (Jura, Normandie, Rhône inférieur), l'alcalinité varie<br />
de 100 à 250 mg/L. L'alcalinité dépend aussi des rejets urbains (phosphates, ammoniaque,<br />
matières organiques, etc.) ou industriels (apports acides ou basiques). Elle peut donner une<br />
indication sur le degré d'oxydation des composés organiques (eaux residuaires, eaux issues de<br />
tourbières ou de ruisseaux forestiers). Dans les eaux de distribution, la concentration en OH- est<br />
faible, l'alcalinité de l'eau est constituée par des hydrogénocarbonates ou par un mélange de<br />
carbonates/hydrogénocarbonates. Pour une eau ne contenant que des hydrogénocarbonates, TA =<br />
0, TAC= HCO 3 - . Pour une eau contenant un mélange carbonates/hydrogénocarbonates,<br />
TA = CO 3 2- / 2<br />
et TAC = HCO 3 - + 2TA<br />
Pour les eaux adoucies ou déminéralisées livrées à la consommation humaine, les directives du<br />
Conseil des communautés européennes et la réglementation française précisent que l'alcalinité ne<br />
doit pas être inférieure à 2,5 degrés français.
La mesure de la conductivité permet d'évaluer rapidement mais très<br />
approximativement la minéralisation globale de l'eau et d'en suivre l'évolution. D'une<br />
façon générale, la conductivité s'élève progressivement de l'amont vers l'aval des<br />
cours d'eau, les écarts sont d'autant plus importants que la minéralisation initiale est<br />
faible, en particulier dans les zones à substrat acide ou à sous-sol siliceux. Dans le<br />
cas d'un contrôle de distribution d'eau potable, l'intérêt de cette méthode ne réside pas<br />
dans une seule mesure mais dans une série de déterminations ou d'enregistrements<br />
en continu qui permettront de déceler les variations de composition pouvant signaler<br />
des arrivées d'eau susceptibles d'être polluées. Dans les eaux de surface et les rejets<br />
d'eaux usées, des modifications importantes de la conductivité peuvent intervenir<br />
rapidement au cours de la journée. On peut admettre que la situation est particulière<br />
ou anormale au-delà de<br />
2000 µS/cm. En France, environ 90% des eaux superficielles ont une conductivité<br />
inférieure à 1000 µS/cm. En ce qui concerne les eaux destinées à la consommation<br />
humaine, une enquête du ministère de la Santé réalisée en France en 1981 a montré<br />
qu'environ 2 % de la population reçoit<br />
Une eau dont la conductivité électrique est supérieure à 1000 µS/cm et que prèsde<br />
90% de la population reçoit une eau dont la conductivité électrique est comprise entre<br />
200 et 1000 µS / cm.<br />
Ces valeurs sont à rapprocher de la conductivité d'une eau déminéralisée très pure qui<br />
est de l'ordre de 0,042 µS/cm et de celle des eaux saumâtres et de l'eau de mer qui<br />
varie entre 10000 et 30000 µS/cm.
<strong>Les</strong> directives du Conseil des communautés européennes relatives à la qualité<br />
des eaux destinées à la consommation humaine indiquent pour la conductivité un<br />
niveau guide de 400 µS/cm à 20 °C. Il est à noter que les directives ne font pas<br />
état de valeur maximale admissible mais si l'on retient une limite de 1,5 g pour les<br />
résidus secs, l'équivalent en conductivité serait<br />
de l'ordre de 2000 µS / cm. La réglementation française prévoit des contrôles<br />
complémentaires dans le cas où la conductivité s'écarte de 400 µS / cm à 20°C.<br />
Une conductivité de l'eau supérieure à 1500 µS/cm fait considérer une eau comme<br />
difficilement utilisable dans les zones irriguées. Pour les usages industriels,<br />
l'interprétation des résultats doit se faire en fonction d'une analyse complète de<br />
l'eau. Il faut retenir, pour le contrôle des rejets industriels, que la conductivité ne<br />
reflète qu'une minéralisation globale et ne permet pas d'identifier les éléments<br />
chimiques en cause.
La turbidité est mesurée par néphélométrie à l'aide d'un turbidimètre de laboratoire et<br />
exprimée en UTN (Unité de Turbidité Néphélométrique).<br />
La néphélométrie, aussi appelée néphélémétrie, fait partie de la photométrie des milieux<br />
troubles. Elle mesure la lumière diffusée et nécessite l'emploi d'un fluorimétre. <strong>Les</strong> valeurs<br />
d'ondes utilisées varient entre 250 et 350 nm. La mesure est effectuée à 90° par rapport à la<br />
lumière incidente. La néphélométrie est une méthode utilisée pour doser des "particules".<br />
En TP, vous utiliserez l'instrument utilisé pour faire les mesures (le néphélomètre).<br />
En TP vous utiliserez aussi un disque Secchi est un dispositif<br />
permettant de mesurer la transparence d'une étendue d'eau. Il<br />
consiste en un disque d'une vingtaine de centimètres. Le disque est<br />
fixé au bout d'une corde, qu'on laisse descendre jusqu'à disparition,<br />
puis on note la longueur de la corde. On remonte ensuite la corde<br />
jusqu'à réapparition puis on note la longueur de la corde. La<br />
profondeur du disque de Secchi est le point médian entre ces deux<br />
mesures. Cette mesure est liée à la turbidité.<br />
Le disque de Secchi permet d’évaluer la hauteur de la zone<br />
euphotique (ou arrive plus de 1% de la lumière incidente).<br />
Prof zone euphotique = 2,3 * Secchi
La turbidité de l’eau est liée à la quantité de MES. En TP, sur les milieux aquatiques<br />
étudiées, vous allez évaluer cette turbidité selon trois approches<br />
(turbidimètre + Secchi + MES).<br />
Protocole de mesure des MES :<br />
Pesez un filtre sec (p1)<br />
Placez le sur le système de filtration<br />
Mesurez un volume (v1) précis d’échantillon préalablement agité<br />
(500 ml par exemple) et versez le sur le filtre.<br />
Conseil : récupérez l’eau filtrée pour les analyses de nitrates,<br />
nitrites, ammonium et orthophosphates<br />
Placez le filtre dans une boite de pétri à l’étuve à 105°C, le<br />
lendemain, pesez le filtre sec (p2).<br />
MES (mg/l) = p2-p1/v1<br />
Mesure complémentaire : Si votre filtre est ensuite placé à 525°C, la matière volatilisable à<br />
525°C sera volatilisée. C’est ainsi que l’on évalue la fraction de Matière Organique qui compose<br />
ces MES. Après passage à 525°C, vous pesez alors p3
N<br />
O O<br />
1 mole d’N = 14 g<br />
1 mole d’O = 16 g<br />
1 mole de nitrite = 14 + (16*2) = 46 g<br />
Votre spectro « nitrite » vous indique une concentration de<br />
0.21 mg/l !<br />
Attention votre spectro peut afficher la concentration en :<br />
Nitrites (NO 2 - )<br />
ou en<br />
azote des nitrites (N) exprimée sous la forme N-NO 2 -<br />
!!!! Vérifiez sur le mode d’emploi !!!<br />
46/14<br />
Si c’est 0,21 mg/l de N-NO 2 - , cela correspond à 0,21*3.286 = 0,69 mg/l d’NO2 -<br />
Si c’est 0,21 mg/l de NO 2 - , cela correspond à 0,21*0.304 = 0,06 mg/l d’N-NO2 -<br />
14/46
N-NO -<br />
2<br />
X 3,286<br />
X 0,304<br />
NO -<br />
2<br />
X 4,429<br />
N-NO -<br />
3 NO -<br />
3<br />
X 0,226<br />
X 1,286<br />
N-NH +<br />
4 NH +<br />
4<br />
X 0,778<br />
X 3,065<br />
P-PO 3-<br />
4<br />
X 0,326<br />
PO 3-<br />
4