Elenco minerali + dispensa
Elenco minerali + dispensa
Elenco minerali + dispensa
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Definizione di un minerale:<br />
Schema per lo studio dei <strong>minerali</strong><br />
è una sostanza inorganica che si trova in natura allo stato solido caratterizzata da una formula chimica ben<br />
definita e i cui atomi, ioni o molecole, si organizzano nello spazio secondo un reticolo cristallino.<br />
Caratteristiche di un minerale<br />
Composizione chimica: ben definita esprimibile con una formula chimica;<br />
Reticolo cristallino: disposizione nelle tre direzioni dello spazio ordinata e paragonabile ad una<br />
Proprietà di un minerale<br />
figura solida.<br />
Abito cristallino: come appare (x ex il cristallo di quarzo è composto da un prisma esagonale con<br />
sopra una piramide anch’essa esagonale; il salgemma appare come tanti cubi, ecc.);<br />
Colore: ATTENZIONE non è una caratteristica molto utilizzabile visto che può cambiare in<br />
relazione alla presenza di impurità, meglio usare la striscia……;<br />
Durezza: Scala di Mohs……………….;<br />
Sfaldatura: è la tendenza di un minerale di rompersi secondo piani ben definiti;<br />
Lucentezza: è il modo con cui un cristallo riflette (o non riflette) la luce;<br />
Densità: dovuta alla compattezza degli atomi.<br />
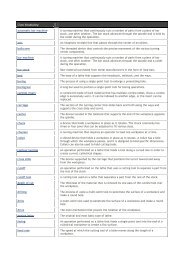
<strong>Elenco</strong> <strong>minerali</strong> più importanti, da memorizzare per la verifica di Scienze<br />
A NaCl<br />
B CaF2<br />
C Fe2O3 x 2 H2O<br />
D Fe2O3<br />
E Fe3O4<br />
F Al2O3<br />
G SiO2<br />
H CaMg(CO3)2<br />
I CaCO3<br />
J Cu2(CO3)(OH)2<br />
K CaSO4 x 2 H2O<br />
L BaSO4<br />
M SrSO4<br />
N FeS2<br />
O PbS<br />
P HgS<br />
Q ZnS<br />
R AsS<br />
S As2S3<br />
T Ca5(F,Cl,OH)(PO4)3<br />
U Mg3Si4O10(OH)2<br />
V KAlSi3O8<br />
W AlSiO4(F, OH)2<br />
X Au<br />
Y C<br />
Z Ag<br />
AA Cu<br />
BB S<br />
a Salgemma<br />
b Fluorite (4)<br />
c Limonite<br />
d Ematite<br />
e Magnetite<br />
f Corindone (9) (rubino, topazio)<br />
g Quarzo (7) (Agata, Onice, Diaspro, Ametista…)<br />
h Dolomite<br />
i Calcite (3), Aragonite<br />
j Malachite<br />
k Gesso (2)<br />
l Barite<br />
m Celestina<br />
n Pirite<br />
o Galena<br />
p Cinabro<br />
q Blenda<br />
r Realgar<br />
s Orpimento<br />
t Apatite (5)<br />
u Talco (1)<br />
v Ortoclasio (6)<br />
w Topazio (8)<br />
x Oro<br />
y Diamante (10), Grafite<br />
z Argento<br />
aa Rame<br />
bb Zolfo
Principali famiglie di <strong>minerali</strong>:<br />
costituiscono il 90% dei <strong>minerali</strong> della Terra contengono Silicio e Ossigeno più altri<br />
metalli quali Al, K, Na, Mg, Fe, Ca….(quarzo, ortoclasio….);<br />
� Nesosilicati<br />
� ciclosilicati;<br />
� fillosilicati;<br />
� sorosilicati (disilicati);<br />
� inosilicati<br />
� tettosilicati.<br />
NESOSILICATI. I gruppi SiO4 sono isolati; gli ossigeni ai vertici dei tetraedri sono legati esclusivamente a<br />
metalli diversi dal silicio. Ogni tetraedro è collegato agli altri non direttamente, ma da atomi (sopratt. Fe ed<br />
Al) che fanno da ponte fra i vertici dei tetraedri stessi. Sono esempi lo zircone, il topazio, i granati, le olivine,<br />
SOROSILICATI. I gruppi SiO4 sono a coppie; un ossigeno costituisce un vertice comune a due tetraedri i<br />
quali formano quindi l’insieme Si2O7 dove sei atomi di ossigeno si legano ad atomi metallici (Al, Ca, Mg,...)<br />
che fanno da ponte con altre coppie di tetraedri. Sono esempi la vesuviana e i <strong>minerali</strong> del gruppo degli<br />
epidoti.<br />
CICLOSILICATI. Più di tre tetraedri (al massimo sei) sono uniti in spezzoni chiusi ad anello: due ossigeni di<br />
ciascun tetraedro formano sempre un ponte. Fanno parte dei ciclosilicati i <strong>minerali</strong> berillo, tormalina,<br />
dioptasio, ecc...<br />
INOSILICATI. Costituiti da catene lineari indefinite singole di gruppi SiO4 dove ciascun tetraedro ha due<br />
vertici in comune con quelli adiacenti oppure le catene possono essere doppie(come due singole adiacenti;<br />
dove i vertici in comune sono in maggior numero. Lestrutture cristalline degli inosilicati sono costituite da<br />
catene allineate nella stessa direzione e unite fra loro da atomi metallici (Ca, Mg, Na, Al,...) che fanno da<br />
ponte fra le estremità libere dei tetraedri di catene adiacenti. Fra i più comuni <strong>minerali</strong> citiamo pirosseni ed<br />
anfiboli (es. orneblenda).<br />
FILLOSILICATI. Tutti i tetraedri mettono in comune tre vertici complanari, formando strati.<br />
Ogni gruppo SiO4 possiede un solo ossigeno esclusivo e tre in comune con i gruppi adiacenti.<br />
. Ogni piano possiede tanti atomi di ossigeno liberi quanti sono i tetraedri che lo compongono; gli ossigeni<br />
liberi si legano con i metalli (prevalentemente Mg ed Al) che fanno da ponte con gli strati sovrastanti e<br />
sottostanti. I fillosilicati più diffusi sono il talco, i gruppi delle miche (es. biotite), dei serpentini, delle cloriti e<br />
dei <strong>minerali</strong> delle argille.<br />
TETTOSILICATI. Tutti i tetraedri hanno in comune i quattro vertici, dando origine ad una intelaiatura<br />
tridimensionale continua e indefinita. La formula per l’insieme è SiO2. Non vi è teoricamente spazio per<br />
atomi metallici;<br />
I <strong>minerali</strong> più frequenti sono il quarzo e i gruppi dei feldspati (es. ortoclasio che è un feldspato potassico ed<br />
il plagioclasio che può essere sodico o calcico), dei feldspatoidi (es. nefelina) e delle zeoliti.<br />
contengono Ossigeno legato a metalli (ematite, magnetite, corindone);<br />
contengono lo ione carbonato (CO3) 2- (calcite, aragonite, dolomite….);<br />
contengono lo ione solfuro S - (pirite, galena, cinabro, blenda ….);<br />
contengono lo ione solfato (SO4) 2- (gesso, barite, celestina, anidride………..);<br />
costituiti da un solo elemento (oro, argento, rame, diamante ……)<br />
sono costituiti dalla unione di uno o più elementi con cloro, bromo, iodio, fluoro (<br />
fluorite, salgemma …..)<br />
(borace da cui si ricava boro utilizzato nell’industria farmaceutica, e dei cosmetici)<br />
contengono lo ione fosfato (PO4) 3- (apatite….)