Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Una proteina in azione: l'emoglobina - Università degli Studi di ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
12 A. <strong>Una</strong> <strong>prote<strong>in</strong>a</strong> <strong>in</strong> <strong>azione</strong>: l’emoglob<strong>in</strong>a © 88-08-07893-0<br />
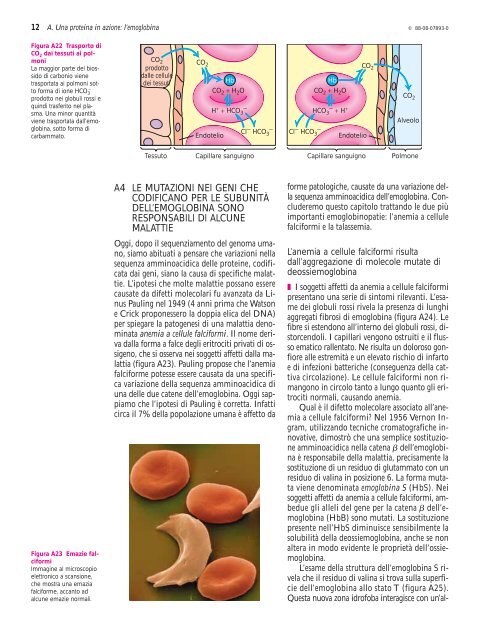
Figura A22 Trasporto <strong>di</strong><br />
CO 2 dai tessuti ai polmoni<br />
La maggior parte del biossido<br />
<strong>di</strong> carbonio viene<br />
trasportata ai polmoni sotto<br />
forma <strong>di</strong> ione HCO 3 –<br />
prodotto nei globuli rossi e<br />
qu<strong>in</strong><strong>di</strong> trasferito nel plasma.<br />
<strong>Una</strong> m<strong>in</strong>or quantità<br />
viene trasportata dall’emoglob<strong>in</strong>a,<br />
sotto forma <strong>di</strong><br />
carbammato.<br />
Figura A23 Emazie falciformi<br />
Immag<strong>in</strong>e al microscopio<br />
elettronico a scansione,<br />
che mostra una emazia<br />
falciforme, accanto ad<br />
alcune emazie normali.<br />
CO2 prodotto<br />
dalle cellule<br />
dei tessuti<br />
Tessuto<br />
CO 2<br />
Endotelio<br />
Hb<br />
CO 2 + H 2 O<br />
H + + HCO 3 −<br />
Cl − HCO 3 −<br />
A4 LE MUTAZIONI NEI GENI CHE<br />
CODIFICANO PER LE SUBUNITÀ<br />
DELL’EMOGLOBINA SONO<br />
RESPONSABILI DI ALCUNE<br />
MALATTIE<br />
Capillare sanguigno Capillare sanguigno Polmone<br />
Oggi, dopo il sequenziamento del genoma umano,<br />
siamo abituati a pensare che variazioni nella<br />
sequenza amm<strong>in</strong>oaci<strong>di</strong>ca delle prote<strong>in</strong>e, co<strong>di</strong>ficata<br />
dai geni, siano la causa <strong>di</strong> specifiche malattie.<br />
L’ipotesi che molte malattie possano essere<br />
causate da <strong>di</strong>fetti molecolari fu avanzata da L<strong>in</strong>us<br />
Paul<strong>in</strong>g nel 1949 (4 anni prima che Watson<br />
e Crick proponessero la doppia elica del DNA)<br />
per spiegare la patogenesi <strong>di</strong> una malattia denom<strong>in</strong>ata<br />
anemia a cellule falciformi. Il nome deriva<br />
dalla forma a falce <strong>degli</strong> eritrociti privati <strong>di</strong> ossigeno,<br />
che si osserva nei soggetti affetti dalla malattia<br />
(figura A23). Paul<strong>in</strong>g propose che l’anemia<br />
falciforme potesse essere causata da una specifica<br />
vari<strong>azione</strong> della sequenza amm<strong>in</strong>oaci<strong>di</strong>ca <strong>di</strong><br />
una delle due catene dell’emoglob<strong>in</strong>a. Oggi sappiamo<br />
che l’ipotesi <strong>di</strong> Paul<strong>in</strong>g è corretta. Infatti<br />
circa il 7% della popol<strong>azione</strong> umana è affetto da<br />
Cl − HCO 3 −<br />
Hb<br />
CO2 + H2O HCO 3 − + H +<br />
Endotelio<br />
CO 2<br />
CO 2<br />
Alveolo<br />
forme patologiche, causate da una vari<strong>azione</strong> della<br />
sequenza amm<strong>in</strong>oaci<strong>di</strong>ca dell’emoglob<strong>in</strong>a. Concluderemo<br />
questo capitolo trattando le due più<br />
importanti emoglob<strong>in</strong>opatie: l’anemia a cellule<br />
falciformi e la talassemia.<br />
L’anemia a cellule falciformi risulta<br />
dall’aggreg<strong>azione</strong> <strong>di</strong> molecole mutate <strong>di</strong><br />
deossiemoglob<strong>in</strong>a<br />
❚ I soggetti affetti da anemia a cellule falciformi<br />
presentano una serie <strong>di</strong> s<strong>in</strong>tomi rilevanti. L’esame<br />
dei globuli rossi rivela la presenza <strong>di</strong> lunghi<br />
aggregati fibrosi <strong>di</strong> emoglob<strong>in</strong>a (figura A24). Le<br />
fibre si estendono all’<strong>in</strong>terno dei globuli rossi, <strong>di</strong>storcendoli.<br />
I capillari vengono ostruiti e il flusso<br />
ematico rallentato. Ne risulta un doloroso gonfiore<br />
alle estremità e un elevato rischio <strong>di</strong> <strong>in</strong>farto<br />
e <strong>di</strong> <strong>in</strong>fezioni batteriche (conseguenza della cattiva<br />
circol<strong>azione</strong>). Le cellule falciformi non rimangono<br />
<strong>in</strong> circolo tanto a lungo quanto gli eritrociti<br />
normali, causando anemia.<br />
Qual è il <strong>di</strong>fetto molecolare associato all’anemia<br />
a cellule falciformi? Nel 1956 Vernon Ingram,<br />
utilizzando tecniche cromatografiche <strong>in</strong>novative,<br />
<strong>di</strong>mostrò che una semplice sostituzione<br />
amm<strong>in</strong>oaci<strong>di</strong>ca nella catena dell’emoglob<strong>in</strong>a<br />
è responsabile della malattia, precisamente la<br />
sostituzione <strong>di</strong> un residuo <strong>di</strong> glutammato con un<br />
residuo <strong>di</strong> val<strong>in</strong>a <strong>in</strong> posizione 6. La forma mutata<br />
viene denom<strong>in</strong>ata emoglob<strong>in</strong>a S (HbS). Nei<br />
soggetti affetti da anemia a cellule falciformi, ambedue<br />
gli alleli del gene per la catena dell’emoglob<strong>in</strong>a<br />
(HbB) sono mutati. La sostituzione<br />
presente nell’HbS <strong>di</strong>m<strong>in</strong>uisce sensibilmente la<br />
solubilità della deossiemoglob<strong>in</strong>a, anche se non<br />
altera <strong>in</strong> modo evidente le proprietà dell’ossiemoglob<strong>in</strong>a.<br />
L’esame della struttura dell’emoglob<strong>in</strong>a S rivela<br />
che il residuo <strong>di</strong> val<strong>in</strong>a si trova sulla superficie<br />
dell’emoglob<strong>in</strong>a allo stato T (figura A25).<br />
Questa nuova zona idrofoba <strong>in</strong>teragisce con un’al-